文章信息
- 朱丽平, 许修宏, 张文浩, 成利军, 李洪涛, 王紫琪, 贺宁
- ZHU Li-ping, XU Xiu-hong, ZHANG Wen-hao, CHENG Li-jun, LI Hong-tao, WANG Zi-qi, HE Ning
- 牛粪堆肥中反硝化细菌与理化参数的关系
- Correlationship between denitrifying bacteria and physicochemical factors in cow manure composting
- 农业环境科学学报, 2016, 35(9): 1781-1787
- Journal of Agro-Environment Science, 2016, 35(9): 1781-1787
- http://dx.doi.org/10.11654/jaes.2016-0250
文章历史
- 收稿日期: 2016-03-01
近年来,随着我国农业和畜牧业的迅速发展,大量畜禽粪便和农业秸秆露天放置,对环境造成了严重污染[1]。目前,采取了多种方式对禽畜粪便和农作物秸秆进行资源化处理,如将禽畜粪便加工成有机肥料、将秸秆进行饲料化或材料化等[2],但好氧堆肥法仍然是处理有机固体废弃物最有效的方式之一[3]。
在堆肥化过程中,反硝化细菌能够将硝酸盐转化成气态氮(NO、N2O、N2)[4],不仅会造成空气污染,同时还降低了堆肥品质。参与反硝化过程的还原酶主要有4种[5],其中的nosZ基因催化N2O 还原成N2[6],能够有效减少温室气体的排放,因此,在反硝化过程中,以nosZ基因为标记,分析反硝化细菌的群落结构变化,对研究堆肥过程中氮素转化过程及规律具有重要的意义。近些年来,虽然在研究堆肥化过程中的反硝化菌方面取得了很大的进展[2, 7],但对堆肥过程中理化参数与反硝化菌群之间关系的研究尚少。
本研究采用牛粪与稻草秸秆进行好氧堆肥实验,对堆肥过程中温度(T)、pH、含水率、氨态氮(NH4+ -N)、硝态氮(NO3--N)等理化参数进行参数测定。通过聚合酶链式反应-变性梯度凝胶电泳技术(PCRDGGE)来研究以nosZ基因为标记的反硝化细菌的群落动态变化,应用冗余分析(Redundancyanalysis,RDA)方法研究堆肥过程中反硝化细菌群落结构与理化参数之间的相关性,利用皮尔逊相关系数法分析反硝化细菌群落多样性与理化参数的相关性,并分析影响菌群变化的驱动因子。
1 材料与方法 1.1 堆肥实验与样品采集堆肥实验中的牛粪与水稻秸秆均来自哈尔滨市农场,堆肥材料主要成分见表 1。将水稻秸秆剪成小段(3~5 cm),便于与牛粪的充分混匀,秸秆与牛粪按照干重比1:3进行充分混合,并且将混合物料的含水率调节为60%~65%,置于实验室自制的堆肥模拟容器中进行发酵,堆肥过程中定期进行翻堆,整个堆肥过程共持续30 d。
在堆体的上中下三层的不同位置分别在第0、1、4、7、13、23、29 d取样并混匀(7 个样品),以堆肥天数为样品标号。在堆肥第3、5、11、21 d进行翻堆。7个样品分为两部分保存,一部分用于理化参数的测定,另一部分放于-80℃用于分子实验分析。
1.2 堆肥理化参数的测定在堆体上、中、下三层的不同位置,使用精密温度计分别测其温度并取平均值,同时记录下室温。堆体含水率的测定采用恒重法,将7 个堆肥样品在105℃下烘干24 h,然后进行计算,得出含水率数值。pH 的测定是将每个堆肥样品称取1 g,按1:10(质量浓度)加入去离子水,150 r·min-1下振荡30 min后在10 000r·min-1进行离心,离心15 min 后过滤,滤液用数字pH仪器测定。NH4+-N 含量根据鲍士旦[8]的农化分析方法进行测定,NO3- -N 含量采用酚二磺酸比色法进行测定[9]。
1.3 DNA 提取、纯化用实验室改进的CTAB法对堆肥样品总DNA进行提取[10],使用OMEGA 纯化试剂盒对粗提取的总DNA进行回收、纯化,检测纯化结果后于-20℃保存备用。
1.4 PCR 扩增堆肥过程中反硝化细菌的检测以nosZ基因为标记,选用引物对nosZ-F/nosZ-1622R 进行PCR 扩增,并且在nosZ-1622R 的5'端添加GC 夹[11]。PCR 扩增,体系为50 μL,其中:10×PCR Buffer 5 μL,dNTP 5 μL,模板1 μL,Taq 酶0.6 μL,上下游引物各0.8 μL,ddH2O 补足至50 μL。扩增条件为:预变性5 min(95℃);35 个循环中再次变性45 s(95℃),退火45 s(61℃),延伸1 min(72℃);最后再延伸10 min(72℃)[12],于4℃下保存并停止反应。
1.5 DGGE及条带测序应用DcodeTM系统对PCR 产物进行DGGE 实验。使用尿素浓度范围为35%~70%的8%聚丙烯酰胺凝胶(丙烯酰胺:双丙烯酰胺=37.5:1,m/V)。电泳条件:在60℃恒温的1伊TAE 电泳缓冲液中,120 V恒定电压下电泳12 h[11]。电泳结束后,将DGGE 胶进行染色并拍照。切下主要条带溶于水后,用不带GC 夹子的引物进行PCR 扩增,并测序。
测序结果提交至GenBank 获得基因登录号,用BLAST比对出同源性最高的序列并下载,使用MEGA4.0程序的邻接法(Neighbor-Joining)构建系统进化树。
1.6 数据处理DGGE 图谱分析采用Quantity One 4.6.2 软件,根据公式H=-ΣPiln Pi 计算出反硝化细菌的多样性指数(H);反硝化细菌群落结构变化与理化参数的相关性分析采用Canoco 4.5 软件分析,首先对分析数据进行除趋势对应分析(Detrended correspondence analysis,DCA),当排序轴的梯度长度相对较短时(<2),选用冗余分析方法进行分析[13],应用Canodraw 4.5 程序将生成的数据文件进行作图分析[14];利用SPSS17.0软件中皮尔逊相关系数法分析反硝化细菌群落多样性与理化参数之间的相关性。
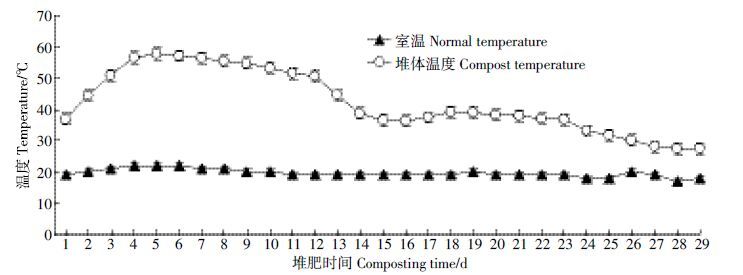
2 结果与讨论 2.1 理化参数的变化图 1 为堆肥过程中温度变化,根据堆肥过程中温度的变化可以将堆肥过程分为三个阶段:0~3 d为升温期;4~12d为高温期;13~29d为降温腐熟期。堆肥开始后温度逐渐升高,在第5 d 时达到最高温57.6℃,并且温度超过55℃的堆肥时间持续了5 d,可在堆肥过程中杀死各种病原菌,满足基本的堆肥卫生标准[15]。堆体温度在堆肥第13 d开始迅速下降,且在堆肥后期(13~29 d)温度变化趋于平稳,堆肥过程结束时温度接近于室温。堆肥过程中温度的变化与堆体内微生物活性息息相关,二者相互影响,微生物的大量活动导致堆体温度升高,同时高温也会影响微生物体内的酶活。所以,温度既是影响堆肥过程中微生物群落变化的重要因素,也是评价堆肥是否达到稳定化的重要条件[16]。
|
| 图 1 堆肥过程中温度变化 Figure 1 Changes of temperature during composting process |
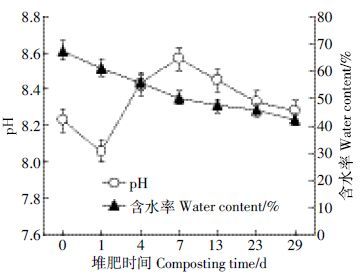
图 2 为堆肥过程中含水率与pH的变化。堆肥过程中含水率的变化始终保持在40%~70%的范围内,整体呈现下降的趋势,在堆肥初期(0 d)堆肥含水率最大,达到65.7%,随着堆体温度升高,含水率逐渐变小,在堆肥结束时达到最低值42.1%。水分不仅直接影响堆体内微生物的代谢,而且会影响堆肥的腐熟速度[15]。堆肥过程中的pH变化在8.06~8.57 之间,在堆肥第1 d降至最低值(8.06),第7 d 时达到最大值(8.57),在堆肥后期(13~29 d)逐渐下降。因为在堆肥初期,微生物分解大量有机物的过程中产生有机酸,使得堆体pH 值降低;后期有机酸的降解及NH4+-N 的大量积累使得堆体pH逐渐升高[8]。
|
| 图 2 堆肥过程中pH和含水率变化 Figure 2 Changes of pH and water content during composting process |
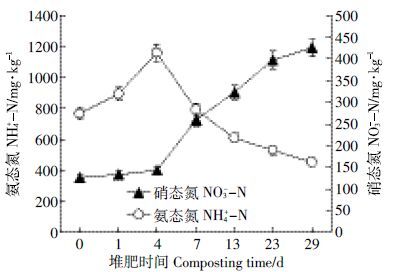
图 3为NH4+-N和NO3--N含量变化。NH4+-N含量在堆肥前期(0~4 d)升高而在堆肥后期(7~29 d)呈迅速降低的变化趋势,其含量从堆肥起始阶段(0 d)的767 mg·kg-1迅速增加到第4 d时的最大值1159 mg·kg-1;随着堆肥的进行,堆体温度逐渐升高,大量NH3挥发[17],从而导致NH4+-N 的含量迅速减少(4~29 d),堆肥结束时降至最小值453 mg·kg-1。而NO3--N含量在整个堆肥过程中呈现上升趋势,在堆肥初期NO3--N含量仅为105 mg·kg-1,可能是由于在初期(0~3 d)某些具有硝化作用的微生物的活性受到了高温以及NH4+-N 大量积累的抑制,致使NO3--N 的生成速度减缓[18]。在堆肥4 d以后NO3--N 含量迅速增加,堆肥结束时达到425 mg·kg-1。
|
| 图 3 堆肥过程中NH4+-N 和NO3--N 变化 Figure 3 Changes of NH4+-N and NO3--N during composting process |
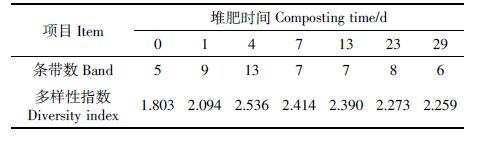
不同时期的堆肥样品PCR 产物经DGGE 分离,其结果如图 4所示。图中字母代表条带编号,在7 个泳道上共识别出8 条特异性的条带。堆肥前期(0~7d)样品条带的分布与后期(13~29 d)分布的差异性较大,说明随着堆肥的进行,反硝化细菌的群落结构发生了明显的变化。在堆肥过程中,每个时期均有条带G 出现,说明其具有较强的耐受性,为堆肥过程中的优势种群;条带B、C 和F 仅在堆肥高温期出现,是高温期的特异性条带,具有较强的耐高温性。

|
| 图 4 堆肥样品的DGGE 图谱 Figure 4 DGGE profile of compost samples |
不同时期反硝化细菌群落的多样性指数应用Shannon-Weaver公式进行计算[19],其结果如表 2所示。反硝化细菌的多样性总体呈现先增加后降低的趋势。在堆肥开始时,反硝化细菌的多样性指数呈整个堆肥过程中的最低值1.803,随着堆肥的进行,反硝化细菌的多样性逐渐升高,在高温期(第4 d)达到最大值2.536,在堆肥后期多样性指数有所下降。这是由于堆肥前期堆体内营养物质含量相对较为丰富,对反硝化细菌的生长较为有利;然而,不同菌属的反硝化细菌对温度等理化参数的敏感程度不尽相同,某些菌属因适应不了高温或因营养物质的减少而被淘汰,使得反硝化细菌的多样性呈现高低不同的趋势[20]。
将8 个成功测序的序列结果提交给Genbank 并获得登录号:KU246118-KU246125。使用MEGA 4.0建立系统发育树,其结果如图 5 所示。所有的条带测序结果与BLAST 数据库中比对的序列同源性菌高于55%。在堆肥过程中,条带G 测序结果与产碱菌属(Alcaligenes)有较高的相似性,在堆肥各个时期始终出现,是堆肥过程中的优势菌属;条带E 和A 分别在堆肥初期(1 d)和后期(13 d)被检测到,经测序与副球菌属(Paracoccus)和固氮螺菌属(Azospirillum)有较高的相似性;条带B、C 和F仅在高温期出现,其测序结果分别与无色杆菌属(Achromobacter)、未培养细菌和假单胞菌属(Pseudomonas)有较高的同源性。

|
| 图 5 反硝化细菌的系统进化树 Figure 5 Phylogenetic tree of denitrifying bacteria |
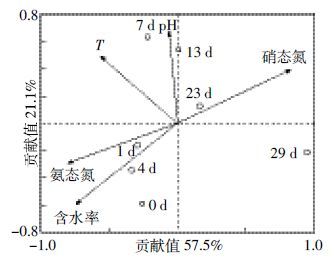
堆肥过程中反硝化细菌群落结构与理化参数的冗余分析结果如图 6。前2 个排序轴分别解释了57.5%和21.1%的反硝化细菌种群变化,说明这些理化参数对堆肥过程中反硝化细菌群落结构的变化有显著的影响。在RDA 二维排序结果中,带箭头的矢量线表示不同的理化参数,圆圈代表在不同堆肥天数时取样样品。箭头的矢量线长度可以表示不同理化参数与物种之间的相关性,其矢量线越长,相关性就越大,反之则越小[21]。从RDA 排序图中可以看出,含水率、硝态氮和氨态氮三个参数的连线相对较长,说明在堆肥过程中这些因素对反硝化细菌群落结构变化的影响较大。在RDA 分析中,圆圈之间的距离表示菌落结构的差异性,圆圈间连线越短,差异性越小[13]。由此可知,反硝化细菌的群落结构在堆肥前期(0~4 d)变化较小。在降温腐熟期(23~29 d)变化则较为剧烈。
|
| 图 6 反硝化细菌种群变化与理化参数的RDA 图 Figure 6 RDA of denitrifying bacteria community and physic-chemical parameters |
堆肥过程中理化参数(含水率、硝态氮和氨态氮)对反硝化细菌群落结构变化有不同程度的影响。含水率与堆肥中溶解氧的浓度密切相关,当含水率较大时,堆体中溶解氧浓度较低[22],利于反硝化菌的生长,因为多数反硝化菌属厌氧微生物。在堆肥初始阶段(0~3 d),堆体含水率较大,在一定程度上使得堆体内成厌氧或缺氧的状态,因而反硝化菌的生长较为稳定,其群落结构变化较小;在堆肥后期(4~29 d),含水率降低使得溶氧量相对较高,使得堆体内的反硝化细菌群落结构发生了较大的变化。
过去的研究中,有学者发现,硝态氮含量可以影响反硝化速率与菌群的群落结构变化[23]。在本文中,硝态氮与反硝化细菌群落结构有一定的相关性,也有学者研究发现,反硝化细菌的变化与硝态氮浓度并无显著的相关性[24]。这些结果表明,在不同的环境条件下,硝态氮浓度对反硝化细菌群落变化的影响存在显著性的差异。堆肥的前期(0~4 d),堆肥中反硝化细菌的群落结构变化较小,在此阶段中,供反硝化细菌作用的营养物质相对较多,反硝化细菌作用时相对稳定,所以,群落结构变化不大,其硝态氮含量逐渐积累增加;但在堆肥后期(23~29 d),反硝化细菌群落结构变化却很大,其原因可能是因为堆肥后期营养物质的减少以及大量硝态氮的积累,对反硝化细菌的作用产生了一定程度的影响。所以,反硝化细菌群落结构变化与理化因子之间的关系还需更多的研究。氨态氮表面上虽然与反硝化细菌的作用并无直接联系,但在氨态氮氧化生成硝态氮的过程中,会产生大量N2O 气体,此气体作为反硝化功能基因(nosZ)的底物,其含量多少会对反硝化细菌的作用产生影响。胡春晓等[25]也在对农业废弃物好氧堆肥过程的研究中发现,氨态氮浓度与nosZ基因呈显著正相关关系。
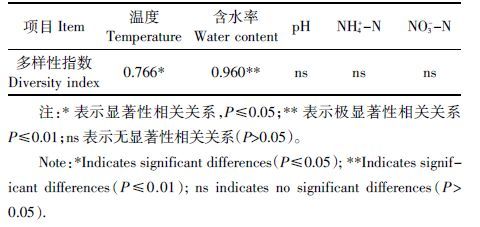
2.6 理化参数与反硝化细菌群落多样性的相关性分析反硝化细菌的变化,不仅体现在其群落结构与理化参数的相关性,还有反硝化细菌群落多样性与理化参数之间的相关性。理化参数与反硝化细菌群落多样性的皮尔逊相关性分析结果如表 3 所示。堆肥过程中反硝化细菌群落多样性与含水率呈极显著正相关关系(r=0.960,P<0.01),说明随着含水率的变大,反硝化细菌的群落多样性呈现显著性的增加,反之则减少;温度与反硝化细菌群落多样性呈显著正相关关系(r=0.766,P<0.05),说明随着温度的增加,反硝化细菌多样性也增加,反之则呈下降的趋势。但温度却不是影响反硝化细菌多样性的最主要因素,温度的变化通过对溶氧量及含水率等因素的影响,从而对反硝化细菌的多样性有一定程度的影响[26-28]。含水率对反硝化细菌群落多样性的影响呈现了极显著的相关性,说明反硝化细菌群落多样性对堆体内含水率的大小敏感程度很大,其细微的变化就能引起多样性的改变。
 |
温度也可以对其他理化参数产生影响,从而间接地影响微生物的代谢活动。在堆肥过程中,温度的变化使得堆体内含水率有所不同,其含水率的大小与溶氧浓度存在着一定的相关性。堆体内含水率较大时,溶氧浓度相对较低,反之溶氧量含量较高[29]。有大量的研究表明,当溶解氧浓度在一定的范围内时,反硝化细菌的活性不会受到溶解氧浓度的影响[30];当溶解氧的浓度低于某个值的时候,反硝化细菌的活性随着溶解氧浓度的降低而升高。这就说明影响反硝化细菌活性的溶解氧浓度存在着一个极限值,也称为阈值[31]。堆肥过程溶氧的变化可能受堆肥水分的影响,因此堆肥过程中反硝化细菌群落多样性随含水率的变大而升高。
3 结论(1)在牛粪堆肥过程中,反硝化细菌群落结构在堆肥前期(0~4 d)变化较小,在堆肥后期(23~29 d)变化较为剧烈;反硝化细菌群落多样性总体呈现先升高(0~4 d)后降低的趋势(23~29 d);
(2)Alcaligenes(条带G)存在于整个堆肥过程中,有较强的耐受性,是堆肥过程中反硝化细菌的优势种属;Achromobacter(条带B)、未培养细菌(条带C)和Pseudomonas(条带F)仅出现在堆肥高温期,具有较强的耐高温性,是高温阶段的优势性菌属。
(3)堆体含水率、硝态氮和氨态氮对群落结构变化有着不同程度的影响。含水率与反硝化细菌群落多样性呈极显著正相关关系,温度与反硝化细菌群落多样性呈显著正相关关系。
| [1] | Jusoh M L C, Manaf L A, Latiff P A. Composting of rice straw with effective microorganisms(EM) and its influence on compost quality[J]. Iranian Journal of Environmental Health Sciences and Enineering , 2013, 10 (1) : 1–9. DOI:10.1186/1735-2746-10-1 |
| [2] | 张玉芹, 刘开启, 王革, 等. 反硝化细菌的筛选及培养条件的研究[J]. 农业环境科学学报 , 2005, 24 (1) : 18–25. ZHANG Yu-qin, LIU Kai-qi, WANG Ge, et al. Screening of denitrifying bacteria and determination of the culture conditions[J]. Journal of Agro-Environment Science , 2005, 24 (1) : 18–25. |
| [3] | Jiang T, Schucharde F, Li G X, et al. Effect of C/N ratio, aeration rate and moisture content on ammonia and greenhouse gas emission during the composting[J]. Journal of Environmental Science , 2011, 23 (10) : 1754–1760. DOI:10.1016/S1001-0742(10)60591-8 |
| [4] | 王海涛, 郑天凌, 杨小茹. 土壤反硝化的分子生态学研究进展及其影响因素[J]. 农业环境科学学报 , 2013, 32 (10) : 1915–1924. WANG Hai-tao, ZHENG Tian-ling, YANG Xiao-ru. Molecular ecology research for soil denitrification and research status for its influencing factors[J]. Journal of Agro-Environment Science , 2013, 32 (10) : 1915–1924. |
| [5] | Wang Q L, Hu N, Ding D X, et al. Removal of NO3--N from polluted groundwater in decommissioned mining area in an in-situ leach uranium mine by denitrifying bacteria bioreactor[J]. Atomic Energy Science and Technology , 2013 (8) : 7–13. |
| [6] | Barrett M, Jahanigir M M, Lee C, et al. Abundance of denitrification genes under different peizometer depths in four Irish agricultural groundwater sites[J]. Environmental Science and Pollution Research , 2013, 20 (9) : 6646–6657. DOI:10.1007/s11356-013-1729-3 |
| [7] | Wei L, Ma F, Su J F, et al. Rapid quantitative detection of denitrifying bacteria in terms of nirS gene[J]. Journal of Harbin Institute of Technology , 2008, 40 (10) : 12–18. |
| [8] | 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000 . BAO Shi-dan. Soil agricultural chemistry analysis[M]. Beijing: China Agriculture Press, 2000 . |
| [9] | Tago K, Okubo T, Shimomura Y, et al. Environmental factors shaping the community structure of ammonia-oxidizing bacteria and archaea in sugarcane field soil[J]. Microbes Environmental , 2015, 30 (1) : 21–28. DOI:10.1264/jsme2.ME14137 |
| [10] | Su J F, Ma F, Gao S S, et al. Aerobic denitrifiers dispose the wastewater of NO3-N and the analysis of the diversity of microbial species[J]. Journal of Basic Science and Engineering , 2008, 16 (1) : 45–50. |
| [11] | 王晓君, 陈少华, 张兆基, 等. 利用氧化亚氮还原酶基因(nosZ)评价人工湿地系统中的反硝化菌[J]. 环境科学 , 2012, 33 (4) : 1306–1311. WANG Xiao-jun, CHEN Shao-hua, ZHANG Zhao-ji, et al. Denitrifying bacteria of constructed wetland system based on the nitrous oxide reductase gene(nosZ)[J]. Environmental Science , 2012, 33 (4) : 1306–1311. |
| [12] | Angnes G, Nicoloso R S, Sliva M L B, et al. Correlation denitrifying catabolic genes with N2O and N2 emissions from swine slurry composting[J]. Bioresource Technology , 2013, 6 : 368–375. |
| [13] | Valentín-Vargas A, Root R A, Neilson J W, et al. Environmental factors influencing the structural dynamics of soil microbial communities during assisted phytostabilization of acid-generating mine tailings:A mesocosm experiment[J]. Science of the Total Environment , 2014, 500 : 314–324. |
| [14] | 龙健, 廖洪凯, 李娟, 等. 基于冗余分析的典型喀斯特山区土壤-石漠化关系研究[J]. 环境科学 , 2012, 33 (6) : 2132–2137. LONG Jian, LIAO Hong-kai, LI Juan, et al. Relationships between soil and rocky desertification in typical karst mountain area based on redundancy analysis[J]. Environmental Science , 2012, 33 (6) : 2132–2137. |
| [15] | 唐珠, 沈其荣, 余光辉. 猪粪堆肥的理化特征及腐熟度评价研究[D]. 南京:南京农业大学, 2011:85. TANG Zhu, SHEN Qi-rong, YU Guang-hui. Characterization and indentification of maturity of pig manure composting[D]. Nanjing:Nanjing Agricultural University, 2011:85. |
| [16] | 柴晓利, 张华, 赵由才. 固体废物堆肥原理与技术[M]. 北京: 化学工业出版社, 2005 : 83 . CHAI Xiao-li, ZHANG Hua, ZHAO You-cai. The principle and technology of soild waste composting[M]. Beijing: Chemical Industry Press, 2005 : 83 . |
| [17] | Liu S T, Wang G F, Xie X F, et al. Effect of matrix on denitrification efficiency and distribution of nitrifying and denitrifying bacteria in constructed wetlands[J]. Journal of Southeast University(Natural Science Edition) , 2011, 41 (2) : 15–18. |
| [18] | Li H B, Lian J, Li M, et al. Isolation and characteristics of denitrifying bacterium strain GW1[J]. Journal of Hebei University of Science and Technology , 2012, 33 (2) : 20–24. |
| [19] | 董西洋. 反硝化细菌对络合脱硝液中Fe(Ⅲ) EDTA和Fe(Ⅱ) EDTA-NO的还原[D]. 大连:大连理工大学, 2013:19-23. DONG Xi-yang. Reduction of Fe(Ⅲ) EDTA and Fe(Ⅱ) EDTA-NO by dinitrifying bacteria in a NOx scrubber liquou[D]. Dalian:Dalian University of Technology, 2013:19-23. |
| [20] | Yi N, Di P P, Wang Y, et al. Diel vertical variability analysis of denitrifying bacteria abundance in oxygen-enriched irrigation pond[J]. Transactions of the Chinese Society of Agricultural Engineering , 2015, 30 (15) : 22–26. |
| [21] | Zhu L, Yin L H, Pu Y P, et al. Optimization and application of fluorescence in situ hybridization assay for detecting nitrifying bacteria in environmental samples[J]. Journal of Southeast University(Natural Science Edition) , 2005, 35 (2) : 21–23. |
| [22] | Su J F, Ma F, Wang J H, et al. Nitrification and denitrification characteristics of new heterotrophic nitrifying bacteria[J]. Journal of Tianjin University , 2007, 40 (10) : 7–14. |
| [23] | Miao Y, Liao R H, Zhang X X, et al. Metagenomic insights into salinity effect on diversity and abundance of denitrifying bacteria and genes in an expanded granular sludge bed reactor treating high-nitrate wastewater[J]. Chemical Engineering Journal , 2015, 10 : 116–123. |
| [24] | Ligi T, Truu M, Turr J, et al. Effects of soil chemical characteristics and water regime on denitrifiction genes(nirS, nirK, and nosZ) abundances in a created riverine wetland complex[J]. Ecological Engineering , 2014, 11 : 47–55. |
| [25] | 胡春晓, 陈耀宁, 张嘉超, 等. 农业废物好氧堆肥中环境因子对nirK、nirK和nosZ数量的影响[J]. 环境科学 , 2013, 34 (3) : 1196–1302. HU Chun-xiao, CHEN Yao-ning, ZHANG Jia-chao, et al. Effects of physico-chemical parameters on the abundance of the denitrification associated genes nirK, nirS and nosZ during agricultural waste composting[J]. Environmental Science , 2013, 34 (3) : 1196–1302. |
| [26] | Zhang L H, Dou C L, Shi H F, et al. Experimental study on the nitrification process in the bio-cathode of microbial fuel cells[J]. Environmental Pollution and Control , 2012, 34 (9) : 26–30. |
| [27] | Chen Q Y, Jiang L F, Chen J Q, et al. Isolation and NH4+-N removal characteristics of a high-efficient heterotrophic nitrifying bacterium alcaligenes faecalis Ni3-1[J]. Environmental Engineering , 2015, 33 (5) : 3–7. |
| [28] | 李卫芬, 郑佳佳, 张小平, 等. 反硝化酶及其环境影响因子的研究进展[J]. 水生生物学报 , 2014 (1) : 166–170. LI Wei-fen, ZHENG Jia-jia, ZHANG Xiao-ping, et al. Progress in studies on denitrification enzymes and environmental impact factors[J]. Acta Hydrobiologica Sinica , 2014 (1) : 166–170. |
| [29] | Michael-Kordatou I, Michael C, Duan X D, et al. Dissolved effluent organic matter:Characteristics and potential implications in wastewater treatment and reuse applications[J]. Water Research , 2015, 6 : 213–248. |
| [30] | 张雪辰. 禽畜粪便堆肥化过程碳氮转化规律及其受调控措施的影响[D]. 杨凌:西北农林科技大学, 2014. ZHANG Xue-chen. The transformation of organic carbon and nitrogen with different regulation technology during the livestock manure composting process[D]. Yangling:Northwest A&F University, 2014. |
| [31] | Niu T H, Zhou Z, Shen X L, et al. Effects of dissolved oxygen on performance and microbial community structure in a micro-aerobic hydrolysis sludge in situ reduction process[J]. Water Research , 2016, 5 : 369–377. |
 2016, Vol. 35
2016, Vol. 35