文章信息
- 胡宝叶, 王贤凤, 陈鹭, 印亮, 雷聪, 童月华, 易志刚
- HU Bao-ye, WANG Xian-feng, CHEN Lu, YIN Liang, LEI Cong, TONG Yue-hua, YI Zhi-gang
- 不同环境因子对南方典型蔗田原位和异位土壤NO通量的影响
- Effects of different environment factors on NO fluxes from intact and disturbed soils from the typical sugarcane field in Southern China
- 农业环境科学学报, 2016, 35(9): 1824-1828
- Journal of Agro-Environment Science, 2016, 35(9): 1824-1828
- http://dx.doi.org/10.11654/jaes.2016-0818
文章历史
- 收稿日期: 2016-06-17
一氧化氮(NO)在对流层臭氧(O3)和羟基自由基的光化学反应过程中发挥重要作用[1]。NO 参与一氧化碳(CO)、甲烷(CH4)以及非甲烷碳氢化合物的催化氧化过程,从而导致对流层O3浓度升高[2]。据估计,全球土壤NO 通量约为8.9 Tg N·a-1[3],Kesik 等[4]预测到2039 年土壤NO 通量将比目前提高9%。农田土壤则是最重要的土壤NO 排放源[5]。Ciais 等[6]估计农业土壤NO 排放量约为3.7 Tg N·a-1,占全球人为排放源的近10%。NO 不仅可被氧化为硝酸(HNO3)以及硝酸盐(NO3-)形成酸雨重新降落到地表,引起土壤或水体酸化、富营养化、生态系统N 饱和等危害[2],还可形成NH4NO3气溶胶降低大气能见度及辐射强度,从而影响植物生长[3]。因此,对农田土壤NO排放机理及影响因素进行研究,为寻求减缓农田NO 排放提供有效措施,对改善全球环境变化具有重要意义。
微生物的硝化和反硝化作用是土壤NO 产生的主要过程。硝化作用是铵盐(NH4+)被氧化为亚硝酸盐(NO2-),并进一步被氧化为NO3-的微生物过程;反硝化作用则是微生物利用NO3-和NO2-生成NO、氧化亚氮(N2O)和氮气(N2)的兼性厌氧过程[3]。灭菌、原位与异位、环境因子(好氧和厌氧条件、温度、水分等)等的改变可对微生物的硝化和反硝化过程产生影响,最终导致土壤NO 通量的变化。温度作为一个重要参数决定土壤硝化及反硝化作用[7]。有研究表明:不同微生物群落对温度有不同最大响应值[8],如:Myers 等[9]研究表明热带土壤硝化作用最适温度为35℃。而另一些研究表明:0~35℃范围内,NO 通量随温度上升呈指数形式上升[3]。全球或区域降水格局改变是当前气候变化的重要议题,降水势必会影响土壤含水量,而土壤湿度则是影响NO 排放的另一重要因素[10]。室内培养研究往往存在将土壤风干、过筛及去除根系等问题,导致土壤物理结构发生极大破坏,过筛土壤室内培养实验不能很好地反映野外实际情况,因此通过原位和异位土壤的比较可以得到土壤物理结构对土壤NO的通量是否有影响。通过灭菌处理去除微生物及酶的作用,研究在NO产生中土壤非生物过程发挥的作用[11],判断土壤NO 产生是以土壤微生物产物为主或以物理化学过程为主。目前,虽然关于农业土壤NO 释放的研究较多,但不同环境因子、尤其是原位和异位土壤NO 通量的研究相对较少。
本研究以南方典型蔗田土壤为对象,通过室内培养,研究不同环境因子对原位和异位土壤NO 通量的影响,并对其微生物作用进行了探讨。有利于在全球气候变化大背景下,更深入了解环境因子对土壤NO通量的影响以及农田土壤氮素转化过程,为进一步研究土壤NO 排放机理奠定基础。
1 材料与方法 1.1 供试土壤实验土壤于2015年11 月22 日采自福建省福州市一甘蔗农田(26°26'N,119°14'E)。福州属典型的亚热带季风气候,年平均降水量为900~2100 mm;年平均气温为20~25℃。原位土柱使用圆柱形(内径为11cm,高为12 cm)土钻无破坏取样。带回实验室后,24 h内将土柱无破坏地转移至自制亚克力材料圆柱形培养罐(内径为11 cm,高为15 cm)中。异位土柱则是在原位土柱旁10 cm 处分层(0~5 cm 和5~12 cm)取样,风干,去除植物残体和根系、过8 mm 筛、混匀,分层填至上述培养罐中,填实高度与原位土柱一致。其中,供试土壤基本理化性质如表 1 所示。
所有土柱在25℃条件下预培养7 d。实验设计4个处理:淤温度对原位土壤NO 通量的影响:保持土壤含水率为20%最大持水量(Maximum water holdingcapacity,MWHC,通过每天加蒸馏水保持相对稳定含水量),设置3 个温度(15、25℃和35℃,在人工气候箱中完成)。采样前土柱在设定温度和含水量条件下预培养24 h,每个处理3 个重复。于不同含水率对原位和异位土壤NO 通量的影响:保持土壤温度为25益,设置3 个含水率(20%、50%和80%MWHC),采样前土柱在设定温度和含水量条件下预培养24 h,每个处理3个重复。盂灭菌对异位土壤NO 通量的影响:使用高压蒸汽对异位土壤进行3 次灭菌处理。调整含水率前用高纯氮气多次冲洗土柱,防止灭菌过程产生气体对土壤NO 通量的影响。保持土壤温度为25℃,土壤含水率为20% MWHC,预培养24 h,每个处理设置3个重复。榆好氧与厌氧环境对原位与异位土壤NO 通量的影响:上述3 个处理进气分别为空气与氮气,形成好氧和厌氧条件。
1.3 样品测定采用动态暗箱-化学发光法测定土壤NO 排放通量。好氧条件下,进气口为不含NO 的压缩空气(使用purafil 和活性炭吸附剂去除空气中的NO),厌氧条件下进气口为高纯氮气,流量1000 mL·min-1左右,通气30 min 后开始测量出气口浓度。测量仪器为Model42i 化学发光NO-NO2-NOx 分析仪(Thermo Environ原mental Instruments Inc,USA),每5 s一个数据,取5min平均值为样品测定值。1.4数据处理与分析根据通量定义和理想气体状态方程计算NO 排放通量[12],具体公式为:
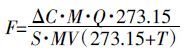 (1)
(1) 式中:F为土壤NO 通量,ng N·m-2·s-1;△C 为出气口和进气口浓度差,nmol·mol-1;M 为NO纯N 的摩尔质量14 g·mol-1;Q 为进气口流量,L·s-1;S 为土壤面积,m2;MV 为标况下气体的摩尔体积22.4 L·mol-1;T 为土壤温度,℃。
使用SPSS18.0 进行单因素方差分析,以Duncan多重检验法检验不同处理间土壤NO 通量差异显著性,数据以平均值依标准差表示。使用Sigmaplot 12.5作图。
2 结果与讨论 2.1 原位和异位土壤NO 通量差异好氧条件下,土壤含水率为20%MWHC 时,原位土柱NO 通量极显著大于异位土柱;土壤含水率为50% MWHC,原位土柱NO 通量显著大于异位土柱;土壤含水率为80% MWHC,原位与异位土柱NO 通量几乎相同(图 1A)。厌氧条件下,原位土壤NO 通量均极显著大于异位土壤(图 1B)。好氧条件下,随着含水率增加,原位土壤NO 通量与异位土壤NO 通量差异越来越小,这可能是由于随着含水率增加,含水率成为控制土壤NO 通量的主要因子,此时土壤物理结构的改变对NO 通量的影响成为次要因素。当土壤含水率适宜土壤NO 排放时,土壤物理结构对NO 通量影响显著。这可能是由于土壤团聚体是土壤结构基本单元,是形成土壤良好结构的物质基础[13],而异位土壤由于风干、去除根系结构、过筛等措施导致土壤团聚体发生极大破坏,从而造成异位土壤NO 通量明显减小。曹元良等[14]在国家紫色土肥力定位监测点,对垄作免耕和常规轮作两种耕作方式下,不同大小土壤团聚体中几种形态氮素含量及脲酶活性分布模式进行了为期18年的研究。研究发现垄作免耕下各团聚体中全氮、微生物生物量氮及脲酶活性显著高于常规轮作。垄作免耕对土壤团聚体的破坏显著小于常规轮作。同理,原位土壤团聚体遭受破坏程度远小于异位土壤。因此,异位土壤相对于原位土壤NO 通量显著降低原因可能在于原位土壤保护土壤团聚体中全氮免遭矿化,有利于微生物硝化作用[14]。

|
| 图 1 含水率对土壤NO 通量的影响(n=3) Figure 1 Effect of water content on soil NO fluxes **, *分别表示同一含水率原位与异位土之间差异在0.01、0.05水平显著;不同小写字母表示原位与异位处理下不同含水率之间在0.05水平差异显著 |
从图 1A 可知,好氧条件下,原位土壤含水率为20%MWHC 时,土壤NO通量最大。随着含水率增加,NO通量不断减少且不同含水率之间NO 通量差异显著(P<0.05)。厌氧条件下(图 1B),原位土壤NO通量对含水率的响应与好氧条件下一致。说明含水率是影响原位土壤NO 通量的重要因素。异位土壤在厌氧及好氧情况下均表现为:当土壤含水率为20%、50%MWHC 时,NO通量几乎相同,当土壤含水率为80%MWHC 时,NO通量显著减小。说明异位土壤只有当含水率达到一定值时才会抑制异位土壤NO排放。原因可能在于:当土壤可利用的水分较少时,微生物活性由于细胞内水势降低引起的水合作用酶活性下降而受到抑制。此外,土壤水分含量低亦会造成养分供应受限,从而降低微生物活性。但是,当土壤含水率超过某一水平时,土壤环境的厌氧程度增加,反硝化作用起主导作用,N2O、N2气体增加,NO 通量也将逐渐减少[15]。此外,淹水状态下,由于土壤扩散限制产生的NO 也很难从土壤释放到大气中[16],进一步导致NO通量随着土壤含水率增加而减小。MWHC 约为60%水分填充孔隙体积(Water-filled pore space,WFPS)。Yang 等[17]在恒温室内培养条件下发现:土壤NO 最大排放量出现在10%WFPS(约为16.5%MWHC)。Pi-legaard 等[18]在野外测定4 月与9 月NO 排放情况,得出当土壤含水率为20%WFPS 时,NO 排放量最大。这些研究进一步证实土壤NO 排放存在最适含水率值。
2.3 好氧和厌氧条件下土壤NO 通量差异通过对比图 1A、图 1B 可得出,除80%MWHC 异位土壤外,厌氧条件下土壤NO通量均显著大于好氧条件(P<0.05),原因可能在于:不同氧气浓度范围,硝化细菌以及反硝化细菌在陆地生态系统土壤NO 产生中发挥重要作用。在氧气充足条件下,大部分NO来自铵态氮被氧化为亚硝态氮(硝化作用),少部分NO来源于硝态氮还原为亚硝态氮(反硝化作用)。相反,厌氧环境,绝大部分NO 产生于反硝化作用,硝化作用几乎不发生。且厌氧条件下NO通量速率远大于好氧条件下。因此,室内培养条件下,NO 通量速率随着氧分压减少而增大。Russow等[19]通过15N 同位素标记实验得出当空气氧气分压为0 时,87%的NO 通过反硝化作用产生,并且厌氧条件下NO 排放量是好氧条件下4 倍,与本研究结果基本一致。
2.4 温度对原位土壤NO 通量的影响如图 2 所示,好氧条件下,温度对原位土壤NO通量影响表现为:土壤温度为25℃时,NO 通量达到最大值,小于或者大于25℃,NO 通量均减小。厌氧条件下,原位土壤NO 通量对温度的响应与好氧条件相一致,即25℃时,土壤NO 通量最大。15℃与35℃好氧及厌氧条件下NO 通量几乎相等,25℃时,厌氧条件下土壤NO 通量极显著大于好氧条件。对于所有生物过程,温度都是一个重要调控因子。特定微生物群落对最适温度响应不同。当土壤温度为35℃时,热带土壤NO 排放量最大[9];在比较寒冷的区域,硝化细菌活性在2~10℃时最大[20]。本研究土壤所在地区为亚热带季风气候,年平均气温为20~25℃,据此也可推断NO 产生最适温度为20~25℃,这与本研究结果相符。

|
| 图 2 温度对土壤NO通量的影响 Figure 2 Effect of temperature on soil NO fluxes ** 表示相同温度处理下好氧和厌氧条件之间差异在0.01水平显著;不同小写字母表示好氧和厌氧条件下不同温度之间差异在0.05水平显著 |
如图 3 所示,当土壤未灭菌时,好氧和厌氧条件对土壤NO 通量影响显著,厌氧土壤NO 通量是好氧土壤NO 通量10倍左右。而对于灭菌土壤,无论是好氧和厌氧,土壤NO 通量几乎相同。好氧和厌氧条件下,非生物过程在NO 产生中所占比重分别为8%和0.8%。可见生物过程是土壤NO 产生的主要过程,且进一步证明厌氧条件下土壤NO 通量显著大于好氧条件。产生NO 非生物过程主要为化学反硝化作用。化学反硝化作用为低pH 下,NO2-或者NO3-被还原为气态氮无酶参与的化学过程。这个过程需要铵根离子、胺或者还原性金属(如Fe2+)、高土壤有机质及土壤含水率。pH 是土壤化学反硝化作用主要控制因素。NO2-浓度、温度以及土壤含水率被当作另外控制因素[3]。此外,为了防止灭菌过程对土壤NO通量产生影响,待土壤温度降为常温且在调整含水率前将高温高压灭菌过程中产生的气体抽出,并使用高纯氮气反复冲洗,使土壤处于完全厌氧的状态,可能是由于这一步骤导致未灭菌土壤NO 通量远大于同一条件下只在土壤表面吹扫氮气时土壤NO 通量。

|
| 图 3 ** 表示灭菌与未灭菌之间差异在0.01水平显著;不同小写字母表示灭菌、未灭菌处理下好氧与厌氧之间差异在0.05 水平显著 Figure 3 **indicate significant difference between sterilization and non sterilization at the 0.01 probability lever; different lowercase letters indicate significant difference between aerobic and anaerobic condition at the 0.05 probability lever 灭菌对异位土壤NO通量的影响 |
基于不同环境因子对南方典型蔗田原位和异位土壤NO 通量影响的研究表明,原位土壤NO 通量显著大于异位土壤,原位土柱代表了野外实际情况,因此以前使用过筛土壤进行试验可能低估了土壤NO的通量;厌氧条件下土壤NO 通量显著大于好氧条件,说明反硝化过程在NO 产生中起主要作用,且是一个微生物主导的反硝化过程;土壤含水率为20%MWHC 时,该地农田土壤NO 通量最大,随着含水率增加,NO 通量迅速减少;特定微生物群落对最适温度响应不同,当温度为年平均气温25℃左右时,该农田土壤NO 通量达到最大值。
| [1] | Ludwig J, Meixner F X, Vogel B, et al. Soil-air exchange of nitric oxide:An overview of processe, environmental factors, and modeling studies[J]. Biogeochemistry , 2001, 52 (3) : 225–257. DOI:10.1023/A:1006424330555 |
| [2] | Galloway J N, Aber J D, Erisman J W, et al. The nitrogen cascade[J]. Bioscience , 2003, 53 (4) : 341–356. DOI:10.1641/0006-3568(2003)053[0341:TNC]2.0.CO;2 |
| [3] | Medinets S, Skiba U, Rennenberg H, et al. A review of soil NO transformation:Associated processes and possible physiological significance on organisms[J]. Soil Biology and Biochemistry , 2015, 80 : 92–117. DOI:10.1016/j.soilbio.2014.09.025 |
| [4] | Kesik M, Ambus P, Baritz R, et al. Inventories of N2O and NO emissions from European forest soils[J]. Biogeosciences , 2005, 2 (4) : 353–375. DOI:10.5194/bg-2-353-2005 |
| [5] | 韦云东, 姚志生, 罗献宝, 等. 茶园生态系统的一氧化氮年排放特征[J]. 农业环境科学学报 , 2015, 34 (8) : 1610–1617. WEI Yun-dong, YAO Zhi-sheng, LUO Xian-bao, et al. Annual fluxes of nitric oxide from a tea plantation ecosystem[J]. Journal of Agro-Environment Science , 2015, 34 (8) : 1610–1617. |
| [6] | Ciais P, Sabine C, Bala G, et al. Carbon and other biogeochemical cycles[M]//Climate Change 2013:The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, 2014:465-570. |
| [7] | Arah J R M. Apportioning nitrous oxide fluxes between nitrification and denitrification using gas-phase mass spectrometry[J]. Soil Biology and Biochemistry , 1997, 29 (8) : 1295–1299. DOI:10.1016/S0038-0717(97)00027-8 |
| [8] | Robertson G P, Groffman P M. Nitrogen transformations[M]//Soil Microbiology, Ecology and Biochemistry. 3rd Edition. New York:Academic Press, 2007:341-364. |
| [9] | Myers R J K. Temperature effects on ammonification and nitrification in a tropical soil[J]. Soil Biology and Biochemistry , 1975, 7 (2) : 83–86. DOI:10.1016/0038-0717(75)90003-6 |
| [10] | Yao Z, Wu X, Wolf B, et al. Soil-atmosphere exchange potential of NO and N2O in different land use types of Inner Mongolia as affected by soil temperature, soil water content, freeze-thaw, and drying-wetting events[J]. Journal of Geophysical Research-Atmospheres , 2010, 115 (D17) : 1383–1392. |
| [11] | 张辉, 张佳宝, 赵炳梓, 等. 高温高压间歇灭菌对中国典型土壤性质的影响[J]. 土壤学报 , 2011, 48 (3) : 540–548. ZHANG Hui, ZHANG Jia-bao, ZHAO Bing-zi, et al. Influence of autoclaving sterilization on properties of typical soils in China[J]. A cta Pedologica Sinica , 2011, 48 (3) : 540–548. |
| [12] | Liu X J, Mosier A R, Halvorson A D, et al. The impact of nitrogen placement and tillage on NO, N2O, CH4 and CO2 fluxes from a clay loam soil[J]. Plant and Soil , 2006, 280 (1/2) : 177–188. |
| [13] | Ludwig J, Meixner F X, Vogel B, et al. Soil-air exchange of nitric oxide:An overview of processes, environmental factors, and modeling studies[J]. Biogeochemistry , 2001, 52 (3) : 225–257. DOI:10.1023/A:1006424330555 |
| [14] | 曹良元, 张磊, 蒋先军, 等. 长期垄作免耕对不同大小土壤团聚体中几种氮素形态分布的影响[J]. 植物营养与肥料学报 , 2009, 15 (4) : 824–830. CAO Liang-yuan, ZHANG Lei, JIANG Xian-jun, et al. Effects of long-term ridge tillage on distribution of different nitrogen forms of soil water stable aggregates[J]. Plant Nutrition and Fertilizer Science , 2009, 15 (4) : 824–830. |
| [15] | Firestone M K, Davidson E A. Microbiological basis of NO and N2O production and consumption in soil[J]. Exchange of Trace Gases Between Terrestrial Ecosystems and the Atmosphere , 1989, 47 : 7–21. |
| [16] | Frank S, Peter S, Kuypers M M M, et al. Nitric oxide turnover in permeable river sediment[J]. Limnology & Oceanography , 2014, 59 (4) : 1310–1320. |
| [17] | Yang W X, Meixner F X. Laboratory studies on the release of nitric oxide from sub-tropical grassland soils:The effect of soil temperature and water content[J]. Gaseous Nitrogen Emissions From Grasslands , 1997 : 67–71. |
| [18] | Pilegaard K, Hummelshøj P, Jensen N O. Nitric oxide emission from a Norway spruce forest floor[J]. Journal of Geophysical Research:Atmospheres , 1999, 104 (D3) : 3433–3445. DOI:10.1029/1998JD100050 |
| [19] | Russow R, Stange C F, Neue H U. Role of nitrite and nitric oxide in the processes of nitrification and denitrification in soil:Results from 15N tracer experiments[J]. Soil Biology and Biochemistry , 2009, 41 (4) : 785–795. DOI:10.1016/j.soilbio.2009.01.017 |
| [20] | Avrahami S, Conrad R. Cold-temperate climate:A factor for selection of ammonia oxidizers in upland soil[J]. Canadian Journal of Microbiology , 2005, 51 (8) : 709–714. DOI:10.1139/w05-045 |
 2016, Vol. 35
2016, Vol. 35





