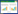文章信息
- 费杨, 阎秀兰, 廖晓勇, 李永华, 林龙勇, 单天宇
- FEI Yang, YAN Xiu-lan, LIAO Xiao-yong, LI Yong-hua, LIN Long-yong, SHAN Tian-yu
- 铁锰双金属材料对As和重金属复合污染土壤钝化修复及其生态效应的影响
- Stabilization effects and ecological impacts on As and heavy metal co-contaminated soils stabilized by Fe-Mn binary oxides
- 农业环境科学学报, 2017, 36(1): 57-65
- Journal of Agro-Environment Science, 2017, 36(1): 57-65
- http://dx.doi.org/10.11654/jaes.2016-0992
文章历史
- 收稿日期: 2016-08-01
2. 中国科学院陆地表层格局与模拟重点实验室, 北京 100101;
3. 中国科学院大学, 北京 100049;
4. 广东省环境科学研究院, 广州 510045
2. Beijing Key Laboratory of Environmental Damage Assessment and Remediation, Beijing 100101, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Guangdong Provincial Academy of Environmental Science, Guangzhou 510045, China
由于工业“三废”排放、污水灌溉、污泥农用、畜禽粪便、化肥农药等的不合理施用,造成土壤中重金属不断超负荷累积。我国面临的土壤环境安全问题日益严峻。2014 年4月,由环境保护部和国土资源部联合发布的《全国土壤污染状况调查公报》[1]显示,全国土壤环境状况总体不容乐观,耕地土壤环境质量堪忧,点位超标率达19.4%,对农产品质量安全和人体健康构成了严重威胁。
土壤钝化技术是一种经济高效的重金属污染治理技术,通过向土壤中添加一种或多种活性材料,利用化学措施改变重金属在土壤中的赋存形态,使其生物有效性和迁移性降低,从而减轻重金属的毒害作用[2]。已有大量研究表明,石灰等pH控制剂、FeSO4等氧化还原控制剂、磷酸盐等沉淀剂、氧化铁等吸附剂和沸石等离子交换剂等,能够通过沉淀、吸附、络合、氧化还原等一系列化学反应,对土壤中Pb、Zn、Cu、Cd、Cr、As等重金属起到钝化作用[3-4]。但是在修复过程中,钝化剂作为一种外源添加物质,会对土壤基本理化性质和生态环境产生影响,从而影响作物的生长及土壤微生物群落等。已有研究表明,在重金属污染土壤修复过程中施用钝化剂海泡石、沸石、赤泥等可使土壤真菌数量降低[5-6]。姜华等[7]研究发现,在污泥堆肥中添加粉煤灰、磷矿粉和草炭等钝化剂,均能提高水田芥种子的发芽指数。然而已有研究仍多集中在钝化材料的修复效率以及土壤中重金属的形态转化方面,对于添加钝化材料后土壤生产功能的恢复以及生态环境的变化研究较少。钝化修复后的土壤能否继续作为粮食安全生产的载体,满足我国可持续农业发展的需要,也越来越受到土壤学家和环境学家的广泛关注。
前期研究发现,通过氧化还原和共沉淀反应生成的铁锰双金属材料(Fe-Mn Binary Oxides,FMBO),结构疏松,比表面积大,表面羟基基团-OH 丰富,具有氧化和吸附的双重作用,能够使As和重金属复合污染土壤的毒性浸出浓度降低[8-9]。本文拟通过室内模拟培养实验,重点探讨不同添加量的FMBO 材料对复合污染土壤中As和重金属有效态的影响,并通过种子发芽实验和微生物多样性测定评估FMBO 材料施用对土壤生态环境的影响,以期为钝化修复后土壤的再利用提供科学指导。
1 材料与方法 1.1 供试材料和土壤 1.1.1 铁锰双金属材料的制备铁锰双金属材料具体合成步骤及理化性质测定方法详见文献[8]。FMBO 材料是一种无定形态的棕褐色粉末状材料,体积平均粒径D[4, 3]为33.7 μm,比表面积为155.7 m2·g-1,Fe、Mn 含量分别为37.9%、12.7%,Fe 和Mn 分别以Fe(Ⅲ)和Mn(Ⅳ)的氧化态存在。
1.1.2 供试土壤污染土壤分别采自辽宁大连(38°58'6''N,121°38'1''E)、湖南郴州(25°35'49''N,112°32'25''E)、湖南株洲(27°52'38''N,113°04'24''E),均为由附近矿产采选冶活动、工业废渣及尾砂无序堆放造成的As 和重金属复合污染农田土壤,污染元素主要为As、Pb、Cd、Zn、Cu等。其中辽宁大连土壤采样区靠近大连某化工厂,生产过程中有大量含氧化铁的废渣排放到土壤中,导致土壤铁含量较高;湖南郴州土壤采样区位于黄沙寺尾矿库附近,历史上由于尾矿库溃坝曾导致大量尾砂进入土壤中;株洲土壤属于耕层土壤,受到附近某化工厂废水废渣乱排污染后已弃耕多年,地力有所恢复,草本植被茂密,有机质含量较高。各供试土壤采样深度0~20 cm,土样自然风干后,研磨过2 mm 筛,均匀混合后储存备用。供试土壤基本理化性质见表 1,分析方法参照《土壤农化分析》[10]。
称量供试土壤200.0 g于250 mL 三角瓶中,分别按质量百分比0%、1%、2.5%、5%加入FMBO 材料,充分搅拌使其混匀,调节土壤含水率为25%左右,然后用封瓶膜封好瓶口,以减少水分的散失,置于人工气候箱(温度25±2℃,相对湿度96%)中进行培养,每个处理3 次重复。培养30 d后取样,进行重金属有效态提取。重金属有效态采用0.01 mol·L-1 CaCl2溶液浸提[11],液固比10:1,翻转振荡器转速30 r·min-1,振荡2 h 后过滤,于4℃下保存待测。
1.3 种子发芽实验分别称量15.0 g上述培养30 d 后的不同处理土壤,加入30 mL 去离子水(水土比2:1),160 r·min-1 水平振荡1 h,过滤至方塑瓶中保存[12]。将小麦种子(轮选987,国审麦2003017 号,购于中国农业科学院作物科学研究所)放入烧杯中用去离子水洗去杂物,1%NaClO 消毒10 min,洗净,再将小麦种子浸泡于30℃去离子水中3 h,捞出,备用。在培养皿(直径9 cm)内放入两张等径滤纸做发芽床,加入6 mL 土壤浸提液,每个发芽床上摆放25粒种子,盖上培养皿盖,置于人工气候箱中培养(温度20℃、湿度96%,光照条件),每两天补充2 mL浸提液。同时用添加去离子水的处理作空白对照,每个处理3 次重复。分别于第3 d和第7 d 统计发芽种子的数量,计算发芽势和发芽率,第7 d每个处理随机挑选10 株幼苗测量株高和根长(最长根)。
发芽势(%)=3 d已发芽的种子数/总粒数伊100%
发芽率(%)=全部发芽的种子粒数/总粒数伊100%
1.4 土壤微生物多样性分析培养30 d 后,取FMBO 添加量为0%、2.5%的3种复合污染土壤进行土壤微生物多样性分析,采用PCR-DGGE法。土壤总DNA 的提取与纯化参照文献[13]进行,土壤DNA 的PCR 扩增参照文献[14-15]并加以改进,将纯化后的DNA 作为PCR 的模板,采用通用引物GC-338F 和518R 扩增16S rDNA 的高变区序列。PCR 产物采用Axygen 公司DNA Gel Ex原traction Kit 纯化回收,取10 μL 产物进行变性梯度凝胶电泳(DGGE),采用变性梯度为35%~55%、浓度为8%的聚丙烯酰胺凝胶,在1伊TAE 缓冲液中150 V、60益下电泳4 h。DGGE完毕后,采用改进的硝酸银染色法进行染色,观察样品的电泳条带并拍照。DGGE 电泳图谱分析采用Bio-Rad公司的Quantity one 分析软件进行。根据条带数目、分布与灰度值计算丰富度香农-威纳多样性指数Shannon -Weiner Index(H)、Richness(S)和均匀度Evenness(E),来评价土壤微生物多样性,其计算公式如下:
H=-Σpi ln(pi)
E=H/Hmax = H/ln S戴斯相似性系数代表各样品间微生物种群结构的相似度,数值越大,两样品间相似度越大。
1.5 化学分析土壤中As和重金属元素总量测定采用微波消解的方法[16]。称量0.2000 g过100 目筛的样品于聚四氟乙烯消解罐中,加入9 mL 浓硝酸和3 mL 氢氟酸,浸泡30 min,再放入微波消解仪(XH-800B,北京祥鹄科技)中消解。溶液中的As使用氢化物发生-原子荧光光谱仪(AFS-9130 型,北京吉天仪器)进行测定,其他重金属包括Fe、Mn 使用ICP-OES(Agilent 5100)进行测定。土壤样品分析过程中采用国家标准参比物质(土壤GBW 07404 和GBW 07402)进行分析质量控制,标样测定结果均在参比物质允许误差范围内。本研究所用试剂除As含量测定所用硼氢化钾和盐酸为优级纯,其余均为分析纯,实验用水为超纯水(PALLCascada AN MK2)。
1.6 数据处理采用Microsoft Excel 2013、SAS 8.0、Origin 8.5 软件进行数据统计分析并作图。
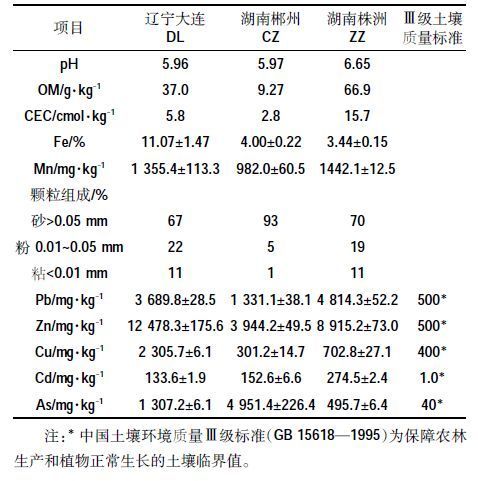
2 结果 2.1 FMBO材料对土壤重金属有效性的影响土壤中的有效态重金属是指能够被植物所吸收的活性较高的部分,其浓度过高会对土壤-植物系统产生毒害作用[17]。从图 1 可以看出,添加FMBO 材料后,3 种复合污染土壤中As 和重金属的有效态浓度均降低,且在0%~5%范围内随着材料添加量的增加,其有效态浓度逐渐降低。FMBO 材料对复合污染土壤中As 有较好的钝化作用,培养30 d 后,与不添加钝化材料的对照处理相比,以1%、2.5%、5%质量百分比添加FMBO 的土壤提取液中,DL 土壤中As 的提取浓度由36.2 μg·L-1分别降低至22.7、3.76、2.27 μg·L-1,CZ 土壤中As 的提取浓度由93.5 μg·L-1 分别降低至60.5、5.59、4.92 μg·L-1,ZZ土壤中As 元素的提取浓度由9.85 μg·L-1分别降低至2.40、1.40 μg·L-1和未检出。当FMBO添加量超过2.5%时,3种复合污染土壤中As的有效态浓度均能降低85%以上,低于我国Ⅲ类地下水环境质量标准(GB/T 14848—93,As≤50 μg·L-1)。
|
| 图 1 中不同土壤中添加FMBO材料后土壤中As和重金属的有效态浓度变化文标题 Figure 1 Concentrations of CaCl2-extractable As and heavy metals after adding FMBO in different soils 图中虚线表示我国Ⅲ类地下水质量标准(GB/T 14848—1993,标准值As≤0.05 mg·L-1,Pb≤0.05 mg·L-1,Cd≤0.01 mg·L-1,Zn≤1.0 mg·L-1,Cu≤1.0 mg·L-1),以人体健康基准值为依据,主要适用于集中式生活饮用水水源及工、农业用水。不同字母表示处理间在0.05水平差异显著,n=3 |
FMBO 材料除对As有较好的钝化作用外,也能够显著降低复合污染土壤中Pb、Cd、Zn、Cu 等重金属元素的有效态含量(图 1)。培养30 d 后,相比于不添加钝化材料的对照处理,以5%质量百分比添加FM-BO 的土壤有效态提取液中,DL土壤中Pb、Cd、Zn、Cu的有效态浓度分别下降了30.8%、93.2%、86.6%、55.8%,CZ 土壤中Pb、Cd、Zn、Cu 的有效态浓度分别下降了53.7%、95.0%、95.3%、100%,ZZ 土壤中Pb、Cd、Zn、Cu 的有效态浓度分别下降了57.8%、81.3%、66.7%、63.0%。当材料添加量为5%时,CZ和ZZ土壤Pb、Zn 的有效态浓度低于我国Ⅲ类地下水环境质量标准(GB/T 14848—93,Pb≤0.05 mg·L-1,Zn≤1.0 mg·L-1)。
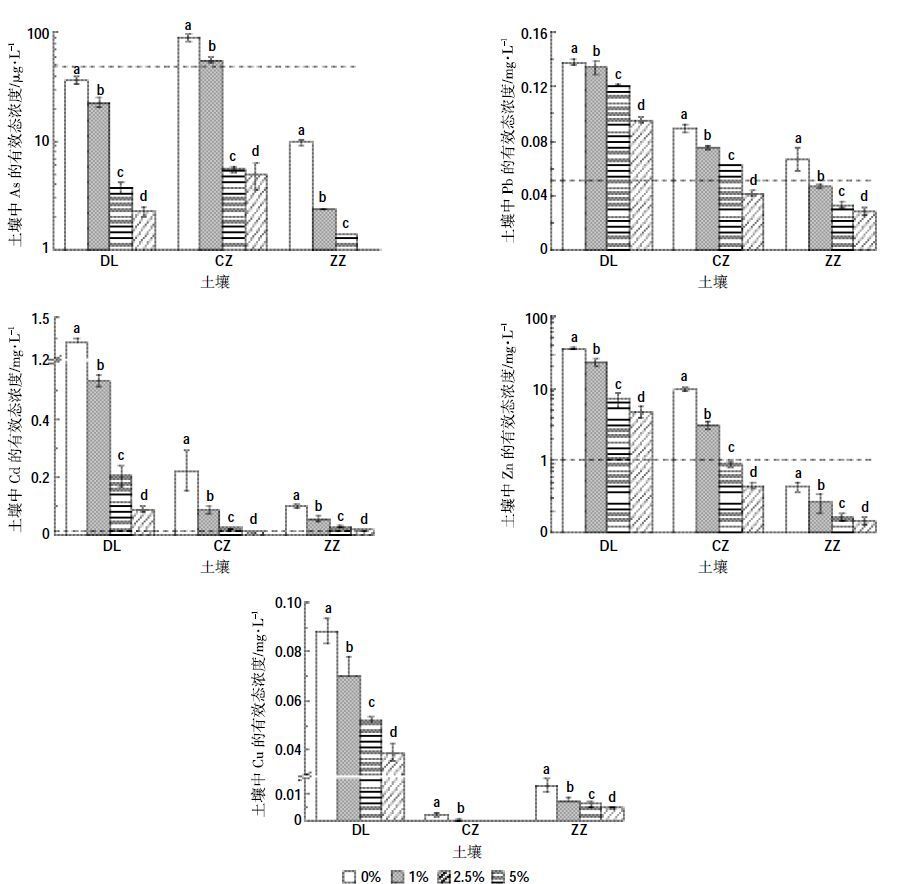
2.2 FMBO材料对种子萌发的影响发芽势和发芽率是反映种子生命力的重要指标,而株高和根长反映了种子萌发后的生长状况,对环境重金属的影响相对敏感[18]。从图 2 可以看出,与去离子水处理相比,不添加FMBO 材料(0%添加量)的3种复合污染土壤浸出液培养的小麦种子萌发及生长情况均受到抑制,DL、CZ 和ZZ 土壤浸出液培养的小麦种子发芽势分别降低了17%、17%、11%,发芽率分别降低了10%、20%、12%,根长分别减少了4.06、4.62、3.34 cm,株高分别减少了1.58、2.54、1.27 cm。
|
| 图 2 不同FMBO添加量土壤浸出液处理对小麦种子发芽势、发芽率、根长及株高的影响 Figure 2 Germination force and rate,root and seedling length of wheat seeds in different soil extracts treated by FMBO H2O:去离子水处理小麦种子发芽势、发芽率、根长及株高 |
从图 2a 可以看出,DL 和CZ 土壤在FMBO 添加量为2.5%时,浸出液培养的小麦种子发芽势较高,分别能达到74%、64%,而ZZ 土壤在FMBO 添加量为1%时,种子的发芽势最高达到74%。从图 2b至图 2d可以看出,不同FMBO 添加量处理的污染土壤浸出液培养的小麦种子发芽率、根长和株高表现出相似的规律。当FMBO 材料添加量≤2.5%时,小麦种子发芽率、根长和株高随FMBO 添加量的增加呈现增加的趋势,但是当FMBO 添加量增加到5%时,反而出现显著下降的趋势。当FMBO 添加量为2.5%时,DL、CZ、ZZ 土壤浸出液培养的小麦种子萌发和生长情况最优,发芽率分别能达到92%、82%、86%,根长分别能达到8.75、7.25、9.09 cm,株高分别能达到9.73、8.62、9.91 cm。当FMBO 添加量为5%时,3 种复合污染土壤浸出液培养的小麦种子发芽率和根长甚至低于不添加FMBO 材料的对照处理。
图 3 所示为种子发芽实验土壤浸出液中Fe、Mn元素的浓度。从图中可以看出,不同FMBO 材料添加量条件下,Fe 元素浸出浓度变化相对较小,5%添加量时浸出浓度相较于2.5%添加量时有所增加,DL、CZ、ZZ 土壤分别能够达到12.33、10.47、14.68 mg·L-1。随着FMBO 材料添加量的增加,土壤中Mn 元素的浸出浓度呈现先降低后升高的趋势。不添加材料的对照处理Mn 元素浸出浓度最高,DL、CZ、ZZ 土壤分别为4.53、26.73、0.43 mg·L-1。随着FMBO 材料添加量增加,Mn 元素的浸出浓度逐渐降低,当材料添加量为2.5%时,DL、CZ、ZZ土壤中Mn浸出浓度最低,分别为0.72、1.83、0.11 mg·L-1。当材料添加量达到5%时,DL、CZ、ZZ 土壤中Mn 浸出浓度升高,分别达到1.28、8.04、0.24 mg·L-1。
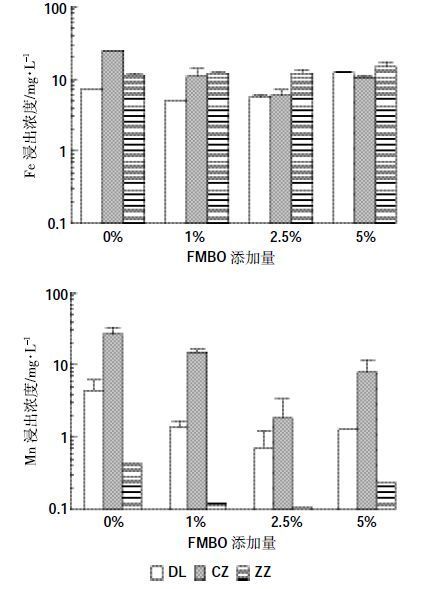
|
| 图 3 不同FMBO添加量处理污染土壤浸提液中Fe 和Mn 的浓度 Figure 3 Fe and Mn concentrations of soil leachates after adding FMBO |
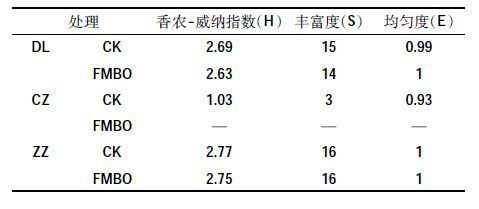
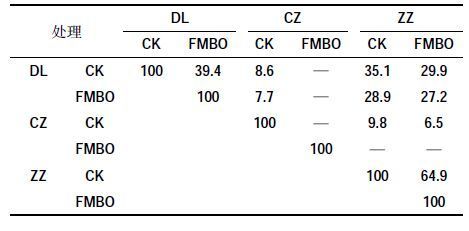
土壤微生物多样性是评价自然或人为干扰引起土壤质量变化的重要指标。图 4 是FMBO 材料添加量为2.5%时3 种复合污染土壤微生物提取的DGGE胶图。表 2 列出了添加FMBO 材料后3 种复合污染土壤中微生物的多样性指标,从表中香农-威纳指数可以看出,当FMBO 材料添加量为2.5%时,3 种土壤中微生物多样性均有一定程度的降低,DL和ZZ 土壤中添加FMBO 材料后,香农-威纳指数分别从2.69、2.77降至2.63、2.75。结合丰富度和均匀度指标来看,土壤微生物多样性虽有降低但变化不大,而CZ 土壤添加FMBO 材料后,香农-威纳指数从1.03 降低至未检出。戴斯相似性系数代表了各样品间微生物种群结构的相似度,从表 3 可以看出,添加FMBO 后3 种复合污染土壤中微生物群落的组成均发生了变化,ZZ土壤添加FMBO 材料与未添加相比,戴斯相似系数为64.9,土壤中微生物群落的组成变化最小,DL 土壤添加FMBO后土壤微生物群落与CK 相比变化较大,戴斯相似系数仅为39.4。以上结果表明,尽管FMBO材料会使土壤中微生物群落组成发生变化,但仍然可以保持一定的微生物多样性。
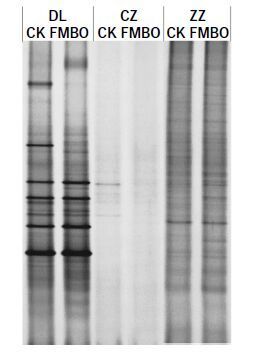
|
| 图 4 添加FMBO后3种复合污染土壤微生物提取的DGGE图谱 Figure 4 DGGE profiles of microbial communities from three co-contaminated soils after adding FMBO |
 |
 |
通过改变污染土壤中重金属形态进行风险控制是钝化修复的核心思路,修复后土壤能否恢复原有的生产功能,是解决我国大面积农田重金属污染问题的关键。本文研究了3种重金属复合污染土壤添加钝化材料FMBO 进行修复对土壤生态效应的影响,结果发现,FMBO 材料可以显著降低污染土壤中As、Pb、Cd、Zn、Cu等重金属的有效态含量,使植物对重金属的吸收减少,能够起到降低风险的作用。此外,土壤中的有效态污染物易随雨水淋溶发生纵向迁移,是造成地下水污染的主要途径[19]。经过钝化修复后,部分处理的As 和重金属浸出浓度可低于我国Ⅲ类地下水环境质量标准(GB/T 14848—1993)。大量研究表明,FMBO 材料对As 元素有很好的吸附作用,其主要通过表面羟基-OH 基团与砷酸根或亚砷酸根离子结合,形成内表面和外表面螯合物,对土壤中的As 能够起到氧化解毒和吸附的双重作用[8, 20-21]。费杨等[9]研究发现,FMBO 也能通过吸附和沉淀等多种方式对土壤中的Pb、Cd、Zn、Cu 等重金属起到稳定化作用,使其TCLP毒性浸出浓度降低。
FMBO 材料钝化对As 和重金属复合污染土壤生态效应的影响,可以通过土壤中植物的生长发育情况表现出来[22]。从本文种子发芽实验可知,与去离子水处理相比,3 种污染土壤浸出液培养的小麦种子发芽势、发芽率、根长及株高均显著降低,说明重金属污染物对种子的萌发及生长均有一定的抑制作用,想要恢复土壤原有的生产功能需要对土壤实施必要的修复措施。大量研究表明,重金属污染物可以通过影响生物的细胞膜结构和渗透性而产生毒性作用,另外还能通过影响生物体内酶的活性而产生毒性效应,从而阻碍了植物的生长发育[22]。由本文重金属有效态提取结果可知,FMBO 材料能够显著降低污染土壤中重金属的活性,在FMBO 材料添加量为0%~2.5%范围内,污染土壤浸出液培养的小麦种子发芽率、根长和株高随FMBO 添加量的增加均呈现增加的趋势,说明FMBO能够通过对重金属污染物的钝化,对污染土壤中种子的萌发及生长起到一定的减毒作用。但是当FMBO添加量增加到5%时,小麦种子的发芽率、根长和株高均显著降低,说明FMBO 添加量过高会对种子萌发及生长产生抑制作用。图 3给出了种子发芽实验土壤浸出液中Fe、Mn 元素浓度,产生该现象可能是由于FMBO 添加量过高导致Mn2+浸出浓度增加而产生的锰毒作用,Fe 元素的影响则较小。Fe 元素的毒害作用一般通过亚铁离子表现出来,蒿宝珍等[23]通过水培实验研究了Fe2+对小麦种子萌发及生长的影响,结果表明Fe2+浓度≥50 mg·L-1对小麦根伸长有抑制作用,≥150 mg·L-1 时才会对种子发芽率和幼苗生长产生抑制作用。本研究不同处理土壤浸出液中Fe 元素的浓度基本在10 mg·L-1左右,并不会产生铁毒作用。侯典云等[24]研究了不同浓度Mn2+对小麦种子萌发和幼苗生长的影响,结果表明当Mn2+浓度超过0.2 mg·L-1 时即可产生锰毒作用。本研究土壤浸出液中Mn2+的浓度与小麦种子萌发及生长的抑制作用保持高度的一致性,从而判断出该变化与Mn 的毒害作用有关。前期研究表明,FMBO 材料中锰元素主要以Mn(Ⅳ)氧化态存在[8],而土壤中含有的还原物质,如Fe(Ⅱ)、As(Ⅲ)、NH4+等,以及微生物活动产生的有机还原性物质,均会使Mn(Ⅳ)还原为Mn2+,导致土壤浸出液中Mn2+浓度升高。高浓度的Mn2+不但会抑制植物根系对Ca2+、Fe2+和Mg2+等必需元素的吸收及活性,还能够引起氧化性胁迫造成氧化损伤,导致C、N 同化代谢相关酶和蛋白质含量降低,从而影响植物生长发育[25]。图 3中,FMBO 材料添加量为5%时,与不添加材料的对照处理相比,Mn2+的浸出浓度虽然低,但其对小麦种子发芽率和根长的抑制作用更强(图 2),该现象可能与材料所含高价Mn(Ⅳ)的氧化性有关。以上结果表明,在进行重金属污染土壤的钝化修复前,需要从钝化效果和生态效应影响两方面进行考虑,确定修复材料的最佳添加量,在保证一定的修复效率的同时,兼顾土地再利用对土壤生态环境的要求,尽可能恢复其最大生产力。结合以上研究结果,针对3 种重金属复合污染土壤,FMBO 钝化材料的最佳添加量为2.5%。
另外,FMBO 材料钝化对As 和重金属复合污染土壤生态效应的影响,可以通过土壤微生物群落的变化情况表现出来[22]。土壤微生物是土壤有机质和土壤养分转化和循环的主要动力,其多样性是土壤生态系统结构及功能稳定性的重要指示因子,也是评价自然或人为干扰引起土壤质量变化的重要指标[26]。从土壤微生物多样性分析结果可以看出,3 种复合污染土壤的微生物多样性为ZZ>DL>CZ,在ZZ 和DL 土壤中添加FMBO 材料后,土壤微生物多样性虽有降低但变化不大,而CZ土壤添加FMBO 材料后,香农-威纳指数降低至未检出。这种差异可能与钝化材料的添加和土壤本身理化性质两方面有关。3种复合污染土壤的有机质含量依次为ZZ(66.9 g·kg-1)>DL(37.0 g·kg-1)>CZ(9.27 g·kg-1),结合种子发芽实验与土壤微生物多样性分析,土壤有机质含量与重金属污染对小麦种子根长和株高以及土壤微生物多样性的抑制作用呈负相关关系,抑制程度为CZ>DL>ZZ,与宋玉芳等[27]研究结果一致。土壤中的有机质具有丰富的表面基团且能通过螯合作用稳定土壤中的有毒有害物质,使土壤具有一定的缓冲特性[28],且有机质是土壤中微生物进行生长繁殖的碳源,有机质含量丰富的土壤中添加FMBO 可以减轻钝化材料给土壤微生物群落带来的负面作用。CZ复合污染土壤由于重金属浓度高且掺有大量尾砂,微生物多样性匮乏,说明矿业活动对土壤生态环境的破坏很大,FMBO 材料的添加加剧了其对微生物群落的破坏作用。综上所述,对有机质含量较低的污染土壤,在使用FMBO 材料进行钝化修复时,配合添加有机质可以使FMBO 对土壤生态环境的影响降到最小。
4 结论添加FMBO 材料能够使复合污染土壤中As 和重金属的有效态含量降低,起到降低环境风险的作用。在添加量为0%~2.5%范围内,FMBO 能够对污染土壤中植物的生长发育起到一定的减毒作用,而当添加量达到5%时,由于Mn2+的释放,反而对种子的萌发及生长产生抑制作用。FMBO 材料会使土壤中微生物多样性降低,群落组成发生变化。
| [1] | 中华人民共和国环境保护部, 中华人民共和国国土资源部. 全国土壤污染状况调查公报[EB/OL]. http://www.zhb.gov.cn/gkml/hbb/qt/201404/W020140417558995804588.pdf.2014. Ministry of Environmental Protection of PRC, Ministry of Land and Resources of PRC. The investigation communique of soil pollution condition of China[EB/OL]. http://www.zhb.gov.cn/gkml/hbb/qt/201404/W020140417558995804588.pdf.2014. |
| [2] | 王立群, 罗磊, 马义兵, 等. 重金属污染土壤原位钝化修复研究进展[J]. 应用生态学报, 2009, 20(5) : 1214–1222. WANG Li-qun, LUO Lei, MA Yi-bing, et al. In situ immobilization remediation of heavy metals-contaminated soils:A review[J]. Chinese Journal of Applied Ecology, 2009, 20(5) : 1214–1222. |
| [3] | Guo G L, Zhou Q X, Ma L Q. Availability and assessment of fixing additives for the in situ remediation of heavy metal contaminated soils:A review[J]. Environmental Monitoring and Assessment, 2006, 116(1/2/3) : 513–528. |
| [4] | Kumpiene J, Lagerkvist A, Maurice C. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments:A review[J]. Waste Management, 2008, 28(1) : 215–225. DOI:10.1016/j.wasman.2006.12.012 |
| [5] | 周斌, 黄道友, 朱奇宏, 等. 施用钝化剂对镉污染稻田土壤微生物学特征的影响[J]. 农业现代化研究, 2012, 33(2) : 234–238. ZHOU Bin, HUANG Dao-you, ZHU Qi-hong, et al. Effects of amendments on soil microbial properties in cadmium contaminated paddy soil[J]. Research of Agricultural Modernization, 2012, 33(2) : 234–238. |
| [6] | Garau G, Castaldi P, Santona L, et al. Influence of red mud, zeolite and lime on heavy metal immobilization, culturable heterotrophic microbial populations and enzyme activities in a contaminated soil[J]. Geoderma, 2007, 142(1/2) : 47–57. |
| [7] | 姜华, 吴波, 李国学. 添加不同钝化剂降低污泥堆肥的植物毒性研究[J]. 环境工程学报, 2008, 2(10) : 1413–1415. JIANG Hua, WU Bo, LI Guo-xue. Study on reducing toxicity to plant from sewage sludge compost treated by different passivation reagents[J]. Chinese Journal of Environmental Engineering, 2008, 2(10) : 1413–1415. |
| [8] | 费杨, 阎秀兰, 廖晓勇, 等. 不同水分条件下铁基氧化物对土壤砷的稳定化效应研究[J]. 环境科学学报, 2015, 35(10) : 3252–3260. FEI Yang, YAN Xiu-lan, LIAO Xiao-yong, et al. Effects of iron-based oxides on arsenic stabilization in soils of different water contents[J]. Acta Scientiae Circumstantiae, 2015, 35(10) : 3252–3260. |
| [9] | 费杨, 阎秀兰, 廖晓勇, 等. 铁锰双金属材料对砷和重金属复合污染土壤的稳定化研究[J]. 环境科学学报, 2016, 36(11) : 4164–4172. FEI Yang, YAN Xiu-lan, LIAO Xiao-yong, et al. Stabilization effects and mechanisms of Fe-Mn binary oxide on arsenic and heavy metal co-contaminated soils[J]. Acta Scientiae Circumstantiae, 2016, 36(11) : 4164–4172. |
| [10] | 鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 1999. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. Third edition. Beijing: China Agriculture Press, 1999. |
| [11] | Houba V, Temminghoff E, Gaikhorst G A, et al. Soil analysis procedures using 0.01 M calcium chloride as extraction reagent[J]. Communications in Soil Science and Plant Analysis, 2000, 31(9/10) : 1299–1396. |
| [12] | 中华人民共和国住房和城乡建设部. CJ/T 340-2011绿化种植土壤种子发芽指数实验方法[S]. 北京:中国标准出版社, 2011. Ministry of Housing and Urban-Rural Development of PRC. CJ/T 340-2011, Planting soil for greening, test method of seed germination index[S]. Beijing:Standards Press of China, 2011. |
| [13] | Zhou J Z, Bruns M A, Tiedje J M. DNA recovery from soils of diverse composition[J]. Applied and Environmental Microbiology, 1996, 62(2) : 316–322. |
| [14] | Damiani G, Amedeo P, Bandi C, et al. Bacteria indentification by PCR-based techniques[M]. 1996: 167-178. |
| [15] | Bruce K D, Hiorns W D, Hobman J L, et al. Amplification of DNA from native populations of soil bacteria by using the polymerase chain-reaction[J]. Applied and Environmental Microbiology, 1992, 58(10) : 3413–3416. |
| [16] | USEPA. SW-846 Test Method 3052:Microwave Assisted Acid Digestion of Siliceous and Organically Based Matrices[EB/OL]. https://www.epa.gov/sites/production/files/2015-12/documents/3052.pdf.1996. |
| [17] | 陈怀满. 土壤中化学物质的行为与环境质量[M]. 北京: 科学出版社, 2002: 79-144. CHEN Huai-man. Behavior of chemicals in soils and its relation to environmental quality[M]. Beijing: Science Press, 2002: 79-144. |
| [18] | Madejón P, Cantos M, Jiménez-Ramos M C, et al. Effects of soil contamination by trace elements on white poplar progeny:Seed germination and seedling vigour[J]. Environmental Monitoring & Assessment, 2015, 187(11) : 1–11. |
| [19] | 张敏, 蔡五田. 污染场地土壤与地下水调查的关键思路和方法介绍:以示范项目调查为例[J]. 环境科学与管理, 2011, 36(6) : 31–35. ZHANG Min, CAI Wu-tian. Introduction to key ideas and methods of contaminated site soil and groundwater investigation:A case study of demonstrative project investigation[J]. Environmental Science and Man-agement, 2011, 36(6) : 31–35. |
| [20] | Carabante I, Grahn M, Holmgren A, et al. Adsorption of As(Ⅴ) on iron oxide nanoparticle films studied by in situ ATR-FTIR spectroscopy[J]. Colloids and Surfaces A-Physicochemical and Engineering Aspects, 2009, 346(1/2/3) : 106–113. |
| [21] | Cundy A B, Hopkinson L, Whitby R L D. Use of iron-based technologies in contaminated land and groundwater remediation:A review[J]. Science of the Total Environment, 2008, 400(1/2/3) : 42–51. |
| [22] | 曹心德, 魏晓欣, 代革联, 等. 土壤重金属复合污染及其化学钝化修复技术研究进展[J]. 环境工程学报, 2011, 5(7) : 1441–1453. CAO Xin-de, WEI Xiao-xin, DAI Ge-lian, et al. Combined pollution of multiple heavy metals and their chemical immobilization in contaminated soils:A review[J]. Chinese Journal of Environmental Engineering, 2011, 5(7) : 1441–1453. |
| [23] | 蒿宝珍, 李万昌, 姜丽娜, 等. Fe2+对小麦籽粒萌发及幼苗铁积累和分配的影响[J]. 江苏农业科学, 2008(3) : 19–22. HAO Bao-zhen, LI Wan-chang, JIANG Li-na, et al. Effects of Fe2+ on seed germination and iron accumulation and distribution in seedling of wheat[J]. Jiangsu Agricultural Sciences, 2008(3) : 19–22. |
| [24] | 侯典云, 赵盼盼, 马占强. 锰处理对小麦种子萌发和幼苗生长的影响[J]. 河南农业科学, 2011, 40(7) : 38–40. HOU Dian-yun, ZHAO Pan-pan, MA Zhan-qiang. The effect of manganese on seed germination and seedling growth of Triticum aestivum[J]. Journal of Henan Agricultural Sciences, 2011, 40(7) : 38–40. |
| [25] | 张玉秀, 李林峰, 柴团耀, 等. 锰对植物毒害及植物耐锰机理研究进展[J]. 植物学报, 2010, 45(4) : 506–520. ZHANG Yu-xiu, LI Lin-feng, CHAI Tuan-yao, et al. Mechanisms of manganese toxicity and manganese tolerance in plants[J]. Chinese Bulletin of Botany, 2010, 45(4) : 506–520. |
| [26] | 林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能[J]. 土壤学报, 2008, 45(5) : 892–900. LIN Xian-gui, HU Jun-li. Scientific connotation and ecological service function of soil microbial diversity[J]. Acta Pedologica Sinica, 2008, 45(5) : 892–900. |
| [27] | 宋玉芳, 周启星, 许华夏, 等. 重金属对土壤中小麦种子发芽与根伸长抑制的生态毒性[J]. 应用生态学报, 2002, 13(4) : 459–462. SONG Yu-fang, ZHOU Qi-xing, XU Hua-xia, et al. Eco-toxicology of heavy metals on the inhabition of seed germination and root elongation of wheat in soils[J]. Chinese Journal of Applied Ecology, 2002, 13(4) : 459–462. |
| [28] | 吴曼, 徐明岗, 徐绍辉, 等. 有机质对红壤和黑土中外源铅镉稳定化过程的影响[J]. 农业环境科学学报, 2011, 30(3) : 461–467. WU Man, XU Ming-gang, XU Shao-hui, et al. Effects of organic matter on the stabilization process of added cadmium and lead in red soil and black soil[J]. Journal of Agro-Environment Science, 2011, 30(3) : 461–467. |
 2017, Vol. 36
2017, Vol. 36