文章信息
- 律泽, 胡筱敏, 安婧, 魏炜
- LÜ Ze, HU Xiao-min, AN Jing, WEI Wei
- 佳乐麝香与镉复合污染对土壤微生物群落功能和丰度的影响
- Joint effects of galaxolide and cadmium on soil microbial community function and abundance
- 农业环境科学学报, 2017, 36(1): 66-75
- Journal of Agro-Environment Science, 2017, 36(1): 66-75
- http://dx.doi.org/10.11654/jaes.2016-1134
文章历史
- 收稿日期: 2016-09-02
2. 中国科学院沈阳应用生态研究所污染生态与环境工程重点实验室, 沈阳 110016;
3. 沈阳建筑大学市政与环境工程学院, 沈阳 110168
2. Key Laboratory of Pollution Ecology and Environmental Engineering, Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China;
3. School of Municipal and Environmental Engineering, Shenyang Jianzhu University, Shenyang 110168, China
人工合成麝香作为香味添加剂已被广泛应用于洗涤剂、化妆品和个人护理品中[1]。毒理学实验研究表明,这类化合物具有潜在的发育毒性和内分泌干扰效应[2-3]。合成麝香能够在人体组织积累,然后出现在母乳中,而且容易通过胎盘屏障进入胚胎和胎儿体内[4]。麝香酮可增加对致癌物的敏感性,在动物实验中发现麝香会致使睾丸萎缩[5]。多环麝香化合物对出生24 h的青鳉鱼均表现为高毒,96 h半致死浓度佳乐麝香高于吐纳麝香和萨利麝香[6]。在有害物质控制方案中,美国EPA 将人工合成麝香中典型代表佳乐麝香(HHCB)列为大产量物质予以重点关注[7]。HHCB已成为药物和个人护理品类污染物(PPCPs)的重要组成部分,环境工作者越来越多地关注其在环境中的存在、分布、迁移转化及潜在的毒性效应[8-9]。
环境污染多具伴生性和综合性,用单一污染的作用机理常常无法解释环境中普遍存在的复合污染现象,过去依赖单一效应制定的有关评价标准无法真实反映环境质量要求[10],关于复合污染的研究已经成为当前环境领域的研究热点之一[11-13]。土壤是生态环境的重要组成部分,也承载着多种环境污染物。HHCB是多环麝香中使用量最多的化合物之一,和吐纳麝香一起共占多环麝香使用量的95%[14]。HHCB能够通过污水灌溉和污泥农田施用等多种途径不断输入土壤中,从而提高其对土壤生物的污染暴露水平;并且由于HHCB 具有较强的亲脂性,其在土壤中可以长期存在[15]。镉(Cd)是重金属污染土壤中一种常见的污染元素,主要来源为污水灌溉、污泥利用、金属采矿和冶炼等[16],动植物的生长发育也受到Cd 污染的影响,其在动植物体内有很强的积累性,还可以通过食物链危害人体健康[17]。多环麝香与重金属Cd 均来源于污水灌溉和污泥利用,二者共存于土壤环境中[18],易对土壤环境造成复合污染。有研究表明,HHCB 通过扰乱细胞防御系统来提高其他毒物的毒性效应,且HHCB和Cd 复合污染可以增强单一污染对动物和植物的毒性[18-19],因而已成为一种新型复合污染物并且在环境中具有潜在危害。
土壤微生物是土壤生态系统中非常重要的一部分,在有机质分解、养分循环和植物养分利用过程中起着重要作用[20]。土壤生态学中把土壤微生物群落结构和功能的研究作为热点研究。土壤中微生物群落代谢功能的不同可以通过土壤微生物对Biolog 微平板中各类碳源的利用情况的差异来反应[21]。特定类群微生物的数量能被定量PCR(qPCR)准确定量,高于1~10 个拷贝的质粒DNA 以及100 cfu·mL-1的微生物量均可以被检测到[22],qPCR 被广泛用于检测环境样品是因为其具有灵敏度高、精确性好、特异性强和安全快速等优点。为了探讨HHCB和Cd 复合污染对土壤微生物群落功能和丰度的影响,采用Biolog 和qPCR相结合的方法,建立复合污染生态毒理诊断指标,提供基础数据及理论基础用于风险评价和修复基准。
1 材料与方法 1.1 供试土壤采集地点:辽宁省沈阳市石佛寺灌渠渠首(42°08.606'N,123°20.712'E),农田土壤表层(0~20 cm)样品,过2 mm筛备用。土壤理化性质见表 1。
HHCB 购于SIGMA-ALORICH 公司,纯度为50%[液体试剂,稀释剂为邻苯二甲酸二乙酯(DEP)],其分子式均为C18H26O,于实验室用丙酮配制为20 g·L-1 HHCB溶液。
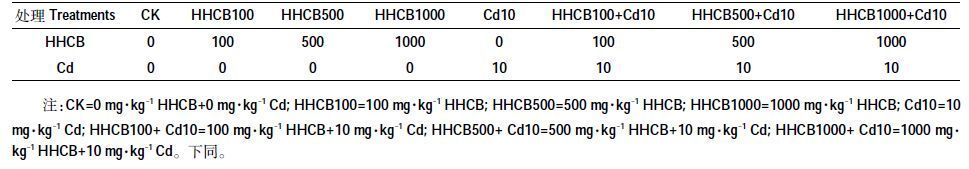
1.3 试验方法 1.3.1 土壤培养本试验采用微宇宙试验。土壤预培养:用500 mL的塑料烧杯称取土壤200 g(相当于烘干土),调节含水量至田间最大持水量的60%左右,为防止水分过量蒸发和空气中的菌体进入,采用具有透气作用的薄膜封口,25℃恒温培养箱中避光培养7 d。土壤染毒:设置HHCB 实验浓度为0、100、500、1000 mg·kg-1,分别抽取0、1、5、10 mL 配制好的20 g·L-1 HHCB 溶液加到200 g 土壤中并混合均匀,待丙酮挥发干净后,加入1 g·L-1的CdCl2溶液,使最终浓度为0、10 mg·kg-1,且2 种污染物均匀分布在土壤中。实验组合方案如表2,共8个处理,每个处理重复3 次。调节土壤含水量为田间最大含水量的60%,每2~3 d调一次水量,25益恒温恒水量避光培养箱中培养10 周。选取第2 周土壤样品用于土壤微生物群落功能多样性试验,第10 周土壤样品用于测定微生物群落丰度试验。
1.3.2 土壤微生物群落功能多样性分析采用Biolog 微生物自动分析系统(Biolog,Hayward,CA,USA)。配制45 mL 0.145 mol·L-1的无菌生理盐水,加入5 g新鲜土样,180 r·min-1 振荡30min,然后在超净台上用无菌生理盐水稀释1000 倍,分别添加150 μL 稀释后的悬液于Biolog 板孔中,3个土壤重复,28℃恒温培养,在第24、48、72、96、120、144、168、192、216、240 h测定各孔在590 nm 波长下的光吸收值。
1.3.3 土壤微生物数量-qPCR 技术样品DNA 的提取采用Fast DNA-SPIN KitForSoil(MP Biomedicals,Santa Ana,CA)试剂盒,从0.5 g土壤中提取土壤基因组DNA,溶于50 μL 水中,置于-20℃保存。
采用荧光qPCR 测定细菌16S rRNA、真菌18SrRNA 和放线菌特异基因的拷贝数。细菌扩增引物为341F/758R(341F:CCTACGGGAGGCAGCAG,758R:CTACCAGGGTATCTAATCC)[23],418 bp,退火温度为55℃; 真菌扩增引物为FR1/FF390(FF390:CGATAACGAACGAGACCT,FR1:AICCATTCAATCG原GTAIT)[24],390 bp,退火温度为50℃;放线菌扩增引物为243F/513R(243F:5'GGATGAGCCCGCGGCCTA3',513R:5'CGGCCGCGGCTGCTGGCACGTA 3')[25],271 bp,退火温度为56℃。2伊SYBR Premix Ex Taq域(TaKaRa)12.5 μL;前引物和后引物(10 pmol·μL)各为1μL;50伊ROXReference Dye(TaKaRa)0.5 μL;DNA模板1 μL;水9 μL;反应体系25 μL。
制作标准曲线,样品中的基因拷贝数根据所得标准曲线计算,然后换算成每克干土的基因拷贝数。
1.4 数据分析
式中:Ai为第i 孔在590 nm处的吸光度值;A0为对照孔在590 nm 处的吸光度值。
三种指数的计算公式分别为:
式中:Pi为第i 孔的相对吸光值与整个平板相对吸光值总和的比率;ni为第i 孔的相对吸光值。
菌种的拷贝数经对数转换后再进行分析和作图,选取Biolog Eco 微平板培养72 h的数据进行指数和碳源分析。采用SPSS 20.0进行实验数据处理,结果以平均值依标准差表示,利用单因素方差分析中的LSD多重比较检验不同处理间的结果差异显著性,处理间差异显著性用不同小写字母表示,显著性水平设为0.05。实验作图采用软件Origin 8.0。
2 结果与讨论 2.1 HHCB与Cd污染对土壤微生物总体活性的影响平均颜色变化率(AWCD)是反映土壤微生物代谢活性的重要指标,微生物对碳源的利用率高低可以通过AWCD 值的高低来表征。AWCD 值越大,表明细菌密度越大、活性越高,反之则细菌密度越小、活性越低[26]。在培养第2 周,HHCB单一污染条件下(图 1A),AWCD 值随浓度变化趋势是HHCB1000>HHCB500>HHCB100>CK。HHCB和Cd复合污染条件下(图 1B):96 h 之前HHCB1000 +Cd10 >HHCB500 +Cd10 >HHCB100+Cd10>Cd10;96~168h之间HHCB500+Cd10>HHCB1000+Cd10>HHCB100+Cd10>Cd10;168h 之后HHCB500+Cd10>HHCB100+Cd10>HHCB1000+Cd10>Cd10。HHCB 单一和HHCB 与Cd 复合污染土壤微生物群落的AWCD 值均高于对照组CK,表明加入HHCB提高了土壤微生物对碳源的利用能力。AWCD值均随着培养时间的延长而增加,表明微生物利用碳源的总量随时间的延长呈现逐渐增加的趋势,其代谢能力增强。
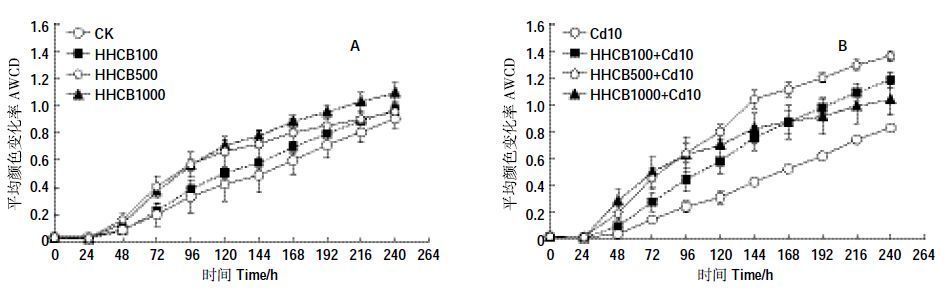
|
| 图 1 HHCB 与Cd 单一、复合污染下土壤微生物AWCD 变化情况 Figure 1 The AWCD variation of soil microbial under the single and joint stress of HHCB and Cd |
Shannon 指数是研究群落物种及其个体数和分布均匀程度的综合指标[27]。用于Biolog Eco 微平板时,Shannon 指数越高说明可供土壤微生物利用的碳源种类就越多,物种丰富度就越高。HHCB 单一污染条件下(图 2A),与对照组CK 相比差异都不显著(P>0.05)。HHCB和Cd复合污染条件下(图 2B),HHCB100+Cd10、HHCB500+Cd10 和HHCB1000+Cd10 分别显著高于对照组Cd10 10.51%、24.37%和17.35%(P<0.05),表明HHCB 的加入提高了复合污染土壤微生物代谢功能,增加了种群的丰富度。这可能是由于某些快速生长的菌种,能利用提供的单一碳源,加快其自身的生长、繁殖。
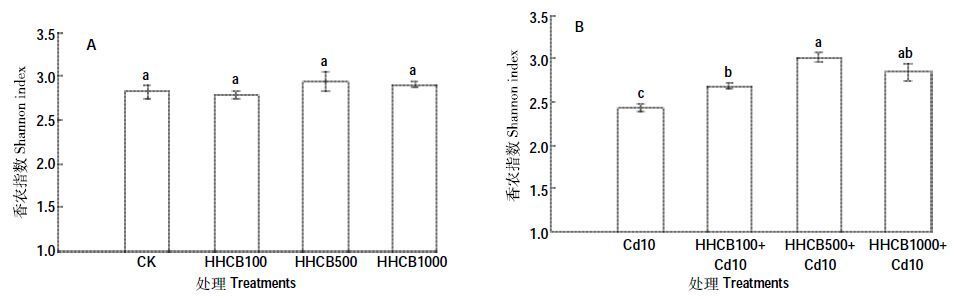
|
| 图 2 HHCB 与Cd 单一、复合污染对Shannon指数的影响 Figure 2 Effect of the single and joint stress of HHCB and Cd on Shannon index |
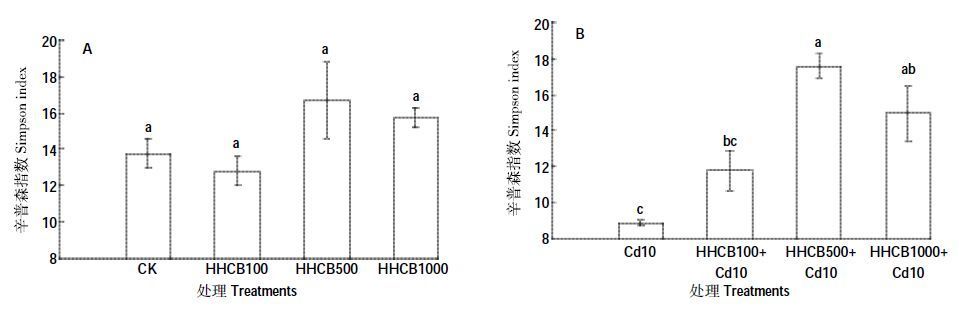
Simpson 优势度指数反映了各物种种群数量的变化情况,指数越大,说明群落内物种数量分布越不均匀,优势种的地位越突出[28]。HHCB单一污染条件下(图 3A),与对照组CK相比差异都不显著(P>0.05)。HHCB 和Cd 复合污染条件下(图 3B),与对照组Cd10 相比,HHCB100+Cd10 差异不显著(P>0.05),而HHCB500+Cd10 和HHCB1000+Cd10 则分别显著高于对照组Cd10 96.60%和67.23%(P<0.05),表明500mg·kg-1和1000 mg·kg-1的HHCB 加入显著增加了复合污染土壤中优势种群,群落内物种数量分布不均匀。这可能是由于某些菌种能够充分利用单一碳源快速生长而成为表征菌种,并且可能发展成为土壤的优势种群。
|
| 图 3 HHCB 与Cd 单一、复合污染对Simpson 指数的影响 Figure 3 Effect of the single and joint stress of HHCB and Cd on Simpson index |
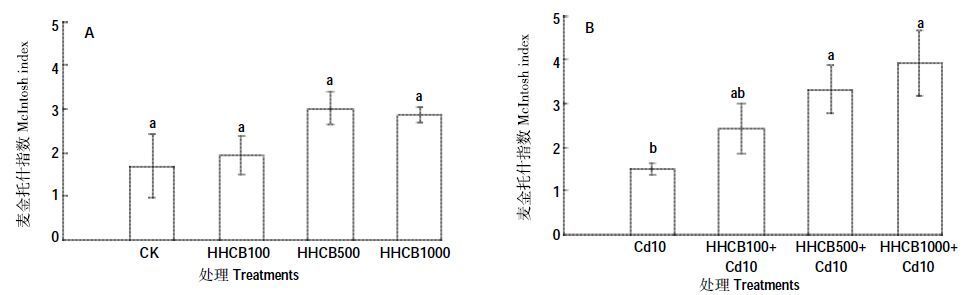
McIntosh 多样性指数是群落物种均一性的度量,是依据土壤微生物群落物种多维空间上Euclidian距离的多样性指数。HHCB单一污染条件下(图 4A),与对照组CK 相比差异都不显著(P>0.05)。HHCB 和Cd 复合污染条件下(图 4B),与对照组Cd10 相比,HHCB100+Cd10 差异不显著(P>0.05);HHCB500+Cd10 和HHCB1000+Cd10 分别显著高于对照组Cd10120.59%和160.75%(P<0.05)。500、1000 mg·kg-1 的HHCB加入使McIntosh 指数升高,表明种群间的均一性被打破。
|
| 图 4 HHCB 与Cd 单一、复合污染对McIntosh 指数的影响 Figure 4 Effect of the single and joint stress of HHCB and Cd on McIntosh index |
HHCB 单一污染条件下,与对照组CK 相比,不同浓度的三种指数没有显著性变化;HHCB 和Cd 复合污染条件下,与对照组Cd10 相比,500、1000 mg·kg-1 HHCB与Cd复合下的三种指数显著提高。
2.3 HHCB 与Cd 污染条件下土壤微生物对不同类型碳源利用强度的影响Biolog Eco 微平板上含有31种碳源,根据碳源官能团不同将其分为6 类,主要包括:单糖、糖苷、聚合糖类,氨基酸类,酯类,醇类,胺类和羧酸类。HHCB单一污染条件下(图 5A),与对照组CK 相比,只有HHCB500 和HHCB1000 处理的糖类和羧酸类利用显著提高(P<0.05),其余处理的碳源利用差异都不显著(P>0.05)。HHCB和Cd复合污染条件下(图 5B),与对照组Cd10 相比,HHCB500+Cd10和HHCB1000+Cd10处理下酯类、醇类和羧酸类利用显著提高,HHCB1000+Cd10处理下胺类的利用显著提高,其余处理的碳源利用差异均不显著。500、1000 mg·kg-1的HHCB 与Cd 复合污染提高了某些碳源的利用率。总体上,土壤微生物对6 大类碳源的利用强度有所差异,其中对酯类的利用效率最高,对糖类和羧酸类碳源的利用强度较低。

|
| 图 5 HHCB 与Cd 单一、复合污染对土壤微生物碳源利用强度的影响 Figure 5 Utilization of carbon substrates by soil microbial community under the single and joint stress of HHCB and Cd |
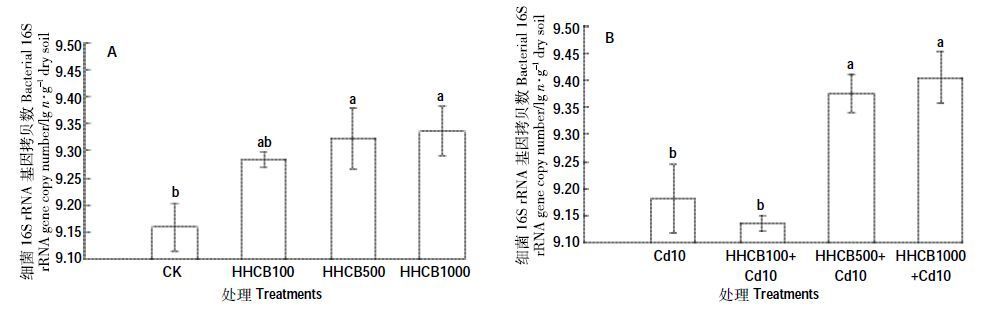
qPCR 技术是一种核酸定量分析方法。相对定量是指不仅能测定目的基因,而且还能测定某一内参基因,基因拷贝数的比较主要通过该内参基因表达[29]。HHCB 单一污染条件下(图 6A),与对照组CK 相比,HHCB100 处理细菌的丰度差异不显著(P>0.05);HHCB500 和HHCB1000 处理分别显著高于对照组CK 1.79%和1.94%(P<0.05)。HHCB 和Cd 复合污染条件下(图 6B),与对照组Cd10 相比,HHCB100+Cd10 处理下细菌的丰度差异不显著;HHCB500+Cd10 和HHCB1000+Cd10 处理分别显著高于对照组Cd10 2.14%和2.45%;HHCB 单一及其与Cd 复合处理,细菌的丰度随着HHCB 浓度的增加而增加。可见某些细菌可能利用HHCB 作为碳源,促进其自身快速的生长、繁殖。
|
| 图 6 HHCB 与Cd 单一、复合污染对细菌丰度的影响 Figure 6 Effect of the single and joint stress of HHCB and Cd on the bacteria abundance |
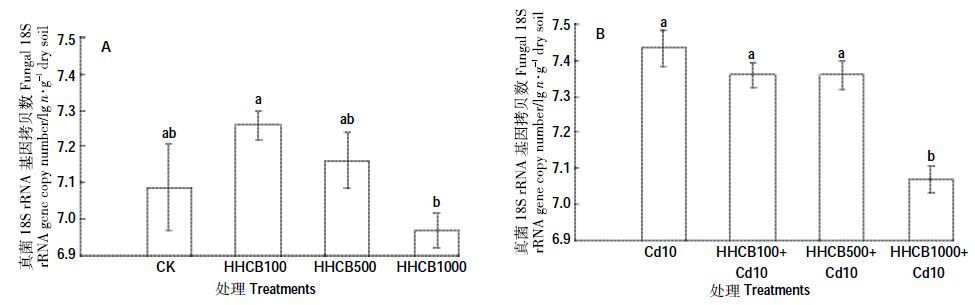
HHCB单一污染条件下(图 7A),与对照组CK 相比,不同浓度的HHCB处理真菌的丰度差异不显著(P>0.05);HHCB和Cd复合污染条件下(图 7B),HHCB1000+Cd10 处理下真菌的丰度显著低于对照组Cd10 4.91%(P<0.05)。与对照组CK 相比,不同浓度的HHCB 与Cd 复合处理真菌的丰度均没有显著差异(P>0.05)。HHCB 的单一及其与Cd 复合处理的真菌与对照组CK 相比均未受到显著影响,真菌的丰度随着HHCB浓度的增加而降低。
|
| 图 7 HHCB 与Cd 单一、复合污染对真菌丰度的影响 Figure 7 Effect of the single and joint stress of HHCB and Cd on the fungi abundance |
HHCB 单一污染条件下(图 8A),HHCB100、HHCB500 和HHCB1000 处理放线菌的丰度显著低于对照组CK 0.86%、6.31%和6.90%(P<0.05),可见HHCB 显著抑制了放线菌生长。HHCB 和Cd 复合污染条件下(图 8B),HHCB100+Cd10和HHCB500+Cd10处理放线菌的丰度分别显著高于对照组Cd10 7.21%和2.89%;HHCB1000+Cd10 处理显著低于对照组Cd10 5.72%;HHCB500+Cd10 和HHCB1000+Cd10 处理显著低于对照组CK 4.49%和12.48%。HHCB的单一及其与Cd 复合处理,与对照组CK 相比,不同浓度处理的放线菌均受到抑制(HHCB100+Cd10除外),其丰度随着HHCB 浓度的增加而降低,放线菌对HHCB和Cd的抑制作用比细菌和真菌更为敏感。本课题组用平板菌落计数的方法研究HHCB 和Cd 单一、复合污染对细菌、真菌和放线菌的影响中也有类似的结果,放线菌受到显著抑制作用[30-31]。
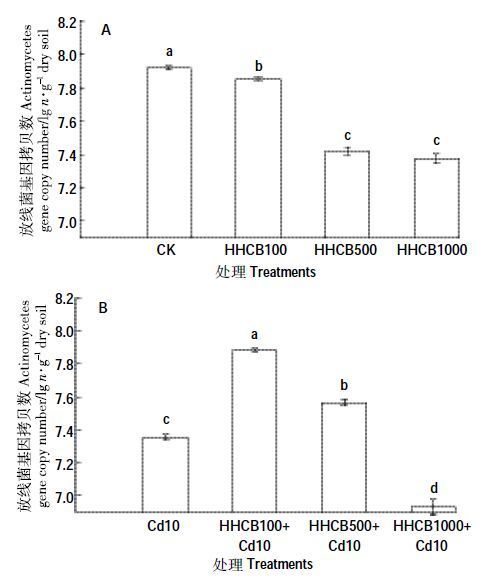
|
| 图 8 HHCB与Cd单一、复合污染对放线菌丰度的影响 Figure 8 Effect of the single and joint stress of HHCB and Cd on the actinomycetes abundance |
本研究中HHCB 单一及其与Cd 复合污染对土壤微生物功能和丰度的影响明显不同,其原因可能是:(1 )作用污染物不同,在单因子污染胁迫下,其本身的理化性质基本决定了污染物对生物的毒害效应,受暴露浓度水平的影响也极为重要,在多元复合污染条件下,污染物理化性质的作用除外,起至关重要的作用是污染物的浓度组合[32];(2)复合污染的联合毒性机理与单一污染致毒机理明显不同,有机物与重金属的联合毒性效应产生机理研究包括竞争结合位点、螯合或络合作用及沉淀作用、影响酶的活性、影响生物细胞结构、干扰生物生理活动和功能、干扰生物大分子的结构和功能等几方面[33]。
Biolog 试验结果表明,HHCB 单一及其与Cd 复合污染土壤微生物群落的AWCD 值均高于对照组CK,表明加入HHCB 提高了土壤微生物对碳源的利用能力。一些有机污染物能够提高微生物的代谢活性,提高对碳源的利用能力。如张雯雯等[34]和吴小虎[35]研究表明,苄嘧磺隆施用初期及使用高浓度氟磺胺草醚处理粉砂质壤土和黑土时,处理组的AWCD 值高于对照组,都提高了微生物的碳源利用能力。
HHCB 和Cd 复合污染条件下,与对照组Cd10相比,500、1000 mg·kg-1 HHCB 与Cd 复合的三种指数显著提高。表明加入HHCB后,复合污染土壤的种群丰富度显著提高,复合污染土壤中优势种群得到显著增加,种群间的均一性被打破。可能由于HHCB 的加入提高了复合污染土壤微生物代谢功能多样性和碳源利用种类数,某些快速增长的菌种,能利用提供的单一碳源,促进其自身快速的生长、繁殖,充分利用单一碳源快速生长的表征菌种,可能发展成为土壤的优势种群,破坏种群的均一性。另外一种可能性推测是土壤中可能存在降解HHCB的微生物,HHCB 的生物降解作用已经得到不少研究的支持和证实[36-38],HHCB的存在会促进这些微生物的活性,从而导致其利用某些碳源的能力增加,三种指数也相应得到提高。
细菌、真菌和放线菌在HHCB 和Cd 复合污染中受到不同程度的影响,可能是由于三种菌在细胞结构和生理功能方面都存在较大差异,且不同污染物对土壤中的微生物毒害效应不一致而导致。500、1000 mg·kg-1 HHCB 单一及其与Cd 复合污染显著促进了细菌的生长,可能是由于HHCB 污染土壤中产生HHCB降解菌,在高浓度组合和暴露条件下的复合污染生态毒理效应,可导致特异微生物物种(如耐受和降解菌)的大量繁殖富集或微生物为了“抵御”污染毒性作用而产生的基因突变[10],多环麝香对细菌的基因毒害作用不明显,但具有一定的诱导性[39]。因此,HHCB污染土壤中细菌数量得到提高。
与对照组CK比,不同浓度处理的放线菌均受到了抑制作用(HHCB100+Cd10 除外),其丰度随着HHCB浓度的增加而降低。土壤放线菌对多种有机和重金属污染物胁迫的反应敏感。沈国清等[40]和张慧等[41]的研究表明,多环芳烃与Cd的复合污染对放线菌生长的抑制率达40%左右;Luckenbach等[42]发现HHCB能够抑制加利福尼亚贻贝对有毒物质的自然抵抗力,减少异生质转运体的活性,使有害物质更容易累积于生物体。因此,HHCB存在有可能降低放线菌体内某种转运体的活性,从而使有害物质累积量增多,抑制放线菌生长。
HHCB 和Cd 复合污染条件下,HHCB100+Cd10和HHCB500+Cd10 处理下放线菌的丰度分别显著高于对照组Cd10 7.21%和2.89%,其原因可能是:(1 )细胞器结构功能的改变会影响复合污染物对生物体的毒性[33]。Moreau 等[43]认为菲对Zn 在生物体内蓄积的拮抗作用可能是因为菲改变了溶酶体膜的稳定性及功能,从而影响了溶酶体解除Zn 毒害的作用。Sikkema 等[44]提出了毒作用麻醉假设,认为PAHs 等脂溶性化合物可以同细胞膜上的脂溶性分子结合,从而影响细胞膜的结构和穿透性。HHCB同样是脂溶性化合物,它也可能改变放线菌细胞膜的通透性,使Cd更不容易进入微生物细胞,降低Cd 对微生物的毒性。(2)有机络合剂与被络合物可形成生物体几乎不能吸收、蓄积的络合物形式,这一点是减毒的重要机制[45]。HHCB 生物降解过程中可能会出现有机酸,而有机酸又是一种很好的络合剂,它能够与具有配位能力的重金属Cd 产生络合作用,形成较大络合物,阻止其通过生物膜,从而拮抗Cd 对生物的毒性。另外,Cd 以二价离子态存在于土壤溶液中,易被静电吸附,降低土壤表面负电荷,促进土壤对HHCB 的吸附固定。这些作用都可能减弱Cd 与HHCB 的生物有效性。(3)与DNA 生成化学加合物(或加成物)常被视作致毒的重要机理[46]。Donnelly等[47]发现,随着三硝基甲苯加入量的增大,苯并芘的毒性逐渐降低,其原因在于前者干扰了后者与DNA 的结合。本研究中HHCB100+Cd10 和HHCB500+Cd10 处理下放线菌丰度高于Cd单一污染的机理有待进一步研究。
4 结论HHCB单一污染及其与Cd复合污染提高了土壤微生物对碳源的利用能力,对6 大类碳源的利用强度有所差异,其中对酯类的利用效率最高,对糖类和羧酸类碳源的利用强度较低。
HHCB 单一污染条件下,Shannon、Simpson 和McIntosh 指数没有显著性变化;HHCB 和Cd 复合污染下,500、1000 mg·kg-1 HHCB 与Cd 复合污染的三种指数显著提高,HHCB 加入后,土壤微生物可以快速消耗单一的碳源,复合污染土壤的种群丰富度显著提高,优势种群增加,种群间的均一性被打破。
500、1000 mg·kg-1 HHCB 的单一污染及其与Cd复合污染显著促进了细菌的生长,HHCB 单一污染及其与Cd 复合污染与对照组CK 相比真菌生长均未受到显著影响,HHCB 单一污染显著抑制了放线菌生长。细菌的丰度随着HHCB 浓度的增加而增加,而真菌和放线菌的丰度随着HHCB 浓度的增加而降低。放线菌受到HHCB 和Cd 的影响时表现得比细菌和真菌更为敏感。
| [1] | Wang M, Peng C, Chen W, et al. Ecological risks of polycyclic musk in soils irrigated with reclaimed municipal wastewater[J]. Ecotoxicology and Environmental Safety, 2013, 97 : 242–247. DOI:10.1016/j.ecoenv.2013.07.032 |
| [2] | Api A M, Smith R L, Pipino S, et al. Evaluation of the oral subchronic toxicity of AHTN(7-Acetyl-1, 1, 3, 4, 4, 6-hexamethyl-1, 2, 3, 4-tetrahydronaphthalene) in the rat[J]. Food and Chemical Toxicology, 2004, 42(5) : 791–801. DOI:10.1016/j.fct.2003.12.016 |
| [3] | Van der Burg B, Schreurs R, van der Linden S, et al. Endocrine effects of polycyclic musks:Do we smell a rat?[J]. International Journal of Andrology, 2008, 31(2) : 88–193. |
| [4] | Lee S, Kim S, Park J, et al. Synthetic musk compounds and benzotriazole ultraviolet stabilizers in breast milk:Occurrence, time-course variation and infant health risk[J]. Environmental Research, 2015, 140 : 466–473. DOI:10.1016/j.envres.2015.04.017 |
| [5] | Melmed S. Fertility and fragrance:Another cause of Kallmann syndrome[J]. Journal of Clinical Investigation, 2015, 125(6) : 2275–2278. DOI:10.1172/JCI82061 |
| [6] | Yamauchi R, Ishibashi H, Hirano M, et al. Effects of synthetic polycyclic musks on estrogen receptor, vitellogenin, pregnane X receptor, and cytochrome P4503A gene expression in the livers of male medaka(Oryzias latipes)[J]. Aquatic Toxicology, 2008, 90(4) : 261–268. DOI:10.1016/j.aquatox.2008.09.007 |
| [7] | USEPA. High Production Volume List. Prevention, pesticides and toxic substances, pollution prevention and toxics[R]. Washington, DC, 2008. |
| [8] | Schiavone A, Kannan K, Horii Y, et al. Polybrominated diphenyl ethers, polychlorinated naphthalenes and polycyclic musks in human fat from Italy:Comparison to polychlorinated biphenyls and organochlorine pesticides[J]. Environmental Pollution, 2010, 158(2) : 599–606. DOI:10.1016/j.envpol.2009.08.011 |
| [9] | Sumner N R, Guitart C, Fuentes G, et al. Inputs and distributions of synthetic musk fragrances in an estuarine and coastal environment, a case study[J]. Environmental Pollution, 2010, 158(1) : 215–222. DOI:10.1016/j.envpol.2009.07.018 |
| [10] | 周启星, 孔繁翔, 朱琳. 生态毒理学[M]. 北京: 科学出版社, 2004. ZHOU Qi-xing, KONG Fan-xiang, ZHU Lin. Ecological toxicology[M]. Beijing: Science Press, 2004. |
| [11] | Chen C H, Zhou Q X, Cai Z. Effect of soil HHCB on cadmium accumulation and phytotoxicity in wheat seedlings[J]. Ecotoxicology, 2014, 23(10) : 1996–2004. DOI:10.1007/s10646-014-1317-4 |
| [12] | Hu S, Gu H, Cui C, et al. Toxicity of combined chromium(Ⅵ) and phenanthrene pollution on the seed germination, stem lengths, and fresh weights of higher plants[J]. Environmental Science and Pollution Research, 2016, 23(15) : 15227–15235. DOI:10.1007/s11356-016-6701-6 |
| [13] | Wang D H, Zhang Q, Zheng Y, et al. Estimating the combined toxicity of flufenacet and imazaquin to sorghum with pore water herbicide concentration[J]. Journal of Environmental Sciences, 2016, 41 : 154–161. DOI:10.1016/j.jes.2015.04.031 |
| [14] | 徐慧琳, 曾文炉, 陈翠红, 等. 镉污染土壤中吐纳麝香的生物有效性及其评价[J]. 农业环境科学学报, 2016, 35(6) : 1021–1027. XU Hui-lin, ZENG Wen-lu, CHEN Cui-hong, et al. Bioavailability of AHTN in cadmium-polluted soil and its assessment[J]. Journal of Agro-Environment Science, 2016, 35(6) : 1021–1027. |
| [15] | Litz N T, Müller J, Böhmer W. Occurrence of polycyclic musks in sewage sludge and their behaviour in soils and plants. Part 2:Investigation of polycyclic musks in soils and plants[J]. Journal of Soils and Sediments, 2007, 7(1) : 36–44. DOI:10.1065/jss2006.10.187.2 |
| [16] | 樊霆, 叶文玲, 陈海燕, 等. 农田土壤重金属污染状况及修复技术研究[J]. 生态环境学报, 2013, 22(10) : 1727–1736. FAN Ting, YE Wen-ling, CHEN Hai-yan, et al. Review on contamination and remediation technology of heavy metal in agricultural soil[J]. Ecology and Environmental Sciences, 2013, 22(10) : 1727–1736. |
| [17] | Smeets K, Opdenakker K, Remans T, et al. Oxidative stress-related responses at transcriptional and enzymatic levels after exposure to Cd or Cu in a multipollution context[J]. Journal of Plant Physiology, 2009, 166(18) : 1982–1992. DOI:10.1016/j.jplph.2009.06.014 |
| [18] | 陈翠红, 周启星, 张志能, 等. 土壤中佳乐麝香和镉污染对苗期小麦生长及其污染物积累的影响[J]. 环境科学, 2011, 32(2) : 567–573. CHEN Cui-hong, ZHOU Qi-xing, ZHANG Zhi-neng, et al. Effects of soil HHCB and Cd contamination on the growth of wheat seedlings(Triticum aestivum) and the pollutants accumulation in plants[J]. Environmental Science, 2011, 32(2) : 567–573. |
| [19] | 陈芳, 周启星. 模拟城市径流中加乐麝香和镉对大型水蚤的毒性效应[J]. 中国环境科学, 2009, 29(1) : 58–62. CHEN Fang, ZHOU Qi-xing. Toxic efects of galaxolide and cadmium on Daphnia magna under polluting flow conditions containing soil-water interfaces from urban area[J]. China Environmental Science, 2009, 29(1) : 58–62. |
| [20] | Kirk J L, Beaudette L A, Hart M, et al. Methods of studying soil microbial diversity[J]. Journal of Microbiological Methods, 2004, 58(2) : 169–188. DOI:10.1016/j.mimet.2004.04.006 |
| [21] | 马驿, 陈杖榴, 曾振灵. 恩诺沙星对土壤微生物群落功能多样性的影响[J]. 生态学报, 2007, 27(8) : 3400–3406. MA Yi, CHEN Zhang-liu, ZENG Zhen-ling. Effects of enrofloxacin on functional diversity of soil microbial communities[J]. Acta Ecologica Sinica, 2007, 27(8) : 3400–3406. |
| [22] | 姚红艳, 赵双宜, 夏光敏. 改良尿素-氯化锂方法提取成熟小麦种子总RNA[J]. 中国生物工程杂志, 2003, 23(4) : 86–88. YAO Hong-yan, ZHAO Shuang-yi, XIA Guang-min. Improved urea-LiCl method for extracting total RNA from wheat mature seeds[J]. China Biotechnology, 2003, 23(4) : 86–88. |
| [23] | |
| [24] | Vainio E J, Hantula J. Direct analysis of wood-inhabiting fungi using denaturing gradient gel electrophoresis of amplified ribosomal DNA[J]. Mycological Research, 2000, 104(8) : 927–936. DOI:10.1017/S0953756200002471 |
| [25] | 袁海平. 镉污染对放线菌生物活性和种群结构的影响及镉生物吸附研究[D]. 杭州:浙江大学, 2009:57-58. YUAN Hai-ping. Studies on variation of microbial activity and actinomycete population under cadmium stress as well as cadmium bioadsorption[D]. Hangzhou:Zhejiang University, 2009:57-58. http://cdmd.cnki.com.cn/Article/CDMD-10335-2010057044.htm |
| [26] | Haack S K, Garchow H, Klug M J, et al. Analysis of factors affecting the accuracy, reproducibility, and interpretation of microbial community carbon source utilization patterns[J]. Applied and Environmental Microbiology, 1995, 61(4) : 1458–1468. |
| [27] | 叶央芳. 酰胺类除草剂苯噻草胺的微生物生态毒理研究及其降解[D]. 杭州:浙江大学, 2004:57. YE Yang-fang. Studies on microbial ecological and toxicological characteristics of acetanilide herbicide mefenacet and its degradation[D]. Hangzhou:Zhejiang University, 2004:57. http://cdmd.cnki.com.cn/Article/CDMD-10335-2004139348.htm |
| [28] | 孟庆杰, 许艳丽, 李春杰, 等. 不同植被覆盖对黑土微生物功能多样性的影响[J]. 生态学杂志, 2008, 27(7) : 1134–1140. MENG Qing-jie, XU Yan-li, LI Chun-jie, et al. Effects of different vegetation coverage on microbial functional diversity in black soil[J]. Chinese Journal of Ecology, 2008, 27(7) : 1134–1140. |
| [29] | 李安, 谢金文, 魏加贵, 等. 荧光定量PCR技术在分子检测上的研究进展[J]. 中国畜牧兽医, 2009, 36(4) : 73–76. LI An, XIE Jin-wen, WEI Jia-gui, et al. The research progress of fluorescence quantitative PCR technique on the molecular detection[J]. China Animal Husbandry & Veterinary Medicine, 2009, 36(4) : 73–76. |
| [30] | 律泽, 胡筱敏, 安婧, 等. 佳乐麝香和镉复合污染对土壤中放线菌数量的影响[J]. 生态学杂志, 2014, 33(6) : 1501–1507. LÜ Ze, HU Xiao-min, AN Jing, et al. Joint effects of galaxolide and cadmium on actinomycetes quantities in soils[J]. Chinese Journal of Ecology, 2014, 33(6) : 1501–1507. |
| [31] | 律泽, 胡筱敏, 魏炜, 等. 佳乐麝香和镉复合污染对土壤中细菌和真菌数量的影响[J]. 生态学杂志, 2014, 33(8) : 2161–2167. LÜ Ze, HU Xiao-min, WEI Wei, et al. Joint effects of galaxolide and cadmium on bacteria and fungi quantities in soil[J]. Chinese Journal of Ecology, 2014, 33(8) : 2161–2167. |
| [32] | 周启星, 程云, 张倩茹, 等. 复合污染生态毒理效应的定量关系分析[J]. 中国科学(C辑:生命科学), 2003, 33(6) : 566–573. ZHOU Qi-xing, CHENG Yun, ZHANG Qian-ru, et al. The analysis of the quantitative relationship on compound pollution ecological toxicology effect[J]. Science in China(Series C:Life Sciences), 2003, 33(6) : 566–573. |
| [33] | 范飞. 土壤环境中人工合成麝香的生态行为及效应研究[D]:沈阳:中科院沈阳应用生态研究所, 2008:21-24. FAN Fei. Ecotoxical behavior and effects of synthetical musks in Burozem[D]:Shenyang:Institute of Applied Ecology, Chinese Academy of Sciences, 2008:21-24. http://cdmd.cnki.com.cn/Article/CDMD-80127-2009032065.htm |
| [34] | 张雯雯, 徐军, 董丰收, 等. 苄嘧磺隆对水稻田土壤微生物群落功能多样性的影响[J]. 农业环境科学学报, 2014, 33(9) : 1749–1754. ZHANG Wen-wen, XU Jun, DONG Feng-shou, et al. Responses of microbial community functional diversity to bensulfuron-methyl in paddy soil[J]. Journal of Agro-Environment Science, 2014, 33(9) : 1749–1754. |
| [35] | 吴小虎. 氟磺胺草醚对土壤微生物多样性的影响[D]. 北京:中国农业科学院, 2014:53-55. WU Xiao-hu. Effects of fomesafen on the soil microbial diversity[D]. Beijing:Institute of Plant Protection, Chinese Academy of Agricultural Sciences, 2014:53-55. http://cdmd.cnki.com.cn/Article/CDMD-82101-1014327035.htm |
| [36] | Kuhlich P, Gostl R, Teichert P, et al. Transformations of polycyclic musks AHTN and HHCB upon disinfection with hypochlorite:Two new chlorinated disinfection by-products(CDBP) of AHTN and a possible source for HHCB-lactone[J]. Analytical and Bioanalytical Chemistry, 2011, 399(10) : 3579–3588. DOI:10.1007/s00216-011-4674-3 |
| [37] | Bester K. Retention characteristics and balance assessment for two polycyclic musk fragrances(HHCB and AHTN) in a typical German sewage treatment plant[J]. Chemosphere, 2004, 57(8) : 863–870. DOI:10.1016/j.chemosphere.2004.08.032 |
| [38] | 张珣, 陈宝楠, 孙丽娜. 植物-微生物联合修复佳乐麝香与镉复合污染土壤的研究[J]. 沈阳农业大学学报, 2016, 47(2) : 166–172. ZHANG Xun, SUN Bao-nan, SUN Li-na. Remediation of galaxolide and cadmium compound contaminated soil with plant-microbial combination[J]. Journal of Shenyang Agricultural University, 2016, 47(2) : 166–172. |
| [39] | 周启星, 王美娥, 范飞, 等. 人工合成麝香的环境污染、生态行为与毒理效应研究进展[J]. 环境科学学报, 2008, 28(1) : 1–11. ZHOU Qi-xing, WANG Mei-e, FAN Fei, et al. Research progress in environmental pollution, ecological behavior and toxicological effects of synthetic musks[J]. Acta Scientiae Circumstantiae, 2008, 28(1) : 1–11. |
| [40] | 沈国清, 陆贻通, 洪静波. 重金属和多环芳烃复合污染对土壤酶活性的影响及定量表征[J]. 应用与环境生物学报, 2005, 11(4) : 479–482. SHEN Guo-qing, LU Yi-tong, HONG Jing-bo. Quantitative expression and effect of combined pollution of heavy metals and polycyclic acromatic[J]. Chinese Journal of Applied and Environmental Biology, 2005, 11(4) : 479–482. |
| [41] | 张慧, 党志, 姚丽贤, 等. 镉芘单一污染和复合污染对土壤微生物生态效应的影响[J]. 农业环境科学学报, 2007, 26(6) : 2225–2230. ZHANG Hui, DANG Zhi, YAO Li-xian, et al. Eco-toxicological effect of cadmium and pyrene combined and simplex pollution on soil microbe[J]. Journal of Agro-Environment Science, 2007, 26(6) : 2225–2230. |
| [42] | Luckenbach T, Epel D. Nitromusk and polycyclic musk compounds as long-term inhibitors of cellular xenobiotic defense systems mediated by multidrug transporters[J]. Environmental Health Perspectives, 2004, 113(1) : 17–24. DOI:10.1289/ehp.7301 |
| [43] | Moreau C J, Klerks P L, Haas C N. Interaction between phenanthrene and zinc in their toxicity to the sheepshead minnow(Cyprinodon variegatus)[J]. Arch Environ Contam Toxicol, 1999, 37(2) : 251–257. DOI:10.1007/s002449900512 |
| [44] | Sikkema J, De Bont J, Poolman B. Interactions of cyclic hydrocarbons with biological membranes[J]. Journal of Biological Chemistry, 1994, 269(11) : 8022–8028. |
| [45] | 郑振华, 周培疆, 吴振斌. 复合污染研究的新进展[J]. 应用生态学报, 2001, 12(3) : 469–473. ZHENG Zhen-hua, ZHOU Pei-jiang, WU Zhen-bin. New advances in research of combined pollution[J]. Chinese Journal of Applied Ecology, 2001, 12(3) : 469–473. |
| [46] | 龙耀庭. 有毒化学物质对DNA的损伤:生成DNA加成物[J]. 环境科学进展, 1993, 1(4) : 24–40. LONG Yao-ting. The damage of DNA by toxic chemical:Formation of DNA adduct[J]. Advances in Environmental Science, 1993, 1(4) : 24–40. |
| [47] | Donnelly K C, Claxton L D, Huebner H J, et al. Mutagenic interactions of model chemical mixtures[J]. Chemosphere, 1998, 37(7) : 1253–1261. DOI:10.1016/S0045-6535(98)00123-4 |
 2017, Vol. 36
2017, Vol. 36