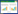文章信息
- 胡伟, 向建华, 向言词, 周练, 陈燕
- HU Wei, XIANG Jian-hua, XIANG Yan-ci, ZHOU Lian, CHEN Yan
- 氮掺杂碳纳米粒子对红壤中氮损失及盐基离子的影响
- Effect of adding nitrogen-doped carbon nanoparticles(N-CNPs) on soil nitrogen loss and base irons in red soil
- 农业环境科学学报, 2017, 36(1): 143-149
- Journal of Agro-Environment Science, 2017, 36(1): 143-149
- http://dx.doi.org/10.11654/jaes.2016-1169
文章历史
- 收稿日期: 2016-09-09
红壤旱地肥力低下、障碍因子多、氮素损失严重,氮肥施用进一步加剧了土壤氮素淋失[1],大量损失的氮素进入环境后,将引起水体的严重污染。有研究表明,湘江流域株洲-湘潭段1年总氨氮和2年总氨氮平均超标率分别高达16.67%和33.33%[2],长沙城区地下水硝态氮超标率35%,是正常值的1.1~1.4 倍[3],严重影响了该流域居民用水安全。利用纳米材料的小尺寸效应、表面界面效应和量子尺度效应等特性来调控土壤氮素转化途径,已成为目前解决氮肥污染,实现氮素高效利用的有效措施[4-5]。通过对碳纳米材料进行氮掺杂可以有效解决碳纳米材料在实际应用中难分散的缺点[6],同时进一步提升纳米材料比表面积和催化活性,在H2S、NO2等有害气体吸附、污水中重金属处理以及氧化还原酶活催化等应用领域[7]已经取得了重要的突破,但氮掺杂碳纳米粒子作为一种新型氮肥增效材料,目前的相关研究报道还比较少。本文以湖南省常见的第四纪红土发育红壤为对象,研究模拟酸雨淋溶条件下氮掺杂碳纳米粒子(N-CNPs)配施尿素后土壤中不同氮素损失特征和土壤盐基饱和度的变化,以期探明氮掺杂碳纳米粒子氮肥增效作用效果和潜在氮肥增效作用机制,为推广氮掺杂碳纳米粒子作为一种新型氮肥增效剂使用提供理论依据。
1 材料与方法 1.1 供试材料供试土壤采自湖南科技大学生物园林地0~20cm土层,采样区为中亚热带季风湿润气候区,植被以落叶乔木为主,土壤类型为第四纪红土发育红壤,将鲜土剔除杂物及残留根系后过0.5 mm 筛备用。土壤有机质13.5 g·kg-1,全N 1.7 g·kg-1,全P 0.23 g·kg-1,全K 6.9 g·kg-1,碱解N 35.7 mg·kg-1,速效P 19.0 mg·kg-1,速效K 39.6 mg·kg-1,土壤pH 5.65,土壤阳离子交换量20.75 cmol·kg-1,土壤盐基饱和度为24.53%。试验用尿素(含N 46%)以及常规硝化抑制剂双氰胺DCD(含N 66%)均为分析纯试剂,N-CNPs 由湖南科技大学物理学院提供,该材料以柠檬酸为原料,以氨水为溶剂和氮掺杂源,采用微波介电加热法制备,氮掺杂量为6.72%(at)。
1.2 试验设计试验设置不施尿素(CK0)、单施尿素(CK1)、尿素+5%双氰铵(CK2,5%为纯氮用量的质量百分比,下同)、尿素+1译N-CNPs(T1)、尿素+5译N-CNPs(T2)和尿素+15译N-CNPs(T3)共6 个处理,每处理3 次重复。具体试验方法如下:
采用一次性施肥方案,以尿素(氮含量46%)作为氮肥施用,施用量为200 mg N·kg-1土,每柱装土量为1kg。首先按处理设置将氮肥和实验材料分别与供试土壤混合均匀,分装至淋溶柱(直径75 mm、高400mm PVC 管)后浸泡于蒸馏水中,使之达到最大田间持水量,起出后悬挂于立架上置于恒温培养箱中培养,实验期间温度保持为25℃,相对湿度保持为85%;用分析纯硫酸和硝酸按9:1 来配制模拟酸雨母液,再参照2012—2014 年长株潭区域降水pH 年平均值调节去离子水pH 值为4.38,于土柱培养后第3d 开始,每隔5 d淋溶一次,每次淋溶液用量为110mL,淋溶速度约为10 mL·h-1,共计淋溶6 次,累积淋溶总量约相当于150 mm 降水(2012—2013 年湘潭地区3月份平均降水量)。淋溶前每隔24 h采用密闭室间歇式通气法收集土柱中气体,测定土壤中挥发出来的氨气总量;单次淋溶结束后收集12 h内滤液定容至250 mL备用;试验结束后,将土柱按原状倒出风干后备用。
1.3 指标测定土壤pH 采用复合电极法测定,土水比为1:2.5;淋溶液中NH4+ -N 和NO3--N 含量经适当比例稀释直接采用全自动流动分析仪(AA3 型,德国)测定;阳离子交换量用1 mol·L-1乙酸铵交换法测定,钾、钠、钙、镁用原子吸收光谱法测定;挥发性氨气利用真空泵减压抽气使密闭淋溶柱上方空气中的氨(NH3)随气流通过装有2% 硼酸的洗气瓶,使其吸收后用0.01 mol·L-1的硫酸滴定来测定。
1.4 数据处理采用Excel 2007和SPSS 13.0 软件对数据进行处理并作图,采用单因素方差分析(one-way ANOVA)和多重比较(Duncan)对不同数据组间进行差异性比较(P<0.05)。
2 结果与分析 2.1 N-CNPs 对尿素在红壤中氮损失的影响 2.1.1 红壤中NH4+-N 淋失量动态变化从图 1 可知,N-CNPs 的加入明显改变了红壤中NH4+-N 淋出量和淋出规律,试验第8 d时纯尿素处理CK1 淋溶液中NH4+-N 含量达到峰值为1.54 mg,之后开始下降并趋于平稳。而添加5译N-CNPs处理T2 和添加15译N-CNPs 处理T3 的NH4+-N 淋溶峰值较纯尿素处理CK1 推迟了5 d,在第13 d时其峰值淋出量分别为3.07、2.56 mg;添加1译N-CNPs 处理T1 峰值出现在第18 d,淋出量达到所有监测数据中的最高值3.40 mg,此时添加N-CNPs各处理峰值较纯尿素处理CK1 分别高出1.86、1.53、1.02 mg;至淋溶试验结束时,添加N-CNPs 的各处理淋溶液中NH4+-N 仍显著高于纯尿素处理CK1,其变化规律与添加5%DCD 的CK2处理极其相似。

|
| 图 1 红壤中NH4+-N 淋失量动态变化 Figure 1 Dynamics of NH4+-N leaching loss in red soil |
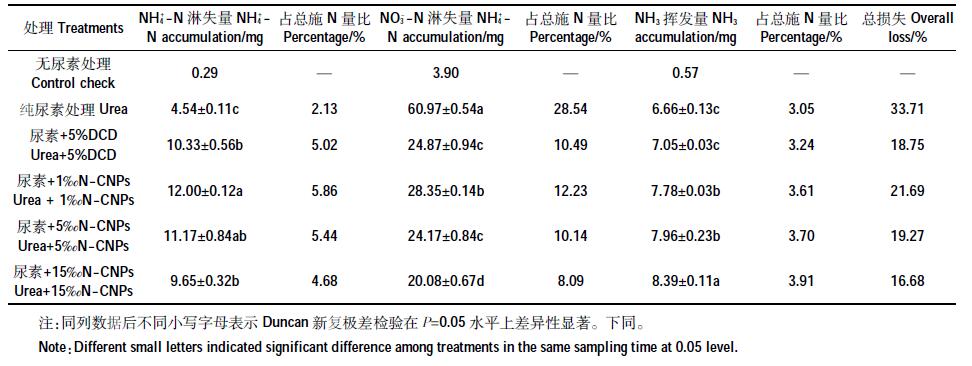
图 2 为不同处理红壤中NO3- -N 淋失量变化曲线。在本次试验期间,添加N-CNPs 各处理淋溶液中NO3--N 含量整体呈现“S”形向下缩减变化规律,在第8d和第18 d出现了两次较为明显的上升过程,并以第8 d 淋失量为最高,而纯施尿素处理在第8 d快速达到峰值后,NO3--N 含量持续下降;添加N-CNPs 各处理淋溶液中NO3- -N 含量显著低于单施尿素处理,以第8d为例,添加N-CNPs的处理T1、T2和T3中NO3--N淋失量分别为10.22、9.23、7.71mg,仅为CK1处理峰值的44.11%、39.86%和33.30%,而CK2处理峰值与T2最为接近,仅低0.26mg。
|
| 图 2 红壤中NO3--N 淋失量动态变化 Figure 2 Dynamics of NO3--N leaching loss in red soil |
图 3 是N-CNPs 处理下红壤中氨挥发动态变化曲线。除不施肥处理CK0外,其余各处理氨挥发量均在每次淋溶完成后呈现一次高峰,各峰值随着淋溶次数的增加快速下降,到第4 次淋溶后趋于平稳,添加了N-CNPs 的各处理每次氨气挥发量均高于单施尿素(CK1)和添加5%DCD 处理(CK2),最大差值达到0.50 mg(添加15译N-CNPs处理和CK1处理,第9 d)。各处理氨气挥发量峰值均出现在第一次高峰,挥发量分别为1.00 mg(CK1)、0.89 mg(CK2)、0.89 mg(T1)、0.84 mg(T2)和0.86 mg(T3)。

|
| 图 3 氨挥发动态变化曲线 Figure 3 Dynamics of NH3 content |
表 1 是淋溶试验过程中不同形态氮素累积损失情况。数据表明,N-CNPs的添加施用对NH4+-N、NO3--N 的淋失总量与氨气的挥发量有着不同的影响。淋溶试验结束时,各处理NH4+-N 累积淋出总量分别占总施N 量的2.13%(CK1)、5.02%(CK2)、5.86%(T1)、5.44%(T2)和4.68%(T3)。这表明N-CNPs 的加入会显著增大尿素施入红壤后NH4+-N 的淋失量。但对于NO3--N 而言,N-CNPs 的加入则显著降低尿素施入红壤后淋出量,相较于CK1 处理的60.97 mg,15译NCNPs处理仅为20.08 mg,5译N-CNPs 添加量与5%DCD 添加量对降低红壤中NO3- -N 淋溶损失的效果最为接近。施用15译N-CNPs处理在试验期间累积氨气释放量最高,达到3.91 mg,显著高于纯尿素处理,也显著高于添加5%硝化抑制剂DCD 处理;减少NCNPs用量,氨气的挥发量也同步降低,且用量间差异达显著水平。尽管N-CNPs的施用会在一定程度上增加NH4+-N淋失量和氨气的挥发量,但从氮的损失总量结果来看,N-CNPs的施用表现出较好的减少尿素氮损失的效果,随着N-CNPs添加量从1译提升至15译,尿素氮损失量的减少幅度从35.67%增加到49.98%。
由表 2 可见,经酸雨淋溶后,各处理红壤中Ca2+、Mg2+、K+和Na+等交换性阳离子均有淋出,各处理淋出交换性阳离子总量为8.74~10.46 mmol,占淋溶前土壤中交换态阳离子比例为17.17%~20.56%。施用尿素(CK1)增加了红壤中交换态阳离子的淋失量,而配施N-CNPs 则有效减少了施用尿素后交换态阳离子的淋出总量,其减少值随N-CNPs 用量增加而增加,分别达到0.44、0.92、1.39 mmol,差异均达到显著水平;硝化抑制剂DCD配施尿素处理较单施尿素处理其交换性阳离子淋出总量小幅降低,但差异不显著。从单种交换性阳离子中淋溶总量来看,N-CNPs 的施用对降低二价阳离子的淋溶量作用显著高于一价阳离子,4种交换性阳离子减少量排序为Ca2+>Mg2+>Na+>K+。以15译N-CNPs 添加量为例,Ca2+累积淋失量较单施尿素处理低1.28 mmol,降幅达27.92%;Mg2+次之,差值0.59 mmol,降幅为14.30%;Na +降幅也达到14.27%,K+降幅最低仅6.41%。
 |
由表 2可知,经多次酸雨淋溶后,各处理土壤pH值、CEC 值和BS 值均表现出明显的下降,其中纯尿素处理(CK1)降幅最大,降幅分别达到0.94、3.13cmol·kg-1和3.64%。N-CNPs的加入,减小了土壤pH值、CEC 值和BS 值的下降幅度,不同用量N-CNPs处理土壤pH 值、CEC 值和BS 值均显著高于纯尿素处理土壤,且随着N-CNPs 用量的增加,各指标下降幅度逐步缩小,当N-CNPs 添加量达到15译时,土壤pH值、CEC值和BS 值分别达到5.23、20.27 cmol·kg-1和24.17%,接近甚至高于原土淋溶(CK0)处理,完全抵消了尿素加入对红壤酸化和阳离子淋失的影响。同样能减少氮素淋失的DCD 处理则没表现出明显的降低pH值、CEC值和BS 值的作用。
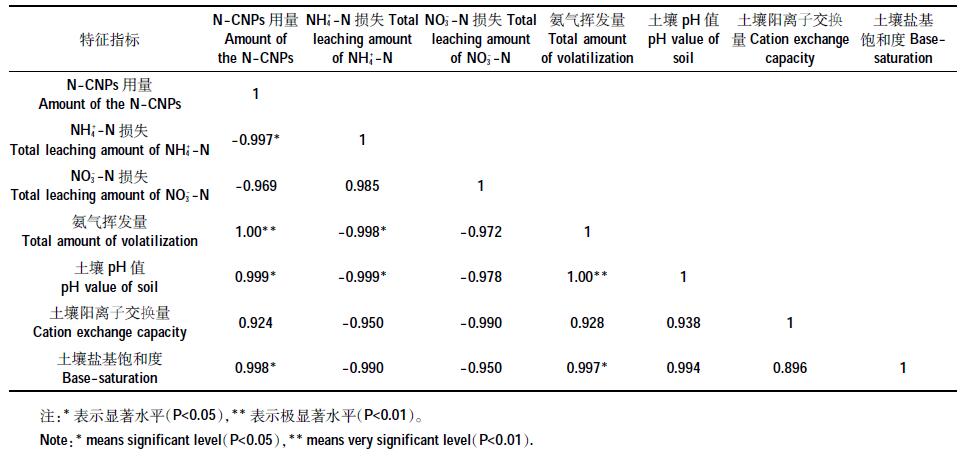
2.3 N-CNPs 用量与尿素氮损失和土壤交换性阳离子相关分析从表 3 相关分析结果可以看出,N-CNPs 用量与NH4+-N 和NO3--N 淋失变化量呈负线性相关,与氨气挥发变化量呈正线性相关,其皮尔逊相关系数分别为-0.998、-0.969 和1.00,并与NH4+-N 淋失变化量的相关性达到显著水平(P<0.05),与氨气挥发量的相关性达到极显著水平(P<0.01)。N-CNPs用量与红壤pH值、CEC 值和BS 值等指标也呈现出正线性相关关系,其中与pH 值和盐基饱和度的相关性均达到了显著水平(P<0.05)。土壤氮素损失量与pH 值、CEC 值和BS 值等指标间也表现出了相关性,其中pH 值与氨气挥发量呈显著正线性相关(P<0.05),与NH4+ -N淋失变化量呈显著负线性相关(P<0.05),盐基饱和度也与氨气挥发量呈显著正线性相关(P<0.05)。
 |
双氰胺是目前农业生产中常用的一种氰胺类硝化抑制剂,将其与氮肥配合使用对于提升氮肥利用率,减轻氮肥施用带来的环境压力已表现出很好的效果[8]。大量试验表明双氰胺能显著降低硝态氮的淋溶,如双氰铵的施用能减少休闲地土壤中的硝态氮损失达25%~50%[9],田间施用7~10 kg·hm-2 DCD 后,春季和秋季土壤中NO3-的淋溶损失分别降低10%~26%和55%~57%[10]。在本研究中,N-CNPs 的施用同样表现出了降低硝态氮淋失的效果,其5译和15译的施用量分别减少红壤中硝态氮的淋失量达60.42%和67.15%,高于本试验中5%DCD 所能达到的59.20%,同时在已报道的各类研究结果中处于较高水平。
双氰胺对硝化作用的抑制作用主要是因为DCD结构中含有与NH3结构相似的氨基(-NH2)和亚氨基(=NH),可使DCD 以底物竞争的形式干扰氨氧化微生物对底物的利用,从而抑制硝化作用[11],在这种机制作用下,土壤中的硝态氮常会表现出一种“S”的变化曲线[12]。在本研究中,DCD 和N-CNPs处理淋溶液中硝态氮含量变化曲线大体相似,均表现出近似“S”型的变化曲线。由此推测,N-CNPs 能减少红壤中硝态氮淋失的主要原因在于减少了土壤中硝态氮含量。采用氨水为氮掺杂源制备的N-CNPs 中同样存在丰富的氨基(-NH2)[13],这可能是N-CNPs 同DCD 一样降低土壤中硝态氮含量的机制之一。同时,碳纳米颗粒作为一种有着极强吸附能力的新型材料[14],其在环境中的存在可能会改变极性或非极性基团(如NH4+、NO3-等)在水相和土相的分配比,从而改变它们在环境中的迁移性[15],也能改变它们发生氧化还原、水解、光解反应的速率和过程[16],应用于土壤还能减少土壤水分流失、提高土壤水肥利用率以及改善土壤物理结构[17]。这些机制也都可能是N-CNPs引发土壤中硝态氮含量减少的原因,本试验对淋溶土壤交换性阳离子含量的测定也表明了这一点。N-CNPs的施用极大地改善了土壤性状,尤其是土壤pH 值和盐基饱和度得到了显著提升。大量研究结果也证明土壤中的硝态氮含量与土壤的pH 值呈显著负相关,与盐基饱和度呈显著正相关[18-19]。
氮素循环伴随着H+的吸收与释放。氨化作用每释放1 mol NH4+需要消耗1 mol H+,硝化作用每氧化1mol NH4+为NO3-向环境中释放2 mol H+[20],因此尿素施用后土壤pH值常出现先升高后降低的趋势[21]。在本研究中,N-CNPs配施尿素处理显著提升了淋溶后土壤pH,且整个淋溶期土壤NH4+淋失量和土壤累积氨气挥发量都明显高于纯尿素处理。这可能是N-CNPs通过延缓硝化作用过程减少H+释放,使得土壤pH 出现了较长时间的上升状态,并保持NH4+始终处于较高水平。
从本研究结果来看,尽管试验过程中由于提升了土壤pH而增加了氨气挥发和NH4+-N淋失的风险,但总体上仍能显著减少酸雨淋溶条件下红壤中氮素的损失总量,若能采取合理的农业措施避免这类风险,对于N-CNPs的氮肥增效效果将有进一步的提升。施用尿素极易造成南方酸性红壤区土壤的进一步退化,进而限制大多数植物的生长[22],因此采用N-CNPs 配施尿素对于提升尿素利用率,同时改善土壤性状,降低土壤酸化风险有着重要的理论意义和推广价值。
4 结论(1) 氮掺杂碳纳米粒子对不同形态氮素损失的影响存在差异,N-CNPs的加入会显著增大尿素施入红壤后NH4+-N 的淋失量和氨气挥发量,但能显著降低NO3--N 淋失量,其作用效果与N-CNPs 添加量呈正相关。
(2) 氮掺杂碳纳米粒子伴随尿素施入红壤后,在pH 4.38 的模拟酸雨多次淋溶条件下,能显著降低总氮损失量,总氮损失量随N-CNPs 的施用量增加而增加,和单施尿素处理相比,总氮损失降幅最大能达到49.98%,其中5译N-CNPs 添加量能达到5%DCD 的硝化抑制效果
(3) N-CNPs 施用后,土壤交换性阳离子淋失量均呈现出下降趋势,具体表现为Ca2+>Mg2+>Na+>K+;同时,淋溶完成后土壤pH 值和BS 值升高,且与NCNPs添加量呈显著正相关(P<0.05)。
(4) 土壤pH 值和BS 值的改善可能是N-CNPs施用于红壤后引起土壤氮素淋失降低的原因之一。
| [1] | 孙波, 王兴祥, 张桃林. 红壤养分淋失的影响因子[J]. 农业环境科学学报, 2003, 22(3) : 257–262. SUN Bo, WANG Xing-xiang, ZHANG Tao-lin. Influencing factors of leaching nutrients in red soils[J]. Journal of Agro-Environment Science, 2003, 22(3) : 257–262. |
| [2] | 刘丽, 廖伏初, 邓时铭, 等. 湘江干流水体无机氮污染现状分析[J]. 环境保护科学, 2011, 37(2) : 14–16. LIU Li, LIAO Fu-chu, DENG Shi-ming, et al. Investigation on the contamination by dissloved inorganic nitrogen in Xiangjiang River[J]. Environmental Protection Science, 2011, 37(2) : 14–16. |
| [3] | 熊江波, 李雁勇, 王翠红, 等. 长沙市城区周边地区地下水硝酸盐态氮含量及污染状况评价[J]. 湖南农业科学, 2010(4) : 88–90. XIONG Jiang-bo, LI Yan-yong, WANG Cui-hong, et al. The nitrate nitrogen content in groundwater in surrounding area of Changsha City and the evaluation of pollution status[J]. Hunan Agricultural Sciences, 2010(4) : 88–90. |
| [4] | 胡伟, 杨玉兰, 王燕. 氮掺杂碳纳米粒子对土壤氮素转化及油菜苗期生长的影响[J]. 中国土壤与肥料, 2016(4) : 108–112. HU Wei, YANG Yu-lan, WANG Yan. Effects of adding nitrogen-doped carbon nanoparticles(N-CNPs) on fertilizer nitrogen transformation in soil and on rapeseed growth at seedling stage[J]. Soil and Fertilizer Sciences in China, 2016(4) : 108–112. |
| [5] | 梁太波, 尹启生, 张艳玲, 等. 施用纳米碳对烤烟氮素吸收和利用的影响[J]. 生态学报, 2014, 34(6) : 1429–1435. LIANG Tai-bo, YIN Qi-sheng, ZHANG Yan-ling, et al. Effects of nanocarbon application on nitrogen absorption and utilization of fluecured tobacco[J]. Acta Ecologica Sinica, 2014, 34(6) : 1429–1435. |
| [6] | 李莉香, 刘永长, 耿新, 等. 掺杂碳纳米管的制备及其电化学性能[J]. 物理化学学报, 2011, 27(2) : 443–448. LI Li-xiang, LIU Yong-chang, GENG Xin, et al. Synthesis and electrochemical performance of nitrogen-doped carbon nanotubes[J]. Acta Physico-Chimica Sinica, 2011, 27(2) : 443–448. |
| [7] | 刘云朋, 周洁, 李中坚, 等. 氮掺杂有序介孔碳的研究进展[J]. 现代化工, 2014, 34(6) : 19–22. LIU Yun-peng, ZHOU Jie, LI Zhong-jian, et al. Research progress of N-doped ordered mesoporous carbon[J]. Modern Chemical Industry, 2014, 34(6) : 19–22. |
| [8] | 串丽敏, 安志装, 杜连凤, 等. 脲酶/硝化抑制剂对壤质潮土氮素淋溶影响的模拟研究[J]. 中国农业科学, 2011, 44(19) : 4007–4014. CHUAN Li-min, AN Zhi-zhuang, DU Lian-feng, et al. Effects of urease/nitrification inhibitor on soil nitrogen leaching loss in loamy fluvo-aquic soil[J]. Scientia Agricultura Sinica, 2011, 44(19) : 4007–4014. |
| [9] | Davies D M, Williams P J. The effect of the nitrification inhibitor dicyandiamide on nitrate leaching and ammonia volatilization:A U. K. Nitrate sensitive areas perspective[J]. Journal of Environmental Management, 1995, 45(3) : 263–272. DOI:10.1006/jema.1995.0074 |
| [10] | Zaman M, Blennerhassett J D. Effects of the different rates of urease and nitrification inhibitors on gaseous emissions of ammonia and nitrous oxide, nitrate leaching and pasture production from urine patches in an intensive grazed pasture system[J]. Agriculture, Ecosystems & Environment, 2010, 136(3/4) : 236–246. |
| [11] | Iizumi T, Mizumoto M, Nakamura K. A bioluminescence assay using Nitrosomonas europaea for rapid and sensitive detection of nitrification inhibitors[J]. Applied and Environmental Microbiology, 1998, 64(10) : 3656–3662. |
| [12] | 孙志梅, 张阔, 刘建涛, 等. 氮肥调控剂对潮褐土中不同氮源氮素转化及油菜生长的影响[J]. 应用生态学报, 2012, 23(9) : 2497–2503. SUN Zhi-mei, ZHANG Kuo, LIU Jian-tao, et al. Effects of nitrogen regulators on fertilizer nitrogen transformation in meadow cinnamon soil and on pakchoi growth[J]. Chinese Journal of Applied Ecology, 2012, 23(9) : 2497–2503. |
| [13] | Liu L Q, Li Y F, Zhang L, et al. One-step synthesis of fluorescent hydroxyls-coated carbon dots with hydrothermal reaction and its application to optical sensing of metal ions[J]. Science China(Chemistry), 2011, 54(8) : 1342–1347. |
| [14] | 姬丽琴, 齐永新, 周林成, 等. 磁性微/纳米材料吸附环境污染物的研究进展[J]. 化工新型材料, 2011, 39(11) : 32–35. JI Li-qin, QI Yong-xin, ZHOU Lin-cheng, et al. Progress in adsorption of environmental pollutants by magnetic micro/nano-materials[J]. New Chemical Materials, 2011, 39(11) : 32–35. |
| [15] | Mauter M S, Elimelech M. Environmental applications of carbon-based nanomaterials[J]. Environmental Science & Technology, 2008, 42(16) : 5843–5859. |
| [16] | Smith B, Wepasnick K, Schrote K E, et al. Colloidal properties of aqueous suspensions of acid-treated, muti-walled carbon nandtubes[J]. Environmental Science & Technology, 2009, 43(3) : 819–825. |
| [17] | 谭帅, 周蓓蓓, 王全九. 纳米碳对扰动黄绵土水分入渗过程的影响[J]. 土壤学报, 2014, 51(2) : 263–268. TAN Shuai, ZHOU Bei-bei, WANG Quan-jiu. Effects of nano-carbon on water infiltration process in disturbed loessal soil[J]. Acta Pedologica Sinica, 2014, 51(2) : 263–268. |
| [18] | 蔡泽江, 孙楠, 王伯仁, 等. 几种施肥模式对红壤氮素形态转化和pH的影响[J]. 中国农业科学, 2012, 45(14) : 2877–2885. CAI Ze-jiang, SUN Nan, WANG Bo-ren, et al. Experimental research on effects of different fertilization on nitrogen transformation and pH of red soil[J]. Scientia Agricultura Sinica, 2012, 45(14) : 2877–2885. |
| [19] | 魏迎春, 李新平, 刘刚, 等. 杨凌地区大棚土壤硝态氮累积效应研究[J]. 水土保持学报, 2008, 22(2) : 174–176. WEI Ying-chun, LI Xin-ping, LIU Gang, et al. Effect of Nitric Nitrogen on different greenhouse soil in Yangling area[J]. Journal of Soil and Water Conservation, 2008, 22(2) : 174–176. |
| [20] | Vries W D, Breeuwsma A. The Relation between soil acidification and element cycling[J]. Water, Air, and Soil Pollution, 1987, 35(3) : 293–310. |
| [21] | Tong D L, Xu R K. Effects of urea and (NH4)2SO4 on nitrification and acidification of ultisols from Southern China[J]. Journal of Environmental Sciences, 2012, 24(4) : 682–689. DOI:10.1016/S1001-0742(11)60832-2 |
| [22] | 曾清如, 廖柏寒, 蒋朝辉, 等. 施用尿素引起红壤pH及铝活性的短期变化[J]. 应用生态学报, 2005, 16(2) : 249–252. ZENG Qing-ru, LIAO Bo-han, JIANG Zhao-hui, et al. Short-term changes of pH value and Al activity in acid soils after urea fertilization[J]. Chinese Journal of Applied Ecology, 2005, 16(2) : 249–252. |
 2017, Vol. 36
2017, Vol. 36