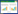文章信息
- 席志楠, 李增波, 王聪颖, 史志明
- XI Zhi-nan, LI Zeng-bo, WANG Cong-ying, SHI Zhi-ming
- 磁性生物质炭对水体中芘的去除效果研究
- The removal effect of magnetic biochar on pyrene in aqueous phase
- 农业环境科学学报, 2017, 36(1): 176-182
- Journal of Agro-Environment Science, 2017, 36(1): 176-182
- http://dx.doi.org/10.11654/jaes.2016-0922
文章历史
- 收稿日期: 2016-07-16
2. 太原科技大学化学与生物工程学院, 太原 030002
2. School of Chemical and Biological Engineering, Taiyuan University of Science and Technology, Taiyuan 030002, China
生物质炭是生物质在缺氧或无氧条件下经高温裂解形成的富碳固体[1]。已有的研究表明[2-5],生物质炭在提高土壤肥力、增加作物产量、改善土壤养分循环、增加土壤固碳等方面具有重要的作用。此外,生物质炭因具有丰富的孔隙、较大的比表面积和高度的稳定性等独特的理化性质,可以作为吸附剂,去除水体中的各种有机和无机污染物[6-8]。一般来说,生物质炭的粒径越小,其去除污染物的能力越强。然而,粉末状的生物质炭在去除水体中的污染物后,从水体中分离十分困难[9-10]。常见的过滤或离心的方法耗时长,操作相对复杂[11],而利用化学方法将生物质炭磁化,在污染物去除后,利用外加磁场将炭从水体中分离[12],可能比离心和过滤等方法更快速有效[13]。Chen 等[14]利用共沉淀的方法制备磁性生物质炭,将其用于吸附水体中的萘、对硝基甲苯等有机污染物,具有较好的效果。目前,关于磁性生物质炭的研究,多集中在对水体中重金属的去除,如Zhang 等[15]利用水葫芦制备磁性生物质炭吸附水体中的Cr(遇),Reddy 等[16]利用松树皮制备磁性生物质炭吸附水体中的Pb(Ⅱ)和Cd(Ⅱ)。而对于水体中有机污染物,特别是多环芳烃(PAHs)的去除研究极少。
本文以柳树枝为原料,在600℃下制备原始生物质炭,再通过化学沉淀法制备磁性生物质炭,然后比较了生物质炭磁化前后对水体中芘的吸附行为,试图验证磁性生物质炭对水体中芘的去除效果,以期为快速去除水体中的PAHs 类有机污染物提供理论依据和可行方法。
1 材料与方法 1.1 试剂与仪器芘标准品纯度为98.9%(J&K Scientific),用甲醇配制芘储备液,浓度为1.0 g·L-1。以0.01 mol·L-1 的CaCl2 和200 mg·L-1 的NaN3 混合溶液作为吸附实验的背景溶液。试验用水为Millipore 超纯水,甲醇等有机溶剂均为色谱级,其他化学试剂均为分析纯。所用的仪器有:Waters1525 高效液相色谱仪(Agilent1200,美国),配备SUPELCO,5 μm,4.6 mm×150 mmC18 色谱柱及Waters 474SFD 和Waters 2487UVD 双检测器,恒温摇床(ZD-85A,金坛市富华仪器有限公司),旋转蒸发仪(Heidolph,德国),马弗炉(SX2-12-10N,上海跃进医疗器械厂),元素分析仪(Flash EA1112,Thermo Finnigan,美国),静态氮吸附仪(TriStar3020 II,美国Micromeritics),pH 计(PHS-3E,中国),傅里叶红外光谱(Tensor 27,Bruker,德国),扫描电镜(S-3400N,日本日立),X 射线衍射仪(X’Pert PRO,荷兰帕纳科)。
1.2 磁性生物质炭的制备方法利用柳树枝在600℃的马弗炉中制备生物质炭,具体制备方法见Wang 等[17]的报道,制得的原始生物质炭标记为LZ。在制备磁性生物质炭之前,将原始炭反复研磨并过150 μm孔径筛。磁性生物质炭的制备方法参考Han 等[9]和Wang 等[13]的研究,并予以适当修改。具体方法为:称取2.50 g的LZ 和3.33 g的FeCl3·6H2O 放入三角瓶中,加入适量去离子水,超声处理15min;在搅拌状态下将反应物加热至80益,维持30 min,然后在N2保护下加入1.31 g的FeCl2·4H2O,再充分搅拌30 min 后冷却至40℃以下;在N2 保护下,滴加NaOH溶液,至pH为10~11,以形成Fe(OH)3沉淀,继续充分搅拌1 h,盖上保鲜膜,静置过夜;去除上清液,用去离子水反复冲洗沉淀物,之后用乙醇冲洗若干次,在45℃下真空干燥24 h,得到磁性生物质炭。在此过程中,调节生物质炭和FeCl3·6H2O、FeCl2·4H2O 的比例,制备磁性强度不同的生物质炭,分别标记为LZ1.5 和LZ2.5(字母后面的数字是按照反应式Fe2++2Fe3+→Fe3O4,生成Fe3O4的理论值,分别为1.5 g和2.5 g),备用。
1.3 磁性生物质炭的结构表征生物质炭的元素组成用元素分析仪测定。生物质炭的比表面积、平均孔径等用静态氮吸附仪测定。表面官能团用傅里叶红外光谱(FTIR)表征。表面结构用扫描电镜(SEM)观察。所含的矿物成分用X射线衍射仪(XRD)分析。pH按照俞美花[7]的方法测定。
1.4 吸附实验选择PAHs中典型的芘进行吸附实验。实验设3次平行,同时设置空白对照。称取5.0 mg生物质炭样品于60 mL 的棕色玻璃瓶中,加入10 μL 一定浓度的芘贮备液(使其最终浓度为100 μg·L-1)和40 mL 的背景溶液(其中含有0.01 mol·L-1 的CaCl2和200 mg·L-1的NaN3混合溶液,以控制离子强度并抑制微生物降解作用)。用带聚四氟乙烯密封垫的盖子密封,置于(25±0.5)℃的摇床上,转速为60 r·min-1,避光振荡一定时间后将样品取出,测定其中的芘。含有原始生物质炭的溶液要经过4000 r·min-1 离心,该过程需30min;而磁性生物质炭从水体中分离,只需通过外加磁铁,该过程仅需要15 s,为保证其尽可能完全沉降,分离时间延长为1 min,即可达到迅速聚集的目的,分离效果见图 1。然后取5 mL 上清液与等体积的二氯甲烷混合,涡旋3 min,静置10 min,收集有机相,此过程重复3 次;将3 次收集的有机相合并,利用旋转蒸发仪浓缩至2 mL,N2吹至近干,用甲醇转移至进样瓶,并定容至1 mL,用高效液相色谱仪测定。

|
| 图 1 磁性生物质炭的分离效果 Figure 1 The separation effect of magnetic biochars |
通过上述实验确定:①吸附平衡所需要的时间:分别在第1、2、3、6、12、24、36、48、60、72 h 将样品取出,测定分析;②芘的吸附等温线:芘的初始浓度分别为10、20、30、40、50、60、80、100 μg·L-1[18];③最佳使用量:选取吸附效果最好的生物质炭样品,投加量分别为5.0、10.0、15.0、20.0、25.0 mg。
1.5 色谱条件及质量控制使用高效液相色谱仪分析溶液中芘的浓度时,流动相为90:10(V/V)的甲醇/水溶液,流速为1 mL·min-1;荧光检测器激发波长265 nm、发射波长394 nm[19],进样量为10 μL。色谱峰面积使用外标法定量,芘浓度通过质量平衡计算得到。质量控制方面,芘的加标回收率为96.5%依0.4%,同时对PAHs 实验室背景浓度进行测定,其值低于检测限,表明符合环境样品分析要求。
1.6 计算方法吸附量Qe(μg·g-1)、去除率E(%)按下式计算:
 (1)
(1) 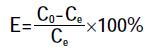 (2)
(2) 式中:C0、Ce 分别为芘初始、平衡时的质量浓度,μg·L-1;V 为芘溶液的体积,L;m为吸附剂的用量,g。
采用Freundlich 和Langmuir 模型对芘的吸附过程进行拟合,方程式分别为:
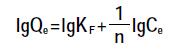 (3)
(3) 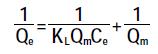 (4)
(4) 式中:n为Freundlich 的常数;KF为Freundlich 吸附常数,μg1-1/n·g-1·L1/n;Qm为吸附剂的最大吸附量,μg·g-1;KL为Langmuir 吸附平衡常数,L·μg-1。
实验数据采用SPSS 17.0 进行处理,采用Origin8.0作图。
2 结果与讨论 2.1 生物质炭的元素组成与结构特征生物质炭的元素组成、表面特性参数(比表面积、孔体积、平均孔径)和pH见表 1。可以看出,原始生物质炭LZ的碳含量最高,为74.2%,磁化后碳含量逐渐降低,LZ1.5 和LZ2.5 的含碳量分别为46.1%和35.7%。三种炭呈弱碱性至碱性。
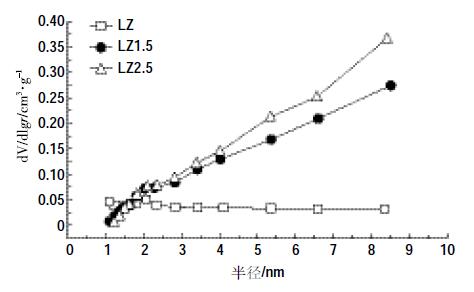
原始生物质炭和磁性生物质炭的表面特征参数也有较大差异。其中,LZ的比表面为228.06 m2·g-1,分别是LZ1.5(61.11 m2·g-1)和LZ2.5(70.09 m2·g-1)的3.73、3.25 倍,可见磁化作用可使炭的比表面积减小。这与一些研究中观察到的结果一致[9, 20],其原因在于铁的氧化物具有相对较小的比表面积[21]。三种炭的孔体积和平均孔径的大小顺序与比表面的规律相反,表现为LZ2.5>LZ1.5>LZ。生物质炭的扫描电镜结果(图 2)清晰地显示了三种炭所富含的多孔结构。图 3为三种炭的孔隙分布图。可以看出,磁化炭LZ1.5和LZ2.5在1.8~2.0 nm之间的微孔含量接近,均明显高于LZ;>2 nm的中孔在LZ1.5 和LZ2.5 中均逐渐增加,而在LZ中变化不明显。

|
| 图 2 生物质炭的扫描电镜图(10 000 倍) Figure 2 Scanning electron microscopy(SEM)of biochars(伊10 000) |
|
| 图 3 生物质炭的孔径分布 Figure 3 Pore size of biochar and magnetic biochars |
生物质炭的XRD 分析结果见图 4。原始生物质炭LZ 中含有较多的CaCO3(d=0.303 5 nm,d=0.228 5nm,d=0.209 5 nm)和SiO2(d=0.334 3 nm,d=0.181 8nm),而磁性生物质炭LZ1.5 和LZ2.5 中的Fe3O4(d=0.270 0 nm,d =0.251 9 nm,d =0.184 0 nm,d =0.169 4nm,d=0.148 6 nm)显著增多,且这两种晶体有相似的XRD 图谱。

|
| 图 4 生物质炭的X 射线衍射(XRD)分析 Figure 4 X-ray diffraction analysis of biochars |
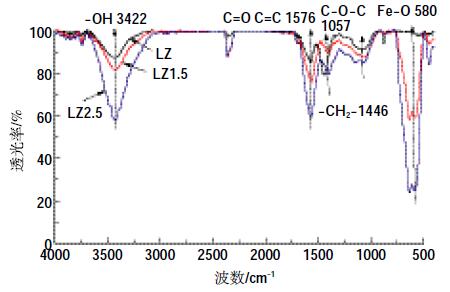
生物质炭的红外谱图见图 5。生物质炭含有丰富的官能团,其中,3650~3000 cm-1 吸收峰来自羟基的-OH 的伸缩振动[1],1650~1520 cm-1主要是芳烃的C=O、C=C 伸缩振动吸收[22],1446 cm-1处为-CH2-伸缩振动吸收[14],1075~1020 cm-1主要是C-O-C 伸缩振动吸收[23],580 cm-1处为Fe-O[24]。从图 5 可以看出,生物质炭磁化之后,依然保留了原始生物质炭的芳香性官能团。而图 4中的Fe3O4(d=0.270 0 nm,d=0.251 9 nm,d=0.184 0 nm,d=0.169 4 nm,d=0.148 6 nm)和图 5 中580cm-1处的Fe-O 振动,充分说明本研究中的磁化方法成功地促使了Fe 元素与表面官能团的结合。
|
| 图 5 三种生物质炭的红外光谱(FTIR)图 Figure 5 Fourier transform infrared spectroscopy(FTIR)of biochars |
在芘的初始浓度为100 μg·L-1时,三种生物质炭对芘的吸附量随时间的变化如图 6 所示。在开始的12 h 内,三种炭对芘的吸附量迅速增加到513.3、370.7、275.4 μg·g-1,且表现为LZ1.5>LZ2.5>LZ。此后,LZ对芘的吸附不再有明显变化,而LZ1.5 和LZ2.5 的吸附量仍然有缓慢增加,且前者的增加幅度大于后者,至72 h时吸附达到平衡,LZ、LZ1.5 和LZ2.5 的吸附量分别为293.1、620.6、449.2 μg·g-1。可见,磁化生物质炭的吸附能力显著高于非磁化炭。Chen 等[14]也得到了相似的结果,在他们的研究中,400℃制备的橘皮磁性炭对萘的吸附能力显著高于非磁化炭。为了便于比较,本研究选择72 h 作为三种生物质炭的吸附平衡时间。

|
| 图 6 生物质炭对芘的吸附动力学曲线 Figure 6 Kinetics curves of pyrene adsorption by biochars |
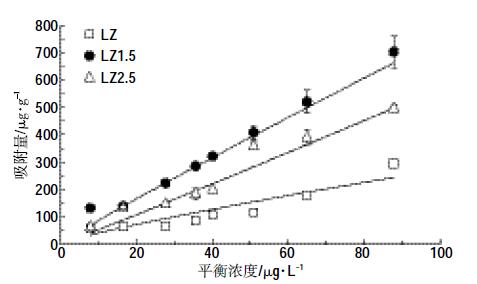
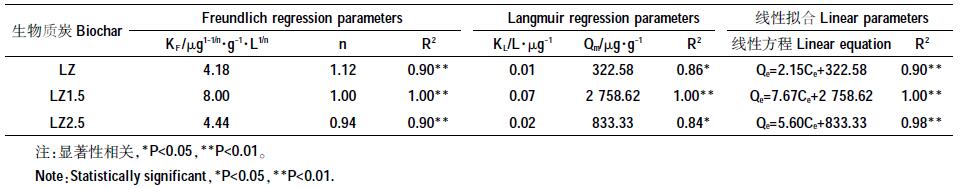
生物质炭对芘的吸附等温线见图 7。随着芘浓度升高,三种生物质炭的吸附量均逐渐增强。同时利用Freundlich 模型和Langmuir 模型对吸附数据进行拟合,结果见表 2。由表 2 可知,Freundlich 模型和Langmuir 模型拟合后的相关系数范围分别为0.90~1.00 和0.84~1.00,可见两种模型均能较好地拟合生物质炭对芘的吸附过程(P<0.05)。而且,Freundlich 模型的拟合优度都高于Langmuir 模型,说明生物质炭对芘的吸附不局限于单层吸附[25]。对于Freundlich 模型,LZ1.5 的吸附系数KF最大,为8.00 μg1-1/n ·g-1·L1/n,其次是LZ2.5和LZ,分别是4.44、4.18 μg1-1/n·g-1·L1/n。而Langmuir 的拟合结果也显示,三种生物质炭的最大吸附容量Qm分别为322.58、2 758.62、833.33 μg·g-1,其中LZ1.5 的最大吸附容量Qm 分别是LZ2.5 和LZ的3.3、8.6 倍。生物质炭磁化之后,对芘的吸附能力显著提高。一方面由于其保留了原有的芳香性官能团(图 5);另一方面,Fe3O4 的存在造成磁性炭表面微孔化(图 3)以及羟基化(图 5)。图 3 显示磁化生物质炭的微孔半径大于1.8 nm 的孔隙明显多于非磁化生物质炭。有资料表明,微孔“吞噬”是碳基材料吸附有机物的重要机理之一[14, 26-27],特别是高温制备的生物质炭[27],而且羟基与有机物分子容易形成氢键作用力[28]。以上原因共同导致LZ1.5 吸附量增大。LZ2.5 的吸附能力之所以低于LZ1.5,主要是因为LZ2.5 中过多的铁氧化物将一部分有效吸附位点覆盖,从而妨碍了其对芘的吸附。
|
| 图 7 生物质炭对芘的吸附等温线 Figure 7 Sorption isotherms of pyrene by biochars |
 |
选择吸附效果最佳的生物质炭LZ1.5 进行最佳投加量实验。LZ1.5 的投加量在5.0~25.0 mg 之间,芘初始浓度为100 μg·L-1,此时生物质炭的投加量浓度分别为125、250、375、500、625 mg·L-1。由实验结果(图 8)可知,当LZ1.5 的投加量从5.0 mg 增加到15.0mg 时,芘的去除率从79.0%逐渐升高,并达到最大值89.5%。这是因为吸附剂投加量的增加使得溶液中吸附剂表面积增大,表面有效吸附位点增多,吸附剂结合位点的可获得性提高,因而更多的芘被吸附。

|
| 图 8 LZ1.5 投加量对芘的去除率的影响 Figure 8 Removal of pyrene by magnetic biochar of LZ1.5 |
此后,随着LZ1.5 投加量继续增加,芘的去除率缓慢下降,投加量为25.0 mg 时,芘的去除率为85.9%。这表明溶液中的芘已经被大量去除,质量浓度很低,而吸附剂表面还存在大量不饱和吸附位点,吸附量下降[6]。因此,在本研究中,当芘的初始浓度为100 μg·L-1时,生物质炭的最佳投加量为15.0 mg。
3 结论生物质炭磁化之后对芘的吸附性能显著提高,但持续增加Fe3O4 的含量不能使磁性炭的吸附能力进一步增强。磁性炭吸附能力提高的原因,一方面在于其保留了原有的芳香性官能团,另一方面,Fe3O4的存在造成了磁性炭表面的微孔化以及羟基化。磁性生物质炭,不仅能增加对水体中芘的吸附能力,而且更易将其从水体中分离出来,故对于磁性吸附剂的商业化生产并用于水体中有机污染物的去除具有重要的理论和实践意义。
| [1] | 陈再明, 陈宝梁, 周丹丹. 水稻秸秆生物碳的结构特征及其对有机污染物的吸附性能[J]. 环境科学学报, 2013, 33(1) : 9–19. CHEN Zai-ming, CHEN Bao-liang, ZHOU Dan-dan. Composition and sorption properties of rice-straw derived biochars[J]. Acta Scientiae Circumstantiae, 2013, 33(1) : 9–19. |
| [2] | 孔丝纺, 姚兴成, 张江勇, 等. 生物质炭的特性及其应用的研究进展[J]. 生态环境学报, 2015, 24(4) : 716–723. KONG Si-fang, YAO Xing-cheng, ZHANG Jiang-yong, et al. Review of characteristics of biochar and research progress of its applications[J]. Ecology and Environmental Sciences, 2015, 24(4) : 716–723. |
| [3] | 刘莹莹. 不同原料生物质炭基本性质及其对溶液中Cd2+和Pb2+吸附特性的研究[D]. 南京:南京农业大学, 2012. LIU Ying-ying. A study on characteristics and adsorption of Cd2+ and Pb2+ in aqueous solution by biochars produced from the pyrolysis of different crop feedstock[D]. Nanjing:Nanjing Agriculture University, 2012. |
| [4] | 李瑞月, 陈德, 李恋卿, 等. 不同作物秸秆生物炭对溶液中Pb2+、Cd2+的吸附[J]. 农业环境科学学报, 2015, 34(5) : 1001–1008. LI Rui-yue, CHEN De, LI Lian-qing, et al. Adsorption of Pb2+ and Cd2+ in aqueous solution by biochars derived from different crop residues[J]. Journal of Agro-Environment Science, 2015, 34(5) : 1001–1008. |
| [5] | 冯彦房, 薛利红, 杨梖, 等. 载镧生物质炭吸附水体中As(Ⅴ)的过程与机制[J]. 农业环境科学学报, 2015, 34(11) : 2190–2197. FENG Yan-fang, XUE Li-hong, YANG Bei, et al. Adsorption of As(Ⅴ) from aqueous solution by lanthanum oxide-loaded biochar:Process and mechanisms[J]. Journal of Agro-Environment Science, 2015, 34(11) : 2190–2197. |
| [6] | 张再利, 况群, 贾晓珊. 花生壳吸附Pb2+、Cu2+、Cr3+、Cd2+、Ni2+的动力学和热力学研究[J]. 生态环境学报, 2010, 19(12) : 2973–2977. ZHANG Zai-li, KUANG Qun, JIA Xiao-shan. Study on the kinetics and thermodynamics of Pb2+, Cu2+, Cr3+, Cd2+, Ni2+ adsorption onto peanut hull[J]. Ecology and Environmental Sciences, 2010, 19(12) : 2973–2977. |
| [7] | 俞花美. 生物质炭对环境中阿特拉津的吸附解吸作用及机理研究[D]. 北京:中国矿业大学, 2014. YU Hua-mei. Sorption/desorption characteristics and mechanisms of biochars with atrazine in environment[D]. Beijing:China University of Mining and Technology, 2014. |
| [8] | 曹美珠, 潘丽萍, 张超兰, 等. 四种生物质炭的表面特性及其对水溶液中镉-阿特拉津的吸附性能研究[J]. 农业环境科学学报, 2014, 33(12) : 2350–2358. CAO Mei-zhu, PAN Li-ping, ZHANG Chao-lan, et al. Surface characteristics of four biochars and their adsorption of Cd and atrazine in aqueous solution[J]. Journal of Agro-Environment Science, 2014, 33(12) : 2350–2358. |
| [9] | Han Z T, Sani B, Mrozik W, et al. Magnetite impregnation effects on the sorbent properties of activated carbons and biochars[J]. Water Research, 2015, 70(1) : 394–403. |
| [10] | Yan L L, Kong L, Qu Z, et al. Magnetic biochar decorated with ZnS nanocrytals for Pb(Ⅱ) removal[J]. ACS Sustainable Chemistry & Engineering, 2015, 3(1) : 125–132. |
| [11] | Wang S S, Gao B, Zimmerman A R, et al. Removal of arsenic by magnetic biochar prepared from pinewood and natural hematite[J]. Bioresource Technology, 2015, 175 : 391–395. DOI:10.1016/j.biortech.2014.10.104 |
| [12] | Zhang G S, Qu J, Liu H, et al. CuFe2O4/activated carbon composite:A novel magnetic adsorbent for the removal of acid orange Ⅱ and catalytic regeneration[J]. Chemosphere, 2007, 68(6) : 1058–1066. DOI:10.1016/j.chemosphere.2007.01.081 |
| [13] | Wang S Y, Tang Y K, Li K, et al. Combined performance of biochar sorption and magnetic separation processes for treatment of chromium -contained electroplating wastewater[J]. Bioresource Technology, 2014, 174 : 67–73. DOI:10.1016/j.biortech.2014.10.007 |
| [14] | Chen B L, Chen Z M, Lv S F. A novel magnetic biochar efficiently sorbs organic pollutants and phosphate[J]. Bioresource Technology, 2011, 102(2) : 716–723. DOI:10.1016/j.biortech.2010.08.067 |
| [15] | Zhang M M, Liu Y G, Li T T, et al. Chitosan modification of magnetic biochar produced from Eichhornia crassipes for enhance adsorption of Cr(VI) from aqueous solution[J]. RSC Advances, 2015, 5(58) : 46955–46964. DOI:10.1039/C5RA02388B |
| [16] | Reddy D K, Lee S M. Magnetic biochar composite:Facile synthesis, characterization and application for heavy metal removal[J]. Collids and Surfaces A:Physicochemical and Engineering Aspects, 2014, 454(1) : 96–103. |
| [17] | Wang C Y, Wang T, Li W B, et al. Adsorption of deoxyribonucleic acid(DNA) by willow wood biochars produced at different pyrolysis temperatures[J]. Biology Fertility of Soils, 2014, 50(1) : 87–94. DOI:10.1007/s00374-013-0836-0 |
| [18] | Zhang W, Wang L, Sun H W. Modifications of black carbons and their influence on pyrene sorption[J]. Chemosphere, 2011, 85(8) : 1306–1311. DOI:10.1016/j.chemosphere.2011.07.042 |
| [19] | 王超, 彭涛, 吕怡兵, 等. 液相色谱法测定水中16种多环芳烃的方法优化[J]. 环境化学, 2014, 33(1) : 62–68. WANG Chao, PENG Tao, LÜ Yi-bing, et al. Optimization of liquid chromatography method for detection of 16 polycyclic aromatic hydrocarbons in environmental water[J]. Environmental Chemistry, 2014, 33(1) : 62–68. |
| [20] | Isari E C, Karapanagioti H K, Manariotis I D, et al. Synthesis of magnetic adsorbents for the removal of Hg(Ⅱ) from aqueous solutions[R]. European Geosciences Union General Assembly Conference, 2014:8923. |
| [21] | Castro C S, Guerreiro M C, Goncalves M, et al. Activated carbon/iron oxide composites for the removal of atrazine from aqueous medium[J]. Journal of Hazardous Materials, 2009, 164(2/3) : 609–614. |
| [22] | Bustin R M, Guo Y. Abrupt changes(jumps) in reflectance values and chemical compositions of artificial charcoals and inertinite in coals[J]. International Journal of Coal Geology, 1999, 38(3/4) : 237–260. |
| [23] | Keiluweit M, Nico P S, Johnson M G, et al. Dynamic molecular structure of plant biomass-derived black carbon(Biochar)[J]. Environmental Science & Technology, 2010, 44(4) : 1247–1253. |
| [24] | Lim S F, Zheng Y M, Chen J P. Organic arsenic adsorption onto a magnetic sorbent[J]. Langmuir, 2009, 25(9) : 4973–4978. DOI:10.1021/la802974x |
| [25] | Alessandro D S. Factors affecting sorption of organic compounds in natural sorbent/water systems and sorption coefficients for selected pollutants:A review[J]. Journal of Physical & Chemical Reference Data, 2011, 30(1) : 187–439. |
| [26] | Cornelissen G, Gustafsson O, Bucheli T D, et al. Extensive sorption of organic compounds to black carbon, coal and kerogen in sediments and soils:mechanisms and consequences for distribution, bioaccumulation and biodegradation (critical review)[J]. Environmental Science & Technology, 2005, 39(18) : 6881–6895. |
| [27] | Chen B, Zhou D, Zhu L. Transitional adsorption and partition of nonpolar and polar aromatic contaminants by biochars of pine needles with different pyrolytic temperatures[J]. Environmental Science & Technology, 2008, 42(14) : 5137–5143. |
| [28] | Tan X, Liu Y, Zeng G, et al. Application of biochar for the removal of pollutants from aqueous solutions[J]. Chemosphere, 2015, 125 : 70–85. DOI:10.1016/j.chemosphere.2014.12.058 |
 2017, Vol. 36
2017, Vol. 36