文章信息
- 郭京霞, 冯莲莲, 张起佳, 李云云, 曾涛, 王果
- GUO Jing-xia, FENG Lian-lian, ZHANG Qi-jia, LI Yun-yun, ZENG Tao, WANG Guo
- 不同钙质钝化剂对稻田土壤溶液中Cd浓度的影响
- Effects of limestone, slaked lime and dolomite on cadmium concentration in the solution of paddy rice soils
- 农业环境科学学报, 2017, 36(10): 1984-1991
- Journal of Agro-Environment Science, 2017, 36(10): 1984-1991
- http://dx.doi.org/10.11654/jaes.2017-1030
文章历史
- 收稿日期: 2017-07-25
- 接受日期: 2017-09-12
重金属污染是我国农业土壤面临的一个严峻的环境问题,其中重金属Cd污染问题比较突出。《全国土壤污染状况调查公报》显示,我国土壤Cd的点位超标率达到了7.0% [1]。土壤中Cd的累积可以通过食物链对人类健康产生潜在严重威胁。水稻是世界第二大、我国第一大粮食作物[2]。长期以来,矿山开采及有色金属冶炼等人为活动使得大量Cd释放到环境中,导致了较严重的农地土壤的Cd污染[3],引起农产品中重金属的超标[4]。在我国南方,已有不少地方出现稻米Cd超标的现象[5-8]。湖南省湘江流域,约60%的稻米中Cd含量超标,11%的稻米中Cd含量高于1 mg·kg-1 [3]。可见农产品、特别是稻米Cd污染已经成为影响我国食品安全的突出问题。
重金属污染的农业土壤主要修复方法包括钝化法、植物提取法、化学淋洗法、电动力学法和客土法等[9]。化学钝化是国内外普遍使用的方法之一[10],土壤钝化材料主要有含钙材料、含磷材料、有机质和含硅材料等[11-22]。石灰石粉、消石灰和白云石粉是常用的重金属污染的酸性土壤的钝化剂。Tyler等[13-15]研究发现,消石灰和石灰石粉是通过施用后提高土壤pH和促进土壤中Cd的沉淀,而降低了土壤中有效Cd含量,进而降低玉米、茶叶、豆荚及水稻对Cd的吸收[16-18]。但从土壤溶液化学组成变化的角度来研究钙质钝化剂对土壤Cd的有效性的影响尚少见。有鉴于此,本文采用盆栽试验,研究了三种钙质钝化剂对植稻期间土壤溶液中Cd浓度变化的影响及其机理,以期为钙质钝化剂的应用提供新的理论支持。
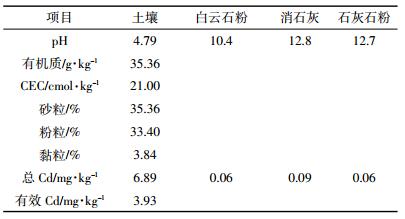
1 材料和方法 1.1 实验材料盆栽土壤采自福建省三明市大田县某矿区周边重金属污染的稻田表层土壤。采集的土壤经过风干、研磨、过1 cm尼龙筛混合均匀后备用。由表 1可知,供试土壤呈酸性,有机质含量较高,保肥能力较强,土壤Cd污染严重。供试的钝化剂是消石灰[Ca(OH)2]、石灰石粉(CaCO3)和白云石粉[Mg、Ca(CO3)2],均购自河北省鑫川矿产品加工厂。供试水稻品种为台粳8号(粳稻)和Ⅱ优3301(籼稻),分别由莆田农科所和福建农嘉种业股份有限公司提供。
盆栽试验于2016年6月23日—10月21日在盆栽房中进行。盆栽试验分为两组,第一组的水稻品种为台粳8号,第二组的水稻品种为Ⅱ优3301。以Ca(OH)2用量为基数,计算CaCO3用量(等Ca量),资料显示白云石粉和石灰石粉钝化效果相似,故白云石粉用量与石灰石粉一致。每组设置4个处理:对照、白云石粉(2.7 g·kg-1)、消石灰(2.0 g·kg-1)和石灰石粉(2.7 g·kg-1),共8个处理,每个处理3个重复。每盆(内径25 cm、高25 cm)加入风干土7.5 kg,在水稻移栽之前分别添加三种钙质钝化剂与肥料(尿素2.1 g、NH4H2PO4 1.2 g、K2SO4 2.1 g),混合均匀,然后淹水放置30 d。挑选颗粒饱满的水稻种子用30% H2O2浸泡30 min,去离子水洗净后继续浸种10 h进行催芽。种子发芽后用无重金属污染土壤培养。23 d后,挑选长势一致的秧苗移栽到盆内,每盆3株。水稻移栽之前,将土壤溶液采集器(RHIZON MOM,10 cm,Wageningen Netherlands)埋入盆栽土壤中。水稻生长过程中持续浇灌去离子水,使土壤始终保持淹水状态(水深2~3 cm)。每15 d采集一次土壤溶液。待水稻成熟后,采集水稻根、茎、叶、籽粒和大约100 g的土壤样品。水稻植株用去离子水洗净,根系提取根表铁膜后与茎、叶一起烘干(70 ℃)至恒重测定干重,然后用不锈钢粉粹机将植物组织粉粹。土壤经风干、磨碎后分别过2 mm和0.149 mm的尼龙筛,供分析使用。
1.3 分析方法土壤Cd全量用四酸(盐酸、硝酸、氢氟酸和高氯酸)消煮,电感耦合等离子体质谱仪(ICP-MS,NexION300X,Perkin Elmer)测定[19]。水稻根表铁膜中重金属含量用DCB(Dithionite-Citrate-Bicarbonate)法浸提[20],ICP-MS,NexION300X,Perkin Elmer测定。根、茎、叶和糙米中重金属的含量采用混酸消煮[21],ICP-MS,NexION300X,Perkin Elmer测定。采集的土壤溶液一部分立即测定其pH,剩余土壤溶液过滤后加入2% HNO3[22-27],用ICP-MS,NexION300X,Perkin Elmer测定其中Cd浓度,用火焰原子分光光度计测定其中的Fe、Mn、Ca、Mg浓度,用总有机碳分析仪(TOC-VCPH,日本岛津)测定其中TOC含量[28]。土壤pH值用pH计(Mettler Seven Compact)测定(水土比2.5:1);土壤机械组成采用激光粒度仪(BT-9300ST)测定[29];土壤有机C采用元素分析仪(Vario Max Cube, Elementar)测定;土壤氧化还原电位(Eh)采用(FJA-6型氧化还原电位去极化法自动测定仪)原位测定[30]。空白和土壤(GBW-07402)、水稻标准物质(GBW-10023,国家标准物质中心)的处理与样品同步进行,回收率在95%~107%之间,以保证结果的准确。
1.4 数据分析采用Microsoft excel 2010、Windows SPSS 19.0和SigmaPlot 12.5软件进行数据的计算、统计与处理。差异显著性分析采用LSD法,差异显著水平为5%。
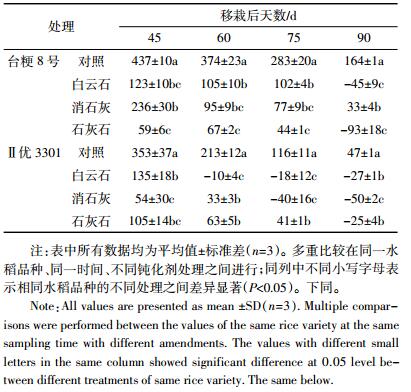
2 结果与分析 2.1 植稻期间土壤氧化还原电位(Eh)变化表 2显示植稻期间土壤氧化还原电位的变化。由表 2可见,在水稻移栽后45~90 d期间,土壤Eh值总体呈下降趋势,移栽后90 d土壤Eh值最低。两种水稻品种之间Eh值下降幅度差异较大,Ⅱ优3301土壤的Eh值较台粳8号土壤Eh值降幅更大。台粳8号土壤的Eh值从437 mV降低到164 mV,降低了62.5%,其中以石灰石粉处理最低,白云石粉处理次之,消石灰处理最高。Ⅱ优3301土壤的Eh值则从353 mV降低到47 mV,降低了86.6%,以消石灰处理最低,白云石处理次之,石灰石粉处理最高且低于对照。
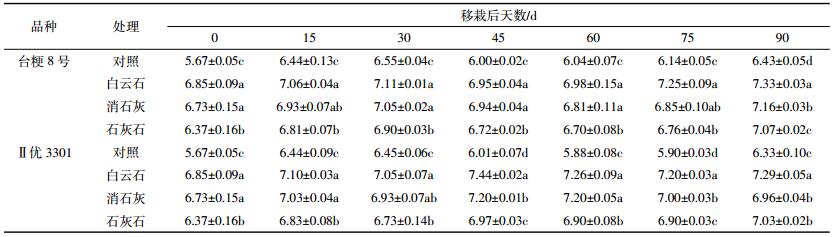
植稻期间土壤溶液中pH的变化如表 3所示。从表 3可见,在植稻期间,土壤溶液pH总体呈升高-降低-再升高的趋势,水稻移栽后45~60 d土壤溶液pH最低。与对照相比,钙质钝化剂显著提高了土壤溶液的pH,且提高幅度以白云石粉最大,消石灰次之,石灰石粉最小。台粳8号土壤溶液pH的波动比Ⅱ优3301更为明显。钝化剂、水稻品种和植稻时间对土壤溶液pH的影响的3因素方差分析结果:F钝化剂=75.98(P < 0.01), F时间=3.61(P=0.02),F品种=0.68(P=0.44),表明钝化剂处理对土壤溶液pH的影响最大,其次是植稻时间。
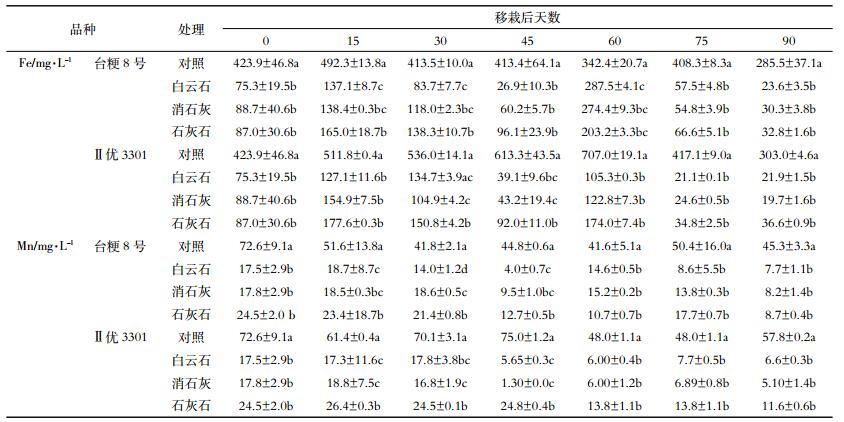
土壤溶液中的Fe和Mn浓度如表 4所示。钙质钝化剂显著降低了土壤溶液中Fe和Mn的浓度,但三种钝化剂的效果差异不显著。随着淹水时间的延长,两个水稻品种对照土壤溶液中的Fe浓度均呈先升后降的趋势。台粳8号对照土壤溶液中Fe浓度的升幅较小且持续时间较短,而Ⅱ优3301对照土壤溶液中Fe浓度的升幅较大且持续时间较长。对钝化剂、水稻品种和种植时间进行3因素方差分析:对土壤溶液中Fe而言,F钝化剂=172.4(P < 0.01),F时间=33.78(P=0.16),F品种=6.42(P=0.04),表明钝化剂处理对土壤溶液中Fe浓度的影响最大,其次是水稻品种;而对土壤溶液Mn而言,F钝化剂=156.8(P < 0.01),F时间=5.97(P=0.05),F品种=1.84(P=0.22),钝化剂处理的影响最大,其次是植稻时间。
|
植稻期间土壤溶液中TOC含量如表 5所示。由表 5可知,在植稻期间,土壤溶液中TOC含量总体呈波动式降低,从移栽到90 d,台粳8号土壤溶液中TOC浓度从247.3 mg·L-1降低到161.5 mg·L-1,降低了34.7%,钙质钝化剂处理与对照之间总体无显著差异。Ⅱ优3301土壤溶液中TOC浓度则从276.3 mg·L-1降低到44.4 mg·L-1,降低了83.9%,在水稻移栽后75~90 d,钙质钝化剂处理与对照差异显著。不同水稻品种的土壤溶液中TOC含量差异显著。Ⅱ优3301土壤溶液中TOC含量的降幅较台粳8号大。在对照土壤溶液中,Ⅱ优3301的TOC浓度高于台粳8号,但在钙质钝化剂处理的土壤溶液中,两个水稻品种的TOC浓度相近。钝化剂、植稻时间和水稻品种对TOC的影响的3因素方差分析结果:F钝化剂=7.72(P < 0.01), F时间=7.74(P=0.02), F品种=0.08(P=0.79),表明水稻种植时间对土壤溶液中TOC含量影响最大,其次是钝化剂。

|
表 6显示植稻期间土壤溶液中Cd浓度的变化。从表 6可见,在植稻期间,土壤溶液中Cd浓度呈波动式下降,到水稻移栽90 d,土壤溶液中Cd浓度趋于稳定。水稻移栽前(第0 d),各钝化剂均显著降低了土壤溶液Cd的浓度,降幅以白云石处理最大、消石灰处理次之、石灰石粉处理最小。从第0 d到第15 d,对照土壤溶液Cd浓度急剧降低,钝化剂处理的土壤溶液Cd浓度也显著降低;此后土壤溶液Cd浓度虽然有所降低,但降幅不大。不同钝化剂处理的土壤溶液Cd浓度无显著差异,两种水稻品种土壤溶液Cd浓度之间的差异亦不显著。钝化剂、植稻时间和水稻品种对土壤溶液Cd浓度的影响的3因素方差分析结果:F钝化剂=1.04(P=0.40), F时间=2.54(P=0.06), F品种=6.43(P=0.04),表明水稻品种对土壤溶液Cd浓度影响较大。

|
不同钙质钝化剂处理下根表铁膜和水稻根系Cd含量的变化如表 7所示。从表 7中可知,与台粳8号相比,三种钙质钝化剂显著降低了Ⅱ优3301根表铁膜-Cd含量,消石灰的降低效果大于其他两种钝化剂。消石灰显著降低了稻根中Cd含量;石灰石粉显著降低了Ⅱ优3301稻根Cd含量,但对台粳8号稻根Cd含量的降低不显著;白云石粉对Ⅱ优3301水稻品种根Cd含量的降低不显著。

|
氧化还原电位对土壤中重金属的溶解性和有效性有较大的影响[31]。在强烈还原条件下,土壤会形成较多的H2S、S2-与Cd2+形成硫化物沉淀,从而降低其有效性[32]。不同钙质钝化剂处理降低了土壤Eh值(表 2)。水稻移栽后60、75 d和90 d,各处理土壤Eh值(重复平均值)与同期土壤溶液中Cd含量之间均呈显著正相关,相关系数(r)分别为0.911**、0.815**和0.759**(n=8),这证明土壤Eh值的降低显著降低了水溶态Cd的浓度,与王成文等[30, 33-34]的研究结果相同。钝化剂的施用降低了土壤的Eh值,因此,钙质钝化剂促进土壤Eh的降低是降低土壤Cd的水溶性的机理之一。
从结果分析可知,钙质钝化剂的施用提高了土壤溶液的pH值。统计结果表明,在水稻移栽后15、45 d和60 d,各处理土壤溶液pH值与Cd含量(重复平均值)之间均无显著相关;但在第30、75和90 d,各处理的土壤溶液pH值与土壤溶液中Cd含量(重复平均值)之间均呈极显著负相关,相关系数(r)分别为-0.763**、-0.925**和-0.916**(n=8),表明在淹水植稻前期土壤溶液pH值与水溶态Cd浓度之间的相关性较差,而后期则相关性极显著。土壤pH值的提高使土壤中Cd2+转化为Cd(OH)2以及CdCO3等沉淀,从而降低了Cd的溶解性[35];同时因为增加土壤可变负电荷而增加了土壤对Cd2+的吸附,降低了土壤中可溶性Cd含量[36]。土壤溶液pH值与土壤溶液Cd浓度在淹水后期的相关性较显著,可能说明由于土壤pH升高而导致的Cd溶解性的降低需要一定时间。
淹水条件会导致土壤形成较多的有机还原物质,有机还原物质的水溶态部分(TOC)会与重金属离子络合而提高重金属的水溶性[37]。水稻移栽后第75 d和90 d,土壤溶液中TOC浓度与Cd浓度(重复平均值)之间呈现极显著正相关,相关系数分别为0.949**和0.919**(n=8),这说明土壤溶液中TOC浓度也是影响水溶态Cd含量的一个因素。土壤溶液中TOC升高,水溶态Cd浓度也升高,这是由于TOC中的有机配位体可与Cd2+形成可溶性络合物,从而提高了Cd的溶解性[38-39]。从前文的分析可知,添加钙质钝化剂总体上降低了土壤溶液中的TOC浓度,不利于Cd的络合溶解,这是钙质钝化剂降低土壤溶液中Cd浓度的另一个机理。
在强烈还原条件下,土壤中的铁锰氧化物会被还原溶解而释放出水溶态Fe2+和Mn2+ [40],同时也释放出原来被Fe/Mn氧化物吸附固定的Cd2+,从而提高水溶态Cd的浓度。在施用钙质钝化剂条件下,土壤pH的提高会促进水溶态Fe2+和Mn2+的沉淀。根据前文的分析,对照土壤溶液中Fe/Mn氧化物并未产生大量的还原溶解,但施用钝化剂均显著降低了土壤溶液中Fe、Mn的浓度,这表明钙质钝化剂可以抑制Fe/Mn氧化物的还原溶解,促进水溶态Fe、Mn的沉淀。水稻移栽后第30、75 d和90 d,土壤溶液中Cd浓度与Fe浓度(重复平均值)之间呈显著正相关,相关系数(r)分别为0.810*、0.987**和0.993**(n=8);水稻移栽后第75 d和90 d,土壤溶液中Cd浓度与Mn浓度(重复平均值)之间呈显著正相关,相关系数(r)分别为0.985**和0.982**(n=8)。可见,钙质钝化剂抑制了Fe/Mn氧化物的还原溶解,从而降低了土壤溶液中Cd的浓度,有利于减少水稻根系对Cd的吸收。这也是钙质钝化剂降低土壤Cd的有效性的机理之一。
采用逐步回归的方法,分析了成熟期(移栽后90 d)5个变量(pH、Eh、Fe、Mn、TOC)对土壤溶液Cd浓度的影响,得到如下回归模型:
[Cd]=0.45+0.000 5×[Fe],R2=0.983
以上模型表明,在淹水植稻末期,土壤溶液中Fe浓度是引起土壤溶液Cd浓度变化的主要因素,土壤溶液Cd浓度随着Fe浓度的升高而升高,即Fe/Mn氧化物的还原溶解速率成为影响土壤溶液Cd浓度的主要因素。
3.2 钙质钝化剂对根表铁膜和水稻根系吸收Cd的影响从表 7可见,三种钙质钝化剂显著降低了Ⅱ优3301根表铁膜数量,同时也显著降低了根表铁膜中Cd的含量,但对台粳8号并没有显著影响。从图 1可知,较高的根表铁膜含量有利于水稻根系对Cd的吸收;当根表铁膜中Cd浓度较低时(≤2 mg·kg-1),根系Cd浓度随根表铁膜中Cd含量的增加而迅速增加;当根表铁膜中Cd浓度继续增加,根系Cd浓度则仅略有增加。这表明当根表铁膜中Cd浓度较低时,铁膜中的Cd促进了根系Cd的吸收,而不是阻挡根系Cd的吸收;只有当铁膜中Cd含量高到一定程度时,铁膜的屏障作用才比较明显,其中机理有待于进一步探讨。移栽后第90 d,土壤溶液中Cd浓度与根表铁膜-Cd和稻根Cd含量(重复平均值)之间均呈极显著正相关关系,相关系数分别为0.702**和0.890**(n= 8)。钙质钝化剂降低了根表铁膜的数量,从而抑制了水稻根系对Cd的吸收,这是钙质钝化剂降低土壤Cd生物有效性的另一个机理。

|
| 图 1 根表铁膜Cd含量与根系Cd含量之间的关系 Figure 1 Correlation between contents of Cd in iron plaque on root and in rice root |
(1)施用三种钙质钝化剂,显著降低了土壤溶液中Cd的浓度。
(2)施用三种钙质钝化剂,均提高了土壤溶液pH值、降低了土壤Eh值和土壤溶液中的TOC、Fe、Mn的浓度。钙质钝化剂通过提高土壤pH值、促进植稻土壤的还原、抑制Fe/Mn氧化物的还原溶解、降低水溶态有机物的形成而降低了土壤Cd的生物有效性。
(3)施用钙质钝化剂降低了水稻根表铁膜的数量和铁膜中Cd的含量。水稻根系Cd含量随根表铁膜Cd含量的升高而升高。钙质钝化剂降低根表铁膜的数量和铁膜中Cd的含量,也是其降低土壤Cd生物有效性的机制之一。
(4)三种钙质钝化剂对土壤Eh值的降低效果因水稻品种而变;对土壤溶液pH值的提高效果,白云石粉总体强于消石灰和石灰石粉;对土壤溶液中Fe、Mn、TOC和Cd的浓度以及根表铁膜数量的影响无显著差异;对根系Cd含量的降低效果因水稻品种而变。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[R]. 北京: 环境保护部, 国土资源部, 2014. Ministry of Environmental Protection, Ministry of Land and Resources.The investigation communique of soil pollution condition of China[R]. Beijing:Ministry of Environmental Protection, Ministry of Land and Resources, 2014. |
| [2] |
王军, 朱金燕, 周勇, 等. 基于染色体单片段代换系的水稻粒QTL定位[J]. 作物学报, 2013, 39(4): 617-625. WANG Jun, ZHU Jin-yan, ZHOU Yong, et al. Mapping of QTLs for grain shape using chromosome single segment substitution lines in rice (Oryza sativa L.)[J]. Acta Agronomica Sinica, 2013, 39(4): 617-625. |
| [3] |
Zhao F J, Ma Y, Zhu Y G, et al. Soil contamination in China:Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759. |
| [4] |
Boisson J, Ruttens A, Mench M, et al. Evaluation of hydroxyapatite as a metal immobilizing soil additive for the remediation of polluted soils. Part 1. Influence of hydroxyapatite on metal exchange ability in soil, plant growth and plant metal accumulation[J]. Environmental Pollution, 1999, 1047(2): 225-233. |
| [5] |
谢晓丽, 陈仁忠, 冯晔. 广州市不同区域水稻质量状况及其污染源探讨[J]. 生态环境学报, 2002, 11(3): 264-267. XIE Xiao-li, CHEN Ren-zhong, FENG Ye. A discussion of the quality and pollution sources of paddy in different areas in Guangzhou City[J]. Soil and Environment, 2002, 11(3): 264-267. |
| [6] |
Yang Q W, Lan C Y, Wang H B, et al. Cadmium in soil-rice system and health risk associated with the use of untreated mining wastewater for irrigation in Lechang, China[J]. Agricultural Water Management, 2006, 84(1/2): 147-152. |
| [7] |
王昌全, 代天飞, 李冰, 等. 稻麦轮作下水稻土重金属形态特征及其生物有效性[J]. 生态学报, 2007, 27(3): 890-897. WANG Chang-quan, DAI Tian-fei, LI bing, et al. The speciation and bioavailability of heavy metals in paddy soils under the rice-wheat cultivation rotation[J]. Acta Ecologica Sinica, 2007, 27(3): 890-897. |
| [8] |
Zhai L M, Liao X Y, Chen T B, et al. Regional assessment of cadmium pollution in agricultural lands and the potential health risk related to intensive mining activities:A case study in Chenzhou City, China[J]. Journal of Environmental Sciences, 2008, 20(6): 696-703. DOI:10.1016/S1001-0742(08)62115-4 |
| [9] |
Li J R, Xu Y M. Immobilization of Cd in paddy soil using moisture management and amendment[J]. Environmental Science and Pollution Research, 2015, 122(7): 131-136. |
| [10] |
Guo G L, Zhou Q X, Ma L Q. Availability and assessment of fixing additives for the in situ remediation of heavy metal contaminated soils:A review[J]. Environmental Monitoring & Assessment, 2006, 116(1/2/3): 513-528. |
| [11] |
黎大荣, 吴丽香, 宁晓君, 等. 不同钝化剂对土壤有效态铅和镉含量的影响[J]. 环境保护科学, 2013, 39(3): 46-49. LI Da-rong, WU Li-xiang, NING Xiao-jun, et al. Effects of different amendments on contents of available Pb and Cd in soil[J]. Environmental Protection Science, 2013, 39(3): 46-49. |
| [12] |
曹心德, 魏晓欣, 代革联, 等. 土壤重金属复合污染及其化学钝化修复技术研究进展[J]. 环境工程学报, 2011, 5(7): 1441-1453. CAO Xin-de, WEI Xiao-xin, DAI Ge-lian, et al. Combined pollution of heavy metals and their chemical immobilization in contaminated soil[J]. Chinese Journal of Environmental Engineering, 2011, 5(7): 1441-1453. |
| [13] |
Tyler L D, Mcbride M B. Influence of Ca, pH and humic acid on Cd uptake[J]. Plant & Soil, 1982, 64(2): 259-262. |
| [14] |
Lee T M, Lai H Y, Chen Z S. Effect of chemical amendments on the concentration of cadmium and lead in long-term contaminated soils[J]. Chemosphere, 2004, 57(10): 1459-1471. DOI:10.1016/j.chemosphere.2004.08.094 |
| [15] |
Mahar A, Wang P, Li R H, et al. Immobilization of lead and cadmium in contaminated soil using amendments:A review[J]. PEDOSPHERE, 2015, 25(4): 555-568. DOI:10.1016/S1002-0160(15)30036-9 |
| [16] |
Hong C O, Lee D K, Chung D Y, et al. Liming effects on cadmium stabilization in upland soil affected by gold mining activity[J]. Archives of Environmental Contamination & Toxicology, 2007, 52(4): 496-502. |
| [17] |
Han W Y, Shi Y Z, Ma L F, et al. Effect of liming and seasonal variation on lead concentration of tea plant(Camellia sinensis, (L.) O. Kuntze)[J]. Chemosphere, 2007, 66(1): 84-90. DOI:10.1016/j.chemosphere.2006.05.017 |
| [18] |
Khan M J, Jones D L. Effect of composts, lime and diammonium phosphate on the phytoavailability of heavy metals in a copper mine tailing soil[J]. Pedosphere, 2009, 19(5): 631-641. DOI:10.1016/S1002-0160(09)60158-2 |
| [19] |
中华人民共和国农业部. GB/T 23739-2009土壤质量有效态铅和镉的测定原子吸收法[S]. 北京: 中国标准出版社, 2009. The Ministry of Agriculture of the People's Republic of China. GB/T 23739-2009 Soil quality. The analytical method of available lead and cadmium. Atomic absorption method[S]. Beijing:Standards Press of China, 2009. |
| [20] |
刘侯俊, 胡向白, 张俊伶, 等. 水稻根表铁膜吸附镉及植株吸收镉的动态[J]. 应用生态学报, 2007, 18(2): 425-430. LIU Hou-jun, HU Xiang-bai, ZHANG Jun-ling, et al. Dynamics of Cd adsorption on rice seedlings root surface with iron coating and Cd uptake by plant[J]. Chinese Journal of Applied Ecology, 2007, 18(2): 425-430. |
| [21] |
张亚玉, 孙海, 高明, 等. 吉林省人参土壤中重金属污染水平及生物有效性研究[J]. 土壤学报, 2011, 48(6): 1306-1313. ZHANG Ya-yu, SUN Hai, GAO Ming, et al. Pollution level and bioavailability of heavy metals in ginseng soil Jilin Province[J]. Acta Pedologica Sinica, 2011, 48(6): 1306-1313. DOI:10.11766/trxb201004100129 |
| [22] |
Chaudri A M, Knight B P, Barbosa-Jefferson V L, et al. Determination of acute Zn toxicity in pore water from soils previously treated with sewage sludge using bioluminescence assays[J]. Environmental Science & Technology, 1999, 33(11): 1880-1885. |
| [23] |
Shaheen S M, Rinklebe J, Rupp H, et al. Temporal dynamics of pore water concentrations of Cd, Co, Cu, Ni, and Zn and their controlling factors in a contaminated floodplain soil assessed by undisturbed groundwater lysimeters[J]. Environmental Pollution, 2014, 191: 223-231. DOI:10.1016/j.envpol.2014.04.035 |
| [24] |
Costello D M, Hammerschmidt C R, Burton G A. Copper sediment toxicity and partitioning during oxidation in a flow-through flume[J]. Environmental Science & Technology, 2015, 49(11): 6926-6933. |
| [25] |
Briant N, Elbaz-Poulichet F, Freydier R, et al. Deciphering As and Cu cycling in sediment pore waters in a large marina(Port Camargue, Southern France) using a multi-tracer(Fe, Mn, U, Mo) approach[J]. Applied Geochemistry, 2016, 66: 242-249. DOI:10.1016/j.apgeochem.2016.01.001 |
| [26] |
Concas S, Ardau C, Bonito M D, et al. Field sampling of soil pore water to evaluate the mobile fraction of trace elements in the Iglesiente area (SW Sardinia, Italy)[J]. Journal of Geochemical Exploration, 2015, 158: 82-94. DOI:10.1016/j.gexplo.2015.07.006 |
| [27] |
Ye H, Yang T, Zhu G R, et al. Pore water geochemistry in shallow sediments from the northeastern continental slope of the South China sea[J]. Marine & Petroleum Geology, 2016, 75: 68-82. |
| [28] |
Beesley L, Dickinson N. Carbon and trace element mobility in an urban soil amended with green waste compost[J]. Journal of Soils and Sediments, 2010, 10(2): 215-222. DOI:10.1007/s11368-009-0112-y |
| [29] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil agricultural chemistry analysis[M]. The third version. Beijing: China Agriculture Press, 2000. |
| [30] |
Kashem M A, Singh B R. Metal availability in contaminated soils:Ⅰ. Effects of floodingand organic matter on changes in Eh, pH and solubility of Cd, Ni and Zn[J]. Nutrient Cycling in Agroecosystems, 2001, 61(3): 247-255. DOI:10.1023/A:1013762204510 |
| [31] |
Davranche M, Bollinger J C. Heavy metals desorption from synthesized and natural iron and manganese oxyhydroxides:Effect of reductive conditions[J]. J Colloid Interface Sci, 2000, 227(2): 531-539. DOI:10.1006/jcis.2000.6904 |
| [32] |
Lindsay W L. Chemical equilibria in soils[J]. Clays & Clay Minerals, 1979, 28(4): 319-319. |
| [33] |
Mcbride M B. Environmental chemistry of soils[M]//Environmental chemistry of soils. New York:Oxford University Press, 1994:70-71.
|
| [34] |
王成文, 许模, 张俊杰, 等. 土壤pH和Eh对重金属铬(Ⅵ)纵向迁移及转化的影响[J]. 环境工程学报, 2016, 10(10): 6035-6041. WANG Cheng-wen, XU Mo, ZHANG Jun-jie, et al. Influence of soil pH and Eh on vertical migration and transformation of Cr(Ⅵ)[J]. Chinese Journal of Environmental Engineering, 2016, 10(10): 6035-6041. DOI:10.12030/j.cjee.201505010 |
| [35] |
Lu H P, Li Z A, Fu S L, et al. Can biochar and phytoextractors be jointly used for cadmium remediation?[J]. Plos One, 2014, 9(4): e95218. DOI:10.1371/journal.pone.0095218 |
| [36] |
Tan W N, Li Z N, Qiu J, et al. Lime and phosphate could reduce cadmium uptake by five vegetables commonly grown in South China[J]. Pedosphere, 2011, 21(2): 223-229. DOI:10.1016/S1002-0160(11)60121-5 |
| [37] |
Kalbitz K, Wennrich R. Mobilization of heavy metals and arsenic in polluted wetland soils and its dependence on dissolved organic matter[J]. Science of the Total Environment, 1998, 209(1): 27-39. DOI:10.1016/S0048-9697(97)00302-1 |
| [38] |
王艮梅, 周立祥. 陆地生态系统中水溶性有机物动态及其环境学意义[J]. 应用生态学报, 2013, 14(11): 2019-2025. WANG Gen-mei, ZHOU Li-xiang. Dynamics of dissolved organic matter in terrestrial ecosystems and its environmental impact[J]. Chinese Journal of Applied Ecology, 2013, 14(11): 2019-2025. |
| [39] |
胡海清, 陆昕, 孙龙. 土壤活性有机碳分组及测定方法[J]. 森林工程, 2012, 28(05): 18-22. HU Hai-qing, LU Xin, SUN Long. Research review on soil active organic carbon Fractionation and analytical methods[J]. Forest Engineering, 2012, 28(5): 18-22. |
| [40] |
Jr W H P, Mahapatra I C. Transformation and availability to rice of nitrogen and phosphorus in waterlogged soils[J]. Advances in Agronomy, 1968, 20: 323-359. DOI:10.1016/S0065-2113(08)60860-3 |
 2017, Vol. 36
2017, Vol. 36