文章信息
- 赵玉婷, 王耀晶, 应博, 杨丹, 何娜, 刘鸣达
- ZHAO Yu-ting, WANG Yao-jing, YING Bo, YANG Dan, HE Na, LIU Ming-da
- 硅对不同pH水田土壤镉吸附热力学特征的影响
- Effect of silicon additives on the adsorption thermodynamics of cadmium in paddy soil with different pH levels
- 农业环境科学学报, 2017, 36(10): 2000-2006
- Journal of Agro-Environment Science, 2017, 36(10): 2000-2006
- http://dx.doi.org/10.11654/jaes.2017-0245
文章历史
- 收稿日期: 2017-02-28
- 接受日期: 2017-06-15
2. 沈阳农业大学理学院, 沈阳 110866;
3. 辽宁省环境监测实验中心, 沈阳 110161
2. College of Science, Shenyang Agricultural University, Shenyang 110866, China;
3. Liaoning Environmental Monitoring and Experiment Center, Shenyang 110161, China
镉是毒性最大的重金属之一,早在1993年,国际癌症研究机构已将镉列为人类致癌物,联合国环境规划署已将镉列入重点研究的环境污染物,WHO已将镉列为优先研究的食品污染物。随着镉在工业中的广泛应用,大量的镉通过大气沉降、污水灌溉和含镉化肥施用的途径进入农田土壤中,使农田土壤的镉污染日益严重。镉不仅影响作物的产量品质,且易通过食物链积累到人类体内[1-2],危害人类健康。2014年4月环境保护部和国土资源部所公布的全国土壤污染状况调查公报显示,镉的点位超标率最高,成为我国土壤的首要污染物[3]。
国内外关于硅缓解植物镉毒害作用已有较多报道,其机制包含两个方面,一是生物生理学机制也称为耐逆作用,二是土壤化学机制也称为避逆作用。耐逆作用表现:施硅会影响镉在植物内的转移和积累,使植物各部位镉含量均有所降低[4-6];施硅会激活植物的抗氧化系统缓解镉毒害作用[7-11];硅与镉在植物体内生成沉淀,抑制镉的转运降低镉的生物活性[12-13];硅还会促进镉离子在植物体内区隔化分布,使镉结合到细胞壁或进入液泡中[14];有研究表明,施硅还会调控镉在植物体内转运基因表达[15-16];硅会通过改变植物的结构形态来降低镉的生物活性[17-18]。避逆作用表现为硅可以通过降低植物生长介质中镉的生物有效性来缓解植物镉毒害作用[19-21]。如施硅后土壤(介质)pH值的升高会改变镉的形态,使其沉淀于土壤中或根系周围,从而减少植物镉的吸收[22-23];再如施硅会促进土壤对镉的吸附从而降低镉的生物有效性[24];还有研究表明施加外源硅可以使土壤中的镉从有效态向无效态转化,转化成铁锰氧化态镉或有机态镉[25]。Shim等[26]研究表明,硅与铅会生成硅酸铅沉淀,那么镉可能也会与硅发生类似反应生成硅酸镉沉淀从而降低镉的生物有效性。此外,陈怀满[27]认为活性硅本身可能是抑制镉吸收的重要因素之一。因此,含硅物料抑制水稻吸收镉包括提高土壤pH和硅本身的双重作用[28-30]。前人在试验中加入的硅酸钠、钢渣、硅肥等含硅物料均为碱性物质,同时还引入了相应的伴随离子,而已有研究表明钙、镁、钾、钠等元素会对植物吸收或转运镉产生一定的影响[31]。显然,上述研究并不能完全解释施硅对土壤镉活性影响的化学机制。
吸附解吸是土壤胶体界面反应的重要物理化学过程,也是决定养分或毒物离子生物效应化学行为的影响机制,开展硅对土壤镉吸附解吸特征的影响,对研究镉在土壤-植物系统内的迁移、转化、富集规律十分必要。本文在消除pH及伴随离子影响的基础上,研究加硅对土壤吸附镉的热力学特征的影响,以期为揭示硅对土壤镉化学行为的影响机制提供理论依据。
1 材料与方法 1.1 供试土壤供试土壤样品A(碱性)采自辽宁省沈阳市康平县(123°24′48.8″E,42°56′0.1″N),土样B(酸性)采自辽宁省抚顺市新宾县(125°20′44.4″E,41°34′9.1″N),均为种稻多年的水田土壤。采样深度为0~20 cm,样品经自然风干后去除植物残体、砾石,过筛后备用。土壤的基本理化性质如表 1所示。
称取供试土壤1.25 g(烘干重)若干份置于50 mL塑料离心管中,分别加入0、10、20、40、60、80、100 mg·L-1(以Cd2+计)的CdCl2溶液和0、120 mg·L-1(以SiO2计)的Na2SiO3溶液共25 mL,用HNO3中和Na2SiO3的碱性,以0.01 mol·L-1 NaNO3为支持电解质并补齐各处理间的离子差异。以上共14个不同硅镉组合,每个处理做3次重复。各处理先在25 ℃(298K)条件下振荡2 h(200 r·min-1),培养24 h后离心(4000 r·min-1)5 min,倒出上清液测定其中镉浓度,残液和土样用于解吸试验。镉的吸附量计算公式如下:
Xa =(C0-C1)×V1 /m
式中:Xa为土壤对镉的吸附量,mg·kg-1;C0为镉的初始浓度,mg·L-1;C1为镉的吸附平衡浓度,mg·L-1;V1为吸附反应溶液的体积,mL;m为土样质量,g。
再分别于35 ℃和45 ℃(308 K和318 K)下进行试验,步骤同上。
1.3 测定方法土壤pH值采用酸度计法测定[32];土壤有机质采用重铬酸钾-外加热法测定[32];碱性土壤阳离子交换量采用乙酸钠-火焰光度法测定,酸性土壤阳离子交换量采用乙酸铵交换法测定[33];土壤有效硅采用1 mol·L-1醋酸-醋酸钠(pH 4)缓冲液提取,硅钼蓝比色法测定[32];土壤全镉采用氢氟酸-硝酸消化,电感耦合等离子体发射光谱仪测定[32];吸附解吸平衡液中的镉用原子吸收分光光度计测定;土壤机械组成采用比重计法测定[32]。
1.4 数据分析试验数据采用Excel 2007统计软件进行分析。
2 结果与讨论 2.1 不同温度下硅对土壤镉吸附的影响不同温度条件下两种土壤对镉的吸附等温线如图 1所示。可以看出,两种土壤对镉的吸附量均随平衡浓度的增大而增加,相同平衡浓度下,碱性土壤镉的吸附量高于酸性土壤。碱性土壤中,298 K条件下土壤对镉的吸附量先是随着平衡浓度的增加而增加,随后增加量趋于平缓,在308 K和318 K的条件下,随着平衡浓度的增加,土壤对镉的吸附量急剧增加;酸性土壤在298 K和308 K的条件下,随着平衡浓度的增加,镉的吸附量增加较为平缓,但在318 K条件下,土壤对镉的吸附量随着平衡浓度的增加而急剧增加。
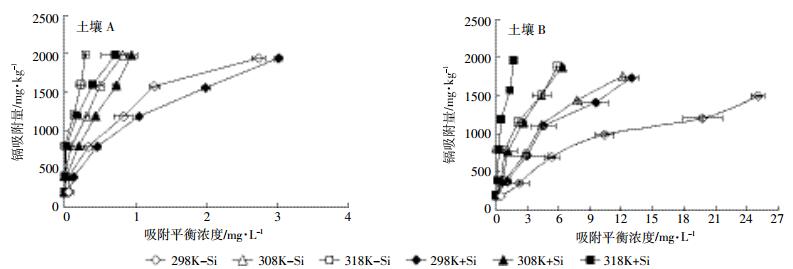
|
| 图 1 不同温度下两种土壤对镉的吸附等温线 Figure 1 Isotherms of Cd adsorption at different temperature of the two soils |
采用不同直线型吸附等温模型对试验数据进行拟合,得到的方程列于表 2。可以看出,在不同温度下,三种方程的相关系数均达到统计学上的显著水平,说明Langmuir、Freundlich和Temkin直线模型均可以较好地描述不同温度下土壤吸附镉的特征。综合来看,其中以Freundlich直线模型效果最佳。
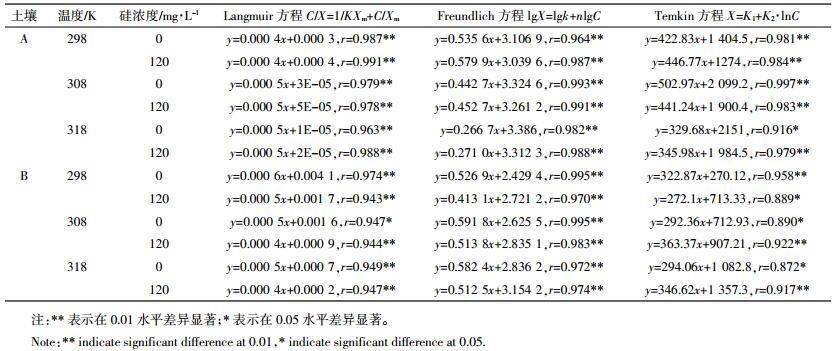
|
根据Freundlich直线型方程计算的参数n和k列于表 3。k值反映土壤表面的吸附点位数,是与吸附容量有关的常数,其数值越大,则吸附容量越大;n值代表吸附强度,n值越大,吸附剂对吸附质的吸附作用越强[34]。
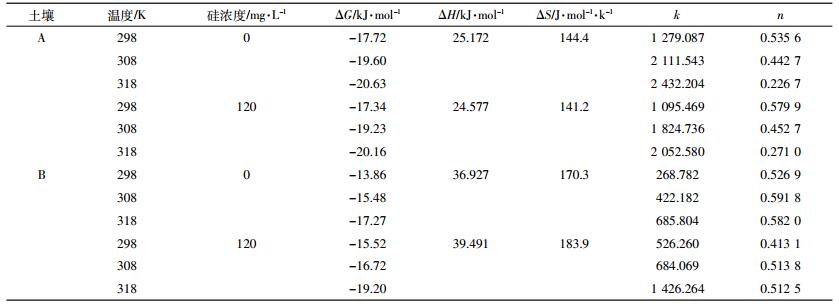
|
两种土壤不同处理的k值均随温度的升高而增大,n值则表现为碱性土壤降低、酸性土壤升高的趋势。同一温度下,加硅后碱性土壤的k值降低、n值升高,酸性土壤k值升高、n值降低。研究表明,在中性或碱性条件下,硅酸可与铜离子发生反应,生成可溶性配合物[35];镉与铜均属于ds区元素,故当碱性土壤中加入硅时可能也会发生类似反应。这导致土壤表面物理吸附的镉比例降低,化学吸附的镉比例相对提高,故吸附容量相应降低,而吸附强度提高。在酸性条件下,硅酸会聚合生成硅凝胶,且硅凝胶在一定pH范围内产生负电荷[36],相当于增加了土壤的负电荷表面,因此增加了酸性土壤的吸附容量。此外还有研究表明,加入的硅酸可与培养液中的铝离子形成高分子硅酸铝复合物并产生沉淀。若硅酸与镉存在着类似反应,则也会导致可溶态镉浓度的降低,而镉在硅凝胶表面的吸附可能多为表面物理吸附,致使相应的化学吸附态镉的比例相对降低,所以镉的吸附容量增大,而吸附强度降低。
2.2 外源硅对土壤镉吸附热力学特征的影响通常,吸附反应的吸附自由能变(ΔG,kJ·mol-1)、焓变(ΔH,kJ·mol-1)和熵变(ΔS,J·mol-1·K-1),可通过以下公式计算:
ΔG=-RTlnK
ΔG=ΔH-TΔS
式中:R为摩尔气体常数,其值为8.314 5 J·mol-1K-1;T为开氏温度,K;K为吸附平衡常数[37]。
在实际计算中,常用Freundlich方程中的吸附常数k代替K;ΔH和ΔS可通过Gibbs-Helmholtz等温式[38]的ΔG对T作图拟合的直线方程求得。其结果列于表 3。
ΔG、ΔH、ΔS可直接反应吸附剂与吸附质分子之间的作用。根据ΔG值的正负可判断吸附反应为非自发反应或自发反应[39]。在通常情况下,物理吸附的自由能变小于化学吸附,物理吸附的自由能变范围在-20~0 kJ·mol-1之间,化学吸附自由能变在-400~80 kJ·mol-1之间[40]。ΔS为吸附过程中的总熵变,其值为溶质的吸附(伴随熵减小)与溶剂的脱附两者(伴随熵增加)的总和,取决于溶质和溶剂固体表面作用的强弱及它们体积的大小[41]。ΔH为标准吸附热,通过其值可推断吸附机理。
在不加硅的条件下,两种土壤各处理的ΔG均为负值,表明吸附反应为自发反应,镉倾向于被土壤表面吸附。两种土壤不同处理的ΔG值的范围在-20.63~ -13.86 kJ·mol-1,说明土壤对镉的吸附既包括物理吸附也包括化学吸附。三种温度条件下,ΔG均呈现出碱性土壤小于酸性土壤。两种土壤自由能变的这种差异与土壤的理化性质有关。碱性土壤的pH和有机质含量均高于酸性土壤,因此土壤中可变负电荷数量多、土壤比表面积大,导致碱性土壤镉吸附的自发程度高于酸性土壤。随着温度的升高,两种土壤不同处理的ΔG均有所降低,说明土壤对镉的吸附量随温度的升高而增大,升温有利于吸附反应的自发进行。两种土壤中不同处理的ΔS均大于零,说明镉吸附反应的混乱度增加,其原因一是镉在离子交换位点置换出更活泼的离子[42],二是在固液吸附的过程中,土壤表面存在亲水基团,水会首先覆盖在土壤表面,镉离子为阳离子,要吸附到土壤表面必须先将水分子解吸下来,这种作用为“置换作用”。因水分子的摩尔体积比镉的摩尔体积小很多,故在置换的过程中,土壤上脱附的水分子少,而吸附的镉离子多,因此熵值为正值[43]。pH较低时,土壤表面的吸附点位被H+占据较多,镉离子可以当量取代两个氢原子,氢离子脱附引起的熵值增加大于镉离子吸附引起的熵值减小,因此熵值较大[44];而在pH升高时,镉离子可能会形成羟基配合物或沉淀,置换下来的氢离子数量减少,故因置换作用产生的熵值增加小于酸性土壤。两种土壤的ΔH均为正值,说明两种土壤对镉的吸附均为吸热反应。碱性土壤ΔH小于酸性土壤,显然是由于相应的ΔG与ΔS变化的综合作用所致。
在相同温度条件下,加硅后碱性土壤ΔG变大,说明土壤吸附镉的自发性降低。这可能是硅酸与镉离子生成了可溶性配合物,使镉的吸附受到抑制,吸附反应的自发性降低。对于酸性土壤来说,加硅后ΔG变小,说明土壤吸附镉的自发性升高。在酸性条件下,硅酸会聚合成带有负电荷的凝胶,相当于增加了土壤的负电荷表面,使镉的吸附自发性提高。加硅后碱性土壤ΔS降低的原因可能是由于硅镉配合物的形成导致体系内镉离子数量减少,混乱程度有所降低;而加硅后酸性土壤ΔS增大则是由于硅酸聚合成凝胶,体系负电荷表面增加,吸附的位点增多,吸附的形式更为丰富,导致镉离子的微观状态数增大的缘故。加硅后碱性土壤ΔH有所减小,可能是由于镉与硅形成水溶性复合物,而参与吸附反应的镉离子数量减少,致使反应ΔH降低;酸性土壤的ΔH有所增大,可能是镉在土壤和硅胶两种介质上发生吸附反应的ΔH叠加的结果。
3 结论(1)3种温度下,Langmuir、Freundlich、Temkin方程均可描述碱性土壤和酸性土壤的等温吸附特征,但以Freundlich方程最佳;加硅降低碱性土壤吸附镉的容量、增加了其强度,增加了酸性土壤吸附镉的容量、降低了其强度。
(2)随着温度的升高,两种土壤吸附镉反应的ΔG降低;加硅后,碱性土壤吸附镉反应的ΔG变大、ΔH变小、ΔS变小,而酸性土壤吸附镉反应的ΔG变小、ΔH变大、ΔS变大;两种土壤对镉的吸附均为吸热、熵增的自发反应。
| [1] |
Tudoreanu L, Phillips C J C. Modeling cadmium uptake and accumulation in plants[J]. Advances in Agronomy, 2004, 84(4): 121-157. |
| [2] |
Cheng W W L, Gobas F A P C. Assessment of human health risks of consumption of cadmium contaminated cultured oysters[J]. Human and Ecological Risk Assessment, 2007, 13(2): 370-382. DOI:10.1080/10807030701226301 |
| [3] |
中华人民共和国环境保护部, 中华人民共和国国土资源部. 全国土壤污染状况调查公报[R]. 北京: 中华人民共和国环境保护部, 中华人民共和国国土资源部, 2014: 1-2. Environmental Protection Department of the People's Republic of China, The Ministry of Land and Resources of People's Republic of China. The soil pollution condition investigation communique[R]. Beijing:Environmental Protection Department of the People's Republic of China, The Ministry of Land and Resources of People's Republic of China, 2014:1-2. |
| [4] |
秦淑琴, 黄庆辉. 硅对水稻吸收镉的影响[J]. 新疆环境保护, 1997, 19(3): 51-52. QIN Shu-qin, HUANG Qing-hui. Effect of silicon on cadmium uptakes by rice[J]. Environmental Protection of Xinjiang, 1997, 19(3): 51-52. |
| [5] |
陈秀芳, 赵秀兰, 夏章菊, 等. 硅缓解小麦镉毒害的效应研究[J]. 西南农业大学学报(自然科学版), 2005, 27(4): 447-450. CHEN Xiu-fang, ZHAO Xiu-lan, XIA Zhang-ju, et al. Alleviation of cadmium toxicity of wheat plants by silicon[J]. Journal of Southwest Agricultural University(Natural Science), 2005, 27(4): 447-450. |
| [6] |
杨超光, 豆虎, 梁永超, 等. 硅对土壤外源镉活性和玉米吸收镉的影响[J]. 中国农业科学, 2005, 38(1): 116-121. YANG Chao-guang, DOU Hu, LIANG Yong-chao, et al. Influence of silicon on cadmium availability and cadmium uptake by maize in cadmium-contaminated soil[J]. Scientia Agricultura Sinica, 2005, 38(1): 116-121. |
| [7] |
Nwugo C C, Huerta A J. Effects of silicon nutrition on cadmium uptake, growth and photosynthesis of rice plants exposed to low-level cadmium[J]. Plant and Soil, 2008, 311(1): 73-86. |
| [8] |
Nwugo C C, Huerta A J. Silicon-induced cadmium resistance in rice(Oryza sativa L.)[J]. Journal of Plant Nutrition and Soil Science, 2010, 171(6): 841-848. |
| [9] |
Feng J P, Shi Q H, Wang X F, et al. Silicon supplementation ameliorated the inhibition of photosynthesis and nitrate metabolism by cadmium(Cd) toxicity in Cucumis sativus[J]. Scientia Horticulturae, 2010, 123(4): 521-530. DOI:10.1016/j.scienta.2009.10.013 |
| [10] |
刘鸣达, 王丽丽, 李艳利. 镉胁迫下硅对水稻生物量及生理特性的影响[J]. 中国农学通报, 2010, 26(13): 187-190. LIU Ming-da, WANG Li-li, LI Yan-li. Effect of Si on biomass and physiological characteristics of rice under Cd stress[J]. Chinese Agricultural Science Bulletin, 2010, 26(13): 187-190. |
| [11] |
王耀晶, 付田霞, 苏瑛, 等. 镉胁迫下硅对草莓生长及生理特性的影响[J]. 农业环境科学学报, 2012, 31(12): 2335-2339. WANG Yao-jing, FU Tian-xia, SU Ying, et al. Effect of silicon on growth and physiological characteristics of strawberry(Fragariaananassa Duch.) under cadmium stress[J]. Journal of Agro-Environment Science, 2012, 31(12): 2335-2339. |
| [12] |
Shi X H, Zhang C C, Wang H, et al. Effect of Si on the distribution of Cd in rice seedlings[J]. Plant and Soil, 2005, 272(1): 53-60. |
| [13] |
Liu J, Ma J, He C W, et al. Inhibition of cadmium ion uptake in rice(Oryza sativa) cells by a wall-bound form of silicon[J]. New Phytologist, 2013, 200(3): 691-699. DOI:10.1111/nph.12494 |
| [14] |
Zhang C C, Wang L J, Nie Q, et al. Long-term effects of exogenous silicon on cadmium translocation and toxicity in rice(Oryza sativa L.)[J]. Environmental & Experimental Botany, 2008, 62(3): 300-307. |
| [15] |
Neugo C C, Huerta A J. The effect of silicon on the leaf proteome of rice(Oryza sativa L.) plants under cadmium-stress[J]. Journal of Proteome Research, 2011, 10(2): 518-528. DOI:10.1021/pr100716h |
| [16] |
Kim Y H, Khan A L, KIM D H, et al. Silicon mitigates heavy metal stress by regulation P-type heavy metal ATPases, Oryza sativa low silicon genes, and endogenous phytohormones[J]. BMC Plant Biology, 2014, 14(1): 13. DOI:10.1186/1471-2229-14-13 |
| [17] |
Vaculik M, Lux A, Luxova M, et al. Silicon mitigates cadmium inhibitory effects in young maize plants[J]. Environmental & Experimental Botany, 2009, 67(1): 52-58. |
| [18] |
Tripathi D K, Singh V P, Kumar D, et al. Rice seedlings under cadmium stress:Effect of silicon on growth, cadmium uptake, oxidative stress, antioxidant capacity and root and leaf structures[J]. Chemistry & Ecology, 2012, 28(3): 281-291. |
| [19] |
Liang Y C, Wong J W C, Wei L. Silicon-mediated enhancement of cadmium tolerance in maize(Zea mays L.) grown in cadmium contaminated soil[J]. Chemosphere, 2005, 58(4): 475-483. DOI:10.1016/j.chemosphere.2004.09.034 |
| [20] |
Da Cunha K P V, Do Nascimento C W A. Silicon alleviates the toxicity of cadmium and zinc for maize(Zea mays L.) grown on contaminated soil[J]. Journal of Plant Nutrition & Soil Science, 2008, 171(6): 849-853. |
| [21] |
Naeem A, Ullah S, Ghafoor A. Suppression of cadmium concentration in wheat grain by silicon is related to its application rate and cadmium accumulating abilities of cultivars[J]. Journal of the Science of Food & Agriculture, 2014, 95(12): 2467-2472. |
| [22] |
Neumann D, Nieden U. Silicon and heavy metal tolerance of higher plants[J]. Phytochemistry, 2001, 56(7): 685-692. DOI:10.1016/S0031-9422(00)00472-6 |
| [23] |
Li P, Wang X X, Zhang T L, et al. Distribution and accumulation of copper and cadmium in soil-rice system as affected by soil amendments[J]. Water, Air & Soil Pollution, 2009, 196(1): 29-40. |
| [24] |
陈晓婷, 王果, 梁志超, 等. 钙镁磷肥和硅肥对Cd、Pb、Zn污染土壤上小白菜生长和元素吸收的影响[J]. 福建农林大学学报(自然科学版), 2002, 31(1): 109-112. CHEN Xiao-ting, WANG Guo, LIANG Zhi-chao, et al. Effect of calcium magnesium phosphate and silicon fertilizer on the growth and element uptake of pakchoi in cadmium, lead and zinc contaminated soil[J]. Journal of Fujian Agriculture and Forestry University(Natural Science), 2002, 31(1): 109-112. |
| [25] |
Chen H M, Zheng C R, Tu C, et al. Chemical methods and phytoremediation of soil contaminated with heavy metals[J]. Chemosphere, 2000, 41(1): 229-234. |
| [26] |
Shim J, Shea P J, Oh B T. Stabilization of heavy metals in mining site soil with silica extracted from corn cob[J]. Water Air & Soil Pollution, 2014, 225(10): 2152. |
| [27] |
陈怀满. 土壤植物系统的重金属污染[M]. 北京: 科学出版社, 1996, 115-125. CHEN Huai-man. Heavy metal pollution in soil-plant system[M]. Beijing: Science Press, 1996, 115-125. |
| [28] |
Liang Y C, Wong J W, Wei L. Silicon-mediated enhancement of cadmium tolerance in maize(Zea mays L.) grown in cadmium contaminated soil[J]. Chemosphere, 2005, 58(4): 475-483. DOI:10.1016/j.chemosphere.2004.09.034 |
| [29] |
Zhao X L, Masaihiko S. Amelioration of cadmium polluted paddy soils by porous hydrated calcium silicate[J]. Water, Air & Soil Pollution, 2007, 183(1): 309-315. |
| [30] |
Rizwan M, Meunier J D, Miche H, et al. Effect of silicon on reducing cadmium toxicity in durum wheat(Triticum turgidum L. cv. Claudio W.) grown in a soil with aged contamination[J]. Journal of Hazardous Materials, 2012, 209/210: 326-334. DOI:10.1016/j.jhazmat.2012.01.033 |
| [31] |
周卫, 汪洪, 李春花, 等. 添加碳酸钙对土壤中镉形态转化与玉米叶片镉组分的影响[J]. 土壤学报, 2001, 38(2): 219-225. ZHOU Wei, WANG Hong, LI Chun-hua, et al. Effects of calcium carbonate addition on transformation of cadmium species in soil and cadmium forms in leaves of maize[J]. Acta Pedologica Sinica, 2001, 38(2): 219-225. DOI:10.11766/trxb199909140210 |
| [32] |
劳家柽. 土壤农化分析手册[M]. 北京: 农业出版社, 1988. LAO Jia-cheng. Soil agricultural chemistry analysis[M]. Beijing: Agriculture Press, 1988. |
| [33] |
刘雷, 杨帆, 刘足根, 等. 微波消解ICP-AES法测定土壤及植物中的重金属[J]. 环境化学, 2008, 27(4): 511-514. LIU Lei, YANG Fan, LIU Zu-gen, et al. Determination of heavy metals in soils and plants with microwave digestion and ICP-AES[J]. Environment Chemistry, 2008, 27(4): 511-514. |
| [34] |
林玉锁, 薛家骅. 由Freundlich方程探讨锌在石灰性土壤中的吸附机制和迁移规律[J]. 土壤学报, 1991, 28(4): 390-395. LIN Yu-suo, XUE Jia-hua. Using of Freundlich equation for studying mechanism and movement of Zn added in calcareous soil[J]. Acta Pedologica Sinica, 1991, 28(4): 390-395. |
| [35] |
李瑞延, 王金晞, 郭腊梅, 等. Cu2+与硅酸、硅胶表面硅羟基的反应及其平衡常数[J]. 无机化学学报, 1996, 12(1): 50-54. LI Rui-yan, WANG Jin xi, GUO La-mei, et al. Reaction of Cu2+ with silicic acid and surface silanol groups and their equilibrium constants[J]. Journal of Inorganic Chemistry, 1996, 12(1): 50-54. |
| [36] |
袁可能. 土壤化学[M]. 北京: 农业出版社, 1990. YUAN Ke-neng. Soil chemistry[M]. Beijing: Agriculture Press, 1990. |
| [37] |
Xu M C, Shi Z Q. Adorption of phenol in non-aqueous system based on hydrogen-bonding[J]. Chinese Journal of Reactive Polymers, 2000, 9(1): 17-22. |
| [38] |
Juang R S, Shiau J Y, Shao H J. Effect of temperature on equilibrium adsorption of phenols onto nonionic polymeric resins[J]. Separation Science and Technology, 1999, 34(9): 1819-1831. DOI:10.1081/SS-100100740 |
| [39] |
何小超, 郑经堂, 于维钊, 等. 活性炭臭氧化改性及其对噻吩的吸附热力学和动力学[J]. 石油学报(石油加工), 2008, 24(4): 426-432. HE Xiao-chao, ZHENG Jing-tang, YU Wei-zhao, et al. Modification of activated carbon by ozone and its thermodynamics and kinetics of the adsorption for thiophene[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2008, 24(4): 426-432. |
| [40] |
谢显传, 张少华, 王冬生, 等. 阿维菌素土壤吸附特性研究[J]. 中国农业科学, 2007, 40(9): 1959-1963. XIE Xian-chuan, ZHANG Shao-hua, WANG Dong-sheng, et al. Adsorption of Abamectin in soil[J]. Scientia Agricultura Sinica, 2007, 40(9): 1959-1963. |
| [41] |
彭书传, 王诗生, 陈天虎, 等. 凹凸棒石吸附水溶性染料的热力学研究[J]. 硅酸盐学报, 2005, 33(8): 1012-1017. PENG Shu-chuan, WANG Shi-sheng, CHEN Tian-hu, et al. Thermodynamics study of adsorption of water soluble dyestuffs onto purified palygorskite[J]. Journal of the Chinese Ceramic Society, 2005, 33(8): 1012-1017. |
| [42] |
Unlu N, Ersoz M. Adsorption characteristic of heavy metal ions onto a low cost biopolymeric sorbent from aqueous solution[J]. Journal of Hazardous Materials, 2006, 136(2): 272-280. DOI:10.1016/j.jhazmat.2005.12.013 |
| [43] |
周涛发, 陶春军, 李湘凌, 等. 磷酸根对水稻土中重金属镉汞铅吸附特性的影响研究[J]. 资源调查与环境, 2009, 30(2): 130-138. ZHOU Tao-fa, TAO Chun-jun, LI Xiang-ling, et al. Effect of phosphate on adsorption properties of heavy metals Cd, Hg, Pb in paddy-soil[J]. Resources Survey & Environment, 2009, 30(2): 130-138. |
| [44] |
Meunier N, Laroulandie J, Blais J F, et al. Cocoa shells for heavy metal removal from acidic solutions[J]. Bioresource Technology, 2003, 90(3): 255-263. DOI:10.1016/S0960-8524(03)00129-9 |
 2017, Vol. 36
2017, Vol. 36