文章信息
- 李哲, 陈潼樾, 冷粟, 吴迪, 张秀芳, 周野, 车驰, 李明堂
- LI Zhe, CHEN Tong-yue, LENG Su, WU Di, ZHANG Xiu-fang, ZHOU Ye, CHE Chi, LI Ming-tang
- 一株氧化木糖无色杆菌对Pb的生物矿化作用及其应用效果研究
- Biomineralization of Pb by a strain of Achromobacter xylosoxidans and its practical application in bioremediation
- 农业环境科学学报, 2017, 36(10): 2014-2020
- Journal of Agro-Environment Science, 2017, 36(10): 2014-2020
- http://dx.doi.org/10.11654/jaes.2017-0432
文章历史
- 收稿日期: 2017-03-24
- 接受日期: 2017-05-09
重金属Pb可通过施用有机肥、灌溉含铅废水、大气沉降和农膜使用等途径进入到土壤中,由于其在土壤中的移动性差,容易富集在表层土壤,且不能被微生物分解,往往会造成土壤中Pb含量的逐渐积累,不仅影响植物的生长,还可通过食物链对人及其他生物的健康造成威胁,所以土壤的Pb污染已经成为现今迫切需要解决的土壤环境问题之一[1]。土壤中Pb的修复方法一般包括物理法、化学法、生物法及联合法。物理法和化学法具有成本高、易造成二次污染和对土壤扰动大、降低土壤使用功能等缺点,在中轻度Pb污染农田土壤修复方面的应用受到限制[2-3]。以植物、微生物以及二者联合作用为主的生物修复法,由于具备成本低、无二次污染、可改善农田生态和实现边生产变修复等优点[4-5],在Pb污染土壤修复中的应用越来越广泛。其中以微生物生长和代谢为核心的修复法的机理主要包括微生物细胞对Pb的吸附和吸收、代谢物对重金属的固定、微生物对重金属的氧化还原作用[6-7]。微生物吸附重金属主要有微生物本身的吸附[8-9]及微生物代谢过程产生的胞外分泌物吸附[10-11],但随着微生物死亡或者环境因素的改变,被固定的重金属会重新释放到环境中。生物矿化是指在生物的特定部位,在有机物质的控制或影响下,离子态重金属转变为固相矿物,因其产物性质稳定、不易活化,与微生物吸附作用相比,具有非常大的应用潜力。
目前,人们主要研究了磷酸盐矿化菌和碳酸盐矿化菌对环境中重金属的矿化固结作用,如柠檬酸细菌属的一株菌可通过磷酸酶产生大量的磷酸氢根离子,在细菌表面与重金属形成矿物[12-13]。碳酸盐矿化菌矿化固结重金属主要是通过分泌尿素酶,从而分解尿素产生碳酸根,使溶液中重金属离子矿化固结为不可溶的碳酸盐晶体物质。王瑞兴等[14]的研究发现碳酸盐矿化菌可通过底物诱导产生酶化作用,释放的碳酸根离子可以使土壤中的有效态Cd矿化固结成稳定的矿物结构,从而使得有效态Cd含量降低50%以上,Podda等[15]发现水体中存在一种光合微生物,可通过代谢作用促进水锌矿Zn5(CO3)2(OH)6生成。成亮等[16]发现碳酸盐矿化菌可通过生物矿化作用形成CdCO3晶体沉淀,从而有效修复Cd污染土壤;钱春香等[17]研究了一株碳酸盐矿化菌对Cu的生物矿化作用,以及伴随阴离子Cl-和SO42-对矿化产物的影响,表明该菌株可基于生物矿化作用来固定土壤中的重金属。Bains等[18]发现一株巨大芽孢杆菌SS3可通过产生的胞外分泌物、尿酶和碳酸酐酶形成碳酸钙矿物晶体结构。鉴于生物矿化固结重金属的研究较少,而可利用的菌种资源更少,尤其是有些研究没有标明是何菌种[19],本文研究了从蔬菜根际土壤分离获得的一株可产尿酶分解尿素,进而释放碳酸根离子固结重金属的氧化木糖无色杆菌对Pb的生物矿化作用及对Pb污染土壤的修复效果,以期为Pb污染土壤的生物修复提供优良的菌种资源、理论依据和技术支持。
1 材料与方法 1.1 材料供试菌株:采用本课题组从长期使用有机肥的蔬菜根际土壤中分离获得的一株氧化木糖无色杆菌菌株LAX2,菌株LAX2与Achromobacter xylosoxidans strain SR50-12的同源性为100%。在含尿素的培养基中生长时可产生碳酸根离子,培养液的pH可达到9.06,尿酶的最高活性可达到140 U·mL-1。
Pb污染土壤:采自吉林省某矿区附近,Pb的总量和有效态含量分别为205.8、80.6 mg·kg-1。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨5 g,氯化钠5 g,pH7.0~7.1,蒸馏水定容至1000 mL,121 ℃高压灭菌25 min。加入2%琼脂粉制成固体培养基。
含尿素培养基:牛肉膏3 g,蛋白胨5 g,氯化钠5 g,尿素30 g,pH7.0~7.1,蒸馏水定容至1000 mL,除尿素外成分均经过121 ℃高压灭菌25 min,将尿素溶液过0.45 μm滤膜后加入培养基中。
菌悬液的制备:用接种环挑取单个菌落接种于LB培养基中,在25 ℃、160 r·min-1下活化培养24 h,再接种于LB培养基相同培养条件下富集培养24 h,将获得的培养液在4 ℃以4000 r·min-1离心10 min,重复清洗2~3次后,将所获得的菌体细胞重悬浮于无菌水,制备成OD600为0.4的菌悬液,每毫升大约含2×108个菌体细胞。
发酵液的制备:将菌悬液按照2%的比例接种于含尿素的培养基中,25 ℃、160 r·min-1培养18 h,作为发酵液用于实验研究。
1.2 菌株LAX2对Pb的抗性将菌株LAX2接种于Pb2+浓度分别为0、100、105、110、115、120 mg·L-1的含尿素培养基中,25 ℃、160 r·min-1培养24 h后测定发酵液的OD600。
1.3 Pb的生物矿化产物特征研究取200 mL发酵液,加入10 mL浓度为0.1 mol·L-1的Pb(NO3)2溶液,在室温下静置12 h后将产物滤出,50 ℃烘干,分别进行X射线衍射(XRD)、扫描电子显微镜、红外光谱和能谱分析。
1.4 发酵液不同组分对Pb2+的去除作用将按照1.1所述方法获得的发酵液,一部分直接用于对Pb2+的去除,另外一部分以4000 r·min-1离心10 min取上清液作为无菌发酵液用于Pb2+的去除,菌体细胞则重悬浮于与发酵液相同体积的无菌水中,用于Pb2+的去除。具体操作如下:分别向20 mL浓度为40 mg·L-1的Pb2+溶液中加入40 mL发酵液、无菌发酵液和菌细胞,静置1 h,过0.45 μm滤膜后测定Pb2+浓度,计算去除率。去除率=(初始浓度-去除后浓度)/初始浓度×100%。
1.5 发酵液对土壤中Pb的固定作用在直径9 cm的培养皿中加入10 g土样,平铺后均匀加入5 mL发酵液,同时以无菌水代替发酵液作为对照处理,共44个培养皿(含11个对照)。在25 ℃恒温培养箱内,分别在培养的第1、2、3、4、5、6、10、15、20、25、30 d各取4个培养皿(含1个对照),每个培养皿采样3次,分别测定土样中有效态Pb含量。
1.6 菌株LAX2对土壤修复的效果筛选形态一致且籽粒饱满的种子进行消毒处理后用于盆栽试验。采用直径20 cm、高15 cm的花盆,每盆装土800 g,按1.1所述方法制备发酵液、无菌发酵液和菌体细胞,分别将100 mL发酵液、无菌发酵液和菌体细胞喷洒到花盆中,搅拌混匀,稳定2周后播种,待种子发芽,生长10 d后进行间苗,使得每盆剩余大小相近的5棵生长状态良好的幼苗。在室外生长45 d收获。分别收集植株的地上部、地下部以及根部土壤,用于测定植株可食部分的生物量和重金属的含量以及土壤中有效态Pb的含量。
1.7 分析测定方法 1.7.1 Pb的测定方法采用硝酸-氢氟酸-高氯酸混合消煮法对土样进行前处理,过0.45 μm滤膜后用于土壤总Pb的测定;采用DTPA浸提法提取土壤中有效态Pb,过0.45 μm滤膜后用于土壤有效态Pb的测定;培养液过0.45 μm滤膜后直接进行Pb2+浓度的测定。均采用石墨炉原子吸收分光光度法测定[20]。
1.7.2 矿化产物XRD、红外光谱、扫描电镜与能谱分析将矿化产物样品用玛瑙研钵研磨,过300目筛后放入圆形凹槽内,压平,在2θ为3~80°范围内进行衍射分析;将矿化产物样品与KBr按照质量比约为1:200混合,在玛瑙研钵中研磨,然后将适量的混合粉末放入压片机中进行压片。将制备好的样品,采用傅里叶红外光谱仪在波数为4000~500 cm-1范围内对样品进行分析;夹取一小片Pb的矿化产物粘于台子上,进行表面镀金后放入仪器内,放大8000倍寻找到清晰晶体形状后拍摄,之后进行能谱分析。
1.8 数据分析所有实验处理重复三次,实验数据利用Excel进行处理,表示为平均值±标准差。用Jade5分析XRD图中矿物晶形。
2 结果与分析 2.1 菌株LAX2对Pb的抗性预实验表明菌株LAX2在Pb2+浓度为100 mg·L-1时生长迅速,几乎不受影响,但在120 mg·L-1时菌株完全受到抑制,几乎不会生长,所以将Pb2+浓度设为0、100、105、110、115、120 mg·L-1。由图 1可以看出,Pb2+浓度为105 mg·L-1时没有受到明显抑制作用,其OD600与不加Pb2+的对照试验几乎无差别(P>0.05),但随着Pb浓度的增加,菌株的生长开始受到影响。总的说来,菌株LAX2对Pb具有较强的抗性,在生物矿化修复重金属污染土壤方面具有较高的应用潜力。
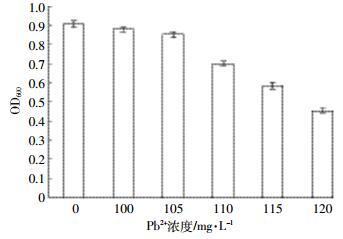
|
| 图 1 Pb2+对菌株LAX2生长的影响 Figure 1 Effects of Pb2+ concentration on the growth of strain LAX2 |
由Pb矿化产物的扫描电镜图(图 2a)可以看出,矿化产生的物质为有规则整齐排布的球状晶体,但球状晶体的直径分布不均匀,可能与晶体处于不同生长期有关,从图中还可以看出晶体的最大直径可达2 μm。由矿化产物的红外光谱图(图 2b)可以看出,矿化产物表面基团存在C-O基团。将XRD图(图 2c)中出峰位置对比PDF标准卡片(47-1734),确定其分子式为PbCO3。通过矿化产物能谱分析可以看出,矿化产物中含有Pb、C、O等元素(图 2d)。
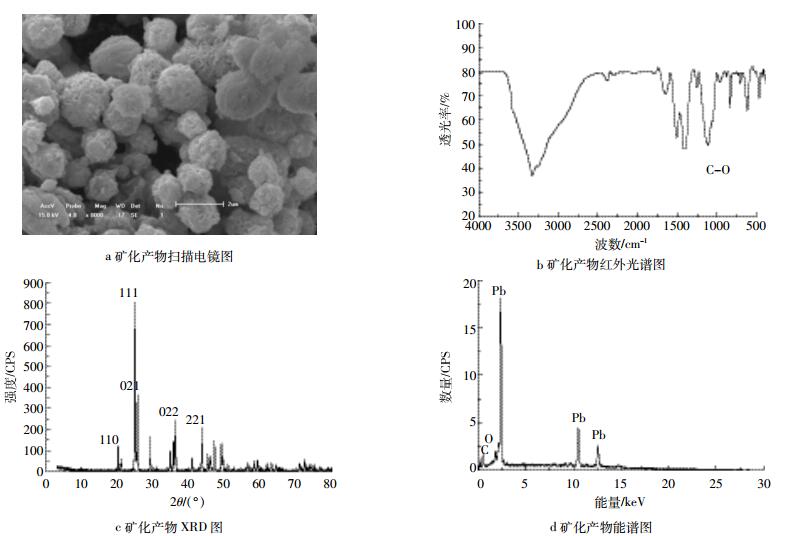
|
| 图 2 Pb的生物矿化产物特征分析 Figure 2 Analysis of Pb biomineralization product |
从图 3可以看出,无菌发酵液的沉淀作用、发酵液的生物矿化作用和菌细胞的吸附作用对重金属的去除率分别为67.4%、86.3%和91.6%(P < 0.05),即吸附作用对Pb2+的去除能力最强,其次为生物矿化作用,化学沉淀对Pb2+的去除能力最差。这说明三种去除作用可能存在机理上的差异,其中生物矿化作用很可能既有菌体细胞的吸附作用,又存在离子之间的化学反应,而这又符合生物矿化作用的机理[21],再次说明菌株LAX2可通过生物矿化作用固定重金属。
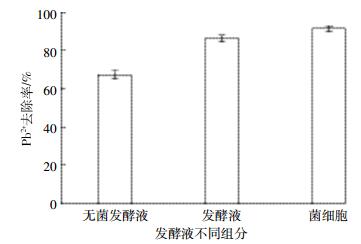
|
| 图 3 菌株LAX2发酵液不同组分对Pb2+的去除作用 Figure 3 Removal of Pb2+ by components of strain LAX2 fermentation broth |
图 4表明发酵液对土壤中有效态Pb的去除呈现适应-快速-慢速的趋势,即发酵液加入到土壤中后并没有立即发生生物矿化作用,而是有一个适应过程。从第2 d起发酵液开始快速矿化固结土壤中的有效态Pb,从而使其含量迅速下降,但从第5 d起土壤中有效态Pb含量缓慢下降。从整个实验周期看,加入发酵液的处理组与对照组相比,土壤中有效态Pb含量呈现持续下降趋势,在培养5、10、30 d时土壤有效态Pb含量分别降低56.1%、76.5%和86.8%。
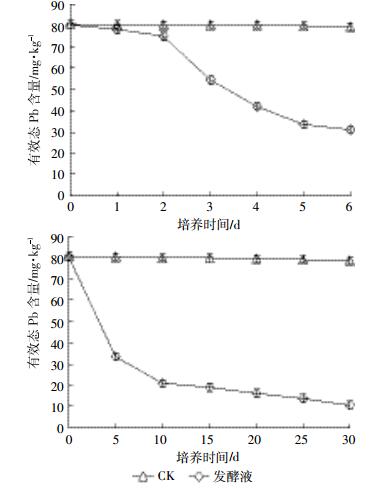
|
| 图 4 菌株LAX2发酵液对土壤有效态Pb的固定作用 Figure 4 Immobilization of available Pb in soil by strain LAX2 fermentation broth |
利用加入发酵液、无菌发酵液和菌体细胞修复过的Pb污染土壤进行小白菜盆栽实验,结果如图 5所示。与对照相比,发酵液、无菌发酵液和菌体细胞处理过的土壤中小白菜的株高分别增加了49.4 %、21.6%和9.6%(P < 0.05)。土壤中有效态Pb含量分别下降了78.1%、64.2%和52.4%(P < 0.05),小白菜可食部分Pb含量分别下降了56.5%、27.4%和14.5%(P < 0.05)。这表明与其他两种固定作用相比,生物矿化作用对土壤中有效态Pb的固定效果最好,能够明显减少Pb对植物的毒害作用,从而促进小白菜的生长和降低可食部分Pb的含量。
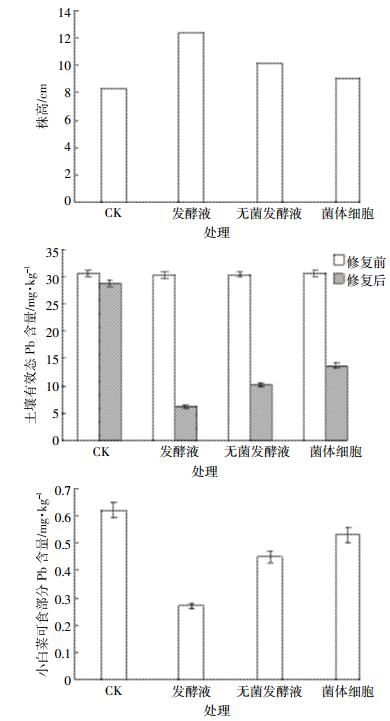
|
| 图 5 发酵液不同组分对小白菜生长、可食部分Pb含量及土壤中有效态Pb含量的影响 Figure 5 Effects of components of strain LAX2 fermentation broth on growth of Chinese cabbage, Pb content in edible part of Chinese cabbage, and available Pb content in soil |
微生物可通过生物矿化作用将土壤中活性态的重金属离子矿化固结为稳定的矿物态,使其不容易释放出来,从而达到重金属污染土壤修复的目的。这种修复技术具有成本低、无二次污染、生态友好和可实现边生产边修复的优点,在土壤污染修复方面逐渐引起人们的重视[22]。研究表明自然环境中存在一类能够通过酶化作用释放碳酸根离子,进而通过生物矿化作用将重金属离子固定为稳定的碳酸盐晶体矿物的微生物,这类微生物被称作为碳酸盐矿化菌。许燕波等[23]利用碳酸盐矿化菌的生物矿化作用将土壤中可交换态的Pb固结为性质稳定的PbCO3,从而降低土壤中可交换态Pb的含量,但在Pb2+浓度为10.35 mg·L-1时该菌的生长及矿化作用受到了明显抑制。由于微生物菌体细胞在生物矿化过程中发挥重要作用,矿化菌对重金属的抗性直接影响了重金属生物矿化产物的形成和稳定性。本文所用的菌株LAX2则对Pb2+表现出了较强的抗性,当溶液中Pb2+的浓度达到105 mg·L-1时,菌株LAX2的生长仍未受到明显的影响。
微生物介导的生物矿化作用往往使微生物首先吸附重金属,然后与溶液中的阴离子反应,产生不溶性共沉淀,然后以微生物为晶核,不断生长,晶体的大小和性质往往受到微生物本身性质和其所分泌的水溶性有机物的影响[24],因此不同微生物形成的同一种矿物晶体,其性质往往存在差异,如菌株LAX2的发酵液矿化固结Pb离子时可形成单一的球形PbCO3,其粒径可达到2 μm;而成艳等[25]利用碳酸盐矿化菌株Bacillus cereus Pb21的生物矿化作用将Pb固结为以颗粒状团聚的PbCO3,多为不规则块状;许燕波等[23]选用的碳酸盐矿化菌对Pb的矿化产物呈斜方和立方混合,因此菌株LAX2对Pb的矿化过程可能有别于其他菌株,具体的矿化过程调控机制有待于进一步研究。菌株LAX2发酵液各组分对Pb2+的去除能力的大小顺序为菌体细胞的吸附作用>生物矿化作用>无菌发酵液的化学沉淀作用,再次说明菌株LAX2可通过生物矿化作用固定Pb2+,而这种作用有别于单一的菌体细胞吸附和化学沉淀作用。目前对重金属碳酸盐矿化作用的研究主要是理论研究,实际应用研究较少,许燕波等[26]用碳酸盐矿化菌对土壤进行两周的修复后,土壤有效态Pb含量减少了58.8%,本菌与其相比具有明显的优势。成亮等[16]研究发现碳酸盐矿化菌能够通过生物矿化作用在25 d内使得土壤中有效态Cd的含量下降91%左右,但并没有研究菌株对土壤中Pb的生物矿化过程。本文所用的菌株LAX2对土壤中有效态Pb的固定化呈现出适应-快速-缓慢的过程,前2 d属于适应阶段,菌株需要一定的时间来调节自身的生理机能去适应新的环境,因此土壤中有效态Pb含量下降很慢,从第2 d开始快速下降,培养5 d后土壤中有效态Pb含量下降56.1%;之后由于重金属有效态含量很低,发酵液对重金属的固定作用进入缓慢阶段,培养10 d后土壤有效态Pb的含量下降了76.5%;随后土壤中有效态Pb的含量下降速度明显减慢,但与对照相比仍在降低,培养30 d的土壤中有效态Pb的含量降低了86.8%。小白菜盆栽实验发现菌株LAX2发酵液对小白菜的生长、吸收Pb的量和土壤有效态Pb含量都有明显的影响。与菌体细胞吸附和化学沉淀相比,生物矿化作用更能有效降低土壤中有效态Pb含量,进而降低Pb的毒性,促进小白菜的生长和减少小白菜对Pb的吸收。以上结果表明,菌株LAX2在矿化固结土壤中有效态Pb,降低其毒性方面具有较大的应用潜力。
4 结论(1)一株对Pb具有较强抗性的氧化木糖无色杆菌LAX2可通过生物矿化作用形成直径高达2 μm的PbCO3晶体。生物矿化作用对溶液中Pb2+的去除率大于化学沉淀作用,但小于菌体细胞的吸附作用。
(2)菌株LAX2发酵液对污染土壤中有效态Pb的固定作用呈现适应-快速-缓慢三个阶段,培养30 d后土壤中有效态Pb的含量可下降86.8%。
(3)与化学沉淀和菌体细胞吸附作用相比,菌株LAX2发酵液可通过生物矿化作用去除土壤中更多的有效态Pb,从而减少Pb对小白菜的毒性作用及其在小白菜可食部位的积累量。因此,菌株LAX2是矿化固结土壤中有效态Pb的优良菌种资源,可应用于Pb污染土壤的生物修复。
| [1] |
高璐, 沙迪, 张雪萍. 松嫩平原耕作黑土Cu、Pb、Zn的污染现状分析[J]. 中国农业通报, 2011, 27(6): 261-265. GAO Lu, SHA Di, ZHANG Xue-ping. Analysis on the current pollution situation of Cu, Pb and Zn in the cultivated black soil of Songnen Plain[J]. Chinese Agricultural Science Bulletin, 2011, 27(6): 261-265. |
| [2] |
徐文杰, 张振中, 赵泉林, 等. 物化法修复火炸药污染土壤研究进展[J]. 环境科学与技术, 2015, 38(增刊1): 294-298. XU Wen-jie, ZHANG Zhen-zhong, ZHAO Quan-lin, et al. Research progress on physical and chemical remediation of explosives-contaminated soil[J]. Environmental Science & Technology, 2015, 38(S1): 294-298. |
| [3] |
陈银合. 化学淋洗和固化/稳定化技术修复重金属污染土壤[J]. 安徽农业科学, 2016, 44(1): 156-158. CHEN Yin-he. Remediation of heavy metal contaminated soil by combined technology of chemical washing and solidification/stabilization[J]. Journal of Anhui Agricultural Sciences, 2016, 44(1): 156-158. |
| [4] |
Gwenzi W, Musarurwa T, Nyamugafata P, et al. Adsorptiom of Zn2+ and Ni2+ in a binary aqueous solution by biosorbents derived from sawdust and water hyacinth(Eichhornia crassipes)[J]. Water Science & Technology, 2014, 70(8): 1419-1427. |
| [5] |
谢运河, 纪雄辉, 黄涓, 等. 赤泥、石灰对Cd污染稻田改制玉米吸收积累Cd的影响[J]. 农业环境科学学报, 2014, 33(11): 2104-2110. XIE Yun-he, JI Xiong-hui, HUANG Juan, et al. Effects of red mud and lime on cadmium uptake of corn in dryland converted from cadmium polluted paddy field[J]. Journal of Agro-Environment Science, 2014, 33(11): 2104-2110. DOI:10.11654/jaes.2014.11.005 |
| [6] |
Park J H, Bolan N, Megharaj M, et al. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J]. Journal of Hazardous Materials, 2011, 185: 829-836. DOI:10.1016/j.jhazmat.2010.09.095 |
| [7] |
郭莹, 秦玉莹, 鞠天琛, 等. 一株穗花狐尾藻内生菌的分离鉴定及其溶磷特征研究[J]. 环境科学学报, 2016, 36(12): 4352-4360. GUO Ying, QIN Yu-ying, JU Tian-chen, et al. Isolation and characterization of a strain endophytic bacterium in Myriophyllum spicatum and its solubilization of phosphate[J]. Acta Scientiae Circumstantiae, 2016, 36(12): 4352-4360. |
| [8] |
周广麒, 任铮宇, 杨洪泽, 等. 微生物菌体对Cd2+等重金属离子的吸附研究[J]. 生物技术通报, 2013, 26(6): 155-159. ZHOU Guang-qi, REN Zheng-yu, YANG Hong-ze, et al. Bacterial adsorption of heavy metal ions such as Cd2+[J]. Biotechnology Bulletin, 2013, 26(6): 155-159. |
| [9] |
李瑞月, 陈德, 李恋卿, 等. 不同作物秸秆生物炭对溶液中Pb2+、Cd2+的吸附[J]. 农业环境科学学报, 2015, 34(5): 1001-1008. LI Rui-yue, CHEN De, LI Lian-qing, et al. Adsorption of Pb2+ and Cd2+ in aqueous solution by biochars derived from different crop residues[J]. Journal of Agro-Environment Science, 2015, 34(5): 1001-1008. DOI:10.11654/jaes.2015.05.025 |
| [10] |
董明, 宋卫锋, 程亚杰. 苯胺黑药高效降解菌(Bacillus vallismortis)胞外聚合物去除重金属的研究[J]. 环境科学学报, 2016, 36(12): 4367-4375. DONG Ming, SONG Wei-feng, CHENG Ya-jie. Study on heavy metals removal by extracellular polymeric substances extracted from aniline aerofloat-degradating bacterium(Bacillus vallismortis)[J]. Acta Scientiae Circumstantiae, 2016, 36(12): 4367-4375. |
| [11] |
周维芝, 李伟伟, 张玉忠, 等. 深海适冷菌Pseudoalteromonas sp. SM9913胞外多糖对Pb2+和Cu2+的吸附性能研究[J]. 环境科学, 2009, 30(1): 200-205. ZHOU Wei-zhi, LI Wei-wei, ZHANG Yu-zhong, et al. Biosorption of Pb2+ and Cu2+ by an exopolysaccharide from the deep-sea psychrophilic bacterium Pseudoalteromonas sp. SM9913[J]. Environmental Science, 2009, 30(1): 200-205. |
| [12] |
Macaskie L E, Dean A C R, Cheethan A K, et al. Cadmium accumulation by a Citrobacter sp.:The chemical nature of the accumulated metal precipitate and its location on the bacterial cells[J]. Journal of Medical Microbiology, 1987, 133(3): 539-544. |
| [13] |
Sondi I, Matidjevic E. Homogeneous precipitation by enzyme-catalyzed reactions-strontium and barium carbonates[J]. Chemistry of Materials, 2003, 15(6): 1322-1326. DOI:10.1021/cm020852t |
| [14] |
王瑞兴, 钱春香, 吴淼, 等. 微生物矿化固结土壤中重金属研究[J]. 功能材料, 2007, 38(9): 1523-1527. WANG Rui-xing, QIAN Chun-xiang, WU Miao, et al. Study on heavy metals in microbial mineralization consolidation soil[J]. Functional Materials, 2007, 38(9): 1523-1527. |
| [15] |
Podda F, Zuddas P, Minacci A, et al. Heavy metal coprecipitation with hydrozincite[Zn5(CO3)2(OH)6] from mine waters caused by photosynthetic microorganisms[J]. Applied and Environmental Microbiology, 2000, 66(11): 5092-5098. DOI:10.1128/AEM.66.11.5092-5098.2000 |
| [16] |
成亮, 钱春香, 王瑞兴, 等. 碳酸盐矿化菌株A固结土壤Cd2+的矿化过程[J]. 硅酸盐学报, 2008, 36(S1): 215-221. CHENG Liang, QIAN Chun-xiang, WANG Rui-xing, et al. Bioremediation process of Cd2+ removal from soil by bacteria A biomineralization[J]. Journal of the Chinese Ceramic Society, 2008, 36(S1): 215-221. |
| [17] |
钱春香, 许燕波, 胡黎明, 等. 一种微生物固结污染体系中Cu2+的研究[J]. 环境科学与技术, 2011, 35(12H): 33-36. QIAN Chun-xiang, XU Yan-bo, HU Li-ming, et al. Study on Cu2+ in contaminated system mineralized by bacteria[J]. Environmental Science & Technology, 2011, 35(12H): 33-36. |
| [18] |
Bains A, Dhami N K, Mukherjee A, et al. Influence of exopolymeric materials on bacterially induced mineralization of carbonates[J]. Appl Biochem Biotechnol, 2015, 175: 3531-3541. DOI:10.1007/s12010-015-1524-3 |
| [19] |
陆兆文, 钱春香, 许燕波, 等. 不同污染条件下微生物矿化固结Zn2+的作用及机理[J]. 东南大学学报(自然科学版), 2013, 43(2): 365-370. LU Zhao-wen, QIAN Chun-xiang, XU Yan-bo, et al. Function and mechanism of microbial mineralization consolidation of Zn2+ under different pollution conditions[J]. Journal of Southeast University(Natural Science Edition), 2013, 43(2): 365-370. DOI:10.3969/j.issn.1001-0505.2013.02.026 |
| [20] |
刘凤芝, 马锦秋. 土壤监测分析实用手册[M]. 北京: 化学工业出版社, 2010. LIU Feng-zhi, MA Jin-qiu. Practical manual for soil monitoring and analysis[M]. Beijing: Chemical Industry Press, 2010. |
| [21] |
钱春香, 王瑞兴, 詹其伟. 微生物矿化的工程应用基础[M]. 北京: 科学出版社, 2015, 4-5. QIAN Chun-xiang, WANG Rui-xing, ZHAN Qi-wei. The basis of microbial mineralization applied in engineering[M]. Beijing: Science Press, 2015, 4-5. |
| [22] |
钱春香, 王明明, 许燕波. 土壤重金属污染现状及微生物修复技术研究进展[J]. 东南大学学报(自然科学版), 2013, 43(3): 669-674. QIAN Chun-xiang, WANG Ming-ming, XU Yan-bo. Current situation of soil contamination by heavy metals and research progress in bio-remediation technique[J]. Journal of Southeast University(Natural Science Edition), 2013, 43(3): 669-674. DOI:10.3969/j.issn.1001-0505.2013.03.041 |
| [23] |
许燕波, 钱春香, 陆兆文, 等. 微生物矿化修复铅离子污染的研究[J]. 化工时刊, 2012, 26(6): 14-17. XU Yan-bo, QIAN Chun-xiang, LU Zhao-wen, et al. Study on Pb2+ mineralized by bacteria for remediation[J]. Chemical Industry Times, 2012, 26(6): 14-17. |
| [24] |
许燕波, 钱春香, 陆兆文. 柠檬酸粗化铜离子矿化产物颗粒粒径的研究[J]. 材料导报B, 2013, 27(1): 92-95. XU Yan-bo, QIAN Chun-xiang, LU Zhao-wen. Study on coarsing particle size of Cu2+ biomineralization products by citric acid[J]. Materials Review B, 2013, 27(1): 92-95. |
| [25] |
成艳, 赵兴青. 碳酸盐矿化菌固结Pb2+的生物矿化[J]. 环境科学研究, 2016, 29(10): 1513-1520. CHENG Yan, ZHAO Xing-qing. Study on the consolidation and mineralization of Pb2+ by carbonate-mineralization bacteria[J]. Research of Environmental Sciences, 2016, 29(10): 1513-1520. |
| [26] |
许燕波, 钱春香, 陆兆文, 等. 微生物矿化修复重金属污染土壤[J]. 环境工程学报, 2013, 7(7): 2763-2768. XU Yan-bo, QIAN Chun-xiang, LU Zhao-wen, et al. Remediation of heavy metal contaminated soils by bacteria biomineralization[J]. Chinese Journal of Environmental Engineering, 2013, 7(7): 2763-2768. |
 2017, Vol. 36
2017, Vol. 36




