文章信息
- 石慧, 白翠华, 周昌敏, 罗东林, 姚丽贤
- SHI Hui, BAI Cui-hua, ZHOU Chang-min, LUO Dong-lin, YAO Li-xian
- 施用猪粪土壤中抗生素的降解、植物有效性及土壤酶活性变化
- Degradation and phytoavailability of antibiotics in soils amended with pig manure and changes of soil enzyme activity
- 农业环境科学学报, 2017, 36(10): 2039-2047
- Journal of Agro-Environment Science, 2017, 36(10): 2039-2047
- http://dx.doi.org/10.11654/jaes.2017-0358
文章历史
- 收稿日期: 2017-03-14
禽畜粪肥被认为是优质有机肥,一直被推荐长期大量施用[1-2]。但在集约化禽畜养殖中,为预防疾病和促进动物生长,通常会在禽畜饲料中添加抗生素[3-4]。禽畜对抗生素的利用率通常较低,大部分随粪便排出体外,导致抗生素在禽畜粪中的残留[5-7]。禽畜粪中检出的抗生素包括磺胺类[5-7]、四环素类[5-7]、喹诺酮类[6-7]、大环内脂类[7]等,其中四环素类抗生素(如金霉素、土霉素等)的检出率最高且含量也较高。施用养殖场禽畜粪可导致粪肥中的抗生素在农田土壤的累积[7-8],进而被蔬菜[4, 9]、玉米[10]等作物吸收累积,这些农产品被人类食用后可能会引起健康风险。已有大量文献报道外源添加抗生素对土壤酶活性的影响[11-13],但鲜有文献报道随粪肥进入土壤的抗生素对土壤酶活性的影响[14]。实际生产中,抗生素主要是随粪肥进入土壤[4, 7-8]。土壤酶作为土壤肥力的重要指标,对植物生长也有重要影响[15]。因此,极有必要研究以探明施用含有抗生素残留的粪肥对土壤酶活性的影响。
我国是最大的荔枝(Litchi chinensis Sonn.)生产国,华南是我国最重要的荔枝产区[16]。荔枝为多年生木本果树,在生产上有长期大量施用禽畜粪的习惯[17]。然而,目前在果园土壤施用禽畜粪后,抗生素在果园土壤的累积及果树对抗生素的吸收累积能力缺乏研究。本研究在荔枝园土壤添加不同用量养殖场猪粪进行土壤培养试验和荔枝盆栽试验,研究抗生素在土壤中的降解动态和土壤酶活性的变化,进一步探究荔枝植株对抗生素的吸收利用能力,为禽畜粪肥在荔枝种植中的合理安全施用提供前期研究基础。
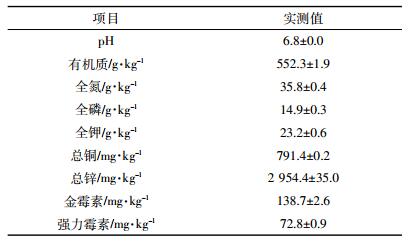
1 材料与方法 1.1 供试材料试验土壤采自广东省广州市增城县荔城街东林果园(113°45′56.32″E,23°14′33.85″N)。所用土壤为赤红壤,砂质黏壤土,具体理化性质和抗生素含量见表 1。土壤经风干、粉碎、过2 mm筛后用于培养试验和盆栽试验。
供试猪粪采于广东省肇庆市四会县某猪场。猪粪经风干、粉碎过2 mm筛后备用。采集基础样本测定基本理化性质、金属和抗生素含量,结果见表 2。
供试荔枝品种为淮枝。淮枝新鲜果实购于广州市从化区温泉镇宣星村农户果园。荔枝果实带回实验室获得种子后,在网室内用干净河沙育苗,仅浇自来水。在种子发芽生长2个月后,选取株高大小基本一致、具有6片真叶的荔枝苗移植进行盆栽试验。
1.2 试验方案 1.2.1 土壤培养试验试验于2015年10月至2016年10月在华南农业大学网室进行。据调查,华南荔枝主产区荔枝有机肥施用量在1~200 kg·株-1范围内[17],按我国荔枝平均种植密度330~390株·hm-2[18]计算,相当于施用量为330~78 000 kg·hm-2。因此,设置猪粪添加量为0、10、20、40 g·kg-1,分别记为对照CK、1%、2%、4%,每个处理重复4次。将不同用量猪粪分别与土壤(10 kg)混拌均匀后装入10 L白色PVC塑料桶(25.1 cm×27.9 cm),加入自来水保持土壤水分为田间持水量的75%左右进行培养。在第0、10、20、30、40、50、60、80、100、120、150、180、210、240、270、300、330、360 d采集土壤样本,每次用不锈钢土钻采集约250 g土,每桶分别采集3钻土样,混匀为一个土壤样本。土样混匀后分为两部分:一部分风干,用于测定土壤酶活性;另一部分土壤立即冻干,磨碎后放在-20 ℃冰箱保存,用于测定抗生素(金霉素、强力霉素)含量。
1.2.2 盆栽试验试验于2015年10月至2016年5月在华南农业大学网室进行。盆栽试验处理及猪粪用量与培养试验相同,但每个处理重复9次。将不同用量猪粪分别与供试土壤(4 kg)混拌均匀,装入5 L白色PVC塑料桶(19.7 cm×19.3 cm),加入自来水调节土壤水分约为田间持水量的75%,老化20 d后移栽荔枝幼苗,每桶移栽一株。试验期间保持土壤水分约为田间持水量的75%。在荔枝移栽后的153 d和210 d,分别收获荔枝植株,同时采集粘附在荔枝根系的根际土壤。荔枝植株收获后,立即带回实验室,用大量自来水彻底冲洗植株根、茎、叶,用蒸馏水二次充分冲洗,用滤纸吸干植株表面水分,称植株鲜重后立即冻干、磨碎,放在-20 ℃冰箱保存用于测定抗生素的含量;土壤样本也立即冻干,磨碎后测定抗生素含量。
1.3 仪器与试剂所用仪器有Waters xevo高效液相色谱仪-TQD(三重四极杆)-MS质谱检测器(美国Waters公司)(UPLC-MS/MS)、Alpha1-4/LD plus冷冻干燥机(德国Christ公司)、Eppendorf Centrifuge 580R高速冷冻离心机、Unique-R20超纯水机、RE-52A旋转蒸发仪(上海亚荣生化仪器厂)、KH5200DE型数控超声波清洗仪(昆山禾创超声仪)、SHZ-D循环水式真空泵(巩义市予华仪器有限公司)、XHDZF-6020真空干燥箱(上海霄汉实业发展有限公司)、HSE-08A多功能数控固相萃取系统(天津市恒奥科技发展公司)、JP200-24 24孔干式氮吹仪(上海旌派仪器有限公司)、Sartorius BSA224S电子天平(赛多利斯科学仪器有限公司)、Waters Oasis SAX强阴离子交换柱(6 mL·500 mg-1)、Waters Oasis HLB固相萃取柱(6 mL·500 mg-1)。
甲醇、乙腈均为色谱纯(Aladdin公司),其他试剂均为优级纯(广州化学试剂厂)。金霉素标准品(纯度≥80%)和强力霉素标准品(纯度≥98%)均购于Aladdin公司。实验用水为超纯水。
抗生素标准溶液:准确称取金霉素和强力霉素标准品溶于甲醇,配制成100 mg·L-1的抗生素标准储备液。取各种储备液适量,用甲醇稀释成混合标准母液。取混合标准母液以甲醇逐步稀释,配制成校正曲线工作液,含量范围为0.1~1000 μg·L-1,避光保存。
EDTA-McIlvaine缓冲液:称取柠檬酸12.9 g,磷酸氢二钠27.5 g,乙二胺四乙酸二钠37.2 g,溶于水中并定容到1 L(pH =4.0)。
1.4 测定方法和条件土壤脲酶采用靛酚蓝比色法测定,其活性以24 h后100 g土壤中NH3-N的毫克数表示;过氧化氢酶用高锰酸钾滴定法测定,其活性以每克土消耗的0.1 mol·L-1的高锰酸钾的毫升数表示;酸性磷酸酶活性采用磷酸苯二钠比色法,结果以24 h后100 g土壤中酚的毫克数表示[15]。
土壤和荔枝植株金霉素、强力霉素含量用超高效液相串联质谱(UPLC-MS/MS)测定。具体操作过程为:称取过100目筛的样品1.00 g,置于50 mL离心管中,加入10 mL正己烷、Na2EDTA-McI1vaine(1:1,V:V)缓冲液(pH 4.0)的混合液,恒温振荡10 min,超声萃取15 min,10 ℃下5000 r·min-1离心20 min后收集提取液。重复提取3次,将上清液合并转移至鸡心瓶中,弃去正己烷层,40 ℃旋转蒸发10 min至液体不再沸腾。提前依次用10 mL甲醇和10 mL超纯水将SAX和HLB固相萃取柱淋洗活化,再将提取液上柱萃取。萃取后用6 mL超纯水冲洗SAX和HLB柱,将SAX柱弃去,将HLB柱40 ℃抽真空2 h以去除柱中残留水分,用甲醇(含0.1%甲酸)洗脱柱子,将洗脱液用氮吹至近干,用乙腈水溶液(1:1,V:V)定容至1 mL,过0.22 μm滤膜后装瓶待测。
UPLC测定条件:色谱柱为Acquity UPLC BEH C18柱(2.1 mm×50 mm,1.7 μm)。柱温35 ℃,流速5 μL·min-1,进样量4 μL;流动相为(0.1%甲酸)乙腈(A)和0.1%甲酸水溶液(B)。梯度洗脱程序为:0~2 min,10%~40%A;2~3 min,40%~60%A;3~3.2 min,60%~10%A;3.2~4.5 min,10%A。
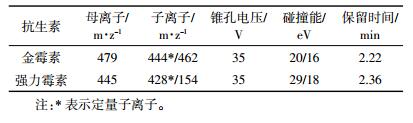
MS检测条件:电喷雾离子源(ESI),离子源温度150 ℃,脱溶剂温度450 ℃,脱溶剂气和锥孔气为氮气,脱溶剂气流速700 L·h-1,锥孔气流速50 L·h-1,采用多反应监测模式(MRM)监测。金霉素和强力霉素MRM参数见表 3。ESI-MS/MS选择性反应正离子检测,进样量4 μL。金霉素和强力霉素的检测限分别为0.40、0.03 μg·kg-1。
用Excel进行数据处理分析和作图。数据表示为平均数±标准误。用SAS软件(2002 by SAS Institute Inc.,Cary,NC,USA)进行统计分析,用Duncan法进行差异显著性比较。IBM SPSS Statistics 20软件进行Pearson相关分析。培养试验中四环素类抗生素在土壤中的降解动态用对数函数模拟,公式为:
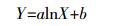 (1)
(1) 式中:a、b为常数;Y为土壤中抗生素的含量,mg·kg-1;X为培养时间,d。
抗生素转移系数的计算公式为:
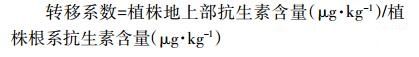 (2)
(2) 施用猪粪土壤的金霉素和强力霉素降解动态如图 1所示。对照土壤在培养期间均未测出两种抗生素。与对照处理相比,施用猪粪可导致金霉素和强力霉素在土壤中的累积。猪粪施用量为1%时,土壤中金霉素含量在0~20 d快速下降,降解率达58.5%±3.2%;20 d后,随培养时间的延长,金霉素含量变化不明显。添加2%和4%猪粪处理土壤金霉素含量在0~60 d快速下降,至60 d时,降解率分别为57.8%±1.1%和68.4%±6.3%。约从60 d开始,这两个处理的金霉素含量缓慢下降并逐渐接近。培养结束时,3个处理土壤金霉素降解率在88.3%±0.6%~95.6%±0.9%之间,残留的金霉素含量在(0.1±0.0)~(0.3±0.0)mg·kg-1之间。不同用量猪粪处理土壤强力霉素含量在培养期间变化规律与金霉素类似。培养结束时,土壤中强力霉素的降解率为(76.6%±5.6%)~(88.9%±1.8%),残留量在(0.2±0.1)~(0.5±0.1)mg·kg-1之间。
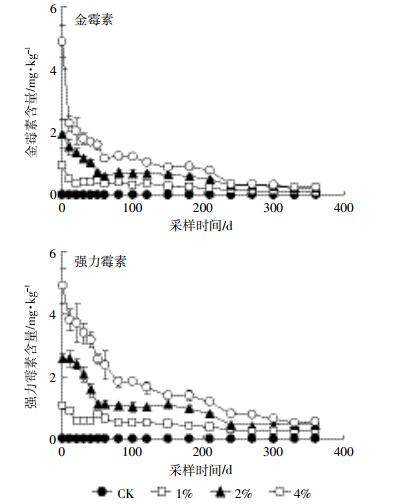
|
| 图 1 不同用量猪粪处理土壤金霉素和强力霉素含量动态变化 Figure 1 Changing trend of chlortetracycline and doxycycline in soils applied with various rates of pig manure |
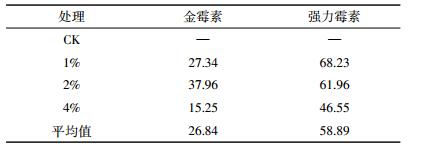
两种抗生素均为施加高量处理的前期降解速率高于低量处理。究其原因,可能是由于猪粪中有机质含量远高于抗生素含量,施用高量猪粪处理显著提高了土壤有机质,增加了微生物可利用的碳源[19],从而提高了微生物活性,导致抗生素前期降解速率较高[14]。随时间延长,由于抗生素自身对土壤微生物有抑制作用[12],且Cu等金属元素对抗生素抑制土壤微生物作用具有协同作用[20],从而降低了抗生素后期的降解速率。两种抗生素在土壤的降解半衰期可用对数函数拟合计算获得(表 4)。3个处理金霉素的平均半衰期为26.86 d。土壤强力霉素的平均半衰期为58.89 d。由于高量处理的抗生素降解速率快于低量处理,两种抗生素的半衰期均为4%处理明显短于低量处理。
|
土壤过氧化氢酶在生物氧化过程中起分解过氧化氢的作用,其活性用于表征土壤生物氧化过程的强弱,并且与土壤肥力有着重要的关系[21-22]。施入猪粪后土壤酶活性随时间变化的趋势如图 2所示。CK土壤在360 d内过氧化氢酶活性变化较小,其值在(0.01±0.00)~(0.04±0.00)mL 0.1 mol·L-1 KMnO4·g-1·min-1之间波动,这可能是由于土壤中的绝大部分微生物处于休眠状态导致的[23]。在0~80 d,土壤过氧化氢酶活性随猪粪用量增加而提高,从80 d开始至培养结束,施入1%和2%猪粪处理的土壤过氧化氢酶活性较为接近,但施加4%猪粪处理的过氧化氢酶活性在培养期间均显著高于两个低量处理。培养结束时,4%处理土壤的过氧化氢酶活性分别是CK、1%和2%处理的8.2、8.6倍和3.9倍。
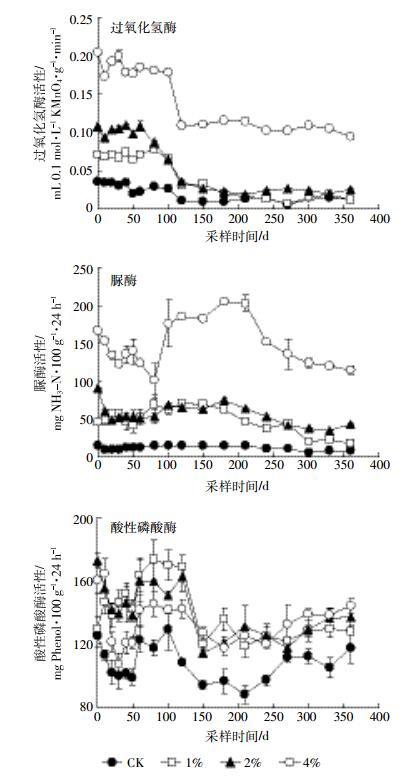
|
| 图 2 不同用量猪粪处理土壤酶活性的变化 Figure 2 Changing trend of enzyme activities in soils applied with various rates of pig manure |
土壤脲酶是唯一对尿素的转化具有重要影响的酶[22],能够催化尿素分解生成氨、二氧化碳和水,对提高氮素利用率及促进土壤氮素循环具有重要作用[24]。CK处理土壤脲酶活性在培养期间变化较小,在(5.17±1.45)~(14.55±1.04)mg NH3-N·100 g-1·24 h-1范围内波动。施肥处理可显著提高土壤脲酶活性(P < 0.05),脲酶活性为CK的3.2~11.8倍。施加1%和2%猪粪处理的脲酶在培养期间活性均接近,而且变化幅度均较小。4%猪粪处理在培养期间呈现下降-上升-下降的规律,但至培养结束时仍显著高于其他处理,分别为CK、1%和2%处理的14.4、6.6倍和2.6倍。
磷酸酶能促进有机磷化合物的分解,提高土壤磷素的有效性,为植物提供有效磷素,可以表征土壤磷状况[15, 25]。培养期间,CK处理土壤酸性磷酸酶活性在(88.47±5.55)~(129.08±12.62)mg Phenol·100 g-1·24 h-1之间波动。所有处理土壤酸性磷酸酶活性培养期间变化规律相似,均呈现下降-上升的变化规律,且CK处理在培养期间酸性磷酸酶的活性始终小于施加猪粪处理。因此,施加猪粪可以提高土壤中酸性磷酸酶的活性,至培养结束时,除1%处理,其他两个施肥处理的酸性磷酸酶活性均显著高于CK处理(P < 0.05)。
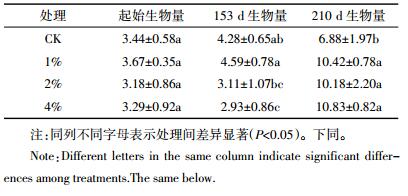
2.3 施用猪粪对荔枝生长影响从表 5荔枝植株生物量可以看出,在第153 d收获时,施加猪粪并未明显提高荔枝植株的生物量,当猪粪用量提高到4%时生物量显著降低。有报道指出,禽畜粪中的抗生素、重金属等物质通过抑制植株根系的生长,进而抑制植株对养分的吸收,从而降低了植株的生物量[26-28]。试验所用猪粪2种抗生素和Cu、Zn含量均较高(表 2),参照《德国腐熟堆肥限量标准》(Cu≤100 mg·kg-1,Zn≤400 mg·kg-1),本试验所用猪粪Cu、Zn含量约为该标准的8倍,至153 d时土壤仍有一定含量的金霉素和强力霉素(图 1),且高用量处理残留量高于低用量处理。因此,猪粪施用量较高的处理可能是在一定程度上通过抑制根系的生长进而抑制荔枝植株的生长。同时,从荔枝苗移栽到第153 d收获,正值广州冬春季节,温度低,不利于植物根系的生长。因此,即使猪粪中含有充足的氮磷钾等养分元素,前期也难以被植株充分吸收,从而未能表现出促进植株生长的作用。第210 d时,3个添加猪粪处理荔枝植株生物量十分接近,均显著高于对照。由此可见,随施入时间延长,土壤抗生素的含量逐渐降低(图 1),对荔枝植株的抑制作用变小,同时猪粪的氮磷钾等养分元素可为植株提供充足的养分[29],因此猪粪在后期逐步表现出促进荔枝生长的作用。
|
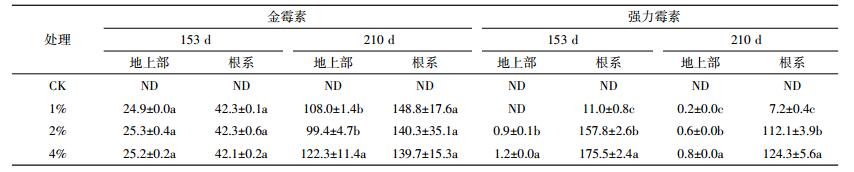
CK处理荔枝植株不同收获期地上部和根系均未检出抗生素(表 6)。在153 d时,施用猪粪处理荔枝植株地上部和根系金霉素含量分别为(24.9±0.0)~(25.3±0.4)μg·kg-1和(42.1±0.2)~(42.3±0.1)μg·kg-1,处理间含量均极为接近。在210 d收获时,地上部金霉素含量在(99.4±4.7)~(122.3±11.4)μg·kg-1之间,4%处理显著高于1%和2%处理;但荔枝根系金霉素含量则差异不大,在(139.7±15.3)~(148.8±17.6)μg·kg-1范围内。210 d植株地上部和根系金霉素含量均为153 d的数倍,表明随猪粪施入时间延长及荔枝的生长,荔枝吸收累积金霉素能力显著提高。
|
除153 d收获的1%处理荔枝植株地上部未检出强力霉素外,两个收获时间其他施肥处理植株均检出强力霉素。在153 d时,4%处理地上部强力霉素含量(1.2±0.0)μg·kg-1,显著高于2%处理的含量(0.9±0.1)μg·kg-1。随猪粪用量提高,荔枝植株根系强力霉素含量显著提高。2%和4%处理的根系强力霉素含量为1%处理的十数倍。至210 d收获时,荔枝植株地上部和根系强力霉素含量反而比153 d时有所降低,但仍然表现出随猪粪用量增加而显著提高的规律。这说明荔枝吸收强力霉素能力随土壤强力霉素含量提高而加强,但其含量容易被生物量稀释而有所降低。
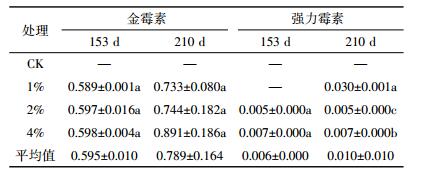
对两种抗生素在植株体内向上转移的能力进行比较可知(表 7),金霉素和强力霉素的转移系数分别为0.595~0.789和0.010,表明金霉素在植株体内向上转移的能力较强,且极显著强于强力霉素。长期施用含金霉素和强力霉素的粪肥,造成荔枝树体累积金霉素的风险相对更大。
|
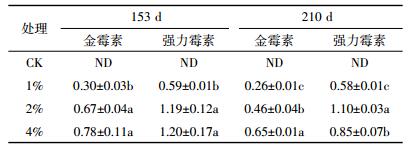
盆栽荔枝收获后,施用猪粪处理土壤仍然出现了两种抗生素的残留(表 8)。在153 d时,添加1%处理土壤残留的金霉素和强力霉素含量分别为(0.30±0.03)mg·kg-1和(0.59±0.01)mg·kg-1,2%和4%处理土壤中残留的金霉素和强力霉素含量显著高于1%处理,但两者差异不显著;至210 d,施用猪粪处理土壤累积的两种抗生素比153 d时有不同程度下降,这是由于荔枝植株吸收了更多的抗生素及抗生素降解造成的(图 1)。除4%处理土壤强力霉素外,土壤累积的抗生素仍随猪粪用量的增加而显著提高(P < 0.05)。
|
培养试验结果表明,虽然猪粪中含有一定量的抗生素,但施入猪粪仍可显著提高土壤3种酶活性,而且这种促进作用随猪粪用量的增加而提高。同时,由表 9可知,猪粪施用量为1%和2%的处理,3种酶活性与土壤金霉素和强力霉素含量显著正相关。有研究表明,外源添加1~300 mg·kg-1的金霉素和四环素溶液到土壤,可显著抑制土壤磷酸酶活性(P < 0.05),且抑制率随抗生素浓度的增加而增加[30]。另外,Liu等[12]发现,外源添加金霉素在第1 d可显著提高土壤中脲酶的活性,随后显著抑制了脲酶的活性,至12 d时抑制率最高可达64.4%。Bansal[13]也报道土壤酶的抑制率与外源添加四环素的含量呈正比。这些结果与本试验结果并不相同,差别在于本试验中抗生素来源于猪粪,而Bansal[13]和Liu等[12]直接将抗生素溶液与土壤混合进行研究。如表 2所示,猪粪有机质含量高,而且含有一定量的氮磷钾等养分,添加猪粪后增加了微生物可利用的碳源[19],因而提高了微生物数量,从而提高了土壤酶的活性[14, 31]。因此,即使猪粪中含有抗生素,施入猪粪也并未对土壤酶活性产生抑制作用。Chen等[14]比较了抗生素(土霉素)直接添加入土壤、抗生素与猪粪同时加入土壤及含抗生素的猪粪施入土壤对土壤酶活性的影响,结果表明,单施土霉素的土壤在100 d内脲酶、碱性磷酸酶活性和过氧化氢酶活性均变化不大,而施用含土霉素的猪粪以及猪粪和土霉素混合施用的处理土壤中脲酶、碱性磷酸酶活性和过氧化氢酶活性均高于单施抗生素处理,而且3种方式进入土壤的抗生素半衰期也存在较大差异。实际生产中,抗生素通常是随粪便进入土壤[32],因此研究兽用抗生素的生态环境效应,使用含抗生素的粪肥开展研究,更加符合实际生产情况。

|
土壤培养和荔枝盆栽试验结果表明,来自猪粪的四环素类抗生素虽然可在土壤中降解,但在土壤培养结束时及荔枝植株收获后,仍然有一定量的残留。研究表明,禽畜粪的排放及施用是土壤抗生素抗性基因面源污染的主要来源[33]。粪肥中抗生素进入农田后,会对土壤微生物耐药性产生压力,从而诱导出抗生素抗性基因,对土壤环境产生威胁[34]。至于土壤抗性基因是否可以通过粪肥-土壤-作物的方式传递到人类食物链,则是一个值得深入研究的大课题。
根据土壤培养试验结果,如果粪肥施用量较低(如1%和2%处理),四环素类抗生素在土壤的半衰期更长,被作物吸收的时间将会越长,如荔枝植株吸收金霉素能力随时间延长而显著提高。如果提高粪肥用量,虽然可以加快抗生素在土壤的降解,但在短期内明显提高了抗生素的供应量,也可能导致作物吸收更多的抗生素,如荔枝植株根系153 d时强力霉素含量明显高于210 d时。另外,不同作物对抗生素吸收能力存在较大差异,如将含有金霉素和泰乐霉素的猪粪施入土壤,洋葱、玉米和卷心菜均可吸收来自猪粪的金霉素,但难以吸收泰乐霉素[10]。因此,作物对粪肥中抗生素的吸收和累积情况不仅与粪肥中抗生素的含量有关,还与作物和抗生素的种类有关。
本研究土壤培养试验和盆栽试验时间短,尚不能完全真实反应粪肥施入果园土壤后抗生素在土壤的累积及被果树实际吸收的能力。但是,本研究结果表明,粪肥施入土壤一年后,随粪肥进入土壤的抗生素仍然在土壤累积,荔枝植株可以吸收和向上运输金霉素和强力霉素,且金霉素相对于强力霉素向上转移能力更强。四环素类抗生素作为人畜共用的抗生素,长期摄入可能导致人体耐药性的产生[35]。因此,今后需要进行田间长期定位试验,研究粪肥中抗生素在荔枝果实可能累积的风险。
4 结论(1)培养一年后猪粪中金霉素和强力霉素在土壤中的降解率分别在(88.3%±0.6%)~(95.6%±0.9%)和(76.6%±5.6%)~(88.9%±1.8%)之间,两种抗生素在土壤中的残留量均为高用量处理>低用量处理,因而长期大量施用猪粪可能存在抗生素在土壤中累积的风险。
(2)虽然猪粪中含有一定量的抗生素,但施入猪粪可提高土壤过氧化氢酶、脲酶、酸性磷酸酶的活性,且当猪粪施用量为1%和2%时,土壤3种酶活性与金霉素和强力霉素含量显著正相关(P < 0.05)。
(3)荔枝植株可吸收来自猪粪的金霉素和强力霉素,且金霉素相对于强力霉素向上转移能力更强。
| [1] |
李祥云, 宋朝玉, 王瑞英, 等. 不同畜禽粪肥及不同用量对大葱生长的影响[J]. 中国土壤与肥料, 2006(6): 45-47. LI Xiang-yun, SONG Chao-yu, WANG Rui-ying, et al. Effect of different kinds of animal manures and quantity on growth of scallion[J]. Soil and Fertilizer Sciences in China, 2006(6): 45-47. DOI:10.11838/sfsc.20060612 |
| [2] |
全国农业技术推广服务中心. 中国有机肥料养分志[M]. 北京: 中国农业出版社, 1999, 5-17. The National Agro-Tech Extension and Service Center(NATESC). Records of nutrients in organic fertilizer in China[M]. Beijing: China Agriculture Press, 1999, 5-17. |
| [3] |
Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. |
| [4] |
Kang D H, Gupta S, Rosen C, et al. Antibiotic uptake by vegetable crops from manure-applied soils[J]. Journal of Agricultural and Food Chemistry, 2013, 61(42): 9992-10001. DOI:10.1021/jf404045m |
| [5] |
Chen Y S, Zhang H B, Luo Y M, et al. Occurrence and assessment of veterinary antibiotics in swine manures:A case study in East China[J]. Chinese Science Bulletin, 2012, 57(6): 606-614. DOI:10.1007/s11434-011-4830-3 |
| [6] |
Zhang H B, Luo Y M, Wu L H, et al. Residues and potential ecological risks of veterinary antibiotics in manures and composts associated with protected vegetable farming[J]. Environmental Science and Pollution Research, 2015, 22(8): 5908-5918. DOI:10.1007/s11356-014-3731-9 |
| [7] |
Hou J, Wan W N, Mao D Q, et al. Occurrence and distribution of sulfonamides, tetracyclines, quinolones, macrolides, and nitrofurans in livestock manure and amended soils of Northern China[J]. Environment Science and Pollution Research, 2015, 22(6): 4545-4554. DOI:10.1007/s11356-014-3632-y |
| [8] |
Wu L E, Pan X, Chen L K, et al. Occurrence and distribution of heavy metals and tetracyclines in agricultural soils after typical land use change in East China[J]. Environmental Science and Pollution Research, 2013, 20(12): 8342-8354. DOI:10.1007/s11356-013-1532-1 |
| [9] |
吴小莲, 向垒, 莫测辉, 等. 长期施用粪肥蔬菜基地蔬菜中典型抗生素的污染特征[J]. 环境科学, 2013, 34(6): 2442-2447. WU Xiao-lian, XIANG Lei, MO Ce-hui, et al. Concentrations of antibiotics in vegetables from manure-mended farm[J]. Environmental Science, 2013, 34(6): 2442-2447. |
| [10] |
Kumar K, Gupta S C, Baidoo S K, et al. Antibiotic uptake by plants from soil fertilized with animal manure[J]. Journal of Environmental Quality, 2005, 34(6): 2082-2085. DOI:10.2134/jeq2005.0026 |
| [11] |
闫雷, 毕世欣, 赵启慧, 等. 土霉素及镉污染对土壤呼吸及酶活性的影响[J]. 水土保持通报, 2014, 34(6): 101-108. YAN Lei, BI Shi-xin, ZHAO Qi-hui, et al. Effect of oxytetracycline and Cd pollution on soil respiration and enzyme activiy[J]. Bulletion of Soil and Water Conservation, 2014, 34(6): 101-108. |
| [12] |
Liu B, Li Y, Zhang X, et al. Effects of chlortetracycline on soil microbial communities:Comparisons of enzyme activities to the functional diversity via Biolog EcoPlatesTM[J]. European Journal of Soil Biology, 2015, 68: 69-76. DOI:10.1016/j.ejsobi.2015.01.002 |
| [13] |
Bansal O. Effects of tetracycline son soil enzyme activities in an alluvial soil[J]. British Journal of Medicine and Medical Research, 2015, 5(8): 1007-1016. DOI:10.9734/BJMMR |
| [14] |
Chen G X, He W W, Wang Y, et al. Effect of different oxytetracycline addition methods on its degradation behavior in soil[J]. Science of the Total Environment, 2014, 479/480(2): 241-246. |
| [15] |
关松荫. 土壤酶及其研究方法[M]. 北京: 农业出版社, 1986. GUAN Song-yin. Soil enzyme and its research methods[M]. Beijing: Agriculture Press, 1986. |
| [16] |
余华荣, 周灿芳, 万忠, 等. 2011年广东荔枝产业发展现状分析[J]. 广东农业科学, 2012, 39(4): 16-17. YU Hua-rong, ZHOU Can-fang, WAN Zhong, et al. Analysis of Guangdong litchi industry development in 2011[J]. Guangdong Agricultural Sciences, 2012, 39(4): 16-17. |
| [17] |
姚丽贤. 我国荔枝养分管理技术应用与需求调研报告[J]. 荔枝科技通讯, 2009(3): 49-50. YAO Li-xian. Investigation report on application and demand of litchi nutrient management technology in China[J]. Lychee Newsletter, 2009(3): 49-50. |
| [18] |
李建国. 荔枝学[M]. 北京: 中国农业出版社, 2008, 412-413. LI Jian-guo. The litchi[M]. Beijing: China Agriculture Press, 2008, 412-413. |
| [19] |
章明奎, 刘兆云. 猪粪和土霉素对不同肥力土壤微生物数量及活性的影响[J]. 应用生态学报, 2009, 20(11): 2790-2798. ZHANG Ming-kui, LIU Zhao-yun. Effects of pig manure and oxytetracycline on microbial number and activity in soils with different fertility levels[J]. Chinese Journal of Applied Ecology, 2009, 20(11): 2790-2798. |
| [20] |
Kong W D, Zhu Y G, Fu B J, et al. The veterinary antibiotic oxytetracycline and Cu influence functional diversity of the soil microbial community[J]. Environmental Pollution, 2006, 143(1): 129-137. DOI:10.1016/j.envpol.2005.11.003 |
| [21] |
罗影, 王立光, 陈军, 等. 不同种植模式对甘肃中部高寒区胡麻田土壤酶活性及土壤养分的影响[J]. 核农学报, 2017, 31(6): 1185-1191. LUO Ying, WANG Li-guang, CHEN Jun, et al. Effects of different flex cropping modes on soil enzyme activities and soil nutrients in the cold area of middle part of Gansu[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(6): 1185-1191. DOI:10.11869/j.issn.100-8551.2017.06.1185 |
| [22] |
周礼恺. 土壤酶学[M]. 北京: 科学出版社, 1987, 228-254. ZHOU Li-kai. Soil enzymology[M]. Beijing: Science Press, 1987, 228-254. |
| [23] |
Thiele-Bruhn S, Beck I. Effects of sulfonamide and tetracycline antibiotics on soil microbial activity and microbial biomass[J]. Chemosphere, 2005, 59(4): 457-465. DOI:10.1016/j.chemosphere.2005.01.023 |
| [24] |
黄继川, 彭智平, 于俊红, 等. 施用玉米秸秆堆肥对盆栽芥菜土壤酶活性和微生物的影响[J]. 植物营养与肥料学报, 2010, 16(2): 348-353. HUANG Ji-chuan, PENG Zhi-ping, YU Jun-hong, et al. Impacts of applying corn-straw compost on microorganisms and enzyme activities in pot soil cultivated with mustard[J]. Plant Nutrition and Fertilizer Science, 2010, 16(2): 348-353. DOI:10.11674/zwyf.2010.0213 |
| [25] |
刘建国, 张伟, 李彦斌, 等. 新疆绿洲棉花长期连作对土壤理化性状与土壤酶活性的影响[J]. 中国农业科学, 2009, 42(2): 725-733. LIU Jian-guo, ZHANG Wei, LI Yan-bin, et al. Effects of long-term continuous cropping system of cotton on soil physical-chemical properties and activities of soil enzyme in oasis in Xinjiang[J]. Scientia Agricultura Sinica, 2009, 42(2): 725-733. |
| [26] |
Chibuike G U, Obiora S C. Heavy metal polluted soils:Effect on plants and bioremediation methods[J]. Applied and Environmental Soil Science, 2014, 1-12. |
| [27] |
Lu X, Gao Y, Luo J, et al. Interactive effects of tetracyclines and copper on plant growth and nutrient uptake by Eichhornia crassipes[J]. Clean-Soil Air Water, 2016, 44(1): 96-104. DOI:10.1002/clen.v44.1 |
| [28] |
Pan M, Chu L M. Phytotoxicity of veterinary antibiotics to seed germination and root elongation of crops[J]. Ecotoxicology & Environmental Safety, 2016, 126: 228-237. |
| [29] |
万盼, 刘芸, 黄小辉, 等. 施有机肥对油桐幼苗生长及其土壤养分含量的影响[J]. 中南林业科技大学学报, 2016, 36(3): 28-32. WAN Pan, LIU Yun, HUANG Xiao-hui, et al. Effects of organic manure on growth and soil nutrients in tung oil tree seedlings[J]. Journal of Central South University of Forestry & Technology, 2016, 36(3): 28-32. |
| [30] |
Liu F, Ying G G, Tao R, et al. Effects of six selected antibiotics on plant growth and soil microbial and enzymatic activities[J]. Environmental Pollution, 2009, 157(5): 1636-1642. DOI:10.1016/j.envpol.2008.12.021 |
| [31] |
Liang Q, Chen H Q, Gong Y S, et al. Effects of 15 years of manure and mineral fertilizers on enzyme activities in particle-size fractions in a North China Plain soil[J]. European Journal of Soil Biology, 2014, 60: 112-119. DOI:10.1016/j.ejsobi.2013.11.009 |
| [32] |
Hamscher G, Sczesny S, Abuqare A, et al. Substances with pharmacological effects including hormonally active substances in the environment:Identification of tetracyclines in soil fertilized with animal slurry[J]. Dtw Deutsche Tierärztliche Wochenschrift, 2000, 107(8): 332-334. |
| [33] |
Resende J A, Silva V L, Rocha de Oliveira T L, et al. Prevalence and persistence of potentially pathogenic and antibiotic resistant bacteria during anaerobic digestion treatment of cattle manure[J]. Bioresource Technology, 2014, 153(2): 284-291. |
| [34] |
Kang Y J, Hao Y Y, Shen M, et al. Impacts of supplementing chemical fertilizers with organic fertilizers manufactured using pig manure as a substrate on the spread of tetracycline resistance genes in soil[J]. Ecotoxicology and Environmental Safety, 2016, 130: 279-288. DOI:10.1016/j.ecoenv.2016.04.028 |
| [35] |
朱永官, 欧阳纬莹, 吴楠, 等. 抗生素耐药性的来源与控制对策[J]. 中国科学院院刊, 2015, 30(4): 509-516. ZHU Yong-guan, OUYANG Wei-ying, WU Nan, et al. Antibiotic resistance:Sources and mitigation[J]. Bulletin of Chinese Academy of Sciences, 2015, 30(4): 509-516. |
 2017, Vol. 36
2017, Vol. 36