文章信息
- 王雨晴, 陈香碧, 董明哲, 冯书珍, 胡亚军, 苏以荣, 葛体达, 张振华, 李巧云
- WANG Yu-qing, CHEN Xiang-bi, DONG Ming-zhe, FENG Shu-zhen, HU Ya-jun, SU Yi-rong, GE Ti-da, ZHANG Zhen-hua, LI Qiao-yun
- 红壤丘陵区旱地和水旱轮作地土壤中纤维素降解功能微生物群落特征
- Characteristics of cellulose-degrading microbial communities in upland and paddy-upland rotation land soils in red soil hilly region
- 农业环境科学学报, 2017, 36(10): 2071-2079
- Journal of Agro-Environment Science, 2017, 36(10): 2071-2079
- http://dx.doi.org/10.11654/jaes.2017-0493
文章历史
- 收稿日期: 2017-04-05
2. 中国科学院亚热带农业生态研究所, 亚热带农业生态重点实验室, 长沙 410125;
3. 广西科技大学, 广西 柳州 545006;
4. 湖南农业大学南方粮油作物协同创新中心, 长沙 410128
2. The Key Laboratory of Subtropical Agro-Ecology, Institute of Subtropical Agriculture, The Chinese Academy of Sciences, Changsha 410125, China;
3. Guangxi University of Science and Technology, Liuzhou 545006, China;
4. Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China, Hunan Agricultural University, Changsha 410128, China
纤维素是D-葡萄糖以β-1,4糖苷键联结而成的线形大分子多糖,大约30个糖链合成一个小纤维单元,然后聚集成微纤维,最后聚集成纤维。纤维素是地球上含量最丰富的碳水化合物,占到植物干重的35%~50%[1]。自然条件下,纤维素通过植物凋落物进入土壤系统,参与土壤碳循环和碳固定过程。农田是最活跃的土壤碳库之一,秸秆还田是农田土壤固碳以及生产力维持的重要措施[2]。作为秸秆中含量最高的组分,纤维素在农田土壤碳转化积累过程中占有非常重要的地位。
天然纤维素的微生物降解机理,普遍接受的理论——协同理论认为纤维素酶对纤维素的降解过程是:内切葡聚糖酶首先进攻纤维素的非晶区,形成外切葡聚糖纤维二糖水解酶需要的新的游离末端,然后外切纤维素酶从多糖链末端切下纤维二糖单位,β-葡萄糖苷酶再水解纤维二糖单位形成葡萄糖[3]。纤维二糖水解酶是纤维素降解的一种重要的外切酶,常被用于表征纤维素降解的关键酶[4-5]。不同微生物分泌酶的编码基因可能不同,如纤维二糖水解酶的编码基因有真菌cbhⅠ、cbhⅡ、细菌cel5等[6-7]。其中,cbhⅠ基因编码的外切葡聚糖酶(CBHⅠ酶)负责切割纤维素分子还原端糖苷键。目前,cbhⅠ已被国内外许多学者广泛用于指示纤维素降解的微生物功能基因[5, 8-9]。以往,环境样品中纤维素微生物降解过程研究主要依赖于纯培养技术且针对单个菌株。研究人员已从不同农田生态系统中分离到降解纤维素的细菌和真菌,例如:景音娟等[10]发现,秸秆还田土壤中纤维素降解菌Streptomycetaceae、Flavobacterium、Sphingobium相对丰度明显多于对照处理;傅筱冲等[11]从稻田土壤中分离的三种纤维素降解真菌:镰刀菌Fusarium sp,青霉菌Penicillium sp,枝顶孢霉菌Acremonium sp。然而,自然界中99%以上的微生物不可纯培养,采用基于PCR扩增的分子生物学技术(T-RFLP、DGGE、克隆、高通量测序)可较为全面地反映环境样品中降解纤维素的微生物功能群[7]。基于T-RFLP技术的研究发现,长期不同施肥处理下(矿质肥、粪肥)纤维二糖水解酶活性与cbhⅠ基因多样性呈显著正相关[5]。基于RFLP技术的研究发现,我国黄淮海平原典型潮土中纤维素降解菌(cbhⅠ基因)分别属于Basidiomycota(担子菌门)和Ascomycota(子囊菌门)[9]。
本研究依托于亚热带红壤丘陵区的长期定位施肥试验,选择两种土地利用方式(旱地和水旱轮作地)下两种施肥模式(单施化肥与秸秆还田配施化肥)的农田生态系统为研究对象,研究红壤丘陵区旱地和水旱轮作地土壤中纤维素降解功能微生物群落特征,探索纤维素含量与纤维二糖水解酶、cbhⅠ基因丰度的关系,为揭示农田土壤有机质中易分解组分(纤维素)转化的微生物机制提供基础数据。
1 研究地区与研究方法 1.1 样地描述与试验布置长期定位试验点位于湖南省桃源县盘塘镇(29°13′48″N,111°31′48″E),属中亚热带北缘的红壤丘陵区,为亚热带湿润季风气候,年均气温16.8 ℃,年均降雨量1230 mm,土壤为黏性土,成土母质为第四纪红土。
长期定位试验前,试验点由杉木为主的森林植被覆盖。2000年,中国科学院亚热带农业生态研究所建立了旱地和水旱轮作地长期定位施肥试验,两个试验点相距约50 m。2013年4月23日,选取两种土地利用方式下的单施化肥(NPK:以尿素、过磷酸钙及氯化钾施用N、P、K分别为224、52、174 kg·hm-2·a-1)和秸秆还田配施化肥处理(NPKS:在秸秆还田的基础上,以尿素和过磷酸钙补充不足的氮和磷)[12]。处理间保持N、P、K总量一致,每种处理4个重复,按随机区组设计排列。旱地每个小区面积为23.3 m2、水旱轮作地的每个小区面积为22.4 m2,小区间用水泥板隔离(埋入深度≥30 cm)。旱地采用红薯-油菜轮作、水旱轮作地则为玉米-水稻-绿肥(紫云英)轮作,根据作物需求一年内进行基肥和追肥的施用[13]。
于2013年4月25日在每个小区按“之”字型打入5个PVC管(高35 cm、直径25 cm、入土深度28 cm),将其中表层土壤(0~15 cm)取出后,与肥料或者秸秆混匀后再回填PVC管内,略压实。PVC管内肥料或者秸秆的添加量根据PVC管内土壤面积占小区面积的百分比对应施入相应小区施肥量的一半,其中NPKS处理需将玉米秸秆灭菌并剪碎至长度为1 cm左右,配合化肥与土壤混合。施肥后用尼龙网对PVC管进行封口以防试验过程中外界植物凋落物进入。
1.2 样品采集与处理以2000年试验点本底土壤样品代表施肥处理前;于2013年4月23日进行样品采集,代表长期(13年)施肥处理后。随后打入PVC管,并于施肥处理后第3 d开始进行每3个月一次的周年季节性采样,采样时间分别为2013年4月28日、7月28日、10月28日以及2014年1月28日和4月28日。对每个小区进行土样采集(采样深度为15 cm,每个PVC管中采集一土钻)并混合作为一个土样(约150 g),样品分为三部分:一部分经自然风干后磨细过筛用于纤维素含量分析,第二部分保存于4 ℃用于酶活性分析,第三部分保存于-80 ℃冰箱用于微生物分子生物学分析。经分析,2000年旱地和水旱轮作地试验点本底土壤中纤维素含量分别为0.98、0.76 g·kg-1干土。
1.3 研究方法 1.3.1 土壤纤维素含量的测定总碳水化合物:取过80目土样1 g,加入12 mol·L-1硫酸,室温振荡16 h,加水稀释至1 mol·L-1,100 ℃冷凝回流5 h,冷却离心,取1 mL上清液用蒽酮-硫酸法测定还原糖含量。
稀酸水解碳水化合物:取过80目筛的土样1 g,加入10 mL 0.5 mol·L-1硫酸,采用冷凝回流方式,在80 ℃下水解24 h,取1 mL水解液用硫酸-蒽酮法测定还原糖量。
纤维素含量=总碳水化合物-稀酸水解碳水化合物。
1.3.2 酶活性的测定纤维二糖水解酶(CBH)活性采用荧光微孔板检测法测定[16],底物为4-MUB-β-D-cellobioside。土壤多酚氧化酶和过氧化物酶参考李振高等[17]的方法进行测定。
1.3.3 土壤微生物分子生物学分析 1.3.3.1 土壤微生物总DNA提取将存于-80 ℃土壤样品冷冻干燥后进行研磨并分装,采用FastDNA® Spin Kit for Soil试剂盒提取土壤微生物总DNA。
1.3.3.2 荧光定量PCR采用编码纤维二糖水解酶的功能基因cbhⅠ的引物Fung cbhⅠF/Fung cbhⅠR[6]进行荧光定量PCR扩增,目的基因长度为520 bp。扩增反应条件:94 ℃ 2 min;40个循环为94 ℃ 30 s,48 ℃ 45 s,72 ℃ 60 s;1个循环为95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s。扩增体系(10 μL)均为:5 μL SYBR Premix Ex Taq Ⅱ(2×,Takara),上游和下引物各0.4 μL(10 μmol·L-1),DNA模板1 μL(5 ng),ddH2O补至10 μL。对目的基因进行荧光定量PCR扩增的同时,以不同浓度梯度的含目的基因质粒DNA模板制作标准曲线。标准曲线的优劣取决于其扩增效率及R2值,扩增效率适用范围为90%~110%,R2须大于0.99,且标准曲线扩增熔解曲线应是单峰,并可作为DNA样品荧光定量的参照,以反映其扩增的专一性。每个样品3次重复,并设置阴性对照,以384孔板作为载体进行PCR扩增,所用仪器为ABI7900。
1.3.3.3 末端限制性片段长度多态性(T-RFLP)分析T-RFLP是基于不同目的基因片段限制性酶切长度多态性进行微生物种群结构研究的方法,被广泛应用于微生物群落结构分析。操作步骤如下:首先,以Fung cbhⅠF/Fung cbhⅠR为引物对提取的DNA进行PCR扩增,其中Fung cbhⅠF的5′端用6-FAM进行荧光标记。扩增体系(25 μL)为:2× PCR Premix(0.1U PrimeSTAR HS DNA Polymerase,0.5 mmol·L-1 dNTPs,Takara)12.5 μL,上游和下引物各10 pmol·L-1,DNA模板1 μL,ddH2O补至25 μL。其中cbh Ⅰ扩增程序为:94 ℃ 5 min,35个循环为94 ℃ 30 s,48 ℃ 45 s,72 ℃ 90 s;最后72 ℃延伸15 min。所有引物由上海英潍捷基贸易有限公司合成,PCR扩增反应采用Eppendorf Mastercycler(Gemany)。随后对PCR产物进行纯化,具体步骤为:将获得的PCR产物进行1.0%的琼脂糖凝胶电泳,然后在紫外条件下切取目的条带并利用琼脂糖凝胶回收试剂盒(TIANGEN)对其进行凝胶回收纯化。参照Fan等[5]的方法,选择Taq1酶作为cbhⅠ基因的限制性内切酶对纯化所得DNA进行酶切,反应条件及体系按说明书设置。将酶切产物送至上海桑尼生物科技有限公司(Sunny Biotechnology Co.,Shanghai)进行T-RFLP(末端限制性片段长度多样性)检测。
将检测所得T-RFLP图谱中相差1 bp以内的T-RFLPs(限制性酶切片段)作为同一个操作分类单元(OTU,operational taxonomic unit),OTU丰度用相对峰值表示,并去除OTU丰度百分比小于1%或长度小于50 bp的T-RFLPs。
1.3.3.4 克隆文库的构建以Fung cbhⅠF/Fung cbhⅠR为引物的PCR扩增产物(四个重复等体积混合)经1.5%的琼脂糖凝胶电泳后,采用Wizard SV Gel and PCR Clean-UP System试剂盒(Promega)回收目的片段;运用PGEM-T载体试剂盒(Promega)对回收的cbhⅠ基因目的片段(520 bp)进行克隆;挑取白色菌落用载体特异性引物Sp6和T7对克隆产物进行菌液PCR扩增,经电泳后每个样品筛选120个有预期片段的克隆子进行测序(华大基因),测序仪为ABI Prism 3100 Genetic Analyzer。获得的有效序列与GenBank数据库中已有序列进行比对,选取最高同源序列确定序列的微生物分类。本研究所获得的cbhⅠ基因代表序列已提交GenBank数据库,序列登录号为MF188259~MF188843。
1.4 数据分析方法运用SPSS 20.0软件对本研究同一时间点各处理的纤维素含量、纤维二糖水解酶活性、cbhⅠ基因丰度进行方差分析,相关图采用Excel 2013绘制。采用Sigmaplot 12.5软件对两种土地利用方式下纤维素含量与纤维二糖水解酶活性、cbhⅠ基因丰度与纤维二糖水解酶活性之间的关系进行回归分析并绘图。T-RFLP数据采用Primer 5.0进行群落相似性分析。
2 结果与分析 2.1 纤维素降解动态特征经连续13年定位施肥后,旱地土壤中纤维素含量略微上升(差异不显著),而水旱轮作地则略微下降,且均为NPKS处理显著高于NPK处理(P < 0.05)。就周年季节变化来看,施用NPKS后旱地和水旱轮作地纤维素含量分别由1.09、0.75 g·kg-1增至2.44、1.98 g·kg-1。3个月后,旱地和水旱轮作地土壤中纤维素新增含量的56%和100%被降解或被转化为其他形态;至6个月后,两种土地利用方式下农田土壤中纤维素含量均已降解到施肥前水平。施用NPK后,农田土壤中纤维素含量的周年季节变化幅度不大(图 1)。
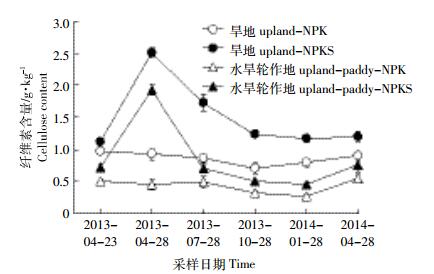
|
| 2013-04-23代表 13年长期施肥后;2013-04-08、2013-07-28、2013-10-28、2014-01-28、2014-04-28分别代表 2013年4月施肥处理后每间隔3个月采集一次样品 2013-04-23 on behalf of 13 years after long-term fertilization; 2013-04-08, 2013-07-28, 2013-10-28, 2014-01-28, 2014-04-28, respectively, in April 2013 after fertilization treatment every 3 months to collect a sample 图 1 不同处理下土壤中纤维素含量的周年动态变化 Figure 1 Dynamic of cellulose content in treated soils |
降解纤维素的功能酶纤维二糖水解酶活性为旱地>水旱轮作地(P < 0.01),同一土地利用方式下均以NPKS处理显著高于NPK处理(P < 0.05或P < 0.01,图 2)。
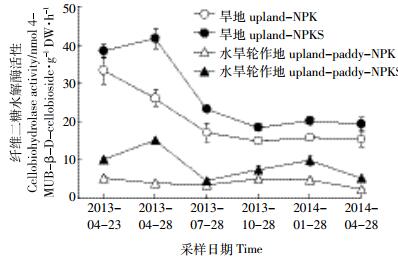
|
| 图 2 不同处理下土壤中纤维二糖水解酶活性动态变化 Figure 2 Dynamic of cellobiohydrolase activity in treated soils |
两种土地利用方式下纤维素含量与纤维二糖水解酶活性的动态变化回归分析结果表明,旱地和水旱轮作地中的纤维素含量与纤维二糖水解酶活性均呈线性正相关,其线性回归方程分别为y=10.65x+11.05(R2=0.34 P < 0.01)和y=2.77x+5.79(R2=0.47,P < 0.01)(图 3)。
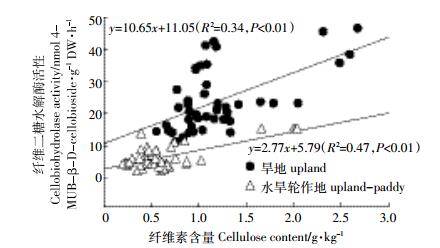
|
| 图 3 旱地和水旱轮作地中纤维素含量与纤维二糖水解酶活性的线性关系 Figure 3 Linear relationship between cellulose content and cellobiohydrolase activity in upland and upland-paddy rotation land soils |
2013年4月进行施肥处理前,旱地土壤中纤维素降解功能基因(cbhⅠ)丰度略高于水旱轮作地(图 4)。秸秆还田配施化肥(NPKS)后cbhⅠ丰度急剧上升(P < 0.05),其中水旱轮作地增幅最大,达到了施肥前4.4倍,旱地和水旱轮作地中cbhⅠ丰度分别在施肥处理6个月和3个月后降至施肥前水平,与纤维素含量变化基本一致(图 1和图 4)。NPK处理后,cbhⅠ基因丰度也出现一定程度的增长,之后随季节小幅波动,整个周年均以旱地高于水旱轮作地(图 4)。
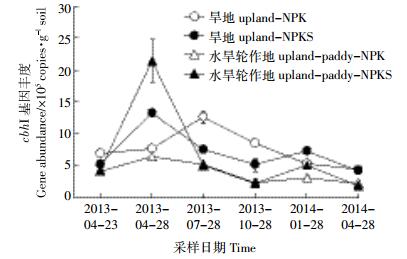
|
| 图 4 纤维素降解功能微生物群落丰度周年动态变化 Figure 4 Annual dynamic of the cellobiohydrolases genes abundance |
将两种土地利用方式下纤维二糖水解酶活性与cbhⅠ基因丰度的动态变化作回归分析,其结果表明,旱地和水旱轮作地中的纤维二糖水解酶活性与cbhⅠ基因丰度均呈线性正相关,其线性回归方程y=4.22+0.12x(R2=0.20,P < 0.01)和y=-0.63+0.89x(R2=0.47,P < 0.05)(图 5)。
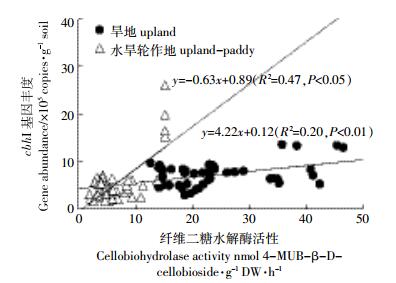
|
| 图 5 旱地和水旱轮作地中纤维二糖水解酶活性与cbhⅠ基因丰度的线性关系 Figure 5 Linear relationship between cellobiohydrolase activity and cbhⅠ gene abundance in upland and upland-paddy rotation land soils |
基于T-RFLP测序数据,对施用NPK和NPKS后两种土地利用方式的纤维素降解功能微生物(含cbhⅠ真菌)群落相似性进行聚类分析,结果表明:旱地和水旱轮作地分别聚为一簇;旱地的NPK和NPKS分别聚集在一起;在2013年和2014年的4月,水旱轮作地的NPK和NPKS处理群落相聚较近,而其他季节NPK和NPKS均相互交叉聚集(图 6)。
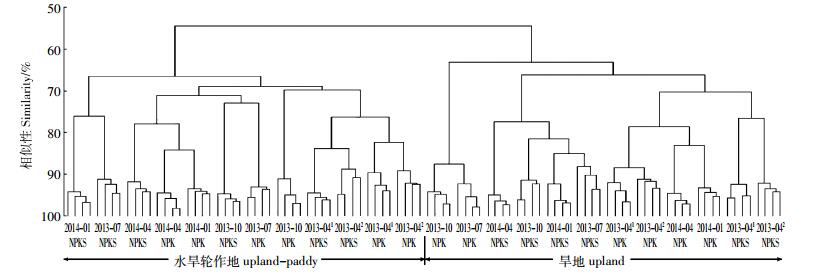
|
| 2013-041和2013-042分别表示2013年4月进行施肥处理前和施肥处理后 2013-041 and 2013-042 represent the day before and the day after fertilization in April 2013, respectively 图 6 纤维素降解微生物(含cbhⅠ基因的真菌)群落相似性 Figure 6 Similarity of fungal community containing cbhⅠ gene in the treated soils |
经克隆测序,本研究农田土壤中含cbhⅠ基因功能微生物主要属于担子菌门和子囊菌门,可分为五纲,分别为伞菌纲(担子菌门)和锤舌菌纲、粪壳菌纲、座囊菌纲及散囊菌纲(子囊菌门),其中伞菌和粪壳菌分别占总克隆库的22.9%~39.5%(平均为34.7%)、17.7%~42.3%(平均为28.5%),为优势类群(图 7)。此外,12.0%~29.8%的序列属于未知微生物。
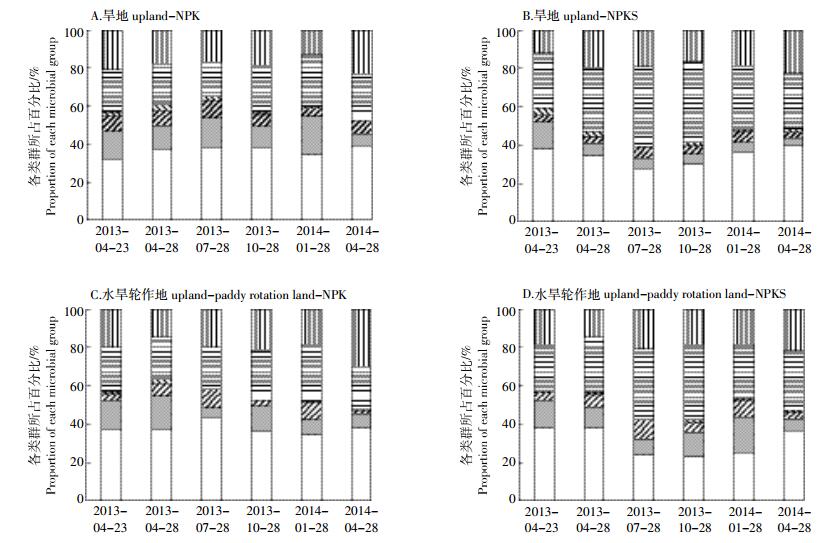
|
| 图 7 纤维素降解功能微生物群落结构周年动态变化 Figure 7 Annual dynamic of the microbial communities related to cellulose decomposition |
NPK施肥前和施肥后一年内,旱地和水旱轮作地土壤中纤维素降解微生物群落保持基本稳定。与NPK处理相比,NPKS处理下旱地和水旱轮作地伞菌总体比例分别由36.4%、37.8%降低至34.2%、30.6%,而粪壳菌分别由23.0%、24.6%增加至34.7%、31.5%(图 7)。与施肥处理前(2013年4月23日)相比,NPKS施肥后一年内旱地和水旱轮作地中纤维素降解优势菌伞菌比例呈先降低后增加的趋势,而粪壳菌则表现为先增加后降低。非优势菌散囊菌与粪壳菌有相似的趋势。
3 讨论 3.1 农田土壤中纤维素的降解特征长期(13年)秸秆还田后,旱地和水旱轮作地中纤维素含量未发生大量积累(旱地增加13%、水旱轮作地减少6%),说明农田土壤中纤维素不能以原始纤维素状态进行积累。本研究未采用同位素标记技术对纤维素去向进行追踪,因此纤维素有可能转化为其他形态(微生物生物量、可溶性有机质、腐殖质等)进行积累。周年季节变化来看,秸秆还田后旱地和水旱轮作地中纤维素在3个月和6个月即降至还田前水平。这表明,秸秆还田后土壤中纤维素会发生一段时间的快速降解,进而降解趋于缓滞、保持相对稳定状态。纤维素的这种动态过程与纤维素的存在形式密切相关:单独存在的纤维素分子在土壤中会被快速酶解,而一些包埋于木质素外壳中的纤维素分子降解则相当困难,使土壤中纤维素表现出先快后慢的降解特征[18]。水旱轮作地比旱地土壤中纤维素降解更快,其原因一方面可能是由于水分条件改变引起的土壤团聚体受损、黏土胶溶破坏了土壤结构[19],使水旱轮作地中纤维素分子稳定性可能不如旱地,从而更容易被降解;另一方面,水旱轮作地厌氧和好氧微生物更替过程中细胞溶解会释放出大量的氮和磷,显著提高了土壤活性微生物含量,加速了土壤微生物的代谢过程[20]。秸秆还田后(图 2),水旱轮作地中纤维二糖水解酶活性上升了51.9%,显著高于旱地土壤(增幅仅为8.2%),进一步证实水旱轮作地比旱地中纤维素降解潜力更大。
3.2 农田土壤中纤维素降解关键微生物及其丰度特征纤维素降解过程主要由微生物实现,而参与纤维素降解的微生物类群众多。因此,明确能指示纤维素降解的微生物功能基因是研究土壤中参与纤维素降解的微生物功能群首要前提。本研究中两种土地利用方式下纤维素含量与纤维二糖水解酶活性呈显著正相关,而编码纤维二糖水解酶的真菌cbhⅠ基因丰度与纤维二糖水解酶均呈现正相关(表2和表3),表明真菌cbhⅠ基因可较好地用于表征本研究供试土壤中参与纤维素降解/转化过程微生物功能群。需指出的是,该结果并不能说明供试农田土壤中纤维素的降解由真菌主导或者真菌比细菌贡献大。真菌和细菌群落对纤维素降解的贡献大小可通过下一步抑真菌/细菌实验予以验证[21]。
秸秆还田后土壤中cbhⅠ基因丰度均显著增长,旱地和水旱轮作地中cbhⅠ基因丰度则分别在施肥处理6和3个月后降至施肥前水平,与纤维素含量变化趋势一致(图 1和图 2)。这说明功能微生物数量的动态变化依赖于底物(纤维素)的丰缺。此外,秸秆中含有包括纤维素在内的多种有机物质,特别是一些小分子碳水化合物能极快地被糖苷酶降解产生葡萄糖,为微生物的繁殖提供能量保障,并通过释放纤维素酶进而降解纤维素[22-23]。另一方面,化肥(NPK)的输入也会激发纤维素降解功能菌的生长繁殖,增强土壤纤维素酶活性[24]。
3.3 农田土壤中纤维素降解关键微生物群落特征本研究中,旱地和水旱轮作地的纤维素降解微生物(含cbhⅠ基因)互相分离,两者的群落组成相似性小于60%(图 6),表明与施肥相比,土地利用方式是引起农田土壤中纤维素降解群落组成改变最主要的因素。水旱轮作地由于淹水-落干的反复交替,其土壤物理、化学环境频繁变动,造成微生物群落更替频繁,而旱地土壤环境相对稳定[25, 20]。两种施肥方式下,旱地土壤中功能真菌群落能够较好地分开,说明施肥对环境相对稳定的旱地土壤微生物群落影响较大;水旱轮作地除了在2013年和2014年的4月(距施肥的时间较远)外,其余时期NPK和NPKS处理交叉聚集,说明水旱轮作的淹水-落干的反复交替过程弱化了施肥对土壤微生物群落的影响。
目前,对于土壤生态系统中纤维素降解微生物群落的研究较少。Fontaine等[22]发现向不同土层土壤中添加纤维素后,微生物数量均显著上升,纤维素开始迅速降解。黄淮海平原典型潮土中含cbhⅠ基因的纤维素降解微生物群主要属于担子菌门和子囊菌门,且存在大量不可培养纤维素降解菌[9]。Fan等[5]研究表明,长期施肥下黑土玉米地土壤中未检测到含cel5基因的细菌,其纤维素降解功能微生物(含cbhⅠ基因)中伞菌、座囊菌、散囊菌、粪壳菌和未知菌比例分别为16.4%、19.7%、36.8%、15.1%、10.5%,且其纤维素的降解能力(纤维二糖水解酶活性)主要由含cbhⅠ基因的真菌群落结构及多样性决定。与上述黑土和潮土研究一致,红壤丘陵区农田土壤中纤维素降解菌也主要属于担子菌门和子囊菌门,但优势类群差异明显(图 7)。本研究红壤丘陵区旱地和水旱轮作地不同施肥处理下土壤中纤维素降解菌(含cbhⅠ基因)均以伞菌和粪壳菌占绝对优势,而在黑土和潮土中占绝对优势的散囊菌在本研究土壤中仅占各克隆库的2.9%~10.3%(平均为5.8%),可能是土壤类型不同带来的基本物理化学性质差异以及不同气候带引起多方面环境条件不同造成的。两种土地利用方式下,与施化肥相比,秸秆还田(NPKS处理)后6个月内,粪壳菌和散囊菌占克隆库比例增加(尤其是3个月内急剧增加),6个月以后其比例逐渐降低,与纤维素降解趋势刚好吻合(图 1和图 7)。基于粪壳菌(纲)为供试土壤中的优势纤维素降解功能菌(平均占NPKS处理克隆库总克隆子的33.1%),并且广泛存在于红壤丘陵区农田土壤中[26],我们推测本研究红壤丘陵区旱地和水旱轮作地土壤中纤维素降解过程可能主要由粪壳菌主导。但是,由于本研究获得的绝大部分粪壳菌(纲)与GenBank中已知分类的微生物序列相似性小于95%,无法获知其“属”、“种”分类信息,其在纤维素降解过程中的具体功能与机制有待后续深入研究。
4 结论(1)长期施肥后,旱地和水旱轮作地中纤维素含量未大量积累,且秸秆还田后3至6个月纤维素即被降解或转化为其他形态,降解速率以水旱轮作地快于旱地。
(2)纤维二糖水解酶活性与纤维素含量呈显著正相关,而真菌cbhⅠ基因丰度与纤维二糖水解酶呈线性正相关(P < 0.01或P < 0.05),功能基因cbhⅠ可用于指示本研究旱地和水旱轮作地土壤中降解纤维素的关键微生物群。
(3)聚类分析表明,旱地和水旱轮作地的纤维素降解微生物(含cbhⅠ基因)互相分离,即:与施肥相比,土地利用方式是引起土壤中纤维素降解群落组成改变最主要的因素。
(4)红壤丘陵区的两种土地利用方式下纤维素降解功能微生物以伞菌和粪壳菌占绝对优势,其中秸秆还田后的纤维素降解过程可能由粪壳菌主导。
| [1] |
单玉华, 蔡祖聪, 韩勇, 等. 淹水土壤有机酸积累与秸秆碳氮比及氮供应的关系[J]. 土壤学报, 2006, 43(6): 941-947. SHAN Yu-hua, CAI Zu-cong, HAN Yong, et al. Accumulation of organic acids in relation to C:N rations of straws and N application in flooded soil[J]. Acta Pedologica Sinica, 2006, 43(6): 941-947. DOI:10.11766/trxb200604300609 |
| [2] |
Schlesinger W H. Carbon sequestration in soils[J]. Science, 1999, 284(5423): 2095. DOI:10.1126/science.284.5423.2095 |
| [3] |
Lynd L R, Weimer P J, van Zyl W H, et al. Microbial cellulose utilization:Fundamentals and Biotechnology[J]. Microbiology & Molecular Biology Reviews, 2002, 66(3): 506-577. |
| [4] |
Jalak J, Väljamäe P. Mechanism of initial rapid rate retardation in cellobiohydrolase catalyzed cellulose hydrolysis[J]. Biotechnology & Bioengineering, 2010, 106(6): 871-883. |
| [5] |
Fan F, Li Z, Wakelin S A, et al. Mineral fertilizer alters cellulolytic community structure and suppresses soil cellobiohydrolase activity in a long-term fertilization experiment[J]. Soil Biology & Biochemistry, 2012, 55(6): 70-77. |
| [6] |
Edwards I P, Upchurch R A, Zak D R. Isolation of fungal cellobiohydrolase I genes from sporocarps and forest soils by PCR[J]. Applied & Environmental Microbiology, 2008, 74(11): 3481-3489. |
| [7] |
Pereyra L P, Hiibel S R, Prieto Riquelme M V, et al. Detection and quantification of functional genes of cellulose-degrading, fermentative, and sulfate-reducing bacteria and methanogenic archaea[J]. Applied and Environmental Microbiology, 2010, 76(7): 2192-2202. DOI:10.1128/AEM.01285-09 |
| [8] |
Phillips L A, Schefe C R, Fridman M, et al. Organic nitrogen cycling microbial communities are abundant in a dry Australian agricultural soil[J]. Soil Biology & Biochemistry, 2015, 86: 201-211. |
| [9] |
陈坤, 李传海, 朱安宁, 等. 长期保护性耕作对纤维素降解基因cbhI多样性的影响[J]. 土壤学报, 2015, 52(2): 406-413. CHEN Kun, LI Chuan-hai, ZHU An-ning, et al. Effect of long-term conservation tillage on diversity of cellulose degrading gene cbhI in fluvo-aquic soil[J]. Acta Pedologica Sinica, 2015, 52(2): 406-413. |
| [10] |
景音娟, 李传海, 朱安宁, 等. 耕作方式和秸杆还田对纤维素降解细菌多性的影响[J]. 土壤学报, 2016, 53(4): 1027-1036. JING Yin-juan, LI Chuan-hai, ZHU An-ning, et al. Effects of tillage and straw mulching on diversity of cellulose-decomposing bacteria in fluvo-aquic soil[J]. Acta Pedologica Sinica, 2016, 53(4): 1027-1036. |
| [11] |
傅筱冲, 袁林, 郭建军, 等. 从稻田土壤中快速筛选分离纤维素降解真菌[J]. 江西科学, 2015(6): 822-825. FU Xiao-chong, YUAN Lin, GUO Jian-jun, et al. Rapid screening of cellulose degradation fungus from paddy soil[J]. Jiangxi Science, 2015(6): 822-825. |
| [12] |
Zhu H, Wu J, Huang D, et al. Improving fertility and productivity of a highly-weathered upland soil in subtropical China by incorporating rice straw[J]. Plant and Soil, 2010, 331: 427-437. DOI:10.1007/s11104-009-0263-z |
| [13] |
冯书珍, 陈香碧, 何寻阳, 等. 不同土地利用方式及施肥措施对红壤木质素积累特性的影响[J]. 农业环境科学学报, 2015, 34(9): 1761-1768. FENG Shu-zhen, CHEN Xiang-bi, HE Xun-yang, et al. Effects of land use and fertilization on lignin accumulation in red soil[J]. Journal of Agro-Environment Science, 2015, 34(9): 1761-1768. DOI:10.11654/jaes.2015.09.019 |
| [14] |
Puget P, Angers D A, Chenu C. Nature of carbohydrates associated with water-stable aggregates of two cultivated soils[J]. Soil Biology and Biochemistry, 1998, 31(1): 55-63. DOI:10.1016/S0038-0717(98)00103-5 |
| [15] |
Yu H Y, Ding W X, Luo J F, et al. Long-term effect of compost and inorganic fertilizer on activities of carbon-cycle enzymes in aggregates of an intensively cultivated sandy loam[J]. Soil Use and Management, 2012, 28(3): 347-360. DOI:10.1111/sum.2012.28.issue-3 |
| [16] |
Saiya-cork K R, Sinsabaugh R L, Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology and Biochemistry, 2002, 34(9): 1309-1315. DOI:10.1016/S0038-0717(02)00074-3 |
| [17] |
李振高. 土壤与环境微生物研究方法[M]. 北京: 科学出版社, 2008. LI Zhen-gao. Soil and environmental microorganism research methods[M]. Beijing: Science Press, 2008. |
| [18] |
Saito M, Wada H, Takai Y. Development of a microbial community on cellulose buried in waterlogged soil[J]. Biology and Fertility of Soils, 1990, 9: 301-305. DOI:10.1007/BF00634105 |
| [19] |
Wang H, Guan D, Zhang R, et al. Soil aggregates and organic carbon affected by the land use change from rice paddy to vegetable field[J]. Ecological Engineering, 2014, 70: 206-211. DOI:10.1016/j.ecoleng.2014.05.027 |
| [20] |
Baldwin D S, Mitchell A M. The effects of drying and re-flooding on the sediment and soil nutrient dynamics of lowland river-floodplain systems:A synthesis[J]. River Research & Applications, 2000, 16(5): 457-467. |
| [21] |
丁龙君, 肖和艾, 吴金水, 等. 选择性抑菌剂对添加稻草红壤旱土团聚体磷素微生物转化的影响[J]. 应用生态学报, 2010, 21(7): 1759-1765. DING Long-jun, XIAO He-ai, WU Jin-shui, et al. Effects of selective microbial inhibitors on the microbial transformation of phosphorous in aggregates of highly weathered red soil with rice straw amendment[J]. Chinese Journal of Applied Ecology, 2010, 21(7): 1759-1765. |
| [22] |
Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply[J]. Nature, 2007, 450: 277-280. DOI:10.1038/nature06275 |
| [23] |
Fontaine S, Henault C, Aamor A, et al. Fungi mediate long term sequestration of carbon and nitrogen in soil through their priming effect[J]. Soil Biology & Biochemistry, 2011, 43(1): 86-96. |
| [24] |
Ai C, Liang G, Sun J, et al. Responses of extracellular enzyme activities and microbial community in both the rhizosphere and bulk soil to long-term fertilization practices in a fluvo-aquic soil[J]. Geoderma, 2012, 173(2): 330-338. |
| [25] |
胡亚林, 汪思龙, 颜绍馗. 影响土壤微生物活性与群落结构因素研究进展[J]. 土壤通报, 2006(1): 170-176. HU Ya-lin, WANG Si-long, YAN Shao-kui. Research advances on the factors influencing the activity and community structure of soil microorganism[J]. Chinese Journal of Soil Science, 2006(1): 170-176. |
| [26] |
He J Z, Zheng Y, Chen C R, et al. Microbial composition and diversity of an upland red soil under long-term fertilization treatments as revealed by culture-dependent and culture-independent approaches[J]. Journal of Soils and Sediments, 2008, 8(5): 349-358. DOI:10.1007/s11368-008-0025-1 |
 2017, Vol. 36
2017, Vol. 36




