文章信息
- 胡超, 王有宁, 郑足红, 章爱群, 胡红青
- HU Chao, WANG You-ning, ZHENG Zu-hong, ZHANG Ai-qun, HU Hong-qing
- 蒙脱石-壳聚糖复合物对磷吸附性能的研究
- Phosphate adsorption by composites of chitosan-saturated montmorillonite
- 农业环境科学学报, 2017, 36(10): 2086-2091
- Journal of Agro-Environment Science, 2017, 36(10): 2086-2091
- http://dx.doi.org/10.11654/jaes.2017-0402
文章历史
- 收稿日期: 2017-03-20
2. 华中农业大学资源与环境学院, 武汉 430070
2. College of Resources and Environment, Huazhong Agricultural University, Wuhan 430070, China
过量的磷(P)是引起水体富营养化的重要因素之一,控制水体中P含量是防治水体富营养化的重要手段。在P去除的方法中,吸附法因高效简便、运行可靠而备受研究者关注,各种廉价和天然吸附剂常被应用于P吸附的研究[1-2]。壳聚糖具有大量-NH2和-OH官能团,其复合材料常用于对N和P的去除,并表现出较好的吸附特性[2-5]。蒙脱石储量丰富,比表面积大并以内表面为主[6],是纳米复合物中使用最广泛的层状硅酸盐矿物[7-8]。蒙脱石因机械和化学稳定性强、廉价易得,成为可靠的支撑材料,并可降低蒙脱石-壳聚糖复合物(下文简称复合物)的成本[8]。包被在蒙脱石上的薄层壳聚糖能保持结合位点有效,同时其机械稳定性也得到增强。近年来,蒙脱石-壳聚糖复合物因其独特的结构和功能,在环境科学领域引起了广泛关注[9-12]。
复合物表面N原子上的自由电子对在pH近中性或弱酸性时可与阳离子型金属离子络合,吸附金属阳离子。另外,酸性条件下质子化的氨基具备阳离子特点,也可吸附阴离子型重金属或阴离子染料等[13-14]。An等[15]证实在pH为4.0和5.0时,Cr(Ⅵ)和As(Ⅴ)的最大吸附量分别可达到180、120 mmol·kg-1。虽然各种重金属的吸附报道较多,但磷酸盐在复合物上的吸附特性少见报道。本文研究蒙脱石-壳聚糖复合物对P的吸附特性,可为该绿色廉价吸附剂在P去除上的应用提供科学依据。
1 材料与方法 1.1 材料钠基蒙脱石的制备:钙基蒙脱石由美国德州南方粘土公司(Gonzales)提供。用NaCl溶液饱和钙基蒙脱石后,用去离子水反复清洗,直到无Cl-检出。所得样品-60 ℃冻干(VirTis Company,Gardiner,美国)保存。蒙脱石CEC为81 cmol·kg-1(Ca-Mg交换法),比表面积为790 m2·g-1(乙二醇-乙醚吸附法)。
复合物的制备:壳聚糖(分子量200~800 cP)购自美国Sigma-Aldrich公司,80%脱乙酰度,氨基葡萄糖单位分子量为161 g·mol-1。将1 g壳聚糖溶解到1 L 1%(体积比)HCl中,同时配制500 mL 1%(质量比)蒙脱石分散液。用0.1 mol·L-1 NaOH调节壳聚糖溶液pH到5.0。室温搅拌下,将500 mL壳聚糖溶液缓缓加入蒙脱石分散液中,持续搅拌12 h,分散液在9000 r·min-1离心30 min。弃去上清液,底泥与另500 mL壳聚糖溶液混匀,室温下搅拌12 h,离心。用去离子水洗2次,-60 ℃冻干(FD5-3T,SIM,美国),研磨过60目筛后储存备用[16-17]。
磷酸二氢钾(优级纯)在110 ℃烘至恒重,冷却后配成不同含P量的吸附质溶液。其他化学药剂(分析纯)均购自国药集团。采用艾科浦超纯水系统制备实验用水,电导率 < 2.0 μS·cm-1。
1.2 方法 1.2.1 复合物的表征将复合物样品研磨过140目筛,采用粉末压片法在X射线衍射仪(XRD)(Bruker D8 Advance,德国)上记录衍射图谱。测试条件为:Cu Kα,LynxEye阵列探测器,Ni滤波片,管压40 kV,管流40 mA。步进扫描,步长为0.02°,扫描速度1°·min-1。
在已抛光的25 mm×2 mm ZnS透射圆板(Clear Tran,International Crystal Labs,Garfield,美国)上累积沉降5 mL 20 g·L-1的蒙脱石-壳聚糖复合物分散液,风干后在250 W加热灯下烘干。在透射模式下记录傅立叶转换红外光谱(FTIR,Spectrum 100,Perkin-Elmer,美国),分辨率2 cm-1,每个样品扫描64次(4000~700 cm-1)并取平均。分别在不同湿度环境下记录空透射板和各样品的透射光谱,记录分别为:环境湿度不放入透射板;环境湿度放入空的透射板;通入氮气的样品;通入氮气的空透射板。每个样品的以上四种光谱均进行差减,得到对应的样品光谱[18]。本文实验数据均用Microsoft Excel 2013和Origin 8.0拟合和制图,数据分析用IBM SPSS Statistics 22完成。
1.2.2 pH对复合物吸附P的影响称取1.1制得的复合物2.000 g,加入100 mL超纯水,持续磁力搅拌得到20 mg·mL-1复合物分散液。向50 mL离心管中加入分散液1 mL,再分别加入含P 80 mg·L-1的KH2PO4溶液10 mL(使用HCl和NaOH分别调节pH 2~9)。在室温下以200 r·min-1振荡2 h,5000 r·min-1离心15 min,上清液过滤后用钼锑抗比色法在分光光度计(TU-1901,中国)上测定P浓度,再测定溶液pH,设3次重复。根据初始浓度与上清液终浓度的差值计算不同pH下的吸附量。本文实验除特殊说明,均在室温下进行。
1.2.3 复合物对P的吸附动力学向50 mL离心管中加入20 mg·mL-1复合物分散液1 mL,再加入pH 6含P为80 mg·L-1的KH2PO4溶液10 mL。在室温下以200 r·min-1振荡10~300 min后取出,在5000 r·min-1离心15 min,上清液过滤后同1.2.2方法测定P浓度。
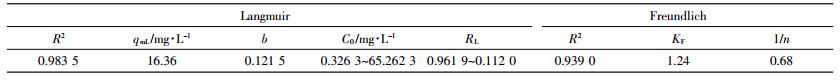
为探究吸附的机理,动力学吸附结果用准一阶方程、准二阶方程和颗粒内扩散方程分别拟合。三类方程的有效拟合分别对应物理吸附、化学吸附(或化学吸附与物理吸附)和颗粒内扩散为速率控制阶段的吸附类型[19]。
准一阶方程的线性形式为:
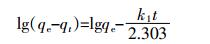 (1)
(1) 式中:k1是准一阶方程的常数,min-1;qt是t时间点的吸附容量,mg·g-1;qe是平衡状态下的吸附容量,mg·g-1。
准二阶动力学方程为:
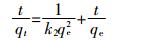 (2)
(2) 式中:k2是准二阶动力学常数,g·mg-1·min-1。
颗粒内扩散模型方程为:
 (3)
(3) 式中:ki是颗粒内扩散常数,mg·g-1·min-1.5;Ci是边界相对厚度。
1.2.4 复合物对P的吸附热力学试验向50 mL离心管中加入1 mL 20 mg·mL-1复合物分散液,再加入含P为80 mg·L-1的KH2PO4溶液10 mL。分别在20、30、40 ℃下以200 r·min-1振荡2 h。重复3次,在5000 r·min-1离心15 min,上清液中P浓度测定方法同1.2.2。
热力学参数的计算按照公式(4)~(6):
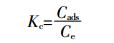 (4)
(4) 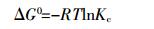 (5)
(5) 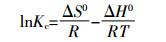 (6)
(6) 式中:ΔG0、ΔH0、ΔS0分别为反应的自由能、焓和熵;Kc为平衡常数;Cads为平衡状态下P吸附量,mg·g-1;Ce为平衡液P浓度,mg·L-1;R为气体常数;T为绝对温度,K。
1.2.5 复合物对P的等温吸附向50 mL离心管中加入1 mL 20 mg·mL-1复合物分散液,再分别加入10 mL pH 6的KH2PO4溶液,得到离心管中P的初始浓度为0.33、0.65、1.63、3.26、6.53、16.32、32.63、65.26 mg·L-1。设3次重复,后续步骤同1.2.2。
将以上测得的吸附量对平衡浓度制作等温吸附曲线,并使用Langmuir和Freundlich方程拟合。
Langmuir方程线性形式如下:
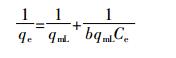 (7)
(7) 式中:qmL是完成单层吸附时的最大吸附容量,mg·g-1;b为磷与吸附剂上吸附位点的亲和力。
b用于计算无量纲分离因子RL,公式如下:
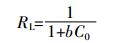 (8)
(8) 式中:C0是初始浓度,mg·L-1;RL值可判定吸附反应为可逆(>1)、线性(=1)、有利(0~1)或不可逆(=0)。
Freundlich方程假设吸附过程为非均质吸附,该方程线性形式如下:
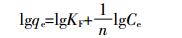 (9)
(9) 式中:KF是相对吸附容量,mg·g-1;1/n表示P在复合物上的吸附强度,与两者间亲和力有关。
2 结果与讨论 2.1 复合物的表征如图 1a所示,复合物相比蒙脱石有更大层间距。纯蒙脱石的特征衍射峰在6.98°(2θ),对应的层间距为1.26 nm;而复合物的衍射峰在5.78°(2θ),对应1.52 nm的层间距。结合文献[16]和[20]及我们前期研究结果[17],本实验层间距的变化证明了壳聚糖在蒙脱石层间的单层插层。复合物的红外图谱(图 1b)显示,其在1535 cm-1(-NH3+弯曲振动)和1381 cm-1(C-H弯曲振动)处对应壳聚糖的峰位,而3625 cm-1(层间O-H伸缩振动)和1044 cm-1(Si-O伸缩振动)来自蒙脱石。这说明蒙脱石和壳聚糖分子表面发生反应并形成复合物[21]。
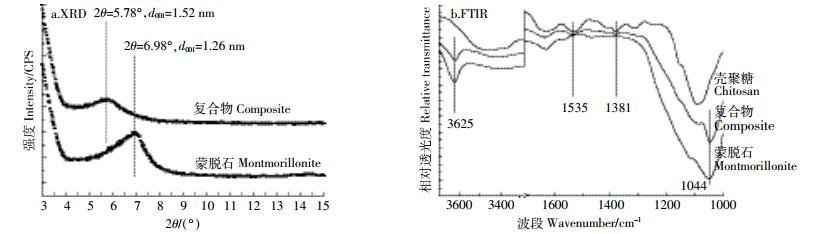
|
| 图 1 复合物的表征 Figure 1 Characterization of the composite |
如图 2所示,P在复合物上的吸附量随pH变化而极显著变化(Duncan,P<0.01)。pH为2时,P的吸附量最低,仅为6.71 mg·g-1;随pH增加,吸附量逐渐增加,到pH 6时,吸附量最大,为16.36 mg·g-1;随pH继续增加,吸附量逐步减少,当pH升至9时,吸附量降低到9.05 mg·g-1。本实验所用复合物为蒙脱石饱和吸附壳聚糖制得,该吸附过程在盐洗状态下并不可逆,吸附量最大约为0.2 g·g-1[17]。考虑到蒙脱石的表面为壳聚糖分子覆盖,本文主要从壳聚糖上的氨基和羟基变化讨论实验结果。壳聚糖氨基质子化的pKa为6.3[15],在pH小于6.3时,壳聚糖分子上-NH3+、-NH2和-OH均可能参与络合磷酸盐及磷酸氢盐,pH大于6时,可忽略质子化氨基的作用,壳聚糖分子由-NH2和-OH参与络合。
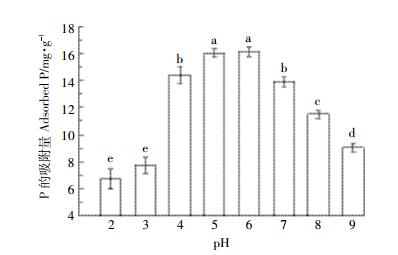
|
| 图 2 不同pH对P吸附量的影响 Figure 2 The effect of pH on the adsorption amount of P |
在pH从1增加到4的过程中,H3PO4逐渐转化为H2PO4-,pH从6增加到10时,H2PO4-逐渐转变为HPO42-[4]。在pH 4~7范围内,P的吸附量较大,而该pH环境下,P主要以H2PO4-存在,说明H2PO4-形态较易与-NH2和/或-OH络合吸附。pH 2~3范围内,磷酸盐的吸附量较低,此时磷酸盐主要形态为H3PO4,次要形态为H2PO4-;pH 4~6范围内,吸附量最高,此时磷酸盐主要形态为H2PO4-。这说明在氨基可质子化范围内,磷酸盐的形态及其带电性对吸附产生重要影响,吸附量随H2PO4-的增加而增加。磷酸盐在pH 4~6时主要以H2PO4-形态存在,而pH>6时主要以HPO42-形态存在。复合物在pH从6增加到7的过程中主导静电吸附的质子化氨基减少为0,而磷酸盐的负电增加,本实验无从判别此时的磷酸盐形态对吸附量的影响。吸附量可能随磷酸盐形态负电增加而增加,也可能随质子化氨基减少而减少。pH>6条件下吸附量减小到9.05 mg·g-1则说明虽然pH<6时质子化氨基明显参与了与磷酸盐的结合,但-NH2和/或-OH可在pH>6条件下与磷酸盐络合导致吸附。
2.3 P的动力学吸附及方程拟合从图 3a可以看出,P的吸附量随吸附时间增加而增加。在反应时间为10、30、60、90、120、150、180 min时,吸附量分别为4.25、8.89、10.75、14.89、15.38、15.66、15.53 mg·g-1。P在复合物表面约3 h达到吸附平衡,达到最大吸附量15.66 mg·g-1。本文所用壳聚糖脱乙酰度为80%,据此计算每克壳聚糖含-OH和-NH2(或-NH3+)分别为11.78、4.71 mmol。根据我们前期实验,本复合物合成方法中蒙脱石吸附壳聚糖的最大吸附量为0.2 g·g-1,假设蒙脱石与氨基结合消耗质子化氨基,-NH2依然存在约3.91 mmol·g-1壳聚糖,折算到复合物上约有1.96、0.65 mmol·g-1的-OH和-NH2,若按静电吸附计算,质子化氨基能提供20.15 mg·g-1的吸附量,高于本实验实测值。因此,根据本实验尚不能明确-OH是否参与络合吸附及络合的机理。
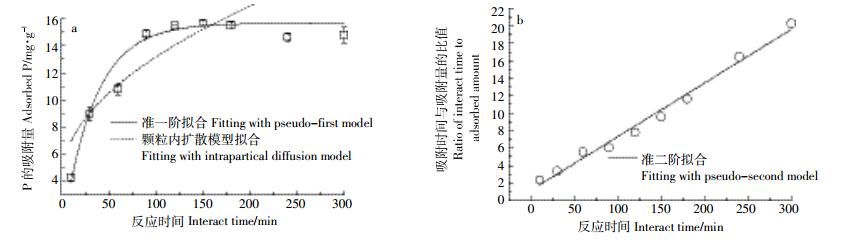
|
| 图 3 随反应时间变化P在复合物上的吸附量及其动力学模型拟合 Figure 3 Adsorption of P on the composite versus time increasing and the fitting with pseudo-first, pseudo-second and intrapartical diffusion models |
将吸附量数据拟合准一阶(图 3a)、准二阶(图 3b)和内扩散模型(图 3a)后发现,准二阶方程对吸附数据拟合最好(R2=0.985),其次为准一阶方程(R2=0.952),颗粒内扩散方程拟合较差(R2=0.695)。拟合得到的最大吸附量为15.67、16.26 mg·g-1(分别为准一阶和准二阶拟合结果),与准一阶方程拟合比较,准二阶方程拟合结果更接近实测值。准一阶方程的拟合不及准二阶拟合的相关性高,说明化学吸附为P在复合物上吸附的速率控制阶段[19]。
2.4 P在复合物表面的吸附热力学随着温度升高,P在复合物上的吸附量逐渐降低。温度从20 ℃上升到30 ℃和40 ℃时,P的吸附量从14.99 mg·g-1下降到14.65、14.25 mg·g-1(Duncan,P<0.01),说明在温度20 ℃~40 ℃的范围内,吸附量随温度增加而减少。根据公式(4)~(6)计算复合物-P热力学吸附的焓、熵、自由能变化值,得到P在复合物上的焓变ΔH0=-8.272 9 kJ·mol-1,而熵变ΔS0=-0.001 8 J·mol-1·K-1。在20、30、40 ℃时的自由能变化ΔG0分别为-5.901 8、-5.692 3、-5.658 9 kJ·mol-1。
ΔG0的结果说明在20~40 ℃范围内,P在复合物表面的吸附可自发发生。ΔH0为负值,说明吸附过程为放热反应;ΔS0为负值,说明P在复合物表面无序性增加,其吸附过程为焓推动过程[17]。
2.5 P在复合物上的等温吸附从图 4中可见,0~40 mg·L-1的平衡浓度范围内,P吸附量随浓度增加而增加,在平衡浓度为5.87 mg·L-1时,吸附量为5.32 mg·g-1,而平衡浓度达到39.17 mg·L-1时,其最大吸附量为13.08 mg·g-1。比较P吸附与各方程拟合的相关度(表 1),P在复合物上的吸附用Langmuir模型(R2=0.983)拟合比Freundlich模型(R2=0.939)更好。而且Langmuir方程拟合得到qmL为16.36 mg·g-1,更近似于实测最大吸附量。说明pH 6时,P在复合物上的吸附位点均质,吸附机制较单一,可能复合物表面仅有-NH2或-OH参与重金属的吸附。无量纲因子RL在各初始浓度条件下均小于1,说明复合物对P的吸附在实验条件下均为有利发生[19]。
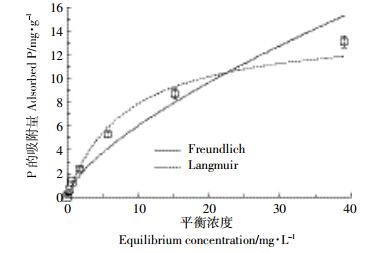
|
| 图 4 P在复合物上的等温吸附及其拟合 Figure 4 The isotherm adsorption of P on the composite and the fitting with the models |
(1)蒙脱石加载壳聚糖可形成单层插层的复合物。
(2)蒙脱石-壳聚糖复合物能在室温条件下3 h内去除中性及弱酸性溶液中约16 mg·g-1的磷酸盐,可应用于水溶液中P的去除。
(3)实验并不能确定壳聚糖上-OH是否参与对P的吸附以及P在复合物上吸附的机理。复合物-磷酸盐吸附体系的机理尚需深入研究。
| [1] |
干方群, 周健民, 王火焰, 等. 坡缕石粘土的磷吸附机制及其铁负载效果研究[J]. 岩石矿物学杂志, 2008, 27(5): 477-482. GAN Fang-qun, ZHOU Jian-ming, WANG Huo-yan, et al. Phosphate adsorption efficiency and mechanism of natural and iron modified palygorskites[J]. Acta Petrologica et Mineralogica, 2008, 27(5): 477-482. |
| [2] |
仉春华, 王文君, 安晓雯, 等. 质子化壳聚糖的除磷性能[J]. 环境工程学报, 2013, 7(2): 568-572. ZHANG Chun-hua, WANG Wen-jun, AN Xiao-wen, et al. Dephosphorization effect of protonated chitosan[J]. Chinese Journal of Environmental Engineering, 2013, 7(2): 568-572. |
| [3] |
付军, 范芳, 李海宁, 等. 铁锰复合氧化物/壳聚糖珠:一种环境友好型除磷吸附剂[J]. 环境科学, 2016, 37(12): 4882-4890. FU Jun, FAN Fang, LI Hai-ning, et al. Fe-Mn binary oxide impregnated chitosan bead(FMCB):An environmental friendly sorbent for phosphate removal[J]. Environmental Science, 2016, 37(12): 4882-4890. |
| [4] |
Mahaninia M H, Wilson L D. Phosphate uptake studies of cross-linked chitosan bead materials[J]. Journal of Colloid Interface Science, 2017, 485: 201-212. DOI:10.1016/j.jcis.2016.09.031 |
| [5] |
Zhao T T, Feng T. Application of modified chitosan microspheres for nitrate and phosphate adsorption from aqueous solution[J]. RSC Advances, 2016, 6: 90878-90886. DOI:10.1039/C6RA17474D |
| [6] |
He H P, Ma L Y, Zhu J X, et al. Synthesis of organoclays:A critical review and some unresolved issues[J]. Applied Clay Science, 2014, 100: 22-28. DOI:10.1016/j.clay.2014.02.008 |
| [7] |
Kar S, Kaur T, Thirugnanam A. Microwave-assisted synthesis of porous chitosan-modified montmorillonite-hydroxyapatite composite scaffolds[J]. International Journal of Biological Macromolecules, 2016, 82: 628-636. DOI:10.1016/j.ijbiomac.2015.10.060 |
| [8] |
Wang Y, Wohlert J, Bergenstrahle-Wohlert M, et al. Molecular mechanisms for the adhesion of chitin and chitosan to montmorillonite clay[J]. RSC Advances, 2015, 5: 54580-54588. DOI:10.1039/C5RA06424D |
| [9] |
Hu C, Zhu P F, Cai M, et al. Comparative adsorption of Pb(Ⅱ), Cu(Ⅱ) and Cd(Ⅱ) on chitosan saturated montmorillonite:Kinetic, thermodynamic and equilibrium studies[J]. Applied Clay Sciences, 2017, 143: 320-326. DOI:10.1016/j.clay.2017.04.005 |
| [10] |
Calagui M J C, Senoro D B, Kan C C, et al. Adsorption of indium(Ⅲ) ions from aqueous solution using chitosan-coated bentonite beads[J]. Journal of Hazardous Materials, 2014, 277: 120-126. DOI:10.1016/j.jhazmat.2014.04.043 |
| [11] |
Wang J L, Chen C. Chitosan-based biosorbents:Modification and application for biosorption of heavy metals and radionuclides[J]. Bioresource Technology, 2014, 160: 129-141. DOI:10.1016/j.biortech.2013.12.110 |
| [12] |
Wang H L, Tang H Q, Liu Z T, et al. Removal of cobalt(Ⅱ) ion from aqueous solution by chitosan-montmorillonite[J]. Journal of Environmental Science, 2014, 26(9): 1879-1884. DOI:10.1016/j.jes.2014.06.021 |
| [13] |
Guibal E. Interactions of metal ions with chitosan-based sorbents:A review[J]. Separation and Purification Technology, 2004, 38(1): 43-74. DOI:10.1016/j.seppur.2003.10.004 |
| [14] |
Yan H, Lin G. Usage of chitosan on the complexation of heavy metal contents and vertical distribution of Hg(Ⅱ) and Cr(Ⅵ) in different textural artificially contaminated soils[J]. Environmental Earth Sciences, 2015, 73(5): 2483-2488. DOI:10.1007/s12665-014-3599-5 |
| [15] |
An J H, Dultz S. Adsorption of Cr(Ⅵ) and As(Ⅴ) on chitosan-montmorillonite:Selectivity and pH dependence[J]. Clays and Clay Minerals, 2008, 56(5): 549-557. DOI:10.1346/CCMN.2008.0560508 |
| [16] |
Darder M, Colilla M, Ruiz-Hitzky E. Biopolymer-clay nanocomposites based on chitosan intercalated in montmorillonite[J]. Chemistry of Materrials, 2003, 15(20): 3774-3780. DOI:10.1021/cm0343047 |
| [17] |
Hu C, Deng Y J, Hu H Q, et al. Adsorption and intercalation of low and medium molar mass chitosans on/in the sodium montmorillonite[J]. International Journal of Biological Macromolecules, 2016, 92: 1191-1196. DOI:10.1016/j.ijbiomac.2016.08.007 |
| [18] |
Deng Y J, Velázquez A L B, Billes F, et al. Bonding mechanisms between aflatoxin B1 and smectite[J]. Applied Clay Science, 2010, 50(1): 92-98. DOI:10.1016/j.clay.2010.07.008 |
| [19] |
Gerente C, Lee V K C, Cloirec P L, et al. Application of chitosan for the removal of metals from wastewaters by adsorption-mechanisms and models review[J]. Critical Reviews in Environmental Science and Technology, 2007, 37(1): 41-127. DOI:10.1080/10643380600729089 |
| [20] |
An J H, Dultz S. Polycation adsorption on montmorillonite:pH and T as decisive factors for the kinetics and mode of chitosan adsorption[J]. Clay Minerals, 2007, 42(3): 329-339. DOI:10.1180/claymin.2007.042.3.06 |
| [21] |
Günister E, Pestreli D, Ünlü C H, et al. Synthesis and characterization of chitosan-MMT biocomposite systems[J]. Carbohydrate Polymer, 2007, 67(3): 358-365. DOI:10.1016/j.carbpol.2006.06.004 |
 2017, Vol. 36
2017, Vol. 36