文章信息
- 李立波, 任晓冬, 窦森
- LI Li-bo, REN Xiao-dong, DOU Sen
- 固态发酵中2种微生物降解玉米秸秆效果的对比研究
- Comparative study of the degradation efficiency of 2 types of microorganisms on the degradation of corn stalks in solid-state fermentation
- 农业环境科学学报, 2017, 36(10): 2136-2142
- Journal of Agro-Environment Science, 2017, 36(10): 2136-2142
- http://dx.doi.org/10.11654/jaes.2017-0336
文章历史
- 收稿日期: 2017-03-10
2. 吉林大学生命科学学院, 长春 130118
2. College of Life Sciences, Jilin University, Changchun 130118, China
我国是一个农业生产大国,玉米、水稻和小麦作为主要的粮食作物,每年大约产8×108 t作物秸秆[1],其中玉米秸秆大约占作物秸秆总量的33.4%,是东北地区常见的农业固体废弃物[2]。玉米秸秆相当于玉米生产的副产品,由于没有被合理的利用[3],大部分玉米秸秆农民都选择堆积在田间地头等待在自然条件下腐烂降解或者是直接在田间用火焚烧,而焚烧秸秆不仅会减少土壤表层有机质,危害土壤墒情,还会引起环境污染,对人类健康产生危害[4-5]。
玉米秸秆中纤维素含量占25%~35%,半纤维素含量占20%~40%,木质素含量占10%~25%[6],三者相互缠绕包裹构成了植物细胞壁,它们通过各种化学键连接,成为难降解物质[7-8]。近年来,国内外致力于研究利用一些物理、化学、生物技术来进行预处理秸秆,从而达到高效利用的目的。物理预处理包括机械加工法和蒸汽爆破法,但其处理效果有限、成本较高,不符合实际应用的要求;化学预处理包括酸预处理法和碱预处理法,但易对环境造成二次污染,不适合进行推广利用;生物预处理主要是通过微生物或者酶降解秸秆,作为一种简单、环保、经济的方法,已经成为秸秆预处理的研究新热点[6, 9]。
生物处理中,降解纤维素的微生物包括真菌、细菌和放线菌[10],真菌如曲霉属、青霉属和木霉属被广泛研究,经常被用来生产高品质和高浓度的木质纤维素酶[11-12],哈茨木霉本身具有较好的纤维素酶活性,并且纤维素酶系组成较为理想,具有较高β-葡萄糖苷酶酶活和木糖苷酶酶活,之前的一些实验研究也表明哈茨木霉具有较高效的纤维素酶生产系统[13]。Castro Aline等[14]研究表明,使用丝状真菌哈茨木霉IOC-3844对经过预处理的甘蔗渣进行液体深层发酵,72 h后产生的纤维素酶活、内切葡聚糖酶活和β-葡萄糖苷酶酶活均达到最高。Nelson Libardi等[15]研究表明,哈茨木霉可利用生活污水作为底物来生产纤维素酶。Vanessa Alves等[16]研究发现,丝状真菌哈茨木霉IOC-3844在最优条件下,42 h后纤维素酶和β-葡萄糖苷酶酶活最高,然后将生产的纤维素酶浓缩后去处理甘蔗渣,28 h后甘蔗渣可以水解约50%。细菌中枯草芽孢杆菌由于具有典型的芽孢结构,抗逆性强,容易适应外界的不利环境,可在比较苛刻的条件下存活,还具有培养周期短的特点,易于工业化生产,所以在工农业上广泛应用。枯草芽孢杆菌是少量可分泌纤维素胞外酶的细菌之一,能够产生包括纤维素酶、淀粉酶、脂肪酶和蛋白酶等多种酶系,王毅[17]研究表明,枯草芽孢杆菌是具有木质纤维素降解能力较高的高温菌。Amir Jalal等[18]研究发现枯草芽孢杆菌生长温度为10~40 ℃,并能生产纤维素酶和木聚糖酶。谢凤行等[19]对枯草芽孢杆菌通过紫外诱变、化学诱变及复合诱变选育出10个高纤维素酶活的突变株。王尧悦等[20]分离出一株纤维素降解菌经鉴定为枯草芽孢杆菌,发现该菌株所产粗酶液对麸皮的粗纤维降解率最高,对麦草秸秆的粗纤维降解率最低。本文就哈茨木霉和枯草芽孢杆菌降解玉米秸秆效果进行对比,旨在研究两者对玉米秸秆降解效果的差异。
1 材料与方法 1.1 供试菌种与培养基本实验采用的微生物是从秸秆还田1年后的鲜土中分离出来的,经鉴定属于哈茨木霉和枯草芽孢杆菌,具体参见刘艳丽[21]的鉴定结果。
将微生物接种在含有30 mL培养基制成的固体斜面上,其中哈茨木霉为PDD培养基、枯草芽孢杆菌为牛肉膏蛋白胨培养基,放入28 ℃培养箱72 h,得到成熟菌丝,取2 mL无菌水加到接种微生物的试管中振荡2 min,得到孢子液,将溶液转移至无菌试管中,通过血球计数板计数,计算浓度并稀释,制成孢子浓度为1×107个·mL-1的孢子悬液,最后将菌液移至液体培养基中(哈茨木霉为PDD液体培养基,枯草芽孢杆菌为牛肉膏蛋白胨液体培养基),菌液与培养基比例为1:10,在温度30 ℃,转速为100 r·min-1的振荡培养箱中振荡培养6 d,得到含有孢团菌丝体的菌液。
PDD培养基:土豆(去皮)200 g·L-1,煮沸30 min并过滤、葡萄糖20 g·L-1、琼脂20 g·L-1。
PDD液体培养基:土豆(去皮)200 g·L-1,煮沸30 min并过滤、葡萄糖20 g·L-1。
牛肉膏蛋白胨培养基:牛肉膏3 g·L-1、蛋白胨10 g·L-1、氢氧化钠5 g·L-1、琼脂20 g·L-1。
牛肉膏蛋白胨液体培养基:牛肉膏3 g·L-1、蛋白胨10 g·L-1、氢氧化钠5 g·L-1。
1.2 供试有机物料玉米秸秆取自吉林农业大学试验田,品种为中金368(北京金粒粒金种子有限公司),2015年4月末播种,10月初秋收。土壤类型为黑土,基本性质为:秸秆有机碳419.34 g·kg-1,全氮为6.91 g·kg-1,全磷7.7 g·kg-1,全钾4.5 g·kg-1,C/N为61。收获后将整株玉米秸秆自然风干后粉碎至0.5 cm备用。
1.3 试验设计采用BIOTECH-30SS固体发酵罐(上海保兴生物工程设备有限公司),容积为30 L,能够自动搅拌、控制湿度和温度。发酵罐设定参数:温度30 ℃,湿度60%,转速6.0 r·min-1。
矿物盐培养液(g·L-1):尿素4.2,硫酸铵19.6,氯化钙0.028,磷酸二氢钾28,硫酸镁4.2,硫酸亚铁0.07,硫酸锰0.021,硫酸锌0.019,氯化钴4.2,酵母膏7。pH=5。
将1.5 kg的秸秆粉末加入发酵罐中后进行灭菌,待温度下降至设定温度后开始接菌和加入无菌无机矿物盐培养液,其中菌液为600 mL,无机矿物盐培养液为3.75 L,发酵罐开始运行。
每隔24 h在发酵罐中不同位置重复取样3次,并分别对样品进行测定分析,记作3次重复,试验连取25 d。未经发酵的秸秆记作对照组(CK)。样品放入玻璃样品管中在-20 ℃条件下冷藏储存。
1.4 分析测定方法秸秆有机碳含量采用重铬酸钾容量法[22]。
秸秆纤维素和木质素含量测定参考国际通用方法[23]。取两个砂芯漏斗或砂芯坩埚,分别记作1号和2号,放入马弗炉中575 ℃恒重4 h,分别称其重量并记为W1和W2,放入干燥器中备用。称取两个烘干的秸秆样品0.3 g,分别加入两支玻璃试管中,向两支试管里加入3 mL 72% H2SO4,用玻璃棒搅拌直至H2SO4与秸秆样品充分混匀。将两只试管放入30 ℃水浴锅中保温1 h,并用玻璃棒搅拌,10 min 1次,共6次,使秸秆与H2SO4充分接触反应。1 h后将试管取出,将试管中全部水解液和秸秆样品残渣分别倒入2个500 mL蓝盖试剂瓶中,然后向每个蓝盖试剂瓶中加入84 mL蒸馏水,摇匀,接着称取0.11 g葡萄糖放入第三个500 mL蓝盖试剂瓶中,加入10 mL蒸馏水和348 μL 72% H2SO4,将瓶盖拧好并用牛皮纸(双层)扎口(防止加热时瓶盖被顶开发生危险)。将3个玻璃试剂瓶同时装入高压灭菌锅中121 ℃反应1 h待反应结束后冷却到25 ℃取出,将砂芯坩埚与抽滤装置相连,将上述试剂瓶内的秸秆水解液分别用坩埚漏斗进行抽滤,并用50 mL离心管收集滤液,抽滤结束后用50 mL蒸馏水对秸秆残渣进行淋洗。将盛有秸秆残渣的1号和2号漏斗分别放入马弗炉(575 ℃,24 h)和烘箱(105 ℃,4 h)中, 待反应结束后分别称其重量,并记为W1+灰和W2+酸不溶性残渣,根据公式(2)与公式(3)分别计算酸不溶性和酸可溶性木质素含量。以4% H2SO4为对照,使用分光光度计测定滤液在320 nm处的吸光度值,根据吸光度值计算酸可溶性木质素的含量,酸不溶性与酸可溶性木质素含量的总和即为秸秆总木质素含量[74]。
样品水解滤液和葡萄糖水解液中葡萄糖的含量用葡萄糖试剂盒分别进行测定,糖的回收率可依据公式(4)计算,公式(5)可用来计算样品中纤维素水解产生葡萄糖浓度,公式(6)可计算糖苷浓度,样品纤维素含量可根据公式(7)来进行计算。
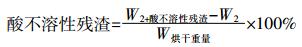 (1)
(1) 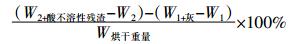 (2)
(2) 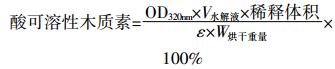 (3)
(3) 公式(3)中:V水解液=滤液体积87 mL(3 mL H2SO4+84 mL蒸馏水)
 (4)
(4) 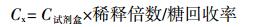 (5)
(5) 公式(5)中:C试剂盒为用试剂盒测得的样品中葡萄糖的含量,Cx为纤维素水解产生的葡萄糖的浓度。
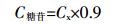 (6)
(6) 公式(6)中0.9为酐的效正值。
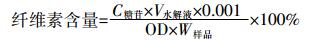 (7)
(7) 配制浓度为10 mg·mL-1的葡萄糖标准液,将其稀释为0.1、1、2、4 mg·mL-1 4种浓度,加入DNS试剂并测其吸光度值,然后绘制葡萄糖溶液标准曲线,再配制2.5 mg·mL-1葡萄糖溶液用于标准曲线偏差的计算。
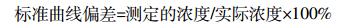 (8)
(8) 纤维素酶活采用国际标准方法[24]:将1条whatman滤纸条(长6 cm,宽1 cm)折叠放入试管底部,加入1 mL pH4.8的柠檬酸缓冲液(使滤纸条完全浸于液体中)和0.5 mL适当稀释的粗酶液混匀。50 ℃反应60 min,加入3 mL DNS,沸水浴5 min后迅速冷却,取200 μL到2.5 mL水中,OD540测吸光值。根据NREL计算方法,计算样品中葡萄糖含量,找出其中释放2 mg葡萄糖所对应酶浓度,0.37与此酶浓度比值即为此纤维素酶的活力。
木聚糖酶活测定方法[25]:称取1.0 g木聚糖溶于80 mL 50 mmol·L-1柠檬酸缓冲液中,60 ℃加热至沸腾,冷却过程中用磁力搅拌仪搅拌直至溶解,放置过夜后,用缓冲液补足至100 mL配制成10 mg·mL-1木聚糖溶液,4 ℃储存最多放置一周。取1.8 mL 10 mg·mL-1木聚糖溶液于15 mL试管中,加200 μL适当稀释的酶液,50 ℃水浴5 min,然后加入3 mL DNS试剂,沸水浴5 min,迅速冷却,OD510处测其吸光值。计算每分钟生成1 μmol产物需要的酶量,即一个酶活单位。
纤维二糖法测β-葡萄糖苷酶活[26]:用pH4.8柠檬酸缓冲液适当稀释酶液,取1 mL酶液加入试管中,再加入1 mL 15 mmol·L-1纤维二糖,50 ℃反应30 min,沸水浴5 min,迅速冷却,用葡萄糖试剂盒测其葡萄糖含量。取1 mL各个稀释的酶液加入装有1 mL pH4.8柠檬酸缓冲液的试管中作为酶空白;取1 mL纤维二糖加入装有1 mL pH4.8柠檬酸缓冲液的试管中作为纤维二糖空白。在样品葡萄糖含量为1 mg·mL-1处找出对应的酶浓度,取0.092 6/酶浓度值为此苷酶的活力。
1.5 数据处理采用Microsoft Office Excel 2016软件进行数据分析处理。
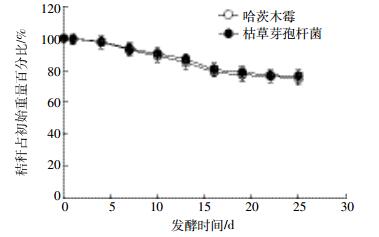
2 结果与分析 2.1 2种微生物对玉米秸秆降解效果的对比 2.1.1 秸秆重量变化图 1为2种微生物处理条件下单位体积秸秆不同发酵时间占初始重量的百分比。可以看出2种处理条件下,随着发酵时间的增加秸秆重量在减少,整个发酵期间哈茨木霉处理条件下秸秆重量都始终低于枯草芽孢杆菌处理,但是差别不大,且秸秆重量均在发酵10~16 d时降低速率最快。发酵结束时,哈茨木霉处理剩余秸秆占初始重量的78.21%;枯草芽孢杆菌处理剩余秸秆占初始重量的79.88%。
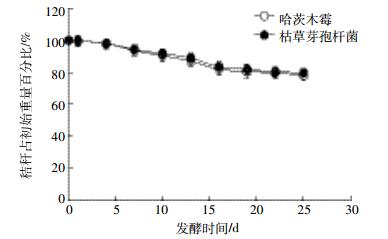
|
| 图 1 秸秆重量随时间的变化情况 Figure 1 The weight changes of corn straw at different fermentation time |
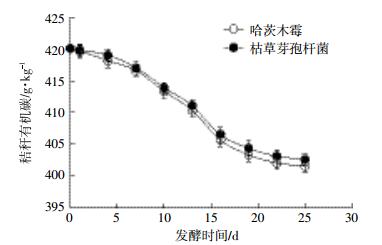
2种微生物对秸秆有机碳含量的影响如图 2所示。2种处理下秸秆有机碳含量变化曲线相似,均随着发酵时间的增加而降低,在发酵进行到10~16 d时,2种微生物处理条件下秸秆含碳量下降速率均达到最高。在发酵结束时,哈茨木霉处理下秸秆含碳量较初始降低了4.43%;枯草芽孢杆菌处理下秸秆含碳量较初始降低了4.17%。
|
| 图 2 秸秆有机碳含量随时间的变化情况 Figure 2 The organic carbon content changes of corn straw at different fermentation time |
图 3是剩余秸秆有机碳总量占初始百分比随时间变化的情况。和秸秆重量变化情况类似,2种处理下秸秆有机碳总量均随发酵时间的进行逐渐降低,且2种处理下秸秆有机碳总量相差不大。在10~16 d时降解速率最高,25 d发酵结束时,哈茨木霉和枯草芽孢杆菌处理下秸秆有机碳重量与初始相比分别降低了25.26%和23.46%。
|
| 图 3 秸秆有机碳总量随时间的变化情况 Figure 3 The total organic carbon content changes of corn straw at different fermentation time |
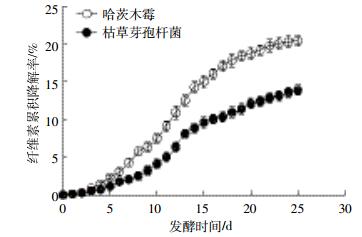
秸秆纤维素累积降解率如图 4所示。在发酵开始的前5 d,哈茨木霉和枯草芽孢杆菌处理秸秆纤维素降解率相差不大,在发酵进行5 d后,哈茨木霉处理纤维素降解率开始快速上升,哈茨木霉处理均比发酵同期枯草芽孢杆菌处理秸秆纤维素累积降解率高,在发酵中期10~16 d时2种处理纤维素降解速率均达到最高,在发酵进行到25 d时,哈茨木霉处理和枯草芽孢杆菌处理秸秆纤维素累积降解率分别为20.44%和13.90%。
|
| 图 4 秸秆纤维素累积降解率随时间的变化情况 Figure 4 The cellulose cumulative degradation of corn straw at different fermentation time |
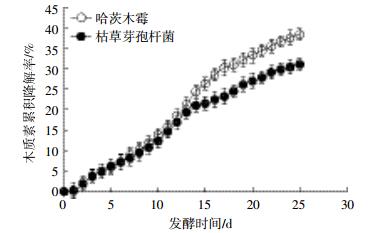
图 5为2种微生物中秸秆木质素累积降解率随发酵时间的变化曲线。2种微生物处理下木质素的降解速率随着时间的增加均呈现先升高后降低趋势,发酵25 d时,哈茨木霉处理和枯草芽孢杆菌处理下秸秆木质素累积降解率分别为38.10%和31.11%。
|
| 图 5 秸秆木质素累积降解率随时间的变化情况 Figure 5 The lignin cumulative degradation of corn straw at different fermentation time |
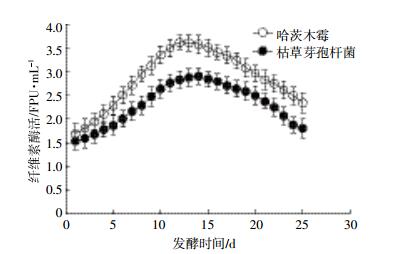
图 6为微生物纤维素酶活的变化情况。不同处理纤维素酶活都呈现先升后降的趋势,哈茨木霉处理在发酵12 d时达到最高3.61 FPU·mL-1,枯草芽孢杆菌在发酵14 d时达到最高2.91 FPU·mL-1。
|
| 图 6 纤维素酶活随时间的变化情况 Figure 6 The changes of cellulase activity at different fermentation time |
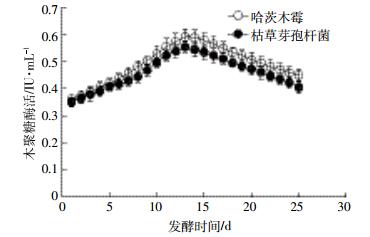
图 7为固态发酵的过程中,微生物木聚糖酶活的变化情况。哈茨木霉处理和枯草芽孢杆菌处理下都在发酵13 d时达到最高峰,分别为0.59、0.55 IU·mL-1,然后下降,到25 d发酵结束时分别降到0.45、0.40 IU·mL-1。
|
| 图 7 木聚糖酶活随发酵时间的变化情况 Figure 7 The changes of xylanase activity at different fermentation time |
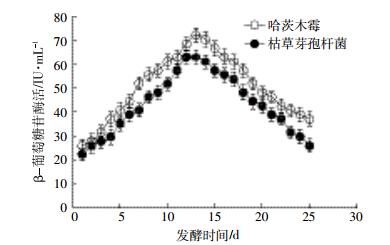
β-葡萄糖苷酶活随着发酵时间的变化如图 8所示。2种处理下β-葡萄糖苷酶活都是随发酵时间的增加先升高后下降,哈茨木霉处理下β-葡萄糖苷酶活最高为72.22 IU·mL-1,最低为25.93 IU·mL-1;枯草芽孢杆菌处理下β-葡萄糖苷酶活最高为62.96 IU·mL-1,最低为22.22 IU·mL-1。
|
| 图 8 β-葡萄糖苷酶酶活随发酵时间的变化情况 Figure 8 The changes of beta-glucosidase activity at different fermentation time |
固态发酵后,哈茨木霉和枯草芽孢杆菌对玉米秸秆都有一定的降解效果,2种处理均在发酵10~16 d时玉米秸秆降解速率达到最高,同时哈茨木霉和枯草芽孢杆菌的纤维素酶、木聚糖酶和β-葡萄糖苷酶均在此时间段内酶活性最高。这可能是因为微生物在加入到一个新的环境中后需要一个适应新环境的过程,经过慢慢适应之后开始分泌产生大量纤维素酶、木聚糖酶和β-葡萄糖苷酶,使得这些酶的活性增加,进而加快了秸秆的分解,导致在中期秸秆分解速率加快,到发酵后期相应的酶活降低,秸秆的降解速率也随之下降。Lee等[27]用里氏木霉发酵1:1混合的甘蔗渣和棕榈粕时,纤维素酶活在5 d时达到最高。李红亚等[28]研究解淀粉芽孢杆菌MN-8菌株,在发酵24 d后,玉米秸秆中纤维素、半纤维素、木质素分别降解42.9%、40.6%和27.1%。
本实验中,哈茨木霉对秸秆的降解效果与枯草芽孢杆菌处理差别不大,但哈茨木霉处理的纤维素酶、木聚糖酶和β-葡萄糖苷酶的酶活都高于同时期的枯草芽孢杆菌处理。这可能是由于哈茨木霉属于真菌,真菌降解纤维素的主要机制是分泌大量的胞外酶来破坏木质纤维素的紧密结构,从而有效降解玉米秸秆;枯草芽孢杆菌属于细菌,细菌降解木质纤维素的机制是主要通过分泌的纤维素酶的纤维素结合域附着在木质纤维素的表面,纤维素受细菌作用易于膨胀而被破坏分解[29]。虽然2种微生物降解玉米秸秆机制不同,但哈茨木霉处理玉米秸秆降解效果与枯草芽孢杆菌相差不大,酶活略高于枯草芽孢杆菌。
4 结论发酵第10~16 d时,哈茨木霉和枯草芽孢杆菌处理的玉米秸秆分解速率、纤维素酶活、木聚糖酶活和β-葡萄糖苷酶活均达到最高;发酵25 d后,2种微生物的玉米秸秆分别累积降解了21.79%和20.12%。说明添加哈茨木霉和枯草芽孢杆菌均可以降解秸秆,但哈茨木霉与枯草芽孢杆菌对玉米秸秆的降解效果差异不明显。鉴于这2种微生物对玉米秸秆有较好的分解效果,可在玉米秸秆肥料化利用中使用哈茨木霉或枯草芽孢杆菌制成的秸秆腐熟剂,使玉米秸秆在农田中快速分解,缩短玉米秸秆在农田中的分解时间。
| [1] |
常志州, 靳红梅, 黄红英, 等. "十三五"江苏省秸秆综合利用策略与秸秆产业发展的思考[J]. 江苏农业学报, 2016, 32(3): 534-541. CHANG Zhi-zhou, JIN Hong-mei, HUANG Hong-ying, et al. New thinking regarding integrated utilization strategy and industrial development of crop straws in Jiangsu Province for the 13th Five Year Plan[J]. Jiangsu Journal of Agricultural Sciences, 2016, 32(3): 534-541. |
| [2] |
吴文韬, 鞠美庭, 刘金鹏, 等. 一株纤维素降解菌的分离、鉴定及对玉米秸秆的降解特性[J]. 微生物通报, 2013, 40(4): 712-719. WU Wen-tao, JU Mei-ting, LIU Jin-peng, et al. Isolation, identification and corn stalk degradation characteristics of cellulose-degrading bacterial strain NH11[J]. Microbiology China, 2013, 40(4): 712-719. |
| [3] |
吴鸿欣, 曹洪国, 韩增德, 等. 中国玉米秸秆综合利用技术介绍与探讨[J]. 农业工程, 2011, 1(3): 9-12. WU Hong-xin, CAO Hong-guo, HAN Zeng-de, et al. Introduction and discussion of cornstalk utilization technology in china[J]. Agricultural Engineering, 2011, 1(3): 9-12. |
| [4] |
曹国良, 张小曳, 龚山陵, 等. 中国区域主要颗粒物及污染气体的排放源清单[J]. 科学通报, 2011, 56(3): 261-268. CAO Guo-liang, ZHANG Xiao-ye, GONG Shan-ling, et al. Emission inventories of primary particles and pollutant gases for China[J]. Chinese Sci Bull, 2011, 56(3): 261-268. |
| [5] |
曹国良, 张小曳, 郑方成, 等. 中国大陆秸秆露天焚烧的量的估算[J]. 资源科学, 2006, 28(1): 9-13. CAO Guo-liang, ZHANG Xiao-ye, ZHEN Fang-cheng, et al. Estimating the quantity of crop residues burnt in open field in China[J]. Resources Science, 2006, 28(1): 9-13. |
| [6] |
Martinez D, Larrondo L F, Putnam N, et al. Genome sequence of the lignocellulose degrading fungus Phanerochaete chrysosporium strain RP78[J]. Nature Biotechnology, 2004, 22(6): 695-700. DOI:10.1038/nbt967 |
| [7] |
Heck J X, Hertz P F, Ayub M A Z. Cellulase and xylanase production by isolated amazon Bacillus strains using soybean industrial residue based solid-state cultivation[J]. Brazilian Journal of Microbiology, 2002, 33(3): 213-218. DOI:10.1590/S1517-83822002000300005 |
| [8] |
S'anchez C, et al. Lignocellulosic residues:Biodegradation and bioconversion by fungi[J]. Biotechnology Advances, 2009, 27(2): 185-194. DOI:10.1016/j.biotechadv.2008.11.001 |
| [9] |
Akin D E, Rigsby L L, Sethuraman A, et al. Alterations in structure, chemistry, and biodegradability of grass lignocellulose treated with the white rot fungi Ceriporiopsis subvermispora and Cyathus stercoreus[J]. Applied and Environmental Microbiology, 1995, 61(4): 1591-1598. |
| [10] |
顾文杰, 张发宝, 徐培智, 等. 筛选两株稻杆降解放线菌[J]. 微生物学报, 2012, 52(9): 1085-1093. GU Wen-jie, ZHANG Fa-bao, XU Pei-zhi, et al. Screening of two straw-cellulose degrading actinomycetes[J]. Acta Microbiologica Sinica, 2012, 52(9): 1085-1093. |
| [11] |
Gong W L, Zhang H Q, Liu S J, et al. Comparative secretome analysis of aspergillus niger, trichoderma reesei, and penicillium oxalicum during solid-state fermentation[J]. Appl Biochem Biotechnol, 2015, 177: 1252-1271. DOI:10.1007/s12010-015-1811-z |
| [12] |
Glass N L, Schmoll M, Cate J H, et al. Plant cell wall deconstruction by ascomycete fungi[J]. Annual Review of Microbiology, 2013, 67: 477-498. DOI:10.1146/annurev-micro-092611-150044 |
| [13] |
Ahmed S, Bashir A, Saleem H, et al. Production and purification of cellulose degrading enzymes from a filamentous fungus Trichoderma harzianum[J]. Pakistan Journal of Botany, 2009, 41(3): 1411-1419. |
| [14] |
Castro A, Ferreira M, Cruz J. High-yield endoglucanase production by Trichoderma harzianum:Cultivated in pretreated sugarcane mill byproduct[J]. Enzyme Research, 2010, IOC-3844: 1-8. |
| [15] |
Nelson L, Carlos R S, Aristoteles G N, et al. Domestic wastewater as substrate for cellulase production by Trichoderma harzianum[J]. Process Biochemistry, 2017, PRBI-10964: 1-10. |
| [16] |
Vanessa A, Roberto N, Lidia M, et al. Sugarcane bagasse as feedstock for cellulose production by Trichoderma harzianum in optimized culture medium[J]. Electronic Journal of Biotechnology, 2013, 16(5): 1-13. |
| [17] |
王毅. 农林废物堆肥化中细菌对木质素的降解及产酶研究[D]. 长沙: 湖南大学, 2008. WANG Yi. Research of lignin degrading ability and the enzyme production by bacteria in agriculture and forestry waste composting[D]. Changsha:Hunan University, 2008. http://d.wanfangdata.com.cn/Thesis/Y1259766 |
| [18] |
Amir J, Naeem R, Nouman R, et al. Gene cloning and characterization of a xylanase from a newly isolated Bacillus subtilis strain R5[J]. Journal of Bioscience and Bioengineering, 2009, 107(4): 360-365. DOI:10.1016/j.jbiosc.2008.12.005 |
| [19] |
谢凤行, 张峰峰, 周可, 等. 原生质体诱变选育高纤维素酶活性枯草芽孢杆菌的研究[J]. 华北农学报, 2010, 25(5): 211-214. XIE Feng-xing, ZHANG Feng-feng, ZHOU Ke, et al. The mutagenesis of Bacillus subtilis protoplast for screening highly producing cellulase strains[J]. Acta Agriculturae Boreali-Sinica, 2010, 25(5): 211-214. DOI:10.7668/hbnxb.2010.05.043 |
| [20] |
王尧悦, 曹平华, 陈玉林, 等. 一株纤维素降解菌的鉴定及其对饲料粗纤维的降解效果[J]. 西北农林科技大学学报(自然科学版), 2016, 44(7): 16-24. WANG Yao-yue, CAO Ping-hua, CHEN Yu-lin, et al. Identification of a cellulose-decomposing strain and its application for degrading different cellulosic materials[J]. Journal of Northwest A & F University(Nat. Sci. Ed), 2016, 44(7): 16-24. |
| [21] |
刘艳丽. 细菌利用纤维素和木质素形成腐殖质研究[D]. 长春: 吉林农业大学, 2011. LIU Yan-li. Study on formation of humus by bacteria with cellulose and lignin[D]. Changchun:Jilin Agricultural University, 2011. |
| [22] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Ru-kun. Analytical methods for soil and agro-chemistry[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [23] |
Sluiter A, Hames B, Ruiz R, et al. Determination of structural carbohydrates and lignin in biomass. National Renewable Energy Laboratory(NREL) Laboratory Analytical Procedures(LAP) for standard biomass analysis[R]. NREL/TP-510-42618, 2008.
|
| [24] |
Ghose T K. Measurement of cellulase activities[J]. Pure Appl Chem, 1987, 59(2): 257-268. |
| [25] |
Bailey M J, Biely P, Poutanen K. Interlaboratory testing of methods for assay of xylanase activity[J]. Journal of Biotechnology, 1992, 23(3): 257-270. DOI:10.1016/0168-1656(92)90074-J |
| [26] |
Jabasingh S A. Response surface methodology for the evaluation and comparison of cellulase production by Aspergillus nidulans SU04 and Aspergillus nidulans MTCC 344 cultivated on pretreated sugarcane bagasse[J]. Chemical & Biochemical Engineering Quarterly, 2011, 25(4): 501-511. |
| [27] |
Lee C K, Darah I, Ibrahim C O. Production and optimization of cellulase enzyme using Aspergillus niger USM AI 1 and comparison with trichoderma reesei via solid state fermentation system[J]. Biotechnology Research International, 2011, 10: 1-6. |
| [28] |
李红亚, 李术娜, 王树香, 等. 解淀粉芽孢杆菌MN-8对玉米秸秆木质纤维素的降解[J]. 应用生态学报, 2015, 26(5): 1404-1410. LI Ya-hong, LI Shu-na, WANG Shu-xiang., et al. Degradation of lignocellulose in the corn straw by Bacillus amyloliquefaciens MN-8[J]. Chinese Journal of Applied Ecology, 2015, 26(5): 1404-1410. |
| [29] |
张斯童, 兰雪, 李哲, 等. 微生物降解玉米秸秆的研究进展[J]. 吉林农业大学学报, 2016, 38(5): 517-522. ZHANG Si-tong, LAN Xue, LI Zhe, et al. Research progress of microbial degradation of corn straw[J]. Journal of Jilin Agricultural University, 2016, 38(5): 517-522. |
 2017, Vol. 36
2017, Vol. 36




