文章信息
- 俎丽红, 王鑫, 王润玺, 午红蕊, 黄亚萍, 石福臣
- ZU Li-hong, WANG Xin, WANG Run-xi, WU Hong-rui, HUANG Ya-ping, SHI Fu-chen
- 不同大气环境中白皮松针叶重金属积累及抗性特征研究
- Study on resistance characteristics to heavy metal accumulation of Pinus bungeana Zucc. needles from different atmospheric environments
- 农业环境科学学报, 2017, 36(11): 2207-2215
- Journal of Agro-Environment Science, 2017, 36(11): 2207-2215
- http://dx.doi.org/10.11654/jaes.2017-0332
文章历史
- 收稿日期: 2017-03-10
- 接受日期: 2017-05-23
近年来,随着工业化和城市化的快速发展,大气污染问题备受瞩目。大气颗粒物(PM10和PM2.5)比表面积大、成分复杂,能吸附大量重金属,如Zn、Cu、Cd等,不仅污染环境,还可通过多种途径进入人体,给人类健康造成不利影响[1-2]。大气颗粒物的重金属污染已成为当前大气污染的研究热点之一[3]。植物能通过气孔吸收大气重金属,并将其积累于体内,使形态结构和生理生化特征发生改变[4]。重金属胁迫能导致超氧阴离子和过氧化氢等大量活性氧自由基(ROS)的产生,造成脂质过氧化和细胞代谢异常[5]。由于植物可以直接反应空气污染状况,在环境监测方面,常作为常规气象观测技术的补充而广泛应用于大气污染的防治与监测[6-7]。植物叶片通过干湿沉降或对颗粒物的拦截吸附重金属,进而将重金属吸收到叶片[8]。因此植物叶片中积累的重金属量,以及叶片本身的抗性生理指标,不仅能真实反映该地区空气污染状况,也可以反映空气污染对生物的影响[9-11]。与阔叶树木相比,常绿针叶植物在空气污染发生严重的秋冬季节仍保持生长,且针叶表面有发达的气孔线,可以从环境中大量吸收污染物,因而更能反映大气环境的变化过程[12]。
目前国内外对常绿植物与大气环境的相关研究多集中在针叶的滞尘能力及对污染的监测方面,对于渗透调节物质的报道不多。事实上植物在污染的大气环境下,体内可以积累可溶性蛋白和游离脯氨酸等渗透调节物质以抵抗环境胁迫[13]。
本研究以白皮松(Pinus bungeana)为材料,测定了白皮松在城区、郊区、山区不同大气环境中各年龄针叶中Cu、Mn、Zn、Cd重金属的含量,为揭示白皮松在不同大气环境中重金属的积累状况,明确不同年龄针叶对重金属污染物的累积效应和抗性生理特征,进而为阐明植物与空气污染的生态关系提供依据。
1 材料与方法 1.1 材料实验材料选择各地常用的园林绿化植物——白皮松。白皮松属于松科(Pinaceae)常绿乔木,针叶3针一束,是我国特有树种[14]。因为白皮松在华北地区栽培广泛,其针叶易区分年龄,所以是本研究比较理想的材料。
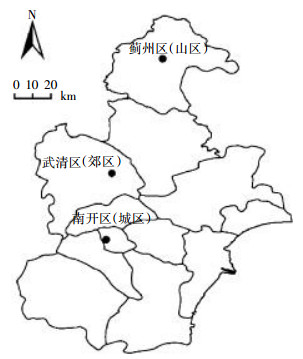
1.2 采样地点通过分析天津市环境空气质量GIS发布平台的数据发现,城区和郊区的大气污染程度明显高于山区。以空气中PM2.5为例,城区(591~618 μg·m-3)和郊区浓度(304 μg·m-3)均高于我国空气质量标准(GB 3095—2012)规定的浓度限值(75 μg·m-3),而山区低于该标准限值[15]。因此,本研究选取城区、郊区、山区3个大气污染程度不同的地点作为采样点(图 1)。
|
| 图 1 样点分布图 Figure 1 The location of sample sites |
在城区、郊区和山区各选取树高、胸径、生长状况一致的白皮松5株,每株树间隔10 m。在树高约2 m处按东、西、南、北四个方位采集当年生(C)、二年生(C+1)和三年生(C+2)针叶及林冠下表层土壤(0~5 cm)。之后针叶按年龄混合均匀,表层土壤按样点混合均匀,并将其小心装入自封袋带回实验室[16]。
采集的植物样品随机取一部分先用自来水清洗,再用去离子水冲洗3次,最后用超纯水冲洗3次,以清除针叶表面的灰尘,一部分不清洗。清洗完毕的植物鲜样一部分用于测定抗性指标,另一部分和未清洗鲜样在105 ℃下杀青30 min,80 ℃烘干至恒重,粉碎,过60目筛。土壤样品自然风干,过筛[17]。用分析天平分别称取0.500 0 g针叶和土壤干样,放置聚四氟乙烯管中,按一定比例加入优级纯浓硝酸和浓盐酸,用微波消解仪进行消解[18]。消解后的溶液定容至25 mL,0.45 μm微孔滤膜过滤,用火焰原子吸收分光光度计(SP-3520AA,上海光谱)测定Cu、Mn、Zn和Cd的含量。针叶中超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光还原法;丙二醛(MDA)含量测定采用硫代巴比妥酸法;可溶性糖含量测定采用蒽酮比色法;可溶性蛋白含量测定采用考马斯亮蓝法;游离脯氨酸含量测定采用酸性茚三酮法[19]。
1.4 数据分析数据为3次实验的平均值±标准误。采用Excel 2013软件整理数据并绘制图表,SPSS 22.0统计分析软件对数据进行双因素方差分析(Two-way ANOVA)、单因素方差分析(One-way ANOVA),并用最小显著差法(LSD)对数据进行多重比较,P<0.05。以未清洗与清洗针叶中重金属含量的差值作为大气重金属含量的相对值[20]。采用Pearson相关系数分析针叶重金属含量和抗性指标的相关性。
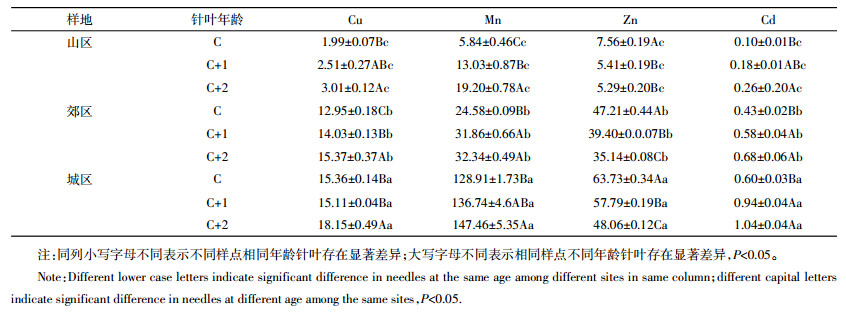
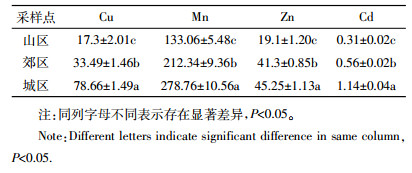
2 结果与分析 2.1 白皮松针叶中Cu、Mn、Zn和Cd的含量白皮松针叶中重金属积累情况如表 1所示,可以看出,在城区、郊区和山区,相同年龄针叶中重金属含量存在差异。当年生针叶中Cu、Mn、Zn和Cd的含量表现为城区>郊区>山区;二年生针叶中,郊区和城区的Cu、Mn、Zn和Cd的含量均显著高于山区;三年生针叶中Cu、Mn、Zn和Cd的含量表现为城区>郊区>山区。由表 1可知,在相同样点,不同年龄针叶对重金属的积累情况也存在差异。在城区,随着针叶年龄的增加,三年生针叶中Cu、Mn和Cd的含量分别比当年生针叶提高了18%、14%和73%;在郊区,二年生和三年生针叶中Cu、Mn和Cd的含量均显著高于当年生针叶;在山区,二年生和三年生针叶中Mn的含量分别是当年生针叶的2.2倍和3.3倍,三年生针叶中Cu和Cd的含量显著高于当年生针叶;而在三个样点,Zn的含量随着针叶年龄的增加逐渐降低。
|
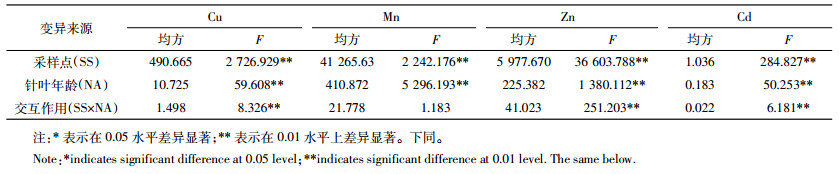
采样点、针叶年龄与白皮松针叶中重金属含量的方差分析结果如表 2所示,可以看出采样点和针叶年龄对针叶中重金属的积累情况均有显著影响。针叶中Cu、Zn和Cd的含量均受到采样点和针叶年龄的显著影响,采样点比针叶年龄影响更大,对针叶中的Mn而言,针叶年龄对其影响比采样点影响更大。
|
各个采样点表层土壤重金属含量如表 3所示,可以看出城区、郊区和山区表层土壤中Cu、Mn、Zn和Cd含量存在差异。土壤中Cu的含量城区和郊区分别是山区的4.5倍和1.9倍,Mn的含量城区和郊区分别是山区的2.1倍和1.6倍,Zn和Cd的含量城区、郊区和山区也存在显著差异。城区可能存在严重的重金属污染,即随着城区、郊区、山区环境变化土壤重金属含量逐渐降低。
|
植物主要通过土壤吸收和大气沉降两个途径吸收环境中的金属元素,将大气重金属含量的相对污染值取未清洗与清洗针叶中重金属含量的差值,二者之间重金属含量的线性回归可以用来研究大气重金属含量对针叶重金属积累的影响[20]。从图 2可以看出,针叶与大气中Cu、Mn和Cd含量存在极显著相关性,说明大气中的重金属对针叶中重金属的积累产生显著影响。针叶与表层土壤中Cu、Mn和Cd存在显著正相关关系,与Zn存在极显著正相关关系,说明针叶中重金属含量不仅与大气重金属的含量有关,也可能与土壤重金属含量有关。

|
| 图 2 针叶中重金属含量与大气或表层土壤重金属含量的回归分析 Figure 2 Regression analysis between the contents of heavy metals in needles and atmosphere or topsoil |
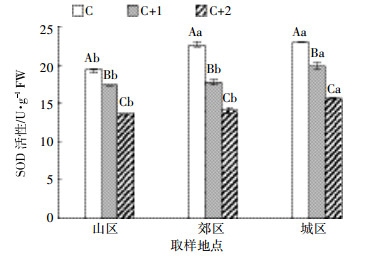
针叶中SOD活性如图 3所示,可以看出,相同年龄针叶中SOD活性总体趋势表现为城区>郊区>山区。当年生针叶中SOD活性表现为城区>郊区>山区,郊区和城区分别比山区提高了17%和19%,而城区和郊区二者间差异不显著;二年生针叶中SOD活性,城区显著高于山区和郊区;三年生针叶中SOD活性表现为城区>郊区>山区,城区比山区提高了14%。由图 3也可以得知,在相同采样点,不同年龄针叶中SOD活性也存在差异。在城区,随着针叶年龄的增加,二年生和三年生针叶SOD活性分别比当年生针叶降低了14%和32%;在郊区,3种年龄针叶中SOD活性存在显著差异,二年生和三年生针叶分别比当年生针叶下降了22%和38%;在山区,随着针叶年龄的增加,SOD活性逐渐降低。
|
| 不同小写字母表示相同年龄针叶差异显著;不同大写字母表示相同样点不同年龄针叶差异显著(P<0.05)。下同 Different lower case letters indicate significant difference in needles at the same age among different sites; different capital letters indicate significant difference in needles at different age among the same sites (P < 0.05). The same below 图 3 白皮松针叶中SOD活性 Figure 3 The superoxide dismutase activity in P. bungeana needles |
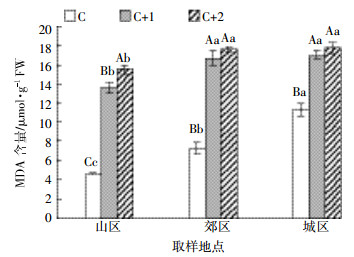
白皮松针叶中MDA的含量如图 4所示,可以看出相同年龄针叶,不同采样点MDA含量总体表现为城区>郊区>山区。当年生针叶中MDA含量表现为城区>郊区>山区,郊区和城区分别比山区增加了57%和145%;二年生针叶中MDA含量,郊区和城区分别是山区的1.2倍和1.3倍;三年生针叶中MDA含量城区显著高于山区,城区和郊区间差异不显著。从图 4还可以看出,相同采样点,不同年龄针叶中MDA含量也存在差异。在城区,针叶中MDA含量随着年龄的增加而增加,二年生和三年生均显著高于当年生;在郊区,二年生针叶和三年生针叶中MDA含量分别是当年生针叶的2.3倍和2.4倍;在山区,随着针叶年龄的增加,针叶中MDA含量逐渐增多。
|
| 图 4 白皮松针叶中MDA的含量 Figure 4 The malondialdehyde content in P. bungeana needles |
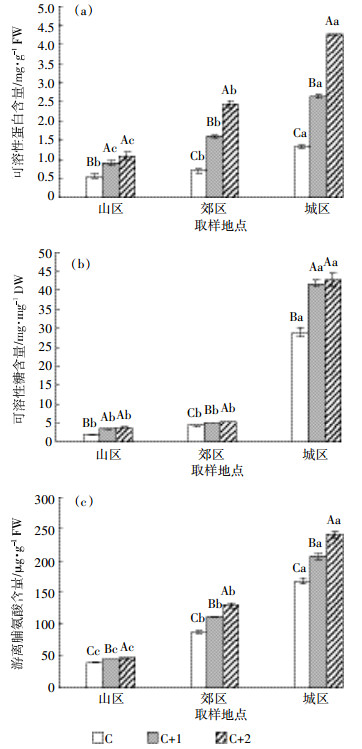
针叶中可溶性蛋白、可溶性糖和游离脯氨酸含量分别如图 5(a)、(b)和(c)所示,可以看出在3个采样点,相同年龄针叶中可溶性蛋白、可溶性糖和游离脯氨酸含量均存在差异。当年生针叶中,可溶性蛋白和可溶性糖含量表现为城区>郊区>山区,而山区和郊区差异不显著;游离脯氨酸含量郊区和城区分别是山区的2.2倍和4.2倍。二年生针叶中,可溶性蛋白含量城区和郊区分别是山区的2.9倍和1.7倍;可溶性糖含量城区显著高于山区和郊区;游离脯氨酸含量城区和郊区显著高于山区。三年生针叶中,可溶性蛋白含量城区最高(4.27 mg·g-1 FW),分别是山区和郊区的3.9倍和1.8倍;可溶性糖含量城区分别是山区和郊区的11.1倍和8.0倍;游离脯氨酸含量郊区和城区显著高于山区。从图 5还可得知,在相同采样点,不同年龄针叶中可溶性蛋白、可溶性糖和游离脯氨酸含量也存在差异。无论在城区、郊区还是山区,随着针叶年龄的增加,可溶性蛋白、可溶性糖和游离脯氨酸含量表现为三年生>二年生>当年生。在城区,可溶性蛋白含量三年生是当年生的3.2倍;可溶性糖含量三年生比当年生增加了47%;游离脯氨酸含量在3种年龄间存在显著差异。在郊区,可溶性蛋白含量三年生和二年生分别是当年生的3.5倍和2.3倍;可溶性糖含量三年生和二年生分别比当年生提高29%和22%。
|
| 图 5 白皮松针叶中渗透调节物质含量 Figure 5 The osmoregulation substance contents in P. bungeana needles |
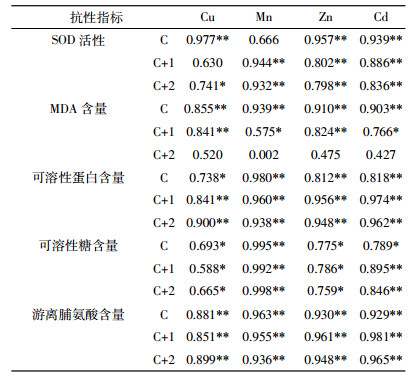
针叶中重金属含量和抗性指标的Pearson相关性分析如表 4所示。当年生针叶中,SOD与Cu、Zn和Cd存在显著正相关关系;MDA含量与Cu、Mn、Zn和Cd存在极显著正相关关系;可溶性蛋白、可溶性糖和游离脯氨酸含量均与针叶中四种重金属呈显著正相关关系。二年生针叶中,SOD与Mn、Zn和Cd存在显著正相关关系,MDA含量与Cu和Zn呈极显著相关,与Mn和Cd存在显著相关关系;可溶性蛋白、可溶性糖和游离脯氨酸与Cu、Mn、Zn和Cd存在显著或极显著正相关关系。三年生针叶中,SOD与Mn、Zn和Cd呈极显著正相关,与Cu呈显著正相关关系;可溶性蛋白、可溶性糖和游离脯氨酸含量均与四种重金属含量存在显著或极显著正相关关系。
|
植物通过叶片上的气孔吸收大气污染物,并将其积累或降解,从而起到净化大气的作用[20]。有研究表明,植物叶片对重金属的累积量与大气中重金属的含量密切相关[21]。在本研究中的3个采样点,白皮松针叶中Cu、Mn、Zn和Cd的含量表现为城区>郊区>山区,说明城区重金属污染比山区和郊区严重。有研究表明,大气污染环境下,针叶年龄对重金属的积累有影响,老叶比新叶能积累更多重金属,老叶比新叶更具有监测价值[22-23]。在城区,三年生针叶中Cu、Mn和Cd的含量高于当年生和二年生针叶,山区和郊区也存在相似的现象,说明重金属在针叶中的积累是不均衡的。重金属的积累量随着针叶年龄以及与环境接触时间的增加而增加的现象,进一步说明白皮松老叶比新叶更具有监测价值。然而,在城区、郊区和山区,随着针叶年龄的增加,针叶中Zn含量逐渐下降,可能在植物衰老的叶片中Zn能运输转移至幼嫩的叶子中,这种转移可以提高必需元素的利用率[24-25]。
相关研究表明,植物体内的重金属含量可以反映土壤和大气的污染水平[26],本研究发现针叶中重金属含量不仅与大气重金属含量相关,也与土壤重金属含量呈正相关,说明针叶中的重金属不仅来源于大气,而且体内也积累了来自于土壤的重金属。陈培飞等[27]的研究表明,PM2.5中Cu和Zn的含量分别达0.13、1.08 μg·m-3,说明针叶表层吸附的大气沉降物含有大量的重金属元素。
3.2 白皮松针叶重金属对其抗性生理特性及渗透调节物质的影响在正常情况下,细胞内自由基的产生和清除处于动态平衡状态。当植物受到重金属胁迫时,会造成植物体自由基的过量积累,造成氧化胁迫[28]。为了保护自身免受伤害,植物进化出了有效的抗氧化系统以清除活性氧自由基[29]。SOD在活性氧清除系统中作为第一道防线,可以催化超氧阴离子自由基转化为过氧化氢。在本研究中,在城区中当年生针叶中SOD活性显著高于山区和郊区,在二年生和三年生针叶中也可以看到相似的现象,这可能因为城区针叶中重金属元素含量较高,胁迫较严重,SOD活性提高,进一步促进酶库中酶被激活或者是编码SOD的基因表达增加[30-31]。无论在城区、郊区还是山区,随着针叶年龄的增加,SOD活性逐渐下降,可能是植物体内渗透调节物质一定程度上缓解了胁迫,使植物适应了环境;或者可能是随着针叶年龄中重金属的积累增加,过量的过氧化氢抑制了酶的活性[30, 32]。
MDA是不饱和脂肪酸过氧化的最终产物,其含量可以反映细胞膜脂类过氧化程度,因而MDA含量常被作为鉴别逆境伤害程度的指标之一[33-34]。有研究表明,重金属会使植物MDA含量升高,体内MDA含量越高,植物受胁迫越严重[35]。在本研究中,无论在城区、郊区还是山区,同年龄针叶中MDA含量表现为城区>郊区>山区,说明城区白皮松受胁迫严重,与针叶中重金属含量结果一致。在城区,随着针叶年龄增加MDA含量逐渐增加,相同的积累模式可以在山区和郊区中观察到。从表 4可知,针叶中MDA含量与重金属含量存在正相关关系,MDA含量的增加可能是由于植物体内重金属积累引起的。
植物在受到重金属等逆境胁迫时,会迅速积累脯氨酸,可溶性蛋白、可溶性糖以及有机酸等一系列渗透调节物质,从而增强植物的抵抗能力[36]。蛋白质合成是植物抵抗重金属胁迫的机制之一,可溶性蛋白含量是植物生理状态的重要指标[37]。相关研究表明,重金属胁迫下,植物体内可溶性蛋白含量增加[4]。在本研究中,相同年龄针叶中可溶性蛋白含量表现为城区>郊区>山区,针叶中可溶性蛋白含量的增加可能是细胞补偿与金属结合而失活的蛋白的机制,也可能是应激蛋白增加的结果[38-39]。可溶性糖是构成植物体生物大分子的碳架和主要能量来源,可以有效地提高细胞渗透压,降低水势[40-41]。有研究表明,可溶性糖能通过保护膜结构和渗透调节来缓解胁迫[37]。在本研究中,可溶性糖含量城区显著高于山区和郊区。游离脯氨酸与植物体氧自由基的清除有密切关系,能抑制大气重金属污染导致的膜脂过氧化[42]。有研究表明,在大气污染环境下,植物体积累游离脯氨酸是一种普遍的现象[43-44],并发现在污染区,欧洲赤松(P. sylvestris)在重金属胁迫下,体内脯氨酸积累量增加[45]。在本研究中,针叶中游离脯氨酸含量表现为城区>郊区>山区,与前人研究结果一致。长期生长在污染严重地区的白皮松未见形态学上的受害病症,说明这些有机小分子渗透调节物质避免了生物大分子物质受到损害,起到维持细胞正常生理功能的作用。在本研究中,相关性分析表明,针叶中可溶性蛋白、可溶性糖和游离脯氨酸与Cu、Mn、Zn和Cd呈显著或极显著正相关关系,可溶性蛋白、可溶性糖和游离脯氨酸可能作为指示重金属胁迫的常用指标。
4 结论(1)天津城区白皮松针叶中重金属含量显著高于山区和郊区,说明城区的重金属污染较山区和郊区严重。
(2)相同样点针叶中的Cu、Mn、Cd含量,三年生针叶中积累量显著高于当年生,说明老叶比新叶更具有生物监测价值。
(3)相关性分析表明,可溶性蛋白、可溶性糖和游离脯氨酸与Cu、Mn、Zn和Cd存在极显著正相关关系,表明白皮松在遭受重金属胁迫时可能主要通过积累这三种渗透调节物质实现自我保护和对污染环境的生态适应。
| [1] |
冯茜丹, 党志, 吕玄文, 等. 大气PM2.5中重金属的化学形态分布[J]. 生态环境学报, 2011, 20(6): 1048-1052. FENG Qian-dan, DANG Zhi, LÜ Xuan-wen, et al. Chemical speciation distribution of PM2.5-bound heavy metals in the air[J]. Ecology & Environmental Sciences, 2011, 20(6): 1048-1052. |
| [2] |
Huang D S, Xu J H, Zhang S Q. Valuing the health risks of particulate air pollution in the Pearl River Delta, China[J]. Environmental Science & Policy, 2012, 15(1): 38-47. |
| [3] |
方凤满. 中国大气颗粒物中金属元素环境地球化学行为研究[J]. 生态环境学报, 2010, 19(4): 979-984. FANG Feng-man. Research on environmental geochemistry of metal elements in atmospheric particles in China[J]. Ecology & Environmental Sciences, 2010, 19(4): 979-984. |
| [4] |
Doǧanlar Z B, Atmaca M. Influence of airborne pollution on Cd, Zn, Pb, Cu, and Al accumulation and physiological parameters of plant leaves in Antakya(Turkey)[J]. Water, Air, & Soil Pollution, 2011, 214(1/2/3/4): 509-523. |
| [5] |
Aravind P, Prasad M N V. Zinc alleviates cadmium-induced oxidative stress in Ceratophyllum demersum L.:A free floating freshwater macrophyte[J]. Plant Physiology & Biochemistry, 2003, 1(4): 391-397. |
| [6] |
Fujiwara F G, Gómez D R, Dawidowski L, et al. Metals associated with airborne particulate matter in road dust and tree bark collected in a megacity(Buenos Aires, Argentina)[J]. Ecological Indicators, 2011, 11(2): 240-247. DOI:10.1016/j.ecolind.2010.04.007 |
| [7] |
Divan A M, de Oliveira P L, Perry C T, et al. Using wild plant species as indicators for the accumulation of emissions from a thermal power plant, Candiota, South Brazil[J]. Ecological Indicators, 2009, 9(6): 1156-1162. DOI:10.1016/j.ecolind.2009.01.004 |
| [8] |
张刚, 王俊霞, 徐峰, 等. 利用针叶指示电子废物拆解区重金属的污染[J]. 农业环境科学学报, 2015, 34(8): 1486-1492. ZHANG Gang, WANG Jun-xia, XU Feng, et al. Coniferous leaves as an indicator of heavy metal pollution in E-waste dismantling area[J]. Journal of Agro-Environment Science, 2015, 34(8): 1486-1492. DOI:10.11654/jaes.2015.08.008 |
| [9] |
Lau O W, Luk S F. Leaves of Bauhinia blakeanaas indicators of atmospheric pollution in Hong Kong[J]. Atmospheric Environment, 2001, 35(18): 3113-3120. DOI:10.1016/S1352-2310(01)00069-3 |
| [10] |
Parzych A, Jonczak J. Content of heavy metals in needles of Scots Pine(Pinus Sylvestris L.) in selected pine forests in Słowiński National Park[J]. Archives of Environmental Protection, 2013, 39(1): 41-51. |
| [11] |
Sun F F, Wen D Z, Kuang Y W, et al. Concentrations of sulphur and heavy metals in needles and rooting soils of Masson pine(Pinus massoniana L.) trees growing along an urban-rural gradient in Guangzhou, China[J]. Environmental Monitoring & Assessment, 2009, 154(1): 263-274. |
| [12] |
Urbat M, Lehndorff E, Schwark L. Biomonitoring of air quality in the Cologne conurbation using pine needles as a passive sampler. Part Ⅰ:Magnetic properties[J]. Atmospheric Environment, 2004, 38(23): 3781-3792. DOI:10.1016/j.atmosenv.2004.03.061 |
| [13] |
王爱霞, 方炎明. 6种交通重金属污染物在悬铃木叶、枝条组织中的分布研究[J]. 植物研究, 2011, 31(4): 478-488. WANG Ai-xia, FANG Yan-ming. Tissue distribution of 6 kinds of transport heavy metal pollutants in Platanus hispanica leaves and annual branches[J]. Bulletin of Botanical Research, 2011, 31(4): 478-488. |
| [14] |
刘家宜. 天津植物志[M]. 天津: 天津科学技术出版社, 2004. LIU Jia-yi. Flora of Tianjin[M]. Tianjin: Tianjin Science and Technology Press, 2004. |
| [15] |
Zhao R R, Shi F C, Zhou M L, et al. Resistance characteristics of Cedrus deodara and Sabina chinensis to heavy metal accumulation under different atmospheric conditions[J]. Acta Ecologica Sinica, 2017, 37(1): 18-22. DOI:10.1016/j.chnaes.2016.12.001 |
| [16] |
Serbula S M, Kalinovic T S, Ilic A A, et al. Assessment of airborne heavy metal pollution using Pinus spp. and Tilia spp.[J]. Aerosol & Air Quality Research, 2013, 13(2): 563-573. |
| [17] |
Celik A, Kartal A A, Akdoǧan A, et al. Determining the heavy metal pollution in Denizli(Turkey) by using Robinio pseudo-acacia L[J]. Environment International, 2005, 31(1): 105-112. DOI:10.1016/j.envint.2004.07.004 |
| [18] |
张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003. ZHANG Zhi-liang, QU Wei-jing. Experiment instruction of plant physiology[M]. 4th Edition. Beijing: Higher Education Press, 2003. |
| [19] |
Kingston H M. Microwave assisted acid digestion of siliceous and organically-based matrices, Method 3052[J]. Washington DC:US Environmental Protection Agency, 1988. |
| [20] |
庄树宏, 王克明. 城市大气重金属(Pb, Cd, Cu, Zn)污染及其在植物中的富集[J]. 烟台大学学报(自然科学与工程版), 2000, 13(1): 31-37. ZHUANG Shu-hong, WANG Ke-ming. Study on the relationship between atmospheric heavy metal pollution(Pb, Cd, Cu, Zn) and its accumulations in leaves of urban trees[J]. Journal of Yantai University(Natural Science & Engineering Edition), 2000, 13(1): 31-37. |
| [21] |
穆立蔷, 孙海燕, 祝宁. 东北主要绿化树种对大气中砷吸收能力的研究[J]. 植物研究, 2004, 24(2): 220-226. MU Li-qiang, SUN Hai-yan, ZHU Ning. Study on the absorption capacity of northeast main greening tree species to As in the atmosphere[J]. Bulletin of Botanical Research, 2004, 24(2): 220-226. |
| [22] |
Sun F F, Wen D Z, Kuang Y W, et al. Concentrations of heavy metals and polycyclic aromatic hydrocarbons in needles of Masson pine(Pinus massoniana L.) growing nearby different industrial sources[J]. Journal of Environmental Sciences, 2010, 22(7): 1006-1013. DOI:10.1016/S1001-0742(09)60211-4 |
| [23] |
Kuang Y W, Zhou G Y, Liu S Z. Distribution of elements in needles of Pinus massoniana(Lamb.) was uneven and affected by needle age[J]. Environmental Pollution, 2007, 145(3): 730-737. DOI:10.1016/j.envpol.2006.05.033 |
| [24] |
Chapin F S, Kedrowski R A. Seasonal changes in nitrogen and phosphorus fractions and autumn retranslocation in evergreen and deciduous taiga trees[J]. Ecology, 1983, 64(2): 376-391. DOI:10.2307/1937083 |
| [25] |
Rautio P, Huttunen S. Total vs. internal element concentrations in Scots pine needles along a sulphur and metal pollution gradient[J]. Environmental Pollution, 2003, 122(2): 273-289. DOI:10.1016/S0269-7491(02)00289-0 |
| [26] |
Ots K, Mandre M. Monitoring of heavy metals uptake and allocation in Pinus sylvestris organs in alkalised soil[J]. Environmental Monitoring & Assessment, 2012, 184(7): 4105-4117. |
| [27] |
陈培飞, 张嘉琪, 毕晓辉, 等. 天津市环境空气PM10和PM2.5中典型重金属污染特征与来源研究[J]. 南开大学学报(自然科学版), 2013, 46(6): 1-7. CHEN Pei-fei, ZHANG Jia-qi, BI Xiao-hui, et al. Pollution characteristics and sources of heavy metals in PM10 and PM2.5 in Tianjin City[J]. Acta Scientiarum Naturalium Universitatis Nankaiensis, 2013, 46(6): 1-7. |
| [28] |
Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology & Biochemistry, 2010, 48(12): 909-930. |
| [29] |
潘昕, 邱权, 李吉跃, 等. 干旱胁迫对青藏高原6种植物生理指标的影响[J]. 生态学报, 2014, 34(13): 3558-3567. PAN Xin, QUAN Quan, LI Ji-yue, et al. Physiological indexes of six plant species from the Tibetan Plateau under drought stress[J]. Acta Ecological Sinica, 2014, 34(13): 3558-3567. |
| [30] |
Mishra S, Srivastava S, Tripathi R D, et al. Phytochelatin synthesis and response of antioxidants during cadmium stress in Bacopa monnieri L.[J]. Plant Physiology & Biochemistry, 2006, 44(1): 25-37. |
| [31] |
Zhang S S, Zhang H M, Qin R, et al. Cadmium induction of lipid peroxidation and effects on root tip cells and antioxidant enzyme activities in Vicia faba L.[J]. Ecotoxicology, 2009, 18(7): 814-823. DOI:10.1007/s10646-009-0324-3 |
| [32] |
Peng D, Shafi M, Wang Y, et al. Effect of Zn stresses on physiology, growth, Zn accumulation, and chlorophyll of Phyllostachy spubescens[J]. Environmental Science & Pollution Research, 2015, 22(19): 14983-14992. |
| [33] |
Mutlu S, AticiÖ, Esim N, et al. Essential oils of catmint(Nepeta meyeri Benth.) induce oxidative stress in early seedlings of various weed species[J]. Acta Physiologiae Plantarum, 2011, 33(3): 943-951. DOI:10.1007/s11738-010-0626-3 |
| [34] |
Jiang J, Zhuang J Y, Fan Y Y, et al. Mapping of QTLs for leaf malondialdehyde content associated with stress tolerance in rice[J]. Rice Science, 2009, 16(1): 72-74. DOI:10.1016/S1672-6308(08)60059-1 |
| [35] |
Ivanov Y V, Kartashov A V, Ivanova A I, et al. Effects of zinc on Scots pine(Pinus sylvestris L.) seedlings grown in hydroculture[J]. Plant Physiology & Biochemistry, 2016, 102: 1-9. |
| [36] |
Rai P K. Impacts of particulate matter pollution on plants:Implications for environmental biomonitoring[J]. Ecotoxicology & Environmental Safety, 2016, 129: 120-136. |
| [37] |
Kandziora-Ciupa M, CiepałR, Nadgórska-Socha A, et al. A comparative study of heavy metal accumulation and antioxidant responses in Vaccinium myrtillus L. leaves in polluted and non-polluted areas[J]. Environmental Science & Pollution Research, 2013, 20(7): 4920-4932. |
| [38] |
Mesmar M N, Jaber K. The toxic effect of lead on seed germination, growth, chlorophyll and protein contents of wheat and lens[J]. Acta Biologica Hungarica, 1990, 42(4): 331-344. |
| [39] |
Seregin I V, Ivanov V B. Physiological aspects of cadmium and lead toxic effects on higher plants[J]. Russian Journal of Plant Physiology, 2001, 48(4): 523-544. DOI:10.1023/A:1016719901147 |
| [40] |
Qi Y Q, Wang J Y, Wang Q, et al. Physiological response of Chinese wolfberry seedling to NaCl stress[J]. Agricultural Science & Technology, 2016, 17(6): 1301-1304. |
| [41] |
苏明洁, 廖源林, 叶充, 等. 镉胁迫下苦楝(Melia azedarach L.)幼苗的生长及生理响应[J]. 农业环境科学学报, 2016, 35(11): 2086-2093. SU Ming-jie, LIAO Yuan-lin, YE Chong, et al. The growth and physiological responses of Melia azedarach L. seedlings to cadmium stress[J]. Journal of Agro-Environment Science, 2016, 35(11): 2086-2093. DOI:10.11654/jaes.2016-0929 |
| [42] |
Wang F J, Zeng B, Sun Z X, et al. Relationship between proline and Hg2+-induced oxidative stress in a tolerant rice mutant[J]. Archives of Environmental Contamination & Toxicology, 2009, 56(4): 723-731. |
| [43] |
Seeyeednejad S M, Koochak H. A study on air pollution-induced biochemical alterations in Eucalyptus camaldulensis[J]. Australian Journal of Basic & Applied Sciences, 2011, 5(3): 601-606. |
| [44] |
Chen C T, Chen T H, Lo K F, et al. Effects of proline on copper transport in rice seedlings under excess copper stress[J]. Plant Science, 2004, 166(1): 103-111. DOI:10.1016/j.plantsci.2003.08.015 |
| [45] |
Kandziora-Ciupa M, CiepałR, Nadgórska-Socha A, et al. Accumulation of heavy metals and antioxidant responses in Pinus sylvestris L. needles in polluted and non-polluted sites[J]. Ecotoxicology, 2016, 25(5): 970-981. DOI:10.1007/s10646-016-1654-6 |
 2017, Vol. 36
2017, Vol. 36