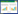文章信息
- 朱秀辉, 曾巧云, 解启来, 丁丹, 茹淑玲
- ZHU Xiu-hui, ZENG Qiao-yun, XIE Qi-lai, DING dan, RU Shu-ling
- 广州市北郊蔬菜基地土壤四环素类抗生素的残留及风险评估
- Residues and risk assessment of tetracycline antibiotics in vegetable-growing soils from suburban areas of northern Guangzhou
- 农业环境科学学报, 2017, 36(11): 2257-2266
- Journal of Agro-Environment Science, 2017, 36(11): 2257-2266
- http://dx.doi.org/10.11654/jaes.2017-0549
文章历史
- 收稿日期: 2017-04-12
- 接受日期: 2017-07-05
畜禽粪便农用是目前处置方法中最有前景和主要的方法,且绿色蔬菜基地和有机蔬菜基地等经有关机构认证的蔬菜基地也强调有机肥的施用,以改善耕作土壤质量。由于畜禽粪便普遍含有抗生素,且含量较高[1-2],蔬菜基地大量直接使用含有抗生素的畜禽粪便和/或由畜禽粪便堆制的有机肥,势必会造成土壤中抗生素的积累和污染。
土壤抗生素污染一方面破坏土壤微生物的群落结构与功能,干扰生态系统物质循环和能量流动[3],甚至被农作物吸收累积[4]而危及农产品安全;另一方面土壤抗生素污染作为面型污染源通过淋滤、地表径流等造成地表水和地下水抗生素污染[5],对水生生物造成各种毒害,最终危及人类健康。因此,近年来抗生素已经成为一类新型的重要环境有机污染物。
城市近郊,作为城市生活与生产资料的来源地,该地段土壤污染情况将直接关系到农产品的安全生产和人们的身体健康。广州市北郊全年蔬菜种植面积约13 186 hm2,占全市总种植面积的9.06%,位居第二。在众多的抗生素中,四环素类抗生素的用量达全国抗生素总用量的7%[6]。因此,本研究针对广州市北郊,调查其蔬菜基地土壤中四环素类抗生素的残留情况,并引入层次分析法、风险商值法和指示克里金法,分析研究区域土壤抗生素的主要来源、生态风险以及空间分布,以期为蔬菜基地土壤质量管理和畜禽粪便农用抗生素的污染控制提供科学依据。
1 材料与方法 1.1 研究区概况研究区位于广州市北部,112°56′56″~113°28′1″E,23°14′53″~23°37′1″N,亚热带湿润季风气候,属于东南丘陵的一部分,海拔高度介于1.2~581.1 m。
1.2 仪器设备与试剂本研究所用仪器设备:Agilent 1200型高效液相色谱仪,6410三重四极杆质谱仪,IKA Voterx 1漩涡混合器,2101TH超声波清洗器,TGL-18MS高速冷冻离心机和VisiprepTM-DL型固相萃取装置(Supelco)。
本研究采用Oasis® HLB固相萃取小柱(500 mg,6cc),填料为N-乙烯基吡啶烷酮和二乙烯苯共聚物,美国Waters公司生产。CNWBOND SAX(Strong anion exchanger,强阴离子交换)固相萃取小柱(500 mg,6 mL)德国CNW科技公司生产(CNW TECHNOLOGIES GMBH)。
本论文选择3种四环素类抗生素(TCs),分别是四环素(TC)、金霉素(CTC)和土霉素(OTC),均购买于CATO(Cato Research Chemicals Inc,美国),纯度均大于96.2%。选择地美环素(DMC)作为内标(IS),购于Dr.Ehrenstorfer(德国),纯度大于99.0%。
甲醇、甲酸(色谱纯)购买于CNW公司,纯度大于98%。实验用水均为超纯水,其他化学试剂均为分析纯。
抗生素标准溶液:准确称取各种抗生素标准品溶于甲醇,配制成1000 μg·mL-1的各种抗生素标准储备液。取各种储备液适量,用甲醇稀释成混合标准母液,取混合标准母液以甲醇逐步稀释,配成校正曲线工作液,避光储备于冰箱。
提取液配制:称取一水合柠檬酸10.5 g,二水合柠檬酸钠14.7 g,乙二胺四乙酸钠(Na2EDTA)1.86 g溶于500 mL纯净水,得到含1 mmol·L-1 Na2EDTA的0.1 mol·L-1柠檬酸缓冲液(pH=4),然后与500 mL甲醇1:1混合即得含1 mmol·L-1 Na2EDTA的0.1 mol·L-1柠檬酸缓冲液(pH=4)。
1.3 土壤样品的采集和制备2015年7月采集土壤样品。根据研究区蔬菜基地空间分布及种植规模,采集土样共30个,涉及生产基地20个,其中17个传统蔬菜基地,2个无公害蔬菜基地,1个大棚蔬菜基地(来自同一蔬菜基地的采样点编号分别为:S1/S2;S12/S13;S14/S15;S16/S17;S18/S19;S21/S22;S24/S25;S26/S27;S28/S29/S30)。
样品采集方法主要依照《土壤环境监测技术规范》(HJ/T166—2004)中的相关要求,采用S形多点取样(深度为0~20 cm),然后用四分法保留相当于1.0 kg风干土壤样品装入牛皮纸信封,再装入塑料袋,并写好标签,用GPS记录中心点位置。采样点具体信息见图 1。
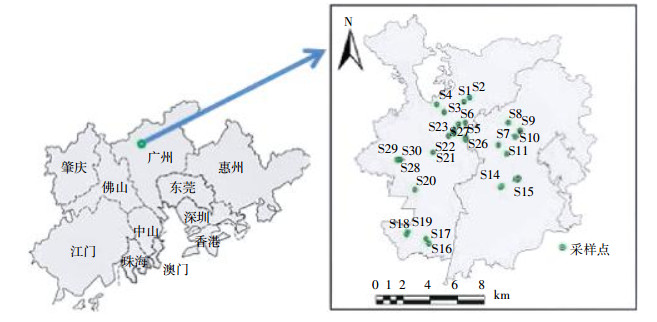
|
| 图 1 土壤采样点分布情况 Figure 1 The distribution of soil sampling sites |
采集的土壤运回实验室后,放在阴凉、干燥、通风、无特殊气味和灰尘污染的室内进行风干和碾碎。在土壤样品半干时,须将土样捏碎,以免完全干后结成硬块,难以磨细,并要剔除枯枝落叶、根茎和动物残体等杂物。风干后,采用四分法,取一部分磨碎过60目尼龙筛,用于测定土壤抗生素含量。
1.4 样品测试 1.4.1 样品预处理准确称取4.00 g样品置于100 mL玻璃离心管中,加入5 mL提取液(1.2所述)于样品中,涡旋混匀1 min((IKA Voterx 1);然后再加入5 mL提取液,常温下超声15 min;在4500 r·min-1转速下离心10 min,转移上清液于250 mL平底烧瓶。残留物继续按上述提取步骤重复5次,将上清液合并至同一平底烧瓶中。于40 ℃下旋转蒸发赶除有机溶剂至溶液无气泡产生(20~25 mL)。加入0.1 g Na2EDTA以消除金属离子干扰,并量取175 mL超纯水稀释。
1.4.2 富集与净化将SAX柱(去除腐植酸)和Oasis HLB柱串接起来,预先用3×2 mL甲醇、3×2 mL超纯水活化处理,然后加入约4 mL的酸化超纯水(pH=3),至接近充满HLB小柱。连接管路,将样品和SPE小柱及SPE装置连接,开启真空泵,调节减压阀,控制样品以5 mL·min-1的流速经过萃取小柱。
1.4.3 样品的浓缩与定容柱富集完成后,取下SAX小柱,用10 mL纯净水冲洗HLB柱,真空干燥后、分析物用2 mL甲醇洗脱3次,洗脱液接至10 mL的玻璃比色管中,在40 ℃水浴下用柔和氮气吹扫至近干,最后用含有20 μg·kg-1浓度的地美环素(IS)的甲醇/水(1:9,V/V)定容至1 mL,0.2 μm针头式滤膜过滤样品至1.5 mL棕色进样瓶中。
1.5 HPLC-MS/MS分析与质量控制采用Agilent 1200型高效液相色谱仪串联6410(QQQ)质谱测试,色谱条件:色谱柱Atlantics C18(Waters 150×2.1 mm,3 μm);保护柱GuardTM C18(4.0×3.0 mm)。流动相A为含5 mmol·L-1醋酸铵和0.1%甲酸水溶液,流动相B为甲醇;进样体积20 mL;流速0.3 mL·min-1;柱温25 ℃。梯度洗脱:初始保持B相10%,0~5 min;50%,5~13 min;90%,保持2 min;15~20 min,返回初始相。
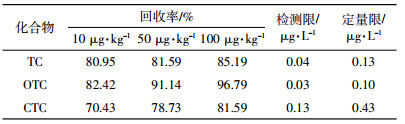
质谱条件:选择电喷雾离子源(ESI),正离子模式;干燥气温度350 ℃;干燥气流速10 L·min-1;毛细管电压4500 V;MS1与MS2温度均匀100 ℃,喷雾针压力40 psi(276 kPa);碰撞气:氮气;多离子反应监测(MRM)扫描模式。以10.0、50.0、100.0 μg·kg-1加标浓度进行四环素类化合物的回收率测定,并根据2 μg·L-1混合工作液色谱峰的10倍信噪比(S/N)确定定量限,结果见表 1。
|
为控制实验过程中人为污染,保证操作准确,每10个样品间隔设置空白样、样品平行样、样品加标样,并且在进样过程中同时进固定浓度标样进行质量控制。空白均未检出3种抗生素,平行样品的标准偏差均 < 3%。整个分析流程的回收率为70.43%~96.79%,所提供的样品分析结果尚未经回收率校正。
1.6 土壤抗生素残留的来源分析方法层次分析法(AHP)可通过判断矩阵确定每个层次的权重,是确定权重的较好方法[7]。目前,层次分析法广泛运用于农田土壤重金属污染评价和水质评价方面,提高土壤环境质量评价的有效性和准确性,增强重金属污染物权重值的科学性。但层次分析法在污染源解析方面的运用还未见报道。本文尝试引用这种方法对蔬菜基地中四环素类抗生素的来源进行权重分析。此方法通常分为三个步骤,具体描述如下:
① 建立递阶层次结构模型。本研究分为三个层次:抗生素的残留为目标层;3种抗生素为准则层;抗生素污染来源为措施层。
② 构造出各层次中所有的判断矩阵。首先确定准则层中3种抗生素的影响排序;然后确定措施层中污染源对准则层的影响大小顺序;其次构造TC、OTC和CTC对抗生素残留影响的判断矩阵和不同污染源对TC、OTC和CTC影响的判断矩阵。
③ 层次单排序及一致性检验和层次总排序及一致性检验。
最后通过Matlab计算获得权重系数,确定污染源对土壤中3种抗生素残留的贡献率。
1.7 土壤抗生素残留的风险评估方法 1.7.1 风险商值法本研究采用风险商值法(RQ)对土壤污染物进行风险评估。这也是目前土壤污染物风险评估的主要方法[8],即测定环境浓度(MEC)或预测环境浓度(PEC)与预测无效应浓度(PNEC)的比值。
PNEC可参考欧洲委员会颁布的风险评估技术指导文件中提出的使用急性或慢性数据和评估因子(AF)估算。敏感物种毒性数据可从USEPA ECOTOX数据库(http://cfpub.epa.gov/ecotox/)和生态毒理文献[9-11]中筛选获取。土壤无效应浓度(PNECsoil)可根据土壤固相-水相的浓度分配关系,用相平衡分配法计算获得。其估算方程式如下:
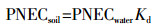
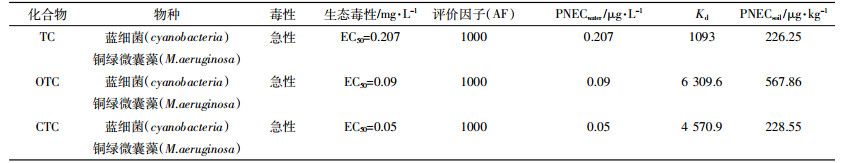
式中:Kd为土壤-水分配系数,其值从文献[12-14]中筛选获取;PNECwater为基于文献报道的最小急性毒性数据与充分考虑种间差异为1000的评价因子所得。
本文选用铜绿微囊藻类的蓝细菌作为土壤中四环素类抗生素敏感物种进行生态风险评价。计算土壤中3种TCs的PNECsoil,土壤-水分配系数见表 2。风险等级的划分参考欧洲委员会指导文件划分等级,分为三个层次:RQ≤0.1为低风险;0.1 < RQ < 1为中风险;RQ≥1为高风险。
|
本研究根据1.7.1的生态风险商值,使用指示克里金法(Kriging)对周边区域土壤3种TCs进行风险估值,并绘制区域风险空间分布图,具体操作参考文献[15]。
1.8 图形制作与数据处理本研究采用ArcGIS 10.2软件绘制采样点分布图以及克里金插值图,使用Origin、Matlab2009和Excel 2010进行数据处理。
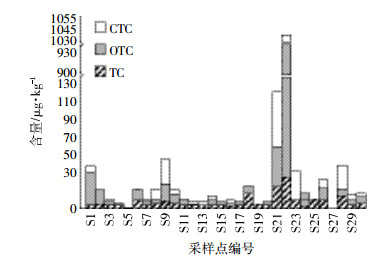
2 结果与讨论 2.1 土壤中3种TCs的含量与组成特征土壤中3种TCs的含量与组成特征见表 3和图 2。采样点土壤中TC、OTC和CTC的检出率分别为90%、90%和63%;3种TCs总含量(∑TCS)在ND(低于检测限)~1 036.52 μg·kg-1之间,平均含量为17.65 μg·kg-1(表 3),其中14个样品(占样品总数的47%)的含量低于10 μg·kg-1,18个样品(占总样品数的60%)同时检出3种目标抗生素,10个样品(占总样品数的33%)同时检出2种目标抗生素。
|
| 图 2 各采样点TCs的含量特征 Figure 2 Characteristics of the three TCs in the soils |
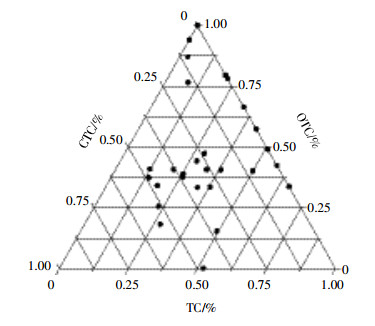
土壤中TC、OTC和CTC的含量范围分别为ND~30.37 μg·kg-1、ND~903.13 μg·kg-1和ND~103.02 μg·kg-1,其平均值分别为5.64、38.39 μg·kg-1和8.92 μg·kg-1,3种抗生素在土壤中的平均含量高低顺序为:OTC > CTC > TC(表 3)。从图 3也可以看出,绝大部分样品中OTC的含量百分比大于50%,TC的含量百分比在25%左右。
|
| 图 3 各采样点土壤中3种TCs的含量比率 Figure 3 Proportions of 3 kinds of TCs in each sample |
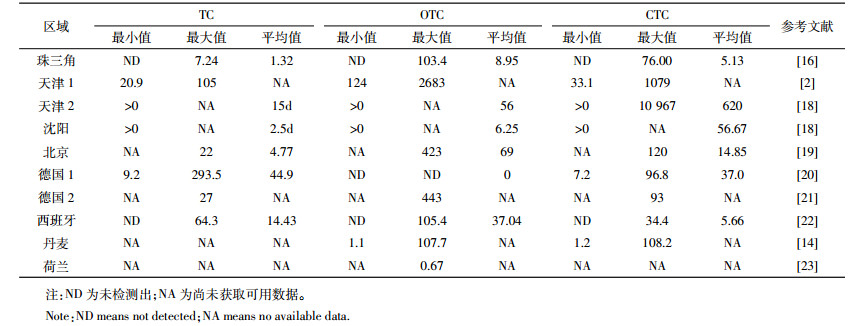
已有大量文献对复种指数较高的城市周边农业土壤抗生素含量分布进行报道(表 4)。如:珠江三角洲蔬菜基地土壤中TC、OTC和CTC的检出率分别为84%、89%和59%,含量范围分别在ND~7.24 μg·kg-1、ND~103.40 μg·kg-1和ND~76.00 μg·kg-1,OTC的平均含量高于TC和CTC[16];长三角地区典型设施蔬菜基地TC、OTC和CTC的检出率分别为100%、100%、97%,含量范围介于0.97~48.9、1.73~432 μg·kg-1和0~102 μg·kg-1之间,3种TCs的平均含量高低顺序为OTC(28.51 μg·kg-1) > CTC(4.10 μg·kg-1) > TC(3.30 μg·kg-1)[17],与本研究结果相似。京津冀地区土壤抗生素污染也较严重,天津、沈阳施用粪肥改良后的土壤中TCs的检出率为100%[18];北京郊区大规模大棚蔬菜基地土壤TC、OTC和CTC的检出率分别为94.6%,100%,83.9%,平均含量高低顺序为OTC(80 μg·kg-1) > CTC(17 μg·kg-1) > TC(5.2 μg·kg-1),OTC和CTC的平均含量是本研究的2倍左右[19]。
|
欧盟成员国针对土壤中TCs残留早在2002年已有报道。Hamscher等[20]采集了3个时间段3个剖面的土壤调查,其中TC和CTC都可被检出,但OTC均未检出。经统计后,TC和CTC含量范围分别为9.2~293.5 μg·kg-1和7.2~96.6 μg·kg-1,平均含量高低顺序为TC > CTC > OTC,与Pawelzick等[21]的调查结果并不一致(OTC是土壤中主要的TCs)。西班牙[22]、丹麦[14]和荷兰[23]等国家的土壤TCs的检出率低于50%,而且平均含量比国内大部分区域低。这可能是因为1996年开始欧盟颁布禁用兽药指令后,欧盟各国使用量急剧减少。
土壤四环素类抗生素含量水平不仅与抗生素种类的基本理化性质有关[24],还受外在因素的影响,如影响抗生素降解的土壤温度和湿度。Hu等[2]的研究表明,冬季天津市的蔬菜土壤中OTC的含量是夏季的2~180倍。
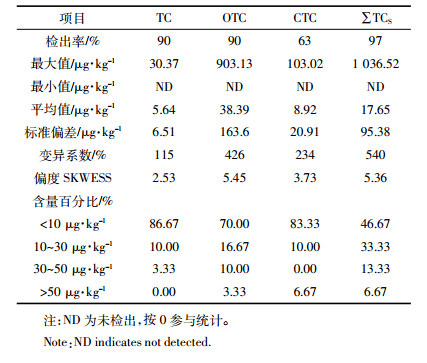
2.2 土壤中3种TCs的来源分析根据文献报道[2, 16]及本文调查结果,蔬菜基地土壤中3种抗生素的含量大小顺序为:OTC > CTC > TC。因此,本文确定3种TCs对总残留的影响排序为:OTC > CTC > TC。根据研究区3种TCs均量和Saaty提出标度,构造OTC(C1)、CTC(C2)和TC(C3)对抗生素残留影响的判断矩阵,见表 5。
根据采样过程中对本研究区施肥情况及生产状况的调查,确定研究区域蔬菜基地土壤中四环素类抗生素的主要来源有粪肥、商业有机肥、鱼塘底泥还田和鱼塘灌溉水。为了改善土壤质量,蔬菜基地大量施用粪肥和商业性有机肥,由于四环素类抗生素在粪肥中含量高于商业性有机肥[17, 25],且研究区蔬菜基地粪肥的施用量高于商业性有机肥,我们认为粪肥对土壤中四环素类抗生素残留高低的影响大于商业性有机肥。鱼塘底泥还田次数每年一般1~2次,使用鱼塘水(沟渠水)进行灌溉的基地和灌溉次数均较少(本研究区大部分采样点灌溉设施齐全),且四环素类抗生素中底泥中的含量远高于水体[26],因此我们判断鱼塘底泥对土壤中3种四环素类抗生素含量的影响大于鱼塘灌溉水。从平均含量水平(四环素类抗生素在有机肥和水产养殖沉积物中的平均含量分别为19.5、15.52 μg·kg-1)和施用数量分析,判断有机肥对土壤中四环素类抗生素含量的影响大于水产养殖沉积物。综上所述,我们判断4种来源对土壤中TC、OCT和CTC的影响排序为:粪肥 > 商业有机肥 > 鱼塘底泥 > 鱼塘灌溉水。然后构建粪肥(P1)、商业性有机肥(P2)、鱼塘底泥(P3)和鱼塘水(P4)对TC、OCT和CTC影响的判断矩阵,见表 6。
通过Matlab软件,可得出粪肥、商业性有机肥、鱼塘底泥和鱼塘灌溉水对土壤中3种TCs的残留贡献率,见表 7。

|
由表 7可知,粪肥的直接施用对土壤中3种TCs的残留贡献率超过50%,为研究区蔬菜基地土壤TCs残留的主要来源;商业性有机肥对土壤中3种TCs的残留贡献率为24%左右;粪肥和商业性有机肥对土壤中3种TCs的残留贡献率达77%。TC、OTC和CTC判断矩阵一致性检验系数(CR)分别为:0.007 8、0.018 9和0.034 9(当CR < 0.10时,判断矩阵是可接受的),层次总排序检验系数(CR)为0.021 9( < 0.10)。这表明,3种抗生素的评判矩阵及总排序具有较满意的一致性,该分析结果是可以接受的。
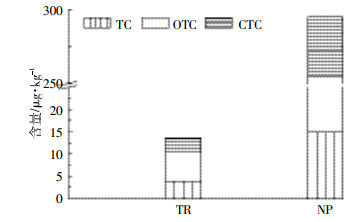
含有抗生素的畜禽粪便农用是土壤抗生素的主要来源[27]。我国浙江地区施用畜禽粪便的土壤中TC、OTC和CTC的残留量分别是未施用畜禽粪便农田的38倍、13倍和12倍[28-29]。鲍陈燕等[30]研究了不同施肥方式对蔬菜基地土壤中各类抗生素残留的影响,结果表明,土壤中各类抗生素的检出率和均量的大小顺序为:施用畜禽粪便的蔬菜地 > 施用商业性有机肥的蔬菜地 > 施用沼渣的蔬菜地 > 单施化肥的蔬菜地。Zhang等[31]的研究也表明,施用商业性有机肥的耕作土壤四环素类抗生素的残留量比施用各种粪肥及混合粪肥低。这可能是由于堆制过程中畜禽粪便中部分抗生素发生了降解[32]。本研究采样点所涉及的20个蔬菜基地包括无公害蔬菜生产基地和传统蔬菜生产基地,施肥方式和有机肥的施用量变化均较大,因此土壤中3种抗生素的含量变异系数较大(表 3),分别为115%(TC),426%(OTC)和234%(CTC)。无公害蔬菜基地以粪肥(22 500 L·hm-2)和商业性有机肥(4500 kg·hm-2)为主,辅施化肥;而传统蔬菜基地以化肥为主,辅施有机肥。进一步分析表明,无公害蔬菜基地TCs平均含量(294.77 μg·kg-1)高于传统蔬菜基地(13.57 μg·kg-1),前者是后者的22倍(图 4)。抗生素含量较高的采样点,如,S1、S9、S21、S22、S23和S28(见图 2)均是以粪肥为主,辅施化肥的蔬菜生产基地,从而进一步说明含有抗生素的畜禽粪便的农用是研究区蔬菜基地土壤中3种TCs的主要来源。
|
| 图 4 传统蔬菜生产基地(TR)和无公害蔬菜生产基地(NP)土壤中TCs平均含量特征 Figure 4 Three kinds of TCs concentrations in soils from traditional (TR)and non-environmental pollution (NP)vegetable farms |
灌溉水对土壤中四环素类抗生素的贡献率较低,为8.44%,与Chen等[33]的研究结果一致,废水灌溉土壤中OTC和CTC的检出率和平均含量均小于施用粪肥土壤或毗邻养殖场的土壤。
综上所述,本文运用层次分析法对研究区蔬菜基地土壤中四环素类抗生素的来源分析的结果是可以接受的。
2.3 土壤抗生素残留的风险评估陆地环境污染物风险评估时,可选生物体毒性数据较少,而水体生物的毒性数据已有大量报道[34]。USEPA ECOTOX数据库也都是针对水体浓度而言。事实上,土壤固相-水相(孔隙水)间存在物质交换,土壤吸附的抗生素可能释放到孔隙水或水体中被生物利用,土壤中能被生物直接利用的只有土壤水相即孔隙水中抗生素[35]。因此,土壤中污染物的风险评估可以采用水、土壤共生的生物毒性数据。
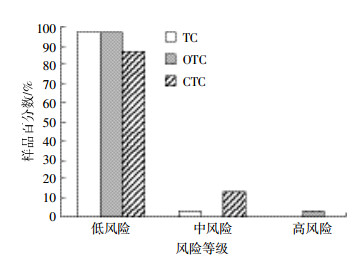
本研究采用风险商值法,计算和评估研究区蔬菜基地土壤中3种TCs的风险商值(RQ介于0~1.59,数据未列出)和风险等级。26个采样点(占样品总数的87%)3种TCs均处于低风险,只有1个蔬菜基地的2个样点(S21和S22)OTC处于高风险(图 5)。因此,OTC是研究区TCs高风险的主要成分,与Zhang等[31]的报道相似。
|
| 图 5 采样点土壤3种TCs的风险等级分布图 Figure 5 The distribution of risk ranks of 3 kinds of TCs in all soil samples |
此外,参考兽药国际筹划指导委员会(VICH)提出土壤抗生素生态毒害效应触发值(100 μg·kg-1),除S22采样点处于高风险外,本研究区域其他采样点单个化合物含量和3种TCs总含量均低于触发值,属于低生态毒害效应区域,低于北京市蔬菜基地土壤(39.3%的样点属于高风险)。
2.4 抗生素生态风险空间分布指示克里金(Kriging)在重金属污染的环境风险评估已成为热点,但在抗生素的生态风险中鲜见报道。本研究尝试采用该方法获得研究区蔬菜基地土壤抗生素生态风险空间分布情况。
克里金法插值的阈值根据风险商值(RQ)的等级划分值(0.1和1)设定,但结合Arcgis克里金插值默认最低等级为3。因此,本研究在临界值0.1的基础上取其中值0.05,来区分风险更低区域。通过0.05、0.1、1和预测无观察效应浓度计算获得克里金插值的阈值,再对数据进行归一化处理,并获得研究区生态风险空间分布图(图 6)。
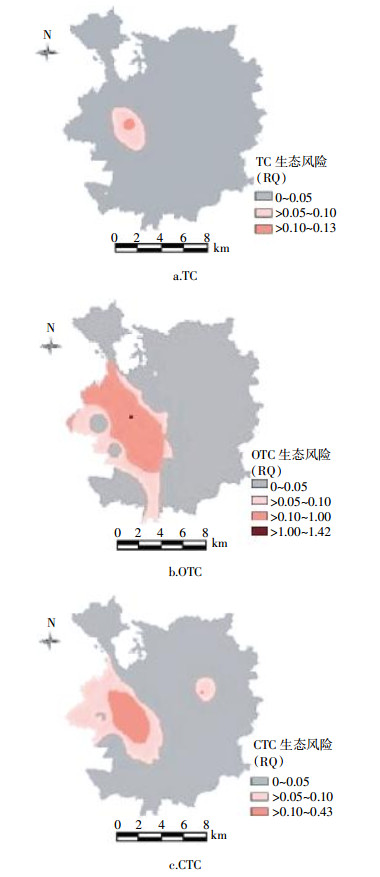
|
| 图 6 研究区3种TCs生态风险空间分布图 Figure 6 The spatial distribution of ecological risk of 3 kinds of TCs in the study area |
从图 6可以看出,研究区蔬菜基地土壤四环素的生态风险较低,基本处于低风险等级。部分区域土霉素和金霉素的生态风险处于中风险等级,个别地区土壤土霉素处于高风险状态,主要位于该区域西部,其他地区基本处于低风险。样品采集过程中,还对研究区作物种植和畜禽养殖的基本分布情况进行了调查,研究区西南部主要分布蔬菜生产基地、养殖鱼塘和畜禽业,东北部主要以水稻种植和果园为主。研究区蔬菜基地主要施用粪肥(鸡粪)和商业有机肥,而且复种指数较高,都可能导致土壤抗生素的残留。总的来说,广州市北郊蔬菜基地土壤抗生素污染虽未到达严重恶化的程度,但值得关注,其中土霉素的生态风险相对较高,重点防控区域为研究区的西部。
3 结论(1)广州市北郊蔬菜基地土壤TC、OTC和CTC的含量范围分别为ND~30.37、ND~903.13 μg·kg-1和ND~103.02 μg·kg-1,其平均值分别为5.64、38.39 μg·kg-1和8.92 μg·kg-1,3种TCs在土壤中的平均含量高低顺序为:OTC > CTC > TC。
(2)基于层次分析法可知,粪肥是土壤中3种TCs的主要来源,其贡献率大于50%;其次是商业性有机肥,其贡献率为24%左右。
(3)广州市北郊蔬菜基地土壤中3种TCs的生态风险整体较低,但西部部分区域处于中、高风险等级,首要防控污染物为OTC,其次是CTC。
| [1] |
孙刚. 畜禽粪便中四环素类抗生素检测分析及其在堆肥中的降解研究[D]. 合肥工业大学, 2010, 25. SUN Gang. Determination of tetracyclines in manure and their degradation during manure composting[D]. Hefei University of Technology, 2010, 25. http://cdmd.cnki.com.cn/Article/CDMD-10359-2010245855.htm |
| [2] |
Hu X G, Zhou Q X, Luo Y. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, Northern China[J]. Environmental Pollution, 2010, 158(9): 2992-2998. DOI:10.1016/j.envpol.2010.05.023 |
| [3] |
Liu W, Pan N, Chen W, et al. Effect of veterinary oxytetracycline on functional diversity of soil microbial community[J]. Plant Soil and Environment, 2012, 58(7): 295-301. |
| [4] |
Redshawa C H, Wootton V G, Rowland S J. Uptake of the pharmaceutical fluoxetine hydrochloride from growth medium by Brassicaceae[J]. Phytochemistry, 2008, 69(13): 2510-2516. DOI:10.1016/j.phytochem.2008.06.018 |
| [5] |
Weiss K, Schüssler W, Porzelt M. Sulfamethazine and flubendazole in seepage water after the sprinkling of manured areas[J]. Chemosphere, 2008, 72(9): 1292-1297. DOI:10.1016/j.chemosphere.2008.04.053 |
| [6] |
Zhang Q, Ying G, Pan C, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science Technology, 2015, 49: 6772-6782. DOI:10.1021/acs.est.5b00729 |
| [7] |
常建娥, 将太立. 层次分析法确定权重研究[J]. 武汉理工大学学报·信息与管理工程版, 2007, 29(1): 153-156. CHANG Jian-e, JIANG Tai-li. Research on the weights of coefficient through Analytic Hierarchy Process[J]. Journal of WUT(Information & Management Engineering), 2007, 29(1): 153-156. |
| [8] |
吴艳阳, 吴群河, 罗昊, 等. 沉积物中多环芳烃的生态风险评价法研究[J]. 环境科学学报, 2013, 33(2): 544-556. WU Yan-yang, WU Qun-he, LUO Hao, et al. Ecological risk assessment for polycyclic aromatic hydrocarbons in river sediments[J]. Act Scientiae Circumstantiae, 2013, 33(2): 544-556. |
| [9] |
Lanzky P F, Halling-serensen B. The toxic effect of the antiboticmetronodazole on aquatic organisms[J]. Chemosphere, 1997, 35(11): 2553-2561. DOI:10.1016/S0045-6535(97)00324-X |
| [10] |
Lützhøft H C Holten, Halling-Sørensen B, Jørgensen S E. Algal toxicity of antibacterial agents applied in danish fish farming[J]. Arch Environ Contam Toxicol, 1999, 36: 1-6. DOI:10.1007/s002449900435 |
| [11] |
Halling-Sorensen B. Algal toxicity of antibacterial agents used in intensive farming[J]. Chemosphere, 2000, 40(7): 731-739. DOI:10.1016/S0045-6535(99)00445-2 |
| [12] |
Pan M, Chu L M. Adsorption and degradation of five selected antibiotics in agricultural soil[J]. Science of the Total Environment, 2016, 545/546: 48-56. DOI:10.1016/j.scitotenv.2015.12.040 |
| [13] |
Gong W, Liu X, He H, et al. Quantitatively modeling soil-water distribution coefficients of three antibiotics using soil physicochemical properties[J]. Chemosphere, 2012, 89(7): 825-831. DOI:10.1016/j.chemosphere.2012.04.064 |
| [14] |
Jacobsen A M, Halling-Sørensen B, Ingerslev F, et al. Simultaneous extraction of tetracycline, macrolide and sulfonamide antibiotics from agricultural soils using pressurised liquid extraction, followed by solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2004, 1038(1/2): 157-170. |
| [15] |
王季槐, 王大霞, 汪建文, 等. 农田环境空间异质性及农作物生产安全风险评价方法研究:以蔬菜生产为例[J]. 生物数学学报, 2014, 29(1): 68-76. WANG Ji-huai, WANG Da-xia, WANG Jian-wen, et al. Study on spatial heterogeneity of farmland environment and risk assessment of crop production safety-take vegetable production as example[J]. Journal of Biomathematics, 2014, 29(1): 68-76. |
| [16] |
邰义萍. 珠三角地区蔬菜基地土壤中典型抗生素的污染特征研究[D]. 暨南大学, 2010: 1-78. TAI Yi-ping. The study on pollution characteristics of typical antibiotics in soil from vegetable fields of Pearl River Delta Area[D]. Jinan University, 2010:1-78. http://cdmd.cnki.com.cn/Article/CDMD-10559-2010124501.htm |
| [17] |
罗凯, 李文红, 章海波, 等. 南京典型设施菜地有机肥和土壤中四环素类抗生素的污染特征调查[J]. 土壤, 2014, 46(2): 330-338. LUO Kai, LI Wen-hong, ZHANG Hai-bo, et al. Investigation on characteristics of tetracycline antibiotics in organic fertilizer and soil in Nanjing[J]. Soil, 2014, 46(2): 330-338. |
| [18] |
Hou J, Wan W, Mao D, et al. Occurrence and distribution of sulfonamides, tetracyclines, quinolones, macrolides, and nitrofurans in livestock manure and amended soils of Northern China[J]. Environmental Science and Pollution Research, 2015, 22(6): 4545-4554. DOI:10.1007/s11356-014-3632-y |
| [19] |
Li C, Chen J Y, Wang J H, et al. Occurrence of antibiotics in soils and manures from greenhouse vegetable production bases of Beijing, China and an associated risk assessment[J]. Science of the Total Environment, 2015, 521/522: 101-107. DOI:10.1016/j.scitotenv.2015.03.070 |
| [20] |
Hamscher G, Sczesny S, Höper H, et al. Determination of persistent tetracycline residues in soil fertilized with liquid manure by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry[J]. Analytical Chemistry, 2002, 74(7): 1509-1518. DOI:10.1021/ac015588m |
| [21] |
Pawelzick H T, Hoper H, Nau H, et al. A survey of the occurrence of various tetracyclines and sulfamethazine in sandy soils in northwestern Germany fertilized with liquid manure//SETAC Euro 14th Annual Meeting, Prague, Czech Republic, 2004, 4:18-22.
|
| [22] |
Andreu V, Vazquez-roig P, Blasco C, et al. Determination of tetracycline residues in soil by pressurized liquid extraction and liquid chromatography tandem mass spectrometry[J]. Anal Bioanal Chem, 2009, 394: 1329-1339. DOI:10.1007/s00216-009-2635-x |
| [23] |
Chitescu C L, Oosterink E, Jong J D, et al. Ultrasonic or accelerated solvent extraction followed by U-HPLC-high mass accuracy MS for screening of pharmaceuticals and fungicides in soil and plant samples[J]. Talanta, 2012, 88: 653-662. DOI:10.1016/j.talanta.2011.11.054 |
| [24] |
郭丽, 王淑平. 兽用抗生素在土壤中运移规律研究进展[J]. 环境科学与技术, 2014, 37: 237-246. GUO Li, WANG Shu-ping. Migration law of Veterinary Antibiotics in soil[J]. Environmental Science & Technology, 2014, 37: 237-246. |
| [25] |
国彬, 姚丽贤, 刘忠珍, 等. 广州市兽用抗生素的环境残留研究[J]. 农业环境科学学报, 2011, 30(5): 938-945. GUO Bin, YAO Li-xian, LIU Zhong-zhen, et al. Environmental residues of veterinary antibiotic in Guangzhou City, China[J]. Journal of Agro-Environment Science, 2011, 30(5): 938-945. |
| [26] |
梁惜梅, 施震, 黄小平. 珠江口典型水产养殖区抗生素的污染特征[J]. 生态环境学报, 2013, 22(2): 304-310. LIANG Xi-mei, SHI Zhen, HUANG Xiao-ping. Occurrence of antibiotics in typical aquaculture of the Pearl River Estuary[J]. Ecology and Environmental Sciences, 2013, 22(2): 304-310. |
| [27] |
Wei R, Ge F, Zhang L, et al. Occurrence of 13 veterinary drugs in animal manure-amended soils in Eastern China[J]. Chemosphere, 2016, 144: 2377-2383. DOI:10.1016/j.chemosphere.2015.10.126 |
| [28] |
Zhang H M, Zhang M K, Gu G P. Residues of tetracyclines in livestock and poultry manures and agricultural soils from North Zhejiang Province[J]. Journal of Ecology and Rural Environment, 2008, 24(3): 69-73. |
| [29] |
张慧敏, 章明奎, 顾国平. 浙北地区畜禽粪便和农田土壤中四环素类抗生素残留[J]. 生态与农村环境学报, 2008, 24(3): 69-73. ZHANG Hui-min, ZHANG Ming-kui, GU Guo-ping. Residues of Tetracyclines in livestock and poultry manures and agricultural soils from North Zhejiang Province[J]. Journal of Ecology Rural Environment, 2008, 24(3): 69-73. |
| [30] |
鲍陈燕, 顾国平, 徐秋桐, 等. 施肥方式对蔬菜地土壤中8种抗生素残留的影响[J]. 农业资源与环境学报, 2014, 31(4): 313-318. BAO Chen-yan, GU Guo-ping, XU Qiu-tong, et al. Residues of eight Antibiotics in vegetable soils affected by fertilization methods[J]. Journal of Agricultural Resource and Environment, 2014, 31(4): 313-318. |
| [31] |
Zhang H B, Zhou Y, Huang Y J, et al. Residues and risks of veterinary antibiotics in protected vegetable soils following application of different manures[J]. Chemosphere, 2016, 152: 229-237. DOI:10.1016/j.chemosphere.2016.02.111 |
| [32] |
Zhang H, Luo Y, Wu L, et al. Residues and potential ecological risks of veterinary antibiotics in manures and composts associated with protected vegetable farming[J]. Environ Sci Pollut Res Int, 2015, 22: 5908-5918. DOI:10.1007/s11356-014-3731-9 |
| [33] |
Chen C Q, Li J, Chen P P, et al. Occurrence of antibiotics and antibiotic resistances in soils from wastewater irrigation areas in Beijing and Tianjin, China[J]. Environmental Pollution, 2014, 193: 94-101. DOI:10.1016/j.envpol.2014.06.005 |
| [34] |
He X, Deng M, Wang Q, et al. Residues and health risk assessment of quinolones and sulfonamides in cultured fish from Pearl River Delta, China[J]. Aquaculture, 2016, 458: 38-46. DOI:10.1016/j.aquaculture.2016.02.006 |
| [35] |
Jechalke S, Heuer H, Siemens J, et al. Fate and effects of veterinary antibiotics in soil[J]. Trends Microbiol, 2014, 22: 536-545. DOI:10.1016/j.tim.2014.05.005 |
 2017, Vol. 36
2017, Vol. 36