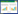文章信息
- 宋立超, 张薇, 钮旭光, 李瑞, 曹阳, 赵浩宇, 周立炀
- SONG Li-chao, ZHANG Wei, NIU Xu-guang, LI Rui, CAO Yang, ZHAO Hao-yu, ZHOU Li-yang
- 焦化厂区地肤根际芘降解细菌筛选和促生潜力研究
- Screening of pyrene-degrading bacteria from Kochia scoparia rhizosphere in coking plant and study of plant growth-promoting ability
- 农业环境科学学报, 2017, 36(11): 2275-2280
- Journal of Agro-Environment Science, 2017, 36(11): 2275-2280
- http://dx.doi.org/10.11654/jaes.2017-0997
文章历史
- 收稿日期: 2017-07-17
- 接受日期: 2017-10-16
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是环境中普遍存在的一类持久性有机污染物,给人类健康和生态环境造成了严重的危害[1-2],它是焦化厂污染土壤中的主要污染物之一,主要来源于炼焦过程中煤的不完全燃烧[3]。李凤梅等[4]报道沈阳某焦化厂土壤中13种PAHs质量浓度总和为5 672.00 mg·kg-1,且以4环和5环为主,占PAHs总和的75.21%。冯嫣等[5]报道北京某焦化厂车间土壤中PAHs质量浓度为144.81 mg·kg-1,以3环和4环为主。近年,由于环境污染和城市规划等原因,一些市中心的焦化厂开始搬迁,而遗留的场地将被改为居住和商业用地。因此,如何有效地清除或降低焦化厂地PAHs污染风险便成为人们重点关注的问题。
针对焦化厂目前已有的PAHs修复技术包括化学淋洗、化学氧化、电动修复、微生物修复和植物修复等[6]。其中微生物修复和植物修复方法由于低耗、经济有效且环境友好等特点,已成为目前污染土壤修复的主要方式[7-8]。Sun等[9]从焦化厂土壤筛选分离出菌株Kocuria sp. P10,液体培养14 d对芴、荧蒽和芘的降解率分别为83.2%、76.5%和59.6%。但由于游离降解菌难于在土壤中存活,导致单纯的微生物修复技术难以大面积推广。Smith等[10]选取了高羊茅、紫羊茅、黑麦草、红车轴草和三叶草分别修复焦化厂污染的土壤,结果表明植物对3环和4环的PAHs具有一定的修复能力。但由于PAHs具有一定的毒性,可影响植物的生长,致使单纯通过植物修复的效率并不高,如何提高植物对PAHs毒性的抗性、提高植物的生物量、降低PAHs的浓度成为提高植物修复效率的重要途径[11]。微生物和植物联合修复技术可弥补各自缺点,微生物可部分降解PAHs,降低土壤PAHs的浓度,减轻PAHs对植物的毒害,而植物的根际区可为共生菌提供良好的生长环境,利于菌株的存活,此外根际共生菌往往还具有促生功能,能够提高植物的生物量[12-13]。Guo等[12]向农田污染土壤中添加降解PAHs的分枝杆菌,可提高黑麦草对PAHs的去除率和土壤中降解PAHs功能微生物的数量。然而,目前关于焦化厂原位优势植物根际区专性降解PAHs促生菌的研究还未见报道。
笔者对沈阳某弃用焦化厂土壤PAHs进行检测,结果表明4环芘的含量最高,占PAHs总量的15.11%,故该试验选择芘为PAHs的代表模型。利用富集法,从焦化厂区优势植物地肤根际分离具芘降解能力的促生菌,研究它们的促生潜能、降解芘的能力以及对地肤种子生长的影响,以期为焦化厂土壤PAHs污染植物-微生物修复提供理论依据。
1 材料与方法 1.1 材料 1.1.1 主要试剂芘(纯度 > 97%)购自Fluka公司;1-氨基环丙烷-1-脱氨酶(1-amino cyclopropane-1-deaminase,ACC)、吲哚乙酸(Indoleacetic Acid,IAA)购自华中海威(北京)基因科技有限公司。
1.1.2 主要培养基① 液体无机盐培养基(g·L-1):MgSO4·7H2O 0.2,K2HPO4 0.8,(NH4)2SO4 1.0,KH2PO4 0.2,NaCl 20.0,CaCl2·2H2O 0.1,葡萄糖0.05,调节pH至8.0。
② DF盐培养基(g·L-1):葡萄糖2.0,(NH4)2SO4 2.0,Na2HPO4 6.0,MgSO4·7H2O 0.2,KH2PO4 4.0,葡萄糖酸2.0,柠檬酸2.0,调节pH至8.0。
③ ADF培养基:用ACC替代DF培养基中(NH4)2SO4,将ACC溶于灭菌蒸馏水后,再过0.22 μm有机滤膜除菌,使其最终浓度为3.0 mmol·L-1。
④ PKO培养基(g·L-1):Ca3(PO4)2 5.0,葡萄糖5.0,NaCl 20.0,KCl 0.3,(NH4)2SO4 0.5,MnSO4·4H2O 0.03,MgSO4·7H2O 0.3,FeSO4·7H2O 0.03,琼脂20.0,调节pH至8.0。
1.1.3 土样的采集及理化性质测定2016年7月,在沈阳某弃用焦化厂区外(41°48′N,123°20′E)采集生长优势植物地肤,采用五点采样法取样,每点掘出面积为10 cm×10 cm,深度为10 cm的包含地肤根系的整块土壤样本,实验室无菌条件下将根际和非根际土壤刮下备用,于4 ℃冰箱保存。测定土壤有机质、pH值、速效N、速效P、速效K以及土壤和地肤中16种PAHs含量。16种PAHs的测定参考Khan等[14]的方法。PAHs的方法检出限为0.021~0.103 mg·kg-1(干重),土壤基质加标回收率为84.21%~108.36%。
1.2 根际土壤中具促生能力的芘降解细菌的筛选取5 g地肤根际土加入到45 mL液体无机盐培养基中(含芘浓度为25 mg·L-1),28 ℃、120 r·min-1振荡培养7 d;取上述培养液5 mL再次加入到45 mL含芘的液体无机盐培养基中,28 ℃、120 r·min-1培养7 d,重复3次,稀释平板法LB固体培养基计数芘耐受菌的数量。
吸取1 mL上述富集液加入到30 mL DF盐培养基中,28 ℃、120 r·min-1振荡培养24 h,按上述方法再次转接1 mL至30 mL的ADF液体培养基中,28 ℃、120 r·min-1培养24 h,重复3次,通过ADF固体培养基进行稀释分离单菌落。
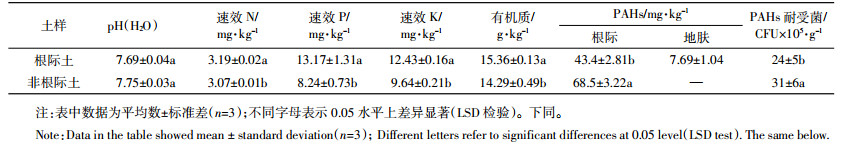
1.3 芘降解细菌的鉴定利用细菌16S rRNA通用引物(F27:5′-AGAGTT TGATCMTGGCTCAG-3′,R1492:5′-TACGYTACCTT GTTACGACT-3′)序列进行PCR扩增,具体参照宋立超等[15]的方法。获得产物进行测序,然后将所测得序列在GenBank中进行比对。同时常规方法对分离菌的形态、革兰氏染色、芽孢以及菌落特征进行分析。
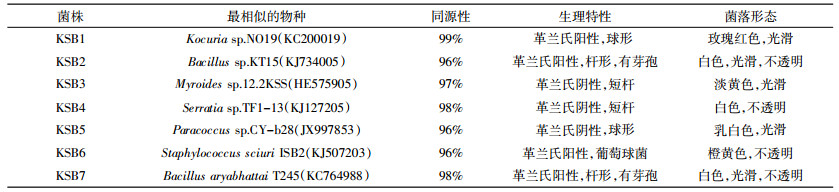
1.4 分离细菌的特点 1.4.1 促生特性测定所分离菌株的ACC脱氨酶活性测定参照Liu等[16]的方法,解磷能力参照张国壮等[17]的方法,产物IAA的检测采用Salkowski方法[18],产铁载体能力参照Payne的[19]方法。
1.4.2 分离菌种的降解特征以浓度108 CFU·mL-1的投菌量和含芘25 mg·L-1液体无机盐培养基为基础,分别投加所筛选细菌,以不加任何菌株作为对照,28 ℃、120 r·min-1恒温振荡培养,分别在7 d和14 d取样分析芘残留量。每个处理设3次重复。溶液中芘的萃取参照宋立超等[15]的方法,芘的测定采用液相色谱法。
1.5 芘胁迫下菌株对地肤种子的促生能力地肤种子的前处理参照Liu等[13]的方法,先将地肤种子用70%的酒精表面消毒2 min,然后再用1%次氯酸钠消毒10 min,最后用无菌水冲洗3遍,20粒消毒后的种子放入铺有两层滤纸的培养皿中,分别添加不同浓度的芘溶液(0、10、25 mg·L-1)和1 mL的菌悬液(OD600nm=0.6~0.8),28 ℃培养5 d,测定种子的发芽率和芽长。
1.6 统计分析统计分析使用SPSS 16.0,样品均值的比较采用LSD检验(α=0.05),数据处理使用软件Origin 8.1。
2 结果与分析 2.1 供试土壤性质地肤根际和非根际土壤理化性质见表 1,可见该地区土壤为弱碱性,地肤根际区的有机质、速效N、速效P和速效K均显著高于非根际区。根际区PAHs质量浓度与非根际区相比,减少了25.1 mg·kg-1,而地肤中PAHs浓度却为7.69 mg·kg-1,且根际区含有大量的PAHs耐受菌,这部分菌株具有降解PAHs的潜能,表明地肤根际区PAHs的去除可能是由植物累积和微生物降解协同作用完成。
以芘和AAC为唯一碳源和氮源从地肤根际富集分离出可培养细菌7株,分别编号为KSB1、KSB2、KSB3、KSB4、KSB5、KSB6和KSB7,其菌落形态及鉴定结果列于表 2。菌株KSB2和KSB7均为芽孢杆菌属,长杆、有芽孢、革兰氏染色为阳性、白色菌落;KSB4为沙雷氏菌,短杆、革兰氏染色阴性、白色菌落。
分离菌株促生特性结果列于表 3,除了菌株KSB3和KSB6以外,其余5株菌ACC脱氨酶活性均大于1.0 M α-丁酮酸mg-1·h-1(M α-KB mg-1·h-1),其中菌株KSB2、KSB4和KSB7的ACC脱氨酶活性在3.55~5.21 M α-KB mg-1·h-1;7株菌均具有产IAA的能力,范围为6.33~108.71 mg·L-1;铁载体为定性检测,菌株KSB3能力最强;菌株KSB2和KSB5不具溶磷特性,菌株KSB7溶磷效果最好。综上,除了铁载体以外,在所有菌株中KSB7具有最高水平的ACC脱氨酶、IAA产物和溶磷活性。
筛选分离所得7株细菌,经14 d培养后其对芘降解效果如图 1所示。各菌株对芘均具有一定的降解能力,其中菌株KSB2和KSB5对芘的降解启动速率较快,在培养7 d后对芘的降解率分别为35.81%和38.57%,然而菌株KSB7在14 d后对芘的降解率却最高,达到90.23%,表明在根际区菌株KSB2和KSB5可能对芘的降解起先导作用,作为共代谢底物促进菌株KSB7对芘的降解,进而提高根际区对PAHs的降解效率。

|
| 图中不同字母表示同一时间不同菌株处理下芘残留率有显著差异(P < 0.05) 图 1 各菌株对芘的降解效果 Figure 1 Biodegradation rate of pyrene by strains |
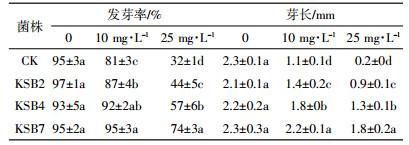
综合上述菌株的促生特性和对芘的降解能力,选取菌株KSB2、KSB4和KSB7,考察它们对地肤种子的促生能力。经过5 d培养后其对种子发芽率和芽长的影响如表 4所示。不添加任何菌时,发芽率和芽长随着芘浓度的增加而降低;接种后,无芘胁迫下各菌株与CK相比促生能力无显著差别,而伴随着芘浓度的增加,它们则可显著提高地肤的发芽率和芽长;菌株KSB7表现出最好的促生能力,与CK相比10 mg·L-1芘胁迫下发芽率和芽长分别提高了14.74%和50%,25 mg·L-1芘胁迫下提高了56.76%和88.9%(KSB7-CK/CK),表明菌株KSB7对高浓度芘胁迫下的地肤种子的萌发和生长具有显著的影响。
|
目前,国内外研究者主要通过添加功能微生物(根际促生菌、PAHs降解菌株)来强化植物对PAHs类有机污染物的吸收降解作用[20]。Liu等[13]在石油污染土壤高羊茅根际筛选出1株具促生能力的Klebsiella sp. D5A,接种后高羊茅对石油烃的降解率提高了16.2%,地上和地下生物量各提高了75.2%和42.2%。刘魏魏等[11]研究表明接种PAHs专性降解菌可使紫花苜蓿对PAHs的降解率提高49.6%,而同时接种植物促生菌和PAHs专性降解菌时紫花苜蓿对PAHs的降解率提高了60.1%。基于此,利用降解PAHs的促生菌联合植物修复PAHs污染的焦化厂具有一定的应用潜力,植物和共生功能菌株的筛选是关键。地肤对环境适应性强,土壤生长范围广,具有一定耐碱特性,Moubasher等[21]研究表明地肤能有效去除干旱地区土壤中石油烃,去除率为31.2%~57.7%,但有关其根际细菌与地肤联合修复有机污染的研究还未见报道。本研究从PAHs污染焦化厂地肤根际分离筛选出7株具芘降解特性的促生菌株,研究了菌株对芘的降解能力。结果表明,摇床培养14 d后菌株KSB1、KSB2、KSB4、KSB5和KSB7对芘的降解率均在58%以上(芘25 mg·L-1)。分离菌株经鉴定分别属于考克氏菌属(Kocuria sp.)、芽孢杆菌属(Bacillus sp.)、类香味菌属(Myroides sp.)、沙雷菌属(Serratia. Sp.)、副球菌属(Paracoccus sp.)、松鼠葡萄球菌属(Staphylococcus sciuri)和芽孢杆菌属(Bacillus sp.)。KSB2、KSB4、KSB5和KSB7所在属的菌株具有降解PAHs的功能已有报道,系统发育分析与KSB2亲缘关系较近的菌株Bacillus sp.SPL-4可去除土壤中35.1%的4环PAHs,53.5%的5环和6环PAHs[22],且有多个研究表明该属菌可产生生物表面活性剂[22-23]。本研究中菌株KSB2培养7 d对芘的降解率最高,表明该属菌株是一类降解PAHs的优势菌群。Liu等[24]研究表明接种菌株Bacillus sp. DZ13可提高花生植株13.8%的生物量。本研究发现菌株KSB2、KSB4和KSB7的ACC脱氨酶活性大于3.5 M α-KB mg-1·h-1,7株菌均具有产IAA的能力,范围为6.33~108.71 mg·L-1,具有较强的促生潜力。
根际促生菌可提高种子的发芽率和芽长,进而提高植株的生物量。但植物对所分离的功能菌株是否具有根际效应,是菌株发挥功能的关键。Chen等[25]发现接种Microbacterium sp. KL5和Candida tropicalis C10可提高黑麦草和东南景天的生物量和对PAHs的去除率,但黑麦草与东南景天比,具有较好的根际效应。为此,我们在促生特性和芘降解能力实验的基础上,选取菌株KSB2、KSB4和KSB7,做了促生试验,结果表明无芘胁迫下菌株的促生特性与对照相比无显著差别,然而随着芘浓度的升高,显著增加了地肤的发芽率和芽长(表 4)。菌株KSB7在芘胁迫下表现出了良好的促生能力,浓度25 mg·L-1与10 mg·L-1相比,其促生功能所发挥的相对作用更强,表明菌株KSB7在污染胁迫下,降解功能起先导作用,先缓解了高浓度芘对种子的毒害作用,进而达到促生的效果。关于菌株KSB7对土壤PAHs地肤修复的影响在今后工作中将做进一步的研究。
4 结论本研究从焦化厂优势植物地肤根际土壤筛选分离出7株具PAHs降解能力的根际促生菌,其中菌株KSB7具有较高的芘降解能力和促生活性,鉴定属于芽孢杆菌属(Bacillus sp.),接种该株菌可显著提高地肤种子对芘的抗性,在25 mg·L-1芘浓度下,与对照相比地肤发芽率和芽长分别提高了56.76%和88.9%。表明菌株KSB7在焦化厂污染土壤的地肤-微生物联合修复中具有较大的应用潜力。
| [1] |
Han X M, Hu H W, Shi X Z, et al. Effects of different agricultural wastes on the dissipation of PAHs and the PAH-degrading genes in a PAH-contaminated soil[J]. Chemosphere, 2017, 172: 286-293. DOI:10.1016/j.chemosphere.2017.01.012 |
| [2] |
Wilcke W. Global patterns of polycyclic aromatic hydrocarbons(PAHs) in soil[J]. Geoderma, 2007, 141: 157-166. DOI:10.1016/j.geoderma.2007.07.007 |
| [3] |
卢晓霞, 李秀利, 马杰, 等. 焦化厂多环芳烃污染土壤的强化微生物修复研究[J]. 环境科学, 2011, 32(3): 864-869. LU Xiao-xia, LI Xiu-li, MA Jie, et al. Enhanced bioremediation of coking plant soils contaminated with polycyclic aromatic hydrocarbons[J]. Environmental Science, 2011, 32(3): 864-869. |
| [4] |
李凤梅, 郭书海, 张灿灿, 等. 多环芳烃降解菌的筛选及其在焦化厂场地污染土壤修复中的应用[J]. 环境污染与防治, 2016, 38(4): 1-5. LI Feng-mei, GUO Shu-hai, ZHANG Can-can, et al. Isolation of PAHs degrading bacteria and its application to mediation of polluted soil in coking site[J]. Environmental Pollution & Control, 2016, 38(4): 1-5. |
| [5] |
冯嫣, 吕永龙, 焦文涛, 等. 北京市某废弃焦化厂不同车间土壤中多环芳烃(PAHs)的分布特征及风险评价[J]. 生态毒理学报, 2009, 4(3): 399-407. FENG Yan, LÜ Yong-long, JIAO Wen-tao, et al. Distribution and risk of polycyclic aromatic hydrocarbons in soils from different workshops of an abandoned coking factory in Beijing[J]. Asian Journal of Ecotoxicology, 2009, 4(3): 399-407. |
| [6] |
叶茂, 付榕, 杨光. 焦化厂多环芳烃污染土壤修复技术[J]. 煤气与热力, 2012, 32(4): 17-19. YE Mao, FU Rong, YANG Guang. Remediation technology for soil contaminated by polycyclic aromatic hydrocarbons at coking plant[J]. GAS & HEAT, 2012, 32(4): 17-19. |
| [7] |
Teng Y, Shen Y Y, Luo Y M, et al. Influence of rhizobium meliloti on phytoremediation of polycyclic aromatic hydrocarbons by alfalfa in an aged contaminated soil[J]. Journal of Hazardous Materials, 2011, 186: 1271-1276. DOI:10.1016/j.jhazmat.2010.11.126 |
| [8] |
Gan S, Lau E V, Ng H K. Remediation of soils contaminated with polycyclic aromatic hydrocarbons(PAHs)[J]. Journal of Hazardous Materials, 2009, 172(2/3): 532-549. |
| [9] |
Sun G D, Jin J H, Xu Y X, et al. Isolation of a high molecular weight polycyclic aromatic hydrocarbon-degrading strain and its enhancing the removal of HMW-PAHs from heavily contaminated soil[J]. International Biodeterioration & Biodegradation, 2014, 90: 23-28. |
| [10] |
Smith M J, Flowers T H, Duncan H J, et al. Study of PAH dissipation and phytoremediation in soils:Comparing freshly spiked with weathered soil from a former coking works[J]. Journal of Hazardous Materials, 2011, 192: 1219-1225. DOI:10.1016/j.jhazmat.2011.06.033 |
| [11] |
刘魏魏, 尹睿, 林先贵, 等. 多环芳烃污染土壤的植物-微生物联合修复初探[J]. 土壤, 2010, 42(5): 800-806. LIU Wei-wei, YIN Rui, LIN Xian-gui, et al. Interaction of phytoremediation-microorganism to remediation of aged polycyclic aromatic hydrocarbons(PAHs) polluted soils[J]. Soils, 2010, 42(5): 800-806. |
| [12] |
Guo M X, Gong Z Q, Miao R H, et al. Microbial mechanisms controlling the rhizosphere effect of ryegrass on degradation of polycyclic aromatic hydrocarbons in an aged-contaminated agricultural soil[J]. Soil Biology and Biochemistry, 2017, 113: 130-142. DOI:10.1016/j.soilbio.2017.06.006 |
| [13] |
Liu W X, Hou J Y, Wang Q L, et al. Isolation and characterization of plant growth-promoting rhizobacteria and their effects on phytoremediation of petroleum-contaminated[J]. Chemosphere, 2014, 117: 303-308. DOI:10.1016/j.chemosphere.2014.07.026 |
| [14] |
Khan S, Waqas M, Ding F H, et al. The influence of various biochars on the bioaccessibility and bioaccumulation of PAHs and potentially toxic elements to turnips(Brassica rape L.)[J]. Journal of Hazardous Materials, 2015, 300: 243-253. DOI:10.1016/j.jhazmat.2015.06.050 |
| [15] |
宋立超, 李培军, 刘宛, 等. 盐碱土壤PAHs降解菌的筛选鉴定及其降解特性[J]. 微生物学通报, 2011, 38(2): 282-287. SONG Li-chao, LI Pei-jun, LIU Wan, et al. Isolation, identification and degradation characteristics of a PAHs-degrading bacteria from salt-alkaline soil[J]. Microbiology China, 2011, 38(2): 282-287. |
| [16] |
Liu W X, Sun J Y, Ding L L, et al. Rhizobacteria(Pseudomonas sp. SB) assist phytoremediation of oily-sludge-contaminated soil by tall fescue(Testuca arundinacea L.)[J]. Plant and Soil, 2013, 371(1/2): 533-542. |
| [17] |
张国壮, 李海超, 孙永林, 等. 5株产ACC脱氨酶细菌的筛选与鉴定[J]. 西北农林科技大学学报(自然科学版), 2014, 42(6): 189-196. ZHANG Guo-zhuang, LI Hai-chao, SUN Yong-lin, et al. Isolation and identification of rhizobacteria producing 1-aminocyclopropane-1-carboxylate(ACC)deaminase[J]. Journal of Northwest A&F University(Natural Science Edition), 2014, 42(6): 189-196. |
| [18] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indole compounds produced by phytopathogenic bacteria[J]. Appl Environ Microbiol, 1995, 61(2): 793-796. |
| [19] |
Payne S M. Detection, isolation, and characterization of siderophores[J]. Methods Enzymol, 1994, 235: 329-344. DOI:10.1016/0076-6879(94)35151-1 |
| [20] |
宋立超, 钮旭光, 张玉龙, 等. 盐渍化土壤翅碱蓬根际促生细菌的筛选及对多环芳烃的降解特性[J]. 生态学杂志, 2016, 35(1): 199-204. SONG Li-chao, NIU Xu-guang, ZHANG Yu-long, et al. Screening of a plan growth-promoting rhizobacterium from Suaeda salsa(L.) in saline soil and its ability to degrade polycyclic aromatic hydrocarbons[J]. Chinese Journal of Ecology, 2016, 35(1): 199-204. |
| [21] |
Moubasher H A, Hegazy A K, Mohamed N H, et al. Phytoremediation of soils polluted with crude petroleum oil using Bassia scoparia and its associated rhizophere microorganisms[J]. International Biodeterioration & Biodegradation, 2015, 98: 113-120. |
| [22] |
Bezza F A, Nkhalambayausi C E M. The role of lipopeptide biosurfactant on microbial remediation of aged polycyclic aromatic hydrocarbons(PAHs)-contaminated soil[J]. Chemical Engineering Journal, 2017, 309: 563-576. DOI:10.1016/j.cej.2016.10.055 |
| [23] |
Zeng J, Zhu Q, Wu Y C, et al. Oxidation of polycyclic aromatic hydrocarbons using Bacillus subtilis CotA with high laccase activity and copper independence[J]. Chemosphere, 2016, 148: 1-7. DOI:10.1016/j.chemosphere.2016.01.019 |
| [24] |
Liu D, Yang Q Q, Ge K, et al. Promotion of iron nutrition and growth on peanut by Paenibacillus illinoisensis and Bacillus sp. strains in calcareous soil[J]. Brazilian Journal of Microbiology, 2017, 48(4): 656-670. DOI:10.1016/j.bjm.2017.02.006 |
| [25] |
Chen F, Tan M, Ma J, et al. Efficient remediation of PAH-metal co-contaminated soil using microbial-plant combination:A greenhouse study[J]. Journal of Hazardous Materials, 2016, 302: 250-261. DOI:10.1016/j.jhazmat.2015.09.068 |
 2017, Vol. 36
2017, Vol. 36