文章信息
- 隗黎丽, 刘毅, 王自蕊, 阮记明, 周颖, 熊六凤, 钟其旺
- WEI Li-li, LIU Yi, WANG Zi-rui, RUAN Ji-ming, ZHOU Ying, XIONG Liu-feng, ZHONG Qi-wang
- MC-LR急性胁迫对草鱼脾脏、头肾显微结构及BAFF和APRIL基因表达的影响
- Acute effects of microcystin-LR on the microstructure of spleen and head kidney and the expression of BAFF and APRIL genes in grass carp
- 农业环境科学学报, 2017, 36(12): 2379-2387
- Journal of Agro-Environment Science, 2017, 36(12): 2379-2387
- http://dx.doi.org/10.11654/jaes.2017-0764
文章历史
- 收稿日期: 2017-05-28
- 录用日期: 2017-08-09
2. 江西师范大学生命学院, 南昌 330022;
3. 江西农业大学生物科学与工程学院, 南昌 330045
2. College of Life Sciences, Jiangxi Normal University, Nanchang 330022, China;
3. College of Bioscience and Bioengineering, Jiangxi Agricultural University, Nanchang 330045, China
微囊藻毒素(Microcystins,MCs)是由富营养化水体中的藻类产生的一类有毒物质,结构变体多达100余种,其中微囊藻毒素-LR(Microcystin-LR,MC-LR)是目前已知的毒性最强、危害最严重的一种毒素,并具有高度的肝毒性[1]。然而大量的资料表明,MCs除了具有高度肝毒性之外,还具有免疫毒性[2]等其他毒性。尽管鱼类是低等脊椎动物,但已具备免疫防御系统,其中,脾脏和头肾是鱼类最主要的免疫器官。在绝大多数的真骨鱼中,脾脏是红细胞和中性粒细胞产生、贮存和成熟的主要场所,同时具有造血和免疫功能[3]。在鱼类肾脏的发育过程中,头肾失去排泄功能而成为免疫器官和造血器官,兼具免疫细胞的生产、分化和增殖以及捕获抗原和产生抗体的功能[4]。鱼体受到污染物的胁迫,组织和器官的结构或形态变化被认为是病理损伤的最初表现,因此鱼类的组织病理变化可被用作检测环境胁迫的有效生物标记。之前的研究多集中在MCs对动物和鱼类肝脏组织病理的影响,而关于鱼类脾脏、头肾等免疫器官在MC-LR作用下的病理变化鲜有报道。
由于细胞因子对环境毒素较为敏感[5],常常作为监测污染物等的生物标志物。B细胞活化因子(B lymphocyte stimulator,BAFF)是一种新型的肿瘤坏死因子家族的配体,属于肿瘤坏死因子(Tumor necrosis factor,TNF)家族成员[6],有报道表明环境污染物可以刺激BAFF的产生[7]。目前的研究结果表明:BAFF与B淋巴细胞的发育、T细胞活化及体液免疫直接相关,而BAFF的过度表达又有可能参与自身反应性B细胞的产生和自身免疫耐受的破坏,影响免疫应答,导致各种自身免疫性疾病和恶性肿瘤的发生[8]。增殖诱导配体(A proliferation-induction ligand,APRIL)是TNF家族的新成员,又名肿瘤坏死因子配体超家族成员13(Tumor necrosis factor ligand superfamily member 13,TNFSF13α)。已有研究证实APRIL可与BAFF形成异源三聚体而刺激B淋巴细胞增殖[9],还能够上调B细胞表面一些重要的共刺激分子的表达,明显增强在抗原呈递过程中B细胞的功能[10]。APRIL作为TNF超家族的成员之一,在促进B淋巴细胞增殖的过程中起到重要的作用,而且是重要的肿瘤细胞增殖诱导因子,在肿瘤发生的早期对APRIL的检测来实现早期诊断治疗。此外,APRIL与免疫系统调节密切相关,其可通过促进B淋巴细胞的增殖来调节B淋巴细胞内环境的稳态。
鉴于脾脏和头肾以及BAFF和APRIL在鱼类免疫中的重要作用,本研究以我国淡水主养品种草鱼(Ctenopharyngodon idella)为试验对象,通过腹腔注射不同剂量的MC-LR,探讨MC-LR对这两个重要免疫器官的免疫毒性以及这两个免疫组织中B淋巴细胞分化相关基因表达的影响,以期更好地了解MC-LR对鱼类免疫系统造成的影响,为MC-LR风险评估提供理论依据和参考。
1 材料与方法 1.1 材料与试剂实验用草鱼购自江西省南昌神龙渔业公司养殖基地,平均体重为22.13±2.17 g,平均体长为12.09±1.33 cm。MC-LR为Taiwan Algal Science Inc公司产品,间氨基苯甲酸乙酯甲烷磺酸盐(MS-222)为Sigma公司产品,乙醇、二甲苯、甲醇、甲醛等试剂为国产分析纯。RNA提取试剂盒TRIzol reagent购自Invitrogen公司,逆转录试剂盒RevertAidTM First Strand cDNA Synthesis Kit购自Fermentas公司,DNA分子质量标准(DL2000)、SYBR Green Real-time PCR Master Mix购自Promega公司。
1.2 实验鱼的处理实验鱼在室内水族箱(85 cm×60 cm×60 cm)暂养2周,水温为20±0.2 ℃,溶氧保持在6.0~7.0 mg·L-1。暂养期间每日按照鱼体重的2.0%投喂饲料,试验前48 h停止投喂并将草鱼随机分组,即对照组和三个浓度组,每组设置三个重复。实验前,将商品MC-LR(纯度≥95%)粉末用甲醇溶解成1 μg·μL-1的溶液,随后用0.8%生理盐水稀释成所需浓度。根据预实验以及参考文献[11]确定注射剂量为25、75 μg MC-LR·kg-1 BW(体重)和100 μg MC-LR·kg-1 BW,每尾鱼注射0.1 mL,对照组则注射等量的0.8%的生理盐水。草鱼染毒采用腹腔注射,即沿腹鳍基部注射入腹腔,为避免伤及鱼体内脏,注射角度小于30°。
1.3 取样在染毒24、48、72 h和96 h,实验组和对照组各取6尾鱼。解剖前,先用100 μg·mL-1的间氨基苯甲酸乙酯甲烷磺酸盐(MS-222)将鱼麻醉,然后迅速分离新鲜的脾脏和头肾,一部分立即放入10%中性甲醛中固定,24 h后更换一次固定液;另一部分置于液氮中提取RNA。
1.4 光镜样品的制备与观察取出经10%中性甲醛固定的样品,冲洗,常规梯度酒精脱水处理、石蜡包埋、切片(厚约5 μm),二甲苯脱蜡、苏木精和伊红(H.E)染色,二甲苯透明,中性树胶封片,采用BM2000型显微系统观察并拍照分析。
1.5 核酸的提取和cDNA模板的合成采用Invitrogen公司的Trizol试剂盒提取总RNA,操作过程(包括组织总RNA提取以及应用RNA的一切相关实验)所用离心管和枪头等需经0.1%焦碳酸二乙酯(diethylpryocarbonate,DEPC)水处理过夜,玻璃器皿及金属器械需经180 ℃高温烘烤6 h以上使RNase彻底失活。RNA的具体提取方法参考试剂盒的说明书进行。cDNA合成按RevertAidTM First Strand cDNA Synthesis Kit操作手册进行。
1.6 qRT-PCR检测MC-LR对草鱼脾脏和头肾组织中BAFF和APRIL基因的表达的影响Real-time quantitative PCR反应在伯乐公司CFX96 TouchTM Real-Time PCR Detection System上完成。BAFF、APRIL和内参glyceraldehyde-3-phosphate dehydrogenase(GAPDH)引物见表 1。反应体系是:20 μL PCR反应液中包括5.0 μL 50倍稀释的cDNA模板,10 μL SYBR Green Real-time PCR Master Mix,上下游引物各0.5 μL、4.0 μL ddH2O。反应条件:94 ℃变性5 min,94 ℃ 10 s、58 ℃ 15 s、72 ℃ 20 s进行45个循环后,72 ℃延伸5 min。荧光定量PCR的数据采用2-△△CT法进行计算,用SPSS软件(16.0)One-way ANOVA进行统计分析。
100 μg MC-LR·kg-1 BW剂量组草鱼在注射MC-LR后即表现出急躁不安,狂游、鱼体抽搐等现象,然后沉于水底,在较短时间内稳定下来,随后又呈失衡状态,75 μg MC-LR·kg-1 BW组草鱼在注射24 h后出现游动异常,随后这种现象缓解,而25 μg MC-LR·kg-1 BW剂量组在注射毒素后没有明显的异常行为。此外,75 μg MC-LR·kg-1 BW和100 μg MC-LR·kg-1 BW在染毒24 h后可见腹部肿胀,解剖后均可见大量积水,肝脏出现大面积充血、出血现象,且100 μg MC-LR·kg-1 BW组草鱼的这种现象更严重。
2.2 对照组草鱼脾脏和肾脏的显微结构对照组草鱼脾脏表面光滑呈暗红色,显微观察显示草鱼脾脏没有明显的白髓和红髓之分,主要由淋巴组织构成,淋巴组织由网状细胞彼此连接构成支架,网眼内充填着淋巴细胞(三角形示)、巨噬细胞(菱形箭头示)、粒细胞(双箭头示)、血细胞(箭头)等(图 1A)。草鱼头肾实质内未见肾单位结构,主要由淋巴组织、造血组织和血窦构成,包括淋巴细胞(三角形示)、红细胞(箭头示)、粒细胞(双箭头示)、巨噬细胞(菱形箭头示)等(图 1B)。
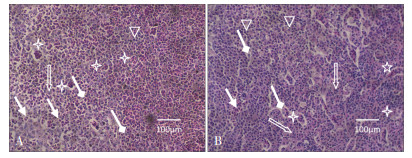
|
| A和B分别示健康草鱼脾脏和头肾的显微结构,其中箭头示红细胞,菱形箭头示巨噬细胞,十字星示血窦,五角星示血管,三角形示淋巴细胞,双箭头示粒细胞 A and B showing the microstructure of spleen and head kidney from grass carp, respectively. The arrow shows red cell, the diamond arrow shows macrophage, the cross star shows blood sinus, the five-pointed star shows the blood vessels, the triangle shows the lymphocyte and the double arrow shows granulocyte 图 1 对照组草鱼脾脏和头肾的显微结构 Figure 1 The microstructure of spleen and head kidney in control grass carp |
25 μg MC-LR·kg-1 BW组草鱼在染毒24 h后,相对于对照组草鱼,脾脏变化不明显,偶可见黑色素巨噬细胞(图 2A);染毒48 h后,可见黑色素-巨噬细胞较24 h的脾脏的黑色素巨噬细胞增多,同时可见脾索血细胞堆积(图 2B);染毒72 h和96 h后,脾索之间可见大量血细胞堆积(图 2C和图 2D)。75 μg MC-LR·kg-1 BW组草鱼在注射MC-LR 24 h后,与对照组相比,黑色素巨噬细胞增多(图 2E);而染毒48 h后,相对于同浓度24 h脾脏中黑色素巨噬细胞的数量明显聚集增多,可见体积比较大的黑色素巨噬中心(图 2F);染毒72 h后,脾索之间有大量的血细胞浸润拥挤其中,并有局部性出血(图 2G);染毒96 h后,可见血窦和血管扩张更明显且淋巴细胞呈现空泡化并伴随个别细胞坏死溶解(图 2H)。100 μg MC-LR·kg-1 BW组草鱼在染毒24 h后,与对照组和其他两个剂量组相比,可见黑色素巨噬细胞增多(图 2I);染毒48 h后,相对于24 h的脾脏的显微结构,黑色素巨噬细胞继续增多,并伴随着黑色素巨噬细胞中心体积增大,脾索之间血细胞明显增多(图 2J);染毒72 h后,细胞排列杂乱,淋巴细胞出现空泡化,局部出现充血(图 2K);染毒96 h后,相对于72 h时间段草鱼的淋巴细胞排列,其表现更加无序,并伴随着大量淋巴细胞呈现空泡化、坏死溶解(图 2L)。
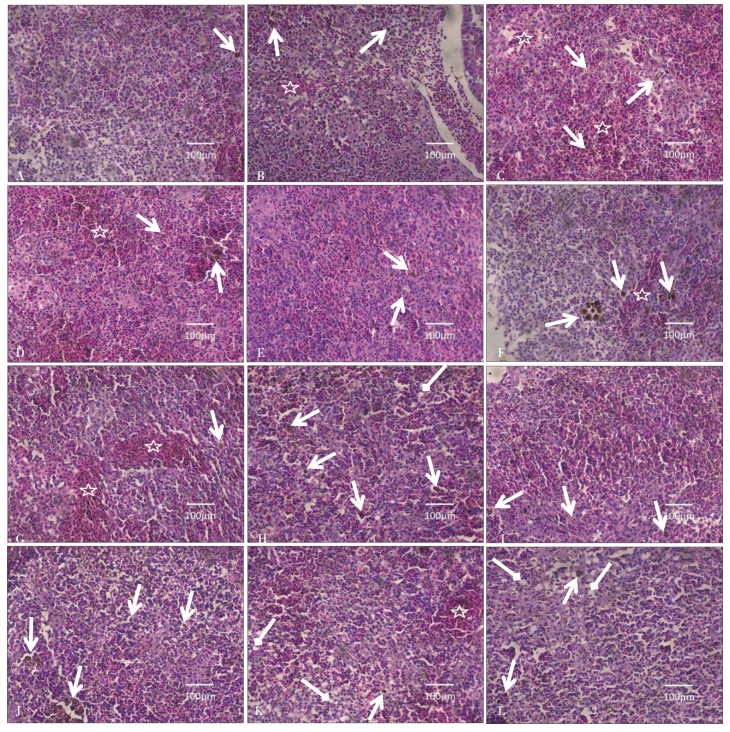
|
| A-D示25 μg MC-LR·kg-1 BW对草鱼脾脏结构的影响,其中A、B、C、D分别代表 25 μg MC-LR·kg-1 BW处理24、48、72 h和96 h草鱼脾脏的显微变化;E-H示75 μg MC-LR·kg-1 BW对草鱼脾脏结构的影响,其中E、F、G、H分别代表 75 μg MC-LR·kg-1 MC-LR处理24、48、72 h和96 h草鱼脾脏的显微变化;I-L示100 μg MC-LR·kg-1 BW对草鱼脾脏结构的影响,其中I、J、K、L分别代表 100 μg MC-LR·kg-1 BW处理24、48、72 h和96 h草鱼脾脏的显微变化。其中,箭头示黑色素巨噬细胞,菱形箭头示淋巴细胞空泡化,星号示充血 Figure A-D show the effects of 25 μg MC-LR·kg-1 BW on the histopathology of spleen from grass carp. A, B, C and D show the time:24, 48, 72 h and 96 h following exposure to 25 μg MC-LR·kg-1 BW, respectively. E-H show the effects of 75 μg MC-LR·kg-1 BW on the histopathology of spleen from grass carp. E, F, G and H show the exposure time:24, 48, 72 h and 96 h following exposure to 75 μg MC-LR·kg-1 BW, respectively. I-L show the effects of 100 μg MC-LR·kg-1 BW on the histopathology of spleen from grass carp. I, J, K and L show the time:24, 48, 72 h and 96 h following exposure to 100 μg MC-LR·kg-1 BW, respectively. Another, arrows show the melano-macrophage, the diamond arrows show lymphocyte vacuolization and asterisk show congestion 图 2 不同剂量MC-LR对草鱼脾脏显微结构的影响 Figure 2 The effects of different dose of MC-LR on the histopathology of spleen from grass carp |
25 μg MC-LR·kg-1 BW组草鱼在染毒24 h后,与对照组相比,头肾无明显变化(图 3A);48 h后,与对照组相比,可见血窦扩张(图 3B),在染毒72 h后,可见血管明显扩张,黑色素巨噬细胞增多(图 3C);而96 h后的样品相对于72 h的样品,血窦扩张更明显,个别淋巴细胞出现坏死(图 3D)。75 μg MC-LR·kg-1 BW组草鱼在染毒24 h后,与对照组相比,血窦扩张,并可见较多黑色素巨噬细胞(图 3E);染毒48 h后,可见黑色素巨噬细胞比24 h时间段的样品中的黑色素细胞数量明显增多(图 3F);染毒72 h和96 h后,可见淋巴细胞空泡化、个别细胞坏死溶解,相对于前一时间段的样品,血窦和血管扩张更明显,黑色素巨噬细胞数量减少(图 3G和图 3H)。100 μg MC-LR·kg-1 BW组草鱼在染毒24 h后,相对于75 μg MC-LR·kg-1 BW组草鱼染毒24 h的样品来说,可见黑色素巨噬细胞增多,血管扩张(图 3I);染毒48 h后,淋巴细胞出现空泡化(图 3J);染毒72 h后,淋巴细胞空泡化比染毒48 h后的样品更严重,细胞排列杂乱(图 3K);染毒96 h后,头肾组织疏松,淋巴细胞排列相对于染毒72 h的头肾淋巴细胞空泡化更加无序,退化区更明显,大量淋巴细胞坏死溶解,黑色素巨噬细胞明显减少(图 3L)。

|
| A-D示25 μg MC-LR·kg-1 BW对草鱼头肾结构的影响,其中A、B、C、D分别代表 25 μg MC-LR·kg-1 BW处理24、48、72 h和96 h草鱼头肾的显微变化;E-H示75 μg MC-LR·kg-1 BW对草鱼头肾结构的影响,其中E、F、G、H分别代表 75 μg MC-LR·kg-1 BW处理24、48、72 h和96 h草鱼头肾的显微变化;I-L示100 μg MC-LR·kg-1 BW对草鱼头肾结构的影响,其中I、J、K、L分别代表 100 μg MC-LR·kg-1 BW处理24、48、72 h和96 h草鱼头肾的显微变化。其中,箭头示黑色素巨噬细胞,加粗菱形箭头示血窦扩张,三角形示血管扩张,星号示淋巴细胞排列无序,溶解坏死 Figure A-D show the effects of 25 μg MC-LR·kg-1 BW on the histopathology of head kidney from grass carp. A, B, C and D show the time:24, 48, 72 h and 96 h following exposure to 25 μg MC-LR·kg-1 BW, respectively. E-H show the effects of 75 μg MC-LR·kg-1 BW on the histopathology of head kidney from grass carp. E, F, G and H show the exposure time:24, 48, 72 h and 96 h following exposure to 75 μg MC-LR·kg-1 BW, respectively. I-L show the effects of 100 μg MC-LR·kg-1 BW on the histopathology of intestine from grass carp. I, J, K and L show the time:24, 48, 72 h and 96 h following exposure to 100 μg MC-LR·kg-1 BW, respectively. Another, arrows show the melano-macrophage, bold and diamond arrows show expanded sinusoid, triangles show vasodilation, and asterisks show disordered and necrotic lymphocytes 图 3 不同剂量MC-LR对草鱼头肾显微结构的影响 Figure 3 The effects of different dose of MC-LR on the histopathology of head kidney from grass carp |
草鱼经不同剂量MC-LR处理96 h后,脾脏中BAFF基因的表达均被抑制,经单因素方差分析,注射剂量为75 μg MC-LR·kg-1 BW可显著抑制BAFF基因在脾脏中的表达水平(P<0.05),与对照组相比,相对表达抑制比为41%±6.6%,剂量为25、100 μg MC-LR·kg-1 BW时,对BAFF的表达水平无显著影响(P>0.05)(图 4A)。在MC-LR的胁迫下,头肾中BAFF基因的表达均下调,剂量为25、75μg MC-LR·kg-1 BW时,BAFF基因的表达显著下降(P<0.05),相对于对照组表达的抑制百分比分别为42%±17.6%和21%±3.8%(图 4B)。
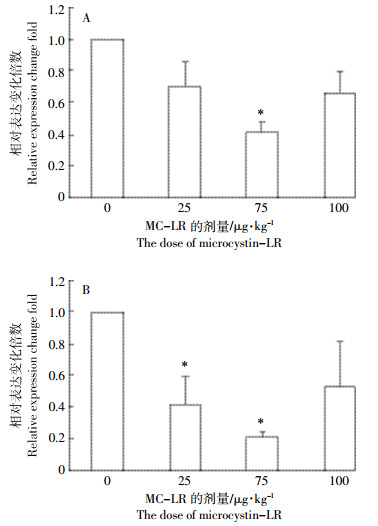
|
| 图 4 MC-LR对脾脏和头肾组织中BAFF mRNA表达水平的影响 Figure 4 The effect of MC-LR on BAFF mRNA expression in spleen and head kidney of grass carp |
草鱼经不同剂量MC-LR处理96 h后,APRIL基因在脾脏组织中表达呈现抑制趋势,并且APRIL基因表达量随MC-LR剂量的升高而逐渐降低,除25 μg MC-LR·kg-1 BW剂量组外,其他两组中APRIL基因的表达均显著被抑制(P<0.05),100 μg MC-LR·kg-1 BW处理组中APRIL基因抑制程度最高,与对照组相比,相对表达抑制百分比为13%±4.7%(图 5A)。在头肾组织中,APRIL基因的表达下降更明显,APRIL基因在三个剂量组中的表达均显著下降(P<0.05),同样在100 μg MC-LR·kg-1 BW处理组中APRIL基因抑制最强,相对表达抑制百分比为7%±1%(图 5B)。
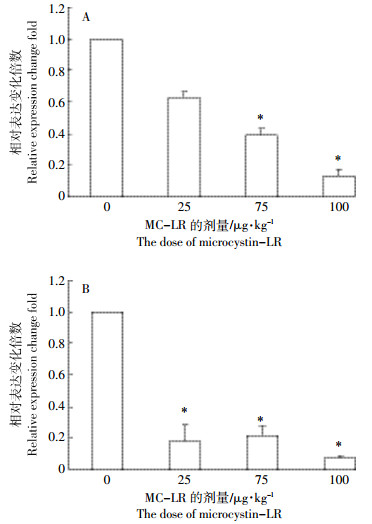
|
| 图 5 MC-LR对脾脏和头肾组织中APRIL mRNA表达水平的影响 Figure 5 The effect of MC-LR on APRIL mRNA expression in spleen and head kidney of grass carp |
免疫器官是免疫系统中重要的组成部分,对于维持机体发挥正常的免疫功能具有极其重要的地位。不仅如此,免疫系统也是对外源性化合物最为敏感的系统之一。目前已有大量的研究报道了MCs对鱼类免疫器官的毒性,如Trinchet等[12]发现青鱂(Oryzias latipes)暴露于5 μg MC-LR·L-1溶液中即可引起脾脏细胞密度降低、淋巴细胞空泡化,且有大面积的坏死。为了系统地从组织学方面提供MC-LR对鱼类免疫毒性的有力证据,本试验通过组织切片的方法检测了不同浓度的MC-LR对草鱼脾脏和头肾的病理影响。脾脏和头肾都是鱼类重要的免疫器官和造血器官,对污染物敏感,容易受到损伤。Carbis等[13]曾报道鲤鱼(Cyprinus carpio)经腹腔注射50 μg MC-LR·kg-1 BW时,脾脏组织结构无明显病理改变。然而本试验发现,草鱼在注射MC-LR后,即使25 μg MC-LR·kg-1 BW剂量组对草鱼脾脏也有明显的病理改变,且呈现剂量依赖效应,高浓度染毒组(100 μg MC-LR·kg-1 BW)草鱼脾脏在染毒96 h后大量淋巴细胞空泡化,这与Trinchet等[14]的结果一致。随着染毒时间的延长和浓度的增加,头肾中的部分淋巴细胞结构逐渐变得不清晰,细胞空泡化甚至裂解。Wei等[11]报道用剂量为50 μg MC-LR·kg-1 BW的MC-LR处理草鱼,可见草鱼脾脏和头肾淋巴细胞发生凋亡、线粒体水肿和内质网扩张。因此,这些研究结果均表明,MC-LR可对鱼类脾脏和头肾这两种重要的免疫器官产生毒性。
此外,本试验还发现在染毒48 h后,脾脏和头肾中都可见黑色素-巨噬细胞增多、体积增大的现象,但在染毒96 h后,黑色素巨噬细胞数量减少。黑色素-巨噬细胞中心是黑色素巨噬细胞在脾脏、头肾等其他器官中累积而成的。黑色素-巨噬细胞中心的增多与以下因素有关:正常的衰老、饥饿、感染疾病、毒物作用等[15]。因此,本试验中出现这种现象的原因可能是MC-LR引起鱼类免疫毒性,导致巨噬细胞功能紊乱,诱导黑色素-巨噬细胞中心增多,从而有效地保护组织免受破坏。但当高浓度、长时间的MC-LR作用时,巨噬细胞的细胞结构被破坏且吞噬功能也受到抑制,阻断了黑色素巨噬细胞的集结发育,导致黑色素-巨噬细胞中心的大小变小,数量又减少。这些也说明随着MC-LR浓度增大、作用时间延长,鱼类的非特异免疫机能受到抑制,从而对鱼类产生免疫毒性。
鱼类免疫系统中有大量的细胞因子,这些细胞因子不仅在非特异性免疫和特异性免疫防御中发挥功能,而且在维持机体内环境的稳定方面也发挥着重要作用[16]。当机体暴露在外来抗原或有毒化学物质中,细胞因子会随着免疫系统的变化而发生改变[17]。Wei等[18]采用基因芯片研究了MC-LR对斑马鱼肝脏基因表达谱的影响,发现MC-LR可抑制斑马鱼肝脏中大量免疫基因的表达,此外,Wei等[19]分别对草鱼白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等六个免疫基因的表达进行分析,发现MC-LR可抑制这些免疫基因表达。这些研究均从分子水平上揭示了MC-LR可对鱼类的细胞因子有抑制作用。BAFF作为肿瘤坏死因子超家族(Tumor necrosis factor superfamily,TNFSF)成员,主要由单核细胞、树突状细胞及T细胞产生,可促进B细胞成熟和分化,在免疫应答中起重要作用,并与自身免疫密切相关[20]。本实验结果显示头肾中BAFF基因的表达水平相比脾脏中BAFF的表达水平更易受到MC-LR的影响。郭琼林和卢全章[21]对草鱼各发育阶段肾脏和脾脏进行对比,发现脾脏中红细胞较多,占总细胞的94.6%,相比头肾,草鱼脾脏是机体内主要的造血器官,但头肾是粒细胞系、单核细胞系的主要发育场所。正是由于脾脏和头肾细胞组成的差异性,可能导致了细胞因子分泌的差异性。BAFF基因作为一种细胞因子,因主要由单核细胞产生,可能在头肾中的表达量更多,也可能粒细胞和单核细胞等免疫细胞对MC-LR更为敏感,从而导致了头肾中BAFF基因的表达水平相比脾脏中BAFF的表达水平更易受到MC-LR的影响。
有文献表明,APRIL与BAFF关系很密切[22]。其在TNF结构域有大约30%的同源性[23],并且B细胞成熟抗原(B cell maturation antigen,BCMA)和跨膜蛋白活化物(Transmembrane activator and cyclophilin ligand interactor TACI,TNFRSF-13B)是它们的共同受体,APRIL和BAFF以及它们的受体组成了“APRIL/BAFF系统”,这个系统在免疫方面起着非常重要的作用[24]。本研究中,经不同剂量的MC-LR处理,APRIL在头肾中的表达均被抑制,尤其在100 μg MC-LR·kg-1 BW处理组中APRIL基因抑制最强,相对表达抑制百分比为7%;在脾脏组织中,APRIL尽管在25 μg MC-LR·kg-1 BW低剂量中的表达没有显著变化,但相对于对照组来说,相对抑制百分比也达到了63%,因此根据脾脏和头肾中APRIL基因表达变化来看,MC-LR可明显影响这些B淋巴细胞相关的表达因子,从而影响鱼类的免疫系统。当然,仅通过检测BAFF和APRIL这两个B淋巴细胞相关的细胞因子的表达,还是难以全面评价MC-LR对鱼类细胞因子的影响,故在今后的研究中,将从多基因角度检测MC-LR对鱼类细胞因子的影响。
4 结论本研究从免疫器官和免疫基因两方面检测了不同浓度MC-LR对草鱼免疫系统的影响,随着MC-LR剂量的增加和时间的延长,脾脏和头肾的病理变化更明显,并呈现剂量和时间效应。从基因水平发现MC-LR可明显抑制B淋巴细胞相关的细胞因子BAFF和APRIL的表达,这些结果均说明MC-LR对草鱼免疫功能有明显的抑制作用。当生物体被有毒物质等胁迫后,会有一系列的基因产生变化,这些基因可以作为生物化学标记以检测有机体是否处于不利环境。从本研究结果中BAFF和APRIL的表达来看,MC-LR对这两个基因的影响没有时间和剂量效应,尽管这两个基因对MC-LR比较敏感,但并不能作为预警MC-LR的基因标记物。因此,在今后的研究中将着重从更多细胞因子中筛选一些基因标记物预警MC-LR对生态环境的影响,为MC-LR的风险评估奠定基础。
| [1] |
Puddick J, Prinsep M R, Wood S A, et al. High levels of structural diversity observed in microcystins from Microcystis CAWBG11 and characterization of six new microcystin congeners[J]. Marine Drugs, 2014, 12(11): 5372-5395. DOI:10.3390/md12115372 |
| [2] |
Rymuszka A. Microcystin-LR induces cytotoxicity and affects carp immune cells by impairment of their phagocytosis and the organization of the cytoskeleton[J]. Journal of Applied Toxicology, 2013, 33(11): 1294-1302. |
| [3] |
Manning M J. Immunology:A comparative approach[C]//Turner R J(Eds.), Chichester:John Wiley and Sons Press, 1994:66-99.
|
| [4] |
Rijkers G T, Frederix-Wolters E M, Van Muiswinkel W B. The haemolytic plaque assay in carp(Cyprinus carpio)[J]. Journal of Immunological Methods, 1980, 33(1): 79-86. DOI:10.1016/0022-1759(80)90084-8 |
| [5] |
Pathak N, Khandelwal S. Impact of cadmium in T lymphocyte subsets and cytokine expression:Differential regulation by oxidative stress and apoptosis[J]. Biometals, 2008, 21(2): 179-187. DOI:10.1007/s10534-007-9106-7 |
| [6] |
Moore P A, Belvedere O, Orr A, et al. BLyS:Member of the tumor necrosis factor family and B lymphocyte stimulator[J]. Science, 1999, 285(5425): 260-263. DOI:10.1126/science.285.5425.260 |
| [7] |
Woo S J, Im J, Jeon J H, et al. Induction of BAFF expression by IFN-γ via JAK/STAT signaling pathways in human intestinal epithelial cells[J]. Journal of Leukocyte Biology, 2013, 93(3): 363-368. DOI:10.1189/jlb.0412210 |
| [8] |
Pieper K, Grimbacher B, Eibel H. B-cell biology and development[J]. Journal of Allergy and Clinical Immunology, 2013, 131(4): 959-971. DOI:10.1016/j.jaci.2013.01.046 |
| [9] |
Pradet-Balade B, Medema J P, López-Fraga M, et al. An endogenous hybrid mRNA encodes TWE-PRIL, a functional cell surface TWEAK-APRIL fusion protein[J]. EMBO Journal, 2002, 21: 5711-5720. DOI:10.1093/emboj/cdf565 |
| [10] |
Dillon S R, Gross J A, Ansell S M, et al. An APRIL to remember:novel TNF ligands as therapeutic targets[J]. Nature Reviews Drug Discovery, 2006, 5(3): 235-246. DOI:10.1038/nrd1982 |
| [11] |
Wei L L, Sun BaoJian, Nie Pin. Ultrastructural alteration of lymphocytes in spleen and pronephros of grass carp(Ctenopharyngodon idella) experimentally exposed to microcystin-LR[J]. Aquaculture, 2008, 280(1-4): 270-275. DOI:10.1016/j.aquaculture.2008.05.015 |
| [12] |
Trinchet I, Djediat C, Huet H, et al. Pathological modifications followings sub-chronic exposure of medaka fish(Oryzias latipes) to microcystin-LR[J]. Reproductive Toxicology, 2011, 32(3): 329-340. DOI:10.1016/j.reprotox.2011.07.006 |
| [13] |
Carbis C R, Rawlin G T, Mitchell G F, et al. The histopathology of carp, Cyprinus carpio L., exposed to microcystins by gavage, immersion and intraperitoneal administration[J]. Journal of Fish Diseases, 1996, 19(3): 199-207. |
| [14] |
Trinchet I, Djediat C, Huet H, et al. Pathological modifications followings sub-chronic exposure of medaka fish(Oryzias latipes) to microcystin-LR[J]. Reproductive Toxicology, 2011, 32(3): 329-340. DOI:10.1016/j.reprotox.2011.07.006 |
| [15] |
Couillard C M, Williams P J, Courtenay S C, et al. Histopathological evaluation of Atlantic tomcod(Microgadus tomcod) collected at estuarine sites receiving pulp and paper mill effluent[J]. Aquatic Toxicology, 1999, 44: 263-278. DOI:10.1016/S0166-445X(98)00085-X |
| [16] |
Secombes C J, Wang T, Bird S. The interleukins of fish[J]. Developmental & Comparative Immunology, 2011, 35: 1336-1345. |
| [17] |
Ryffel B. Role of proinflammatory cytokines in a toxic response:Application of cytokine knockout mice in toxicological research[J]. Toxicology Letters, 1995, 82-83: 477-482. DOI:10.1016/0378-4274(95)03496-X |
| [18] |
Wei L L, Sun B J, Song L R, et al. Gene expression profiles in liver of zebrafish treated with microcystin-LR[J]. Environmental Toxicology and Pharmacology, 2008, 26(1): 6-12. DOI:10.1016/j.etap.2007.12.007 |
| [19] |
Wei L L, Sun B J, Chang M X, et al. Effects of cyanobacterial toxin microcystin-LR on the transcription levels of immune-related genes in grass carp Ctenopharyngodon idella[J]. Environmental Biology of Fishes, 2009, 85(3): 231-238. DOI:10.1007/s10641-009-9488-1 |
| [20] |
Schneider P. The role of APRIL and BAFF in lymphocyte activation[J]. Current Opinion in Immunology, 2005, 17: 282-289. DOI:10.1016/j.coi.2005.04.005 |
| [21] |
郭琼林, 卢全章. 草鱼肾脏和脾脏血细胞发育过程的观察[J]. 水生生物学报, 1993, 17(1): 40-45. GUO Qiong-lin, LU Quan-zhang. Observation on the development of blood cells in kidney and spleen of grass carp[J]. Acta Hydrobiologica Sinica, 1993, 17(1): 40-45. |
| [22] |
Hahne M, Kataoka T, Schröte M, et al. APRIL, a new ligand of the tumor necrosis factor family, stimulates tumor cell growth[J]. Journal of Experimental Medicine, 1998, 188(6): 1185-1190. DOI:10.1084/jem.188.6.1185 |
| [23] |
Rennert P, Schneider P, Cachero T G, et al. A soluble form of B cell maturation antigen, a receptor for the tumor necrosis factor family member APRIL, inhibits tumor cell growth[J]. Journal of Experimental Medicine, 2000, 192(11): 1677-1684. DOI:10.1084/jem.192.11.1677 |
| [24] |
Wu Y, Bressette D, Carrell J A, et al. Tumor necrosis factor(TNF) receptor superfamily member TACI is a high affinity receptor for TNF family members APRIL and BLys[J]. Journal of Biological Chemistry, 2000, 275(45): 35478-35485. DOI:10.1074/jbc.M005224200 |
 2017, Vol. 36
2017, Vol. 36





