文章信息
- 王伟, 柴菁, 孙翰昌, 丁诗华
- WANG Wei, CHAI Jing, SUN Han-chang, DING Shi-hua
- 氟氯氰菊酯对草鱼的急性毒性及转氨酶活性的影响
- Acute toxicity of cyfluthrin and its effect on transaminase activity in grass carp (Ctenopharyngodon idellus)
- 农业环境科学学报, 2017, 36(12): 2388-2393
- Journal of Agro-Environment Science, 2017, 36(12): 2388-2393
- http://dx.doi.org/10.11654/jaes.2017-0817
文章历史
- 收稿日期: 2017-06-09
- 录用日期: 2017-08-23
2. 遂宁市产品质量监督检验所, 四川 遂宁 629000;
3. 重庆文理学院林学与生命科学学院, 重庆 402160
2. Suining Institute Product Quality Supervision & Inspection, Suining 629000, China;
3. College of Forestry and Life Science, Chongqing University of Arts and Sciences, Chongqing 402160, China
氟氯氰菊酯[α-氰基-4-氟-3-苯氧基苄基-3-(2,2-二氯乙烯基)-2,2-二甲基环丙烷羧酸酯,Cyfluthrin]是农业上广泛应用的拟除虫菊酯类杀虫剂,比传统的有机氯、有机磷类杀虫剂具有更好的杀虫效果,已成为传统杀虫剂的重要替代品[1]。但由于长期过量使用,氟氯氰菊酯污染、残留所造成的环境问题已受到广泛关注[2],研究其在环境中的降解、转运以及生物毒性显得尤为迫切。近年来,已有较多关于拟除虫菊酯对鱼类毒性的研究报道[3-5],但有关氟氯氰菊酯对鱼类肝肾毒性效应的研究,特别是对肝肾转氨酶活性影响的研究仍鲜有报道。肝脏、肾脏是脊椎动物重要的内脏器官,研究氟氯氰菊酯对鱼类肝肾转氨酶活性的影响,有助于揭示氟氯氰菊酯对肝肾生理功能的毒性效应。
在脊椎动物体内,谷丙转氨酶(Alanine aminotransferase,EC2.6.1.2,ALT)与谷草转氨酶(Aspartate aminotransferase,EC2.6.1.1,AST)是活性最强的两种转氨酶,催化机体内α-氨基和α-酮基相互转换[6]。中毒或其他原因引起肝肾组织发生病变或损伤时,ALT、AST活性将明显升高。因此,ALT、AST可作为研究肝肾组织损伤的一项重要指标[7-8]。本研究以草鱼(Ctenopharyngodon idellus)为实验对象,利用酶学测定法检测亚致死浓度氟氯氰菊酯处理引起的肝肾ALT、AST活性变化,分析实验室条件下氟氯氰菊酯污染物对草鱼肝肾ALT、AST活性的影响,进而评估该污染物对草鱼肝肾生理功能的毒性效应,为进一步研究氟氯氰菊酯等拟除虫菊酯类污染物的毒理机制提供一定的实验依据。
1 材料与方法 1.1 实验鱼及饲养实验用鱼为草鱼(属重庆永川双竹草鱼原种场的长江水系草鱼原种),购自重庆市北碚区歇马镇留缘水产养殖场,体重20~30 g,体长10.0~12.0 cm,体质健康,无伤病。暂养容器为直径2 m、高1 m的圆柱养殖缸,养殖用水为曝气7 d以上的自来水,水温为(24±1)℃,溶解氧在5 mg·L-1以上,pH在6.8左右,光暗周期为10:14。暂养一周后,挑取2000尾体质健康、规格一致的草鱼作为受试对象,暂养期间每日早晚各喂食一次,投喂量为草鱼体重的3%。
1.2 试剂及仪器氟氯氰菊酯购自山东新势立生物科技有限公司,是有效浓度为2.5%的水乳剂;总蛋白(TP)测定试剂盒、ALT测试盒和AST测试盒均购自南京建成生物工程研究所,其他试剂均为分析纯;UV-1700型紫外分光光度计为日本Shimadzu公司产品;3K15型冷冻离心机为德国Sigma公司产品;SANYO MDF-382E(N)型超低温冰箱为日本SANYO公司产品;A-5082型酶标仪为澳大利亚TECAN公司产品;DY89-Ⅱ电动玻璃匀浆机为宁波新芝生物科技有限公司产品。
0.1 g·L-1氟氯氰菊酯母液配制:用微量移液器量取400 μL 2.5%氟氯氰菊酯加入蒸馏水稀释,搅拌并用100 mL容量瓶定容,摇匀,放到4 ℃备用。实验时,根据处理组浓度,取相应量加入水中,并混匀。
1.3 草鱼暴露处理 1.3.1 急性毒性实验采用静水染毒法,实验容器为120 L的聚乙烯塑料桶,加50 L水,将实验鱼随机分组,每组10尾。实验用水为曝气7 d以上的自来水,水温为(24±1)℃,溶解氧在5 mg·L-1以上,pH在6.8左右,光暗周期为10:14。实验设5个处理组(0.6、0.8、1.0、1.5、2.0 μg·L-1)和1个空白对照组,每个处理组设3个重复,分别于24、48、72 h和96 h后观察草鱼鳃盖是否还有活动,并用玻璃棒轻触尾柄观察是否有应激反应,若没有则说明鱼已死亡,并记录草鱼的死亡数,死亡鱼及时从水中捞出。实验期间不进行喂食,各组每24 h用相应浓度的新鲜实验液更换1/2水体。
1.3.2 亚急性毒性实验根据急性毒性实验结果,按常规方法以96 h LC50×0.10作为安全浓度,实验处理浓度为亚致死浓度,介于96 h LC50与安全浓度之间。实验容器为120 L塑料桶,每桶加相应实验液100 L,将受试草鱼随机分组,每组100尾,设4个处理组(0.2、0.4、0.6、0.8 μg·L-1)和1个空白对照组,每个处理组设置3个重复,每24 h更换实验液的1/2,每日喂食一次。
1.4 样品制备分别在暴露的第1、2、3、5、10 d,从各处理组随机抽取10尾草鱼,并分别放到含35 mg·L-1鱼安定的水中进行麻醉,解剖取肝脏、肾脏。然后置于预冷生理盐水中漂洗,除去血液,滤纸拭干,于冰浴中将肝(或肾)剪碎。称取2 g肝(或肾)样品,加入预冷生理盐水8 mL,一起倒入匀浆器,在冰浴中以1000 r·min-1匀浆8 min,使组织匀浆化。将匀浆液以12 000 r·min-1离心10 min,收集上清液,用于酶活性测定。
1.5 酶活性测定总蛋白含量测定采用考马斯亮蓝法。按照南京建成“蛋白(TP)含量试剂盒”说明书的操作步骤,在样品液中添加相应试剂,混匀后静置1 min,在595 nm下测定吸光值。
ALT活性测定:按照南京建成“ALT测试盒”说明书,根据步骤加入预热的基质液20 μL,并加入待测样品5 μL混合,37 ℃水浴30 min,然后加入2,4-二硝基苯肼液20 μL,混匀,37 ℃水浴20 min,然后加入0.4 mol·L-1氢氧化钠200 μL,混匀,室温放置15 min后,在510 nm下测定吸光值。
AST活性测定:按照南京建成“AST测试盒”说明书,根据步骤加入预热的基质液20 μL,并加入待测样品5 μL混合,37 ℃水浴30 min,然后加入2,4-二硝基苯肼液20 μL,混匀,37 ℃水浴20 min,然后加入0.4 mol·L-1氢氧化钠200 μL,混匀,室温放置15 min后,在510 nm下测定吸光值。
根据标准曲线分别求出ALT、AST活性,酶活性以每克蛋白所含的酶活力单位数(U·g-1)来表示。
1.6 数据处理实验结果利用SPSS 19.0进行统计分析,实验数据用平均数±标准差(Mean±SD)表示,用Origin 2017制作柱状图,方差分析采用单因素方差分析法(One-Way ANOVA),应用最小极差法(LSD)比较组间差异,以P<0.05作为差异显著水平;同时将处理组酶活性与对照组酶活性进行t检验,以确定差异的极显著水平(P<0.01)。
2 结果与分析 2.1 急性毒性实验结果氟氯氰菊酯暴露处理时,中毒草鱼行为异常,身体失去平衡,游动缓慢,腹部向上,游动过程中出现侧翻、打转、跳跃等症状,随之沉入水底,最后死亡。死鱼眼球突出,眼底有出血点,解剖发现腹腔内有黄色液体,肾脏上有小黑点,肝胰脏、胆囊肿大。急性毒性实验结果见表 1,采用Bliss法计算出96 h LC50为1.112 μg·L-1,并以此为依据设置4个亚致死暴露浓度:0.2、0.4、0.6、0.8 μg·L-1。
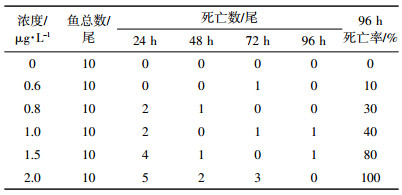
肝脏ALT活性的测定结果见图 1。在暴露初期(3 d内),不同浓度的氟氯氰菊酯对草鱼肝脏ALT活性均表现诱导作用,并且当暴露浓度不超过0.6 μg·L-1时,诱导作用随暴露浓度增加而不断增强。经0.2 μg·L-1氟氯氰菊酯暴露的10 d内,草鱼肝脏ALT活性均高于对照组。0.6 μg·L-1浓度处理组在暴露3 d后表现显著诱导作用(P<0.01),ALT活性上升39.37%,5 d后则表现抑制作用,10 d后活性下降32.26%。0.8 μg·L-1氟氯氰菊酯处理1 d后,ALT活性便上升28.12%,随后逐渐下降,5 d后ALT活性被抑制,并且随时间的延长,抑制作用逐渐增强。
|
| *表示各个处理组与对照组酶活性差异极显著(P<0.01);不同小写字母表示不同浓度之间酶活性差异显著(P<0.05),下同 图 1 氟氯氰菊酯暴露对草鱼肝脏ALT活性的影响 Figure 1 Effects of cyfluthrin on liver ALT activity of C.idellus |
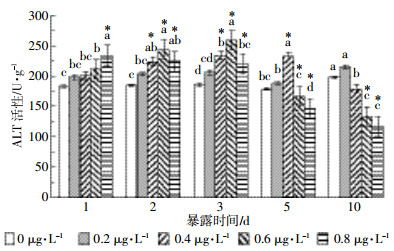
图 2显示,氟氯氰菊酯对草鱼肾脏ALT活性也有较大影响。经氟氯氰菊酯处理1 d后,各处理组肾脏ALT活性大多有所升高,且高浓度处理组(0.8 μg·L-1)活性上升显著,较对照组上升26.74%。当氟氯氰菊酯浓度较低(0.2、0.4 μg·L-1)时,随着暴露时间的增加,ALT活性基本保持恒定,5 d后相对于对照组有所升高。在0.6 μg·L-1和0.8 μg·L-1处理组,草鱼肾脏ALT活性分别在第3 d和第2 d开始降低,并逐渐接近对照组的酶活性水平,在第5 d则显著低于对照组(P<0.01)。
|
| 图 2 氟氯氰菊酯对草鱼肾脏ALT活性的影响 Figure 2 Effects of cyfluthrin on kidney ALT activity of C.idellus |
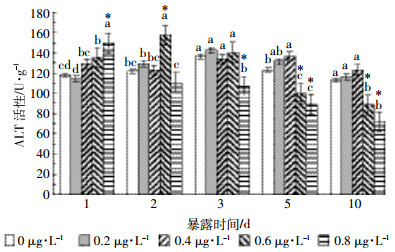
氟氯氰菊酯暴露对草鱼肝脏AST活性的影响结果见图 3。在0.2 μg·L-1处理组中,肝脏AST活性在2 d内受到一定程度的抑制,3 d后与对照组差异不显著(P>0.05)。其余各处理组在暴露1 d时,AST活性均高于对照组,且0.6 μg·L-1和0.8 μg·L-1处理组活性上升极显著,分别比对照组上升23.36%、31.45%。2 d后AST活性开始逐渐降低,并在5 d后显著低于对照组,10 d后0.8 μg·L-1氟氯氰菊酯对肝脏AST活性的抑制作用极显著(P<0.01)。
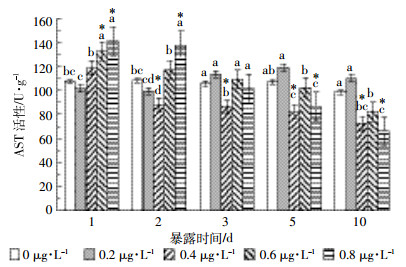
|
| 图 3 氟氯氰菊酯暴露对草鱼肝脏AST活性的影响 Figure 3 Effects of cyfluthrin on liver AST activity of C.idellus |
氟氯氰菊酯对草鱼肾脏AST活性的影响见图 4。在整个暴露期间(10 d内),低浓度氟氯氰菊酯(0.2 μg·L-1)处理组AST活性均略低于对照组活性,对肾脏AST活性影响较小。其他浓度的处理组在暴露1 d时对肾脏AST活性有不同程度的诱导作用,0.8 μg·L-1处理组在暴露1 d时AST活性上升22.56%。2 d时处理组AST活性降低并接近对照组,3 d后开始表现一定的抑制作用,并且随暴露时间延长抑制作用增大,10 d时0.4、0.6、0.8 μg·L-1处理组的AST活性分别下降30.71%(P<0.01)、20.35%(P<0.01)、36.02%(P<0.01)。
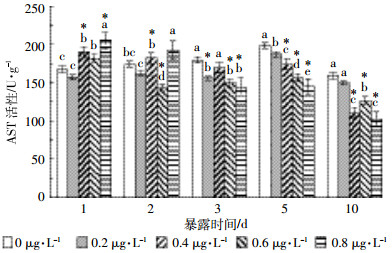
|
| 图 4 氟氯氰菊酯暴露对草鱼肾脏AST活性的影响 Figure 4 Effects of cyfluthrin on kidney AST activity of C.idellus |
拟除虫菊酯是一类含有苯氧基的环丙烷酯类农药,具有高效、广谱的特点,广泛应用于农业病虫害防治和卫生等方面[9]。氟氯氰菊酯是一种含有α-氰基的Ⅱ型拟除虫菊酯,与不含α-氰基的拟除虫菊酯农药相比具有较高的毒性,在我国的使用量较大,现已被美国环保局确定为首要控制使用的拟除虫菊酯类农药之一[10]。本研究结果显示氟氯氰菊酯污染对草鱼急性毒性作用明显,并且随着浓度或暴露时间的增加,草鱼死亡率增大。氟氯氰菊酯对草鱼96 h LC50为1.112 μg·L-1,与鳙鱼(Aristichthys nobilis)、鲫鱼(Carassius auratus)、鲤鱼(Cyprinus carpio)[11]、虹鳟(Oncorhyncus mykiss)[12]等相比,本研究得出的半致死浓度相对偏大,这可能与实验鱼的种类、个体大小差异以及实验环境不同有关。根据我国急性毒性相关标准[13],氟氯氰菊酯对草鱼属于急性毒性类别1。拟除虫菊酯类农药对鱼类来说属于剧毒农药,对鱼类具有较强的神经毒性,鱼类中毒后出现失去平衡、反转、跳跃、打转等神经异常的行为,这些均见于本研究结果。拟除虫菊酯还能诱导肝肾脏病变,本研究中草鱼肝胰脏肿大,肾脏出现黑点。许多研究发现,拟除虫菊酯能引起鱼类肝脏组织出血,肝细胞肿胀,水样变性,甚至细胞裂解等;也能引起肾脏肾间组织充血,肾小管管壁细胞水样变性,肾小球萎缩,肾小囊膨胀等[14-15]。
3.2 氟氯氰菊酯对草鱼转氨酶活性的影响本研究发现,氟氯氰菊酯对草鱼体内ALT、AST具有显著性的影响。ALT、AST是生物体内两种广泛存在的转氨酶,在机体蛋白质代谢过程中发挥重要作用[16],当肝肾等器官的组织细胞发生病变或损伤时,ALT、AST活性会出现明显变化[17]。此外,已发现很多农药污染物对肝肾ALT、AST活性具有一定的诱导或抑制作用[16, 18]。这些研究结果表明,肝肾等器官出现的ALT、AST活性变化实际上提示其生理功能出现异常。因此,ALT、AST可作为检测机体组织、器官是否中毒或病变的重要指标[19]。
在本研究中,暴露初期氟氯氰菊酯诱导肝肾ALT、AST活性升高,并且随着氟氯氰菊酯浓度增大,两种转氨酶活性逐渐增强。原因可能是肝肾具有解毒功能,有毒物质与谷胱甘肽结合是肝肾脏重要的解毒环节[20]。在短期胁迫下,拟除虫菊酯诱导ALT、AST活性升高,催化谷氨酸的生成反应,从而促进谷胱甘肽生成,解毒能力增强,保持机体正常的代谢能力,减少对鱼体的损伤[21]。在肝脏中ALT、AST活性被诱导的时间长于肾脏,原因可能是肝脏是机体最大的解毒器官[22],ALT、AST活性升高可促进肝脏对有毒物质的代谢。氟氯氰菊酯在暴露初期对ALT、AST具有一定的诱导作用,并且氟氯氰菊酯浓度越大,诱导作用越短暂,反之则诱导作用越持久。Loteste等[23]也发现亚致死浓度(0.300 μg·L-1)的氯氰菊酯可引起条纹鲮脂鲤(Prochilodus lineatus)肝脏中两种转氨酶活性的显著升高。王媛等[24]发现高效氯氰菊酯能够诱导鲫鱼(Carassius auratus)血清中ALT、AST活性显著升高。夏晓华等[25]的研究结果显示,在暴露初期高浓度(7.15 μg·L-1)氯氟氰菊酯对泥鳅(Misgurnus anguillicaudatus)肝脏组织中ALT、AST活性的诱导时间少于低浓度处理组,这些研究与本实验获得的结果基本一致。
随着暴露时间延长及浓度的升高,草鱼肝肾ALT、AST活性表现下降趋势,并显著低于对照组,说明氟氯氰菊酯对肝肾ALT、AST活性具有抑制作用。类似的结果也见于其他研究报道,例如高浓度(7.15 μg·L-1)高效氯氟氰菊酯对泥鳅肝脏ALT、AST的抑制比率分别能达到62.27%、59.91%[25]。原因可能是高浓度胁迫或长时间暴露下,肝肾功能障碍,代谢紊乱,有害物质导致组织损伤,肝肾细胞功能下降[25],甚至坏死,致使转氨酶活性降低,从而影响鱼体生理功能,甚至导致鱼体死亡。但Prusty等[26]研究发现,用1.79 μg·L-1氰戊菊酯处理南亚野鲮(Labeo rohita)15 d后,肝脏ALT、AST活性增强。Vani等[27]在研究氯氰菊酯对卡特拉魮(Catla catla)的影响时,也发现经0.443 μg·L-1氯氰菊酯处理60 d后,卡特拉魮肝脏ALT、AST活性分别升高30.16%、32.47%,这些发现与本实验的结果有些差异,可能由于长期暴露下,氧化应激的作用引起蛋白质代谢增加或者肝组织过度损伤[28]。
氟氯氰菊酯对草鱼肝肾ALT、AST活性均有明显的影响,且具有相似的变化趋势,存在明显的时间-剂量效应关系。尤其是肝脏ALT、AST活性变化表现更为明显的时间-剂量效应关系,可作为拟除虫菊酯类农药污染物的生物标记。本研究揭示了氟氯氰菊酯对草鱼肝肾ALT、AST的影响,但有关氟氯氰菊酯进入草鱼机体后的转运、富集、代谢机制以及对基因表达的毒理效应仍需进一步的研究。
4 结论(1)氟氯氰菊酯对草鱼的96 h LC50为1.112 μg·L-1,根据我国相关急性毒性标准,氟氯氰菊酯对草鱼有剧毒。
(2)暴露初期,亚致死浓度的氟氯氰菊酯对草鱼肝肾ALT、AST活性具有一定的诱导作用。随着暴露时间的延长,亚致死浓度的氟氯氰菊酯对两种转氨酶表现出抑制的趋势,并且浓度越大抑制作用越强。
(3)氟氯氰菊酯可影响草鱼肝肾某些生理生化指标,提示其对草鱼肝肾具有一定的毒性效应。
| [1] |
张梅凤, 唐永军, 杨朝晖, 等. 氟氯氰菊酯的合成[J]. 农药, 2006, 45(8): 529-530. ZHANG Mei-feng, TANG Yong-jun, YANG Zhao-hui, et al. Synthesis of cyfluthrin[J]. Agrochemicals, 2006, 45(8): 529-530. |
| [2] |
Chen S H, Dong Y H, Chang C Q, et al. Characterization of a novel cyfluthrin-degrading bacterial strain Brevibacterium aureum and its biochemical degradation pathway[J]. Bioresource Technology, 2013, 132: 16-23. DOI:10.1016/j.biortech.2013.01.002 |
| [3] |
王丽, 张耘泽, 耿歌, 等. 高效氯氰菊酯急性暴露中斑马鱼相关酶活性和基因表达变化[J]. 生态毒理学报, 2016, 11(4): 146-154. WANG Li, ZHANG Yun-ze, GENG Ge, et al. Variations of relevant enzyme activities and genes expressions in zebrafish under acute exposure to beta cypermethrin[J]. Asian Journal of Ecotoxicology, 2016, 11(4): 146-154. |
| [4] |
吴楠, 魏华, 沈竑, 等. 溴氰菊酯对克氏原螯虾肌肉组织的毒性研究[J]. 水产学报, 2015, 39(9): 1412-1421. WU Nan, WEI Hua, SHEN Hong, et al. The toxic research of deltamethrin on the muscle tissue of the red swamp crayfish(Procambarus clarkia)[J]. Journal of Fisheries of China, 2015, 39(9): 1412-1421. |
| [5] |
周贤君, 汤晓华, 宴青青. 氯氰菊酯和溴氰菊酯对青田田鱼幼鱼的急性毒性研究[J]. 饲料工业, 2011, 32(10): 46-48. ZHOU Xian-jun, TANG Xiao-hua, YAN Qing-qing. Acute toxicity of cypermethrin and deltamethrin to juvenile of Cyprinus carpio var. color[J]. Journal of Feed Industry, 2011, 32(10): 46-48. DOI:10.3969/j.issn.1001-991X.2011.10.011 |
| [6] |
牟文, 夏伟, 熊丽, 等. 氯氰菊酯对鲫鱼机体代谢损伤效应研究[J]. 华中师范大学学报(自然科学版), 2008, 42(4): 602-605. MOU Wen, XIA Wei, XIONG Li, et al. Study of metabolizable damage in Carassius auratus caused by cypermethrin[J]. Journal of Central China Normal University(Natural Sciences), 2008, 42(4): 602-605. |
| [7] |
谭娟, 尚蕾, 肖雅元. 甲氰菊酯对尼罗罗非鱼组织乙酰胆碱酯酶、谷丙转氨酶和谷胱甘肽活性的影响[J]. 淡水渔业, 2011, 41(3): 39-42, 21. TAN Juan, SHANG Lei, XIAO Ya-yuan. Effects of fenpropathrin on activities of AChE, GPT and GSH in tissues of Tilapia nilotica[J]. Freshwater Fisheries, 2011, 41(3): 39-42, 21. |
| [8] |
郑永华, 蒲富永. 汞对鲤鲫鱼组织转氨酶活性的影响[J]. 西南农业大学学报, 1997, 19(1): 41-45. ZHENG Yong-hua, PU Fu-yong. Effect of mercury on transaminase activies of tissuse in Cpcarpio & Cauratus[J]. Journal of Southwest Agricultural University, 1997, 19(1): 41-45. |
| [9] |
Shashikumar S, Rajini P S. Cypermethrin-induced alterations in vital physiological parameters and oxidative balance in Caenorhabditis elegans[J]. Pesticide Biochemistry and Physiology, 2010, 97(3): 235-242. DOI:10.1016/j.pestbp.2010.03.002 |
| [10] |
梁茹晶, 宋雪英, 宋晗, 等. 氟氯氰菊酯、溴氰菊酯和联苯菊酯对赤子爱胜蚓的急性毒性[J]. 沈阳药科大学学报, 2016, 33(11): 901-907. LIANG Ru-jing, SONG Xue-ying, SONG Han, et al. Acute toxic effects of cyfluthrin, deltamethrin, and bifenthrin exposure on the earthworm(Eisenia fetida)[J]. Journal of Shenyang Pharmaceutical University, 2016, 33(11): 901-907. |
| [11] |
王学生, 龚书椿. 拟除虫菊酯类杀虫剂对淡水鱼的毒性实验及评价[J]. 上海环境科学, 1990, 9(4): 35-36. WANG Xue-sheng, GONG Shu-chun. The experiment and evaluation toxicity of pyrethroid insecticides to freshwater fish[J]. Shanghai Environmental Sciences, 1990, 9(4): 35-36. |
| [12] |
Bradbury S P, Coats J R. Comparative toxicology of the pyrethroid insecticides[J]. Reviews of Environmental Contamination and Toxicology, 1989, 108: 133-177. |
| [13] |
中国国家标准化管理委员会. GB 30000. 28-2013化学品分类和标签规范第28部分: 对水生环境的危害[S]. 北京: 中国标准出版社, 2013. Standardization Administration of China. GB 30000.28-2013 Rules for classification and labelling of chemicals. Part28:Hazardous to the aquatic environment[S]. Beijing:China Standards Press, 2013. |
| [14] |
Velmurugan B, Selvanayagam M, Cengiz E I, et al. Histopathology of lambda-cyhalothrin on tissues(gill, kidney, liver and intestine) of Cirrhinus mrigala[J]. Environmental Toxicology and Pharmacology, 2007, 24(3): 286-291. DOI:10.1016/j.etap.2007.07.001 |
| [15] |
郑永华, 赵杨, 汪官余. 灭扫利农药对鲫鱼及其它几种水生动物的毒性研究[J]. 西南农业学报, 1999, 12(3): 117-121. ZHENG Yong-hua, ZHAO Yang, WANG Guan-yu. Studys on toxicity of meothrin to Carassius auratus and other several aquatic animals[J]. Southwest China Journal of Agricultural Sciences, 1999, 12(3): 117-121. |
| [16] |
宋美艳, 张永辉, 朴元国, 等. 4-硝基酚对大鼠肝脏的毒性及氧化损伤[J]. 生态毒理学报, 2014, 9(3): 495-502. SONG Mei-yan, ZHANG Yong-hui, PIAO Yuan-guo, et al. Toxic effects and oxidative damage of 4-nitrophenol on rat liver[J]. Asian Journal of Ecotoxicology, 2014, 9(3): 495-502. |
| [17] |
Bhushan B, Saxena P N, Saxena N. Biochemical and histological changes in rat liver caused by cypermehrin and bete-cyfluthrin[J]. Arhiv Za Higijenu Rada Ⅰ Toksikologiju-archiv of Industral Hygiene and Toxicology, 2013, 64(1): 57-67. |
| [18] |
刘红玲, 于红霞, 许铁莲, 等. 联苯胺类化合物对锦鲤肝脏转氨酶影响的初探[J]. 农业环境科学学报, 2005, 24(6): 1069-1074. LIU Hong-ling, YU Hong-xia, XU Tie-lian, et al. Effects of benzidine congeners on two aminopherases in golden carp liver[J]. Journal of Agro-environmental Science, 2005, 24(6): 1069-1074. |
| [19] |
张弛, 刘瑛, 李华珠, 等. 血清谷丙转氨酶在正常范围内对非酒精性脂肪性肝病的预测[J]. 世界华人消化杂志, 2011(8): 841-844. ZHANG Chi, LIU Ying, LI Hua-zhu, et al. Predictive significance of normal serum alanine aminotransferase in patients with nonalcoholic fatty liver disease[J]. World Chinese Journal of Digestology, 2011(8): 841-844. |
| [20] |
丁延祄. 肝脏的解毒功能[J]. 生物学通报, 1985(10): 1-6. DING Yan-jie. The rerview of the detoxification function of the liver[J]. Bulletin of Biology, 1985(10): 1-6. |
| [21] |
Stebbing A R D. Hormesis the stimulation of growth by low levels of inhibition[J]. Science of the Total Environment, 1982, 22(1): 213-234. |
| [22] |
陈家长, 冷春梅, 胡庚东, 等. 溴氰菊酯对罗非鱼血清中溶菌酶质量浓度及肝脾脏影响[J]. 生态环境, 2007, 16(3): 785-789. CHEN Jia-zhang, LENG Chun-mei, HU Geng-dong, et al. Influences of decamethrin on the concentration of serum lysozyme and the surface changes of liver and spleen in tilapia[J]. Ecology and Environment, 2007, 16(3): 785-789. |
| [23] |
Loteste A, Scagnetti J, Simoniello M F, et al. Hepatic enzymes activity in the fish Prochilodus lineatus(Valenciennes, 1836) after sublethal cypermethrin exposure[J]. Bulletin of Environmental Contamination and Toxicology, 2013, 90(5): 601-604. DOI:10.1007/s00128-013-0961-3 |
| [24] |
王媛, 杨康健, 吴中, 等. 氯氰菊酯对鲫鱼血清中谷丙转氨酶及谷草转氨酶活力的影响[J]. 水产科学, 2005, 24(9): 8-10. WANG Yuan, YANG Kang-jian, WU Zhong, et al. Effect of beta-cypermethrin on glutamic-pyruvic transaminase and glutamic-oxaloacetic transaminase activities in Crucian carp[J]. Fisheries Science, 2005, 24(9): 8-10. |
| [25] |
夏晓华, 张林霞, 司松波, 等. 高效氯氟氰菊酯对泥鳅的急性毒性及生理毒性[J]. 江苏农业科学, 2013, 41(6): 270-272. XIA Xiao-hua, ZHANG Lin-xia, SI Song-bo, et al. Acute toxicity and physiological toxicity of iambda-cyhalothrin to Misgurnus anguillicaudatus[J]. Jiangsu Agricultural Sciences, 2013, 41(6): 270-272. |
| [26] |
Prusty A K, Kohli M P S, Sahu N P, et al. Effect of short term exposure of fenvalerate on biochemical and haematological responses in Labeo rohita(Hamilton) fingerlings[J]. Pesticide Biochemistry and Physiology, 2011, 100(2): 124-129. DOI:10.1016/j.pestbp.2011.02.010 |
| [27] |
Vani T, Saharan N, Roy S D, et al. Alteration in haematological and biochemical parameters of Catla catla exposed to sub-lethal concentration of cypermethrin[J]. Fish Physiology and Biochemistry, 2012, 38(6): 1577-1584. DOI:10.1007/s10695-012-9650-0 |
| [28] |
Nayak A K, Das B K, Kohli M P C, et al. The immunosuppressive effect of a-permethrin on Indian major carp, rohu(Labeo rohita Ham.)[J]. Fish Shellfish Immunol, 2004, 16(1): 41-50. DOI:10.1016/S1050-4648(03)00029-9 |
 2017, Vol. 36
2017, Vol. 36