文章信息
- 秦莉, 安毅, 韩建华, 陈丽, 王伟, 潘炯, 陈庚妮, 端正花
- QIN Li, AN Yi, HAN Jian-hua, CHEN Li, WANG Wei, PAN Jiong, CHEN Geng-ni, DUAN Zheng-hua
- PFOS对小油菜生长发育的毒性效应及机制
- Toxic effects and mechanisms of PFOS on the growth of rape (Brassica campestris L.)
- 农业环境科学学报, 2017, 36(12): 2401-2406
- Journal of Agro-Environment Science, 2017, 36(12): 2401-2406
- http://dx.doi.org/10.11654/jaes.2017-0705
文章历史
- 收稿日期: 2017-05-15
- 录用日期: 2017-09-12
2. 天津市农业环境保护管理监测站, 天津 300061;
3. 重庆市农业生态与资源保护站, 重庆 401121;
4. 天津理工大学环境科学与安全工程学院, 天津 300384
2. Tianjin Agro-Environment Monitoring Station, Tianjin 300061, China;
3. Chongqing Agricultural Ecology and Resource Protection Station, Chongqing 401121, China;
4. School of Environmental Science and Safety Engineering, Tianjin University of Technology, Tianjin 300384, China
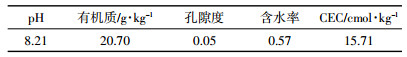
近年来,随着经济的发展,各类农药、工业添加剂的广泛使用,使得大量污染物通过大气沉降、地表径流不断转移到土壤中[1]。由于其具有持久性、生物蓄积性、半挥发性和长距离迁移性[2],能稳定存在于土壤中,造成了严重的土壤污染,给动植物和人类带来巨大的生态威胁。新型污染物全氟化合物(Perfluorinated compounds,PFCs)被大规模使用在生产领域,导致这类物质广泛进入全球环境。PFCs甚至在北极地区的生物体及环境介质中有检出[3]。据Pan等[4]报道,全氟化合物的代表物质全氟辛烷磺酸(Perfluorooctane sulfonate,PFOS,C8F17SO3H)在长江河口底泥中高达536 μg·kg-1。目前底泥肥料化也导致了种植土壤中PFOS的大面积污染[5]。Sepulvado等[6]发现美国芝加哥某生物固体改良土壤中的PFOS浓度范围在2~484 μg·kg-1。Meng等[7]调查发现PFOS为中国北部沿海地区PFCs的主要污染物。
一方面,PFOS在生物的生殖、发育、神经、免疫、遗传等方面具有毒性[8-9]。课题组前期研究也发现,0.5 μg·L-1 PFOS暴露2 d即可抑制人体正常肝细胞增殖[10]。另一方面,PFOS还能提高细胞膜对疏水性配体的渗透性能,从而使PFOS在生物个体中具有较高的生物蓄积速度[11-12]。据报道,PFOS在生物体内的蓄积水平是二恶英等的数百至数千倍[13-14]。因此,土壤环境中广泛存在的PFOS可能会通过土壤-植物系统的迁移转化,最终对人体健康造成威胁。目前PFOS的研究主要集中于几种模式生物的毒性效应上,针对土壤的毒理学试验十分匮乏。作为人类可食用蔬菜的常见代表小油菜,由于品种齐全、育种和培养技术简单成熟、生长周期短,已被广泛应用于外源化合物在土壤-植物系统中的迁移转化及毒性效应影响研究[15-17]。本研究拟在温室盆栽条件下,探讨不同浓度下土壤中PFOS对小油菜萌发、生长的影响,并结合土壤酶活性的变化,探讨土壤中PFOS对小油菜的毒性机理,以期为农业生产中早期预报PFOS对作物的毒害效应,为环境监测中PFOS污染的评价提供一定的理论依据。
1 材料与方法 1.1 材料选用上海青小油菜(Brassica campestris L.)作为供试植物,种子购自中国农业科学院蔬菜花卉研究所。PFOS和二甲基亚枫(DMSO)购自Sigma-Aldrich公司。塑料花盆和营养土购自天津市某花卉市场。花盆尺寸为45 cm×20 cm×30 cm。土壤蔗糖酶(S-SC)、碱性蛋白酶(S-ALPT)、碱性磷酸酶(S-AKP)试剂盒均购自苏州科铭生物有限公司。
1.2 方法采用温室盆栽试验,每盆准确称取营养土7 kg。试验前土壤各理化性状见表 1。称取一定量的PFOS粉末,加入2 mL DMSO助溶到1 L纯净水中,均匀搅拌到营养土中。根据PFOS土壤环境暴露浓度和预实验结果(50 mg·kg-1 PFOS以下无毒性效应表征),试验共设置6个暴露组,即空白对照组、试剂对照组和50、100、250、500 mg·kg-1 PFOS组。土壤老化1个月后,每盆直接播种蔬菜种子50粒。每组设3个平行。
蔬菜生长所需光照全部为自然太阳光,温室温度保持在20 ℃左右。每隔3 d浇灌纯净水1 L。
1.3 观察指标(1) 发芽率:肉眼观察,发芽数以露白为准。计算方法为出芽率=前10 d内出芽种子总数/供试种子总数×100%,取3盆平均值,并计算标准误差值。
(2) 生长状况:在蔬菜出芽20 d后,每盆随机计数10棵蔬菜,测定其苗长,取3盆的平均值,计算标准误差值。
(3) 土壤酶活测定:在蔬菜出芽20 d后,在每盆土层中按照梅花点采样法采集土样,混合均匀后风干,过10目筛后置于4 ℃冰箱中保存。土壤S-SC、S-ALPT、S-AKP的酶活性均依照苏州科铭生物有限公司提供的试剂盒说明书进行测定,取3盆的平均值,并计算标准误差值。
1.4 统计分析每个实验组设3个平行样。采用SPSS 13.0软件,组内进行Student-t检验,并用标准误差SD表示。组间用One-way AVONA检验。
2 结果 2.1 PFOS对小油菜生长发育的影响如图 1A所示,在小油菜的发芽率这个指标上,试剂对照组无毒性效应(P>0.05),而PFOS暴露组表现为低浓度刺激发芽、高浓度抑制发芽。50 mg·kg-1 PFOS暴露时与空白对照组表现出极显著差异(P=0.001),发芽增长率约为9.24%;100 mg·kg-1暴露浓度开始小油菜发芽受到极显著抑制(P=0.004),抑制率约为29.42%。250 mg·kg-1和500 mg·kg-1组的发芽率相对空白组也显著降低,但是与100 mg·kg-1组均无显著差异(P=0.547和P=0.717)。

|
| **表示处理间有极显著差异(P<0.01),*表示处理间有显著差异(P<0.05)。下同 图 1 PFOS对小油菜生长发育的影响 Figure 1 Influences of PFOS on the growth of rapes |
小油菜发育20 d后,从每组小油菜中各随机抽取1棵,拍照见图 2。由图 2可见,随着PFOS暴露浓度的升高,叶片面积和植株高度相对空白对照组,表现出显著的低浓度刺激生长、叶片相对茂盛,高浓度抑制生长、叶片相对瘦小发黄的现象。如图 1B的统计数据所示,在小油菜的生长发育这个指标上,试剂对照组无毒性效应(P>0.05),50 mg·kg-1 PFOS暴露时茎叶增长率约为47.97%(P<0.01),与空白对照组存在极显著差异;100 mg·kg-1 PFOS暴露时茎叶增长率反而略微降低,约为36.41%(P=0.027);250 mg·kg-1浓度暴露开始,PFOS极显著抑制小油菜茎叶的生长(P=0.006),抑制率约为55.64%。500 mg·kg-1组的茎叶增长也相对空白组极显著降低(P<0.01),但与250 mg·kg-1组相比无显著差异(P=0.915)。

|
| 图 2 PFOS影响小油菜生长发育的特征 Figure 2 Characters of the growth of rapes induced by PFOS |
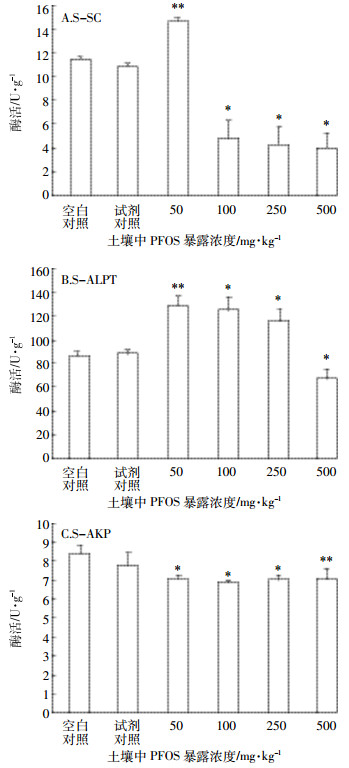
本研究进一步以土壤蔗糖酶(S-SC)、碱性蛋白酶(S-ALPT)和碱性磷酸酶(S-AKP)这3种土壤肥力的重要指标酶为研究对象,分析了PFOS对土壤肥力的影响,从而探讨PFOS对小油菜发育影响的低浓度刺激、高浓度抑制机理。
S-SC的活性测定结果如图 3A所示。溶剂对照组蔗糖酶活与空白对照组无显著差异(P>0.05)。当PFOS浓度为50 mg·kg-1时,S-SC活性显著提高,与空白对照组表现出极显著差异(P<0.01),酶活性增长率约为28.08%;从100 mg·kg-1开始,S-SC活性显著下降,也与空白对照组表现出显著差异(P=0.015),抑制率达57.81%。随着暴露浓度进一步增大,酶活性抑制率与100 mg·kg-1暴露组无显著差异(P>0.05),说明100 mg·kg-1 PFOS即能达到对土壤S-SC活性的抑制极限。总体来看,PFOS对土壤S-SC的作用表现为显著的低浓度刺激、高浓度抑制效应。
|
| 图 3 PFOS对土壤酶活性的影响 Figure 3 The influence of PFOS on the activities of solid enzymes |
S-ALPT活性测定结果如图 3B所示,可以看到50 mg·kg-1的PFOS即可极显著刺激该酶的活性(P=0.006);而暴露浓度增大到100 mg·kg-1和250 mg·kg-1时,PFOS对S-ALTP酶活性的刺激作用反而不如50 mg·kg-1时显著(P=0.017和P=0.027);当PFOS浓度达500 mg·kg-1时,S-ALTP酶活性受到显著抑制(P=0.038),抑制率为21.55%。总体来看,PFOS对土壤S-ALPT的作用也表现为显著的低浓度刺激、高浓度抑制效应。
S-AKP酶活性变化如图 3C所示。当PFOS浓度为50 mg·kg-1时,土壤S-AKP活性相对空白对照即显著降低(P=0.021),酶活抑制率为7.40%。但是随着暴露浓度增高,剂量-酶活抑制效应关系不显著。
3 讨论 3.1 PFOS对植物的毒性作用规律PFOS主要通过土壤孔隙水被植物根部吸收,再通过植物的蒸腾作用经木质部或韧皮部汁液转移到植物根茎部位[18],从而对植物茎叶产生毒性效应。高浓度PFOS能够抑制植物生长已经形成了共识。Stahl等[19]发现3 d短期暴露中,25 mg·kg-1 PFOS可使黑麦草叶片发黄、燕麦出现坏死现象。吕振娥等[20]发现PFOS对小麦的根伸长指标最为敏感,EC50值达352 mg·kg-1。Zhao等[21]研究了PFOS对油菜品种(Brassica chinensis)的根伸长量的影响,结果显示EC50范围从95~200 mg·kg-1不等。因此PFOS对作物的急性毒性相对较小。本实验中PFOS对小油菜的50%生长抑制浓度约为250 mg·kg-1,这与前人的研究结论相一致。
本研究除了发现土壤中高浓度(500 mg·kg-1)PFOS显著抑制小油菜的发芽和生长,还得到了PFOS在低浓度(50 mg·kg-1和100 mg·kg-1)下分别刺激小油菜发芽和生长的结果。即PFOS也会对植物产生类似重金属的毒物兴奋作用。Qu等[22]也发现低浓度PFOS能够刺激小麦萌芽。Zhao等[5]发现低浓度PFOS能够增加小麦的总生物量。究其机理,孔潇潇等[23]发现金鱼藻的光合作用对PFOS的生理响应表现为双重效应,即低浓度胁迫下光合作用受到促进,高浓度胁迫下光合作用受到抑制。植物的发育与其光合作用能力的强弱有显著关系。因此,推断PFOS对小油菜的这种低浓度毒性兴奋、高浓度抑制发育的效应与PFOS对小油菜光合作用的影响有一定的相关性。另外,Qu等[22]研究发现0.1~10 mg·L-1 PFOS能够刺激小麦根和茎叶中SOD酶和POD酶的表达,而当PFOS浓度达到200 mg·L-1时则会破坏植物的抗氧化系统、抑制这些抗氧化酶的表达,这可能也决定了PFOS对小油菜的双重毒性效应。
本文以小油菜的发芽率和茎叶长度作为PFOS的毒性效应观察指标。总体来说,这两个指标都表现出低浓度刺激效应和高浓度抑制效应。但是对于这两个观察指标体现毒性效应的浓度表现出不一致。具体的区别表现在50 mg·kg-1促进油菜发芽、100 mg·kg-1抑制油菜发芽,而在茎叶长度这个指标上表现为50 mg·kg-1促进油菜生长,100 mg·kg-1也促进油菜生长,但是促进的程度略微降低。造成这个差异的原因可能是:小油菜种子直接暴露于PFOS污染土壤中,受到的侵害更加直接;而小油菜在PFOS土壤的生长关系到更多复杂的过程,暴露土壤中酶的变化、根系对PFOS的转移、油菜对PFOS的蓄积从而造成毒性效应等过程,在这些综合作用下,有可能造成茎叶生长与发芽率表现出不同的规律。
3.2 PFOS对植物的毒性作用机制土壤酶作为各类有机污染物在土壤中代谢降解过程的主要参与者,其活性直接反映了土壤中进行的各种生物化学过程的强度和方向。因此土壤酶活性被广泛用于各类土壤毒理学的研究以反映污染物的污染程度和生态风险。
本研究发现,在不同浓度PFOS暴露下,小油菜的发芽率和茎叶生长量指标变化趋势与土壤蔗糖酶和土壤碱性蛋白酶的活性变化趋势具有一致性,即低浓度100 mg·kg-1以下PFOS暴露时这两种土壤酶活性增强,小油菜发芽率和茎叶生长量增大;高浓度500 mg·kg-1 PFOS暴露时这两种土壤酶活性减弱,小油菜发芽率和茎叶生长量降低。这与某些典型有机污染物对土壤酶的毒性效应类似。但是,不同的土壤酶对于PFOS毒性表现出不同的响应,这是由土壤酶自身的敏感性所决定的。从实验结果来看,蔗糖酶在这3种酶中对于PFOS的毒性表现最为敏感,它的活性变化与小油菜的发芽和茎叶生长的变化趋势基本一致。碱性蛋白酶对于PFOS毒性的敏感性其次,所以表现为50~250 mg·kg-1的PFOS均提升了该酶活性,仅PFOS为500 mg·kg-1时碱性蛋白酶活受到显著抑制。但是总的变化趋势与前人的结果相一致。闫颖等[24]发现多菌灵和吡虫啉这两种农药在浓度低于100 mg·kg-1时对土壤酶有激活作用,而浓度高于500 mg·kg-1时抑制土壤酶活性。
研究发现PFOS浓度为50 mg·kg-1时,土壤碱性磷酸酶活性相对空白对照即明显降低。而田海霞等[25]得出碱性磷酸酶对PFOS的同类物质——PFOA不敏感,表明PFOS对土壤肥力的影响更大。这也进一步证实了动物实验中PFOS毒性比PFOA高[10]的结论。另外,PFOS还能促进土壤过氧化氢酶、抑制尿酶的表达[21]。
土壤酶活性的变化与外源化合物改变土壤中有关真菌膜的结构和渗透性有关[26]。PFOS在土壤-微生物-植物系统中的毒性作用过程非常复杂,植物的生理发育指标和土壤酶活性的变化只是其中的一个方面。还有许多研究需要进一步开展,比如解析PFOS在土壤-微生物-植物系统中的形态转化、生物有效性及分子机理等,从而为寻求典型环境污染物的生物标志物和风险评估方法,建立其基于食品限量标准和生态系统健康的土壤安全阈值提供依据。
4 结论(1) PFOS对小油菜的发芽和生长表现为非单调剂量-效应关系。最低有效应浓度50 mg·kg-1暴露时刺激小油菜的发芽和茎叶生长。小油菜发芽和茎叶生长的抑制浓度分别为100 mg·kg-1和250 mg·kg-1,随着暴露浓度进一步增大,小油菜发芽和茎叶增长的抑制率无显著变化。
(2) 土壤蔗糖酶在研究的3种酶中对于PFOS的毒性表现最为敏感,它的活性变化与小油菜的发芽和茎叶生长的变化趋势基本一致。碱性蛋白酶活性在PFOS暴露下也表现为低浓度刺激表达、高浓度抑制表达效应。这与PFOS暴露下小油菜的生长规律具有一定的相关性。
| [1] |
刘冲, 刘晓文, 吴文成, 等. 生物炭及炭基对油麦菜生长及吸收重金属的影响[J]. 中国环境科学, 2016, 36(10): 3064-3070. LIU Chong, LIU Xiao-wen, WU Wen-cheng, et al. Effects of biochar and biochar based fertilizer on growth of Lactuca sativa L.[J]. China Environment Science, 2016, 36(10): 3064-3070. DOI:10.3969/j.issn.1000-6923.2016.10.032 |
| [2] |
赵立杰, 周萌, 任新豪, 等. 全氟辛烷磺酸和全氟辛烷羧酸在天津大黄堡湿地地区鱼体和蔬菜中的分布研究[J]. 农业环境科学学报, 2012, 31(12): 2321-2327. ZHAO Li-jie, ZHOU Meng, REN Xin-hao, et al. Distribution of perfluorooctane sulfonate and perfluorooctanoic acid in different tissues of fishes and vegetables from Dahuangpu wetland nature reserve, Tianjin City, China[J]. Journal of Agro-Environment Science, 2012, 31(12): 2321-2327. |
| [3] |
Wang T, Vestergren R, Herzke D, et al. Levels, isomer profiles, and estimated riverine mass discharges of perfluoroalkyl acids and fluorinated alternatives at the mouths of Chinese rivers[J]. Environmental Science & Technology, 2016, 50(21): 11584-11592. |
| [4] |
Pan G, You C. Sediment water distribution of perfluorooctane sulfonate(PFOS) in Yangtze River estuary[J]. Environmental Pollution, 2010, 158: 1363-1367. DOI:10.1016/j.envpol.2010.01.011 |
| [5] |
Zhao S Y, Fan Z Y, Sun L H, et al. Interaction effects on uptake and toxicity of perfluoroalkyl substances and cadmium in wheat(Triticum aestivum L.) and rapeseed(Brassica campestris L.) from co-contaminated soil[J]. Ecotoxicology and Environmental Safety, 2017, 137(20): 194-201. |
| [6] |
Sepulvado J, Blaine A, Hundal L, et al. Occurrence and fate of perfluorochemicals in soil following the land application of municipal biosolids[J]. Environmental Science & Technology, 2011, 45(19): 8106-8112. |
| [7] |
Meng J, Wang T Y, Wang P, et al. Are levels of perfluoroalkyl substances in soil related to urbanization in rapidly developing coastal areas in North China[J]. Environmental Pollution, 2015, 199(1): 102-109. |
| [8] |
Lee J W, Lee J W, Shin Y J, et al. Multi-generational xenoestrogenic effects of perfluoroalkyl acids(PFAAs) mixture on Oryzias latipes using a flow-through exposure system[J]. Chemosphere, 2016, 169: 212-223. |
| [9] |
周启星, 胡献刚. PFOS/PFOA环境污染行为与毒性效应及机理研究进展[J]. 环境科学, 2007, 28(10): 2153-2162. ZHOU Qi-xing, HU Xian-gang. Researching progresses in environmental pollution behavior, toxic effects and mechanisms of PFOS/PFOA[J]. Chinese Journal of Environmental Science, 2007, 28(10): 2153-2162. DOI:10.3321/j.issn:0250-3301.2007.10.001 |
| [10] |
端正花, 王勋功, 王华, 等. 全氟辛烷羧酸(PFOA)与全氟辛烷磺酸(PFOS)的细胞毒性效应[J]. 生态毒理学报, 2014, 9(2): 23-30. DUAN Zheng-hua, WANG Xun-gong, WANG Hua, et al. The cytotoxic effect of PFOA and PFOS[J]. Asian Journal of Ecotoxicology, 2014, 9(2): 23-30. |
| [11] |
韩建, 方展强. 水环境PFOS和PFOA的污染现状及毒理效应研究进展[J]. 水生态学杂志, 2010, 3(2): 99-105. HAN Jian, FANG Zhan-qiang. Researching progress on PFOS and PFOA:Environmental pollution and toxicology effects[J]. Journal of Hydroecology, 2010, 3(2): 99-105. |
| [12] |
Krrman A, Ericson I, Bert V B, et al. Exposure of perfluorinated chemicals through lactation, levels of matched human milk and serum and a temporal trend, 1996-2004, in Sweden[J]. Environmental Health Perspectives, 2007, 115(2): 226-230. |
| [13] |
张亚辉, 曹莹, 周腾耀, 等. 我国环境中PFOS的预测无效应浓度[J]. 中国环境科学, 2013, 33(9): 1670-1677. ZHANG Ya-hui, CAO Ying, ZHOU Teng-yao, et al. Predicted non-effect concentrations for PFOS of environment in China[J]. China Environmental Science, 2013, 33(9): 1670-1677. |
| [14] |
Qiang L W, Chen M, Zhu L Y, et al. Facilitated bioaccumulation of perfluorooctanesulfonate in common carp(Cyprinus carpio) by graphene oxide and remission mechanism of fulvic acid[J]. Environmental Science & Technology, 2016, 50(21): 11627-11636. |
| [15] |
于会丽, 林治安, 李燕婷, 等. 喷施小分子有机物对小油菜生长发育和养分吸收的影响[J]. 植物营养与肥料学报, 2014, 20(6): 1560-1568. YU Hui-li, LIN Zhi-an, LI Yan-ting, et al. Effects of spraying low molecular organic compounds on growth and nutrients uptake of rape(Brassica Chinensis L.)[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(6): 1560-1568. DOI:10.11674/zwyf.2014.0627 |
| [16] |
宋正国, 徐明岗, 丁永祯, 等. 共存阳离子(Ca、Zn、K)对土壤镉有效性的影响[J]. 农业环境科学学报, 2009, 28(3): 485-489. SONG Zheng-guo, XU Ming-gang, DING Yong-zhen, et al. Effect of coexistence cations(Ca, Zn, K) on cadmium bioavailability in lateritic red soils[J]. Journal of Agro-Enviornment Science, 2009, 28(3): 485-489. |
| [17] |
陈苗苗, 徐明岗, 周世伟, 等. 不同磷酸盐对污染土壤中镉生物有效性的影响[J]. 农业环境科学学报, 2011, 30(2): 255-262. CHEN Miao-miao, XU Ming-gang, ZHOU Shi-wei, et al. Effect of different phosphate on bio-availability of cadmium in contaminated soils[J]. Journal of Agro-Enviornment Science, 2011, 30(2): 255-262. |
| [18] |
Lechner M, Knapp H. Carryover of perfluorooctanoic acid(PFOA) and perfluorooctane sulfonate(PFOS) from soil to plant and distribution to the different plant compartments studied in cultures of carrots(Daucus carota ssp. Sativus), potatoes(Solanum tuberosum), and cucumbers(Cucumis Sativus)[J]. Journal of Agriculture and Food Chemistry, 2011, 59(20): 11011-11018. DOI:10.1021/jf201355y |
| [19] |
Stahl T, Heyn J, Thiele H, et al. Carryover of perfluorooctanoic acid(PFOA) and perfluorooctane sulfonate(PFOS) from soil to plants[J]. Archives of Environmental Contamination and Toxicology, 2009, 57(2): 289-298. DOI:10.1007/s00244-008-9272-9 |
| [20] |
吕振娥, 苏玉红, 乔敏. 全氟辛烷磺酸短期暴露对不同作物苗期生长的影响[J]. 生态毒理学报, 2013, 8(5): 695-701. LÜ Zhen-e, SU Yu-hong, QIAO Min. Influence of short-term exposure of PFOS on seeding growth of different plants[J]. Asian Journal of Ecotoxicology, 2013, 8(5): 695-701. DOI:10.7524/AJE.1673-5897.20130219001 |
| [21] |
Zhao H, Chen C, Zhang X, et al. Phytotoxicity of PFOS and PFOA to Brassica chinensis in different Chinese soils[J]. Ecotoxicology and Environmental Safety, 2011, 74(5): 1343-1347. DOI:10.1016/j.ecoenv.2011.03.007 |
| [22] |
Qu B C, Zhao H X, Zhou J T. Toxic effects of perfluorooctane sulfonate(PFOS) on wheat(Triticum aestivum L.) plant[J]. Chemosphere, 2010, 79: 555-560. DOI:10.1016/j.chemosphere.2010.02.012 |
| [23] |
孔潇潇, 王铁宇, 张晓军, 等. 全氟化合物对水生植物的生态效应研究Ⅱ:金鱼藻对水中PFOS的生物富集及生理响应[J]. 生态毒理学报, 2015, 10(2): 445-453. KONG Xiao-xiao, WANG Tie-yu, ZHANG Xiao-jun, et al. Ecological effects on aquatic plants induced by perfluorinated compoundsⅡ:Bioaccumulation and physiological response of ceratophyllum demersum in PFOS polluted water[J]. Asian Journal of Ecotoxicology, 2015, 10(2): 445-453. |
| [24] |
闫颖, 袁星, 樊宏娜. 五种农药对土壤转化酶活性的影响[J]. 中国环境科学, 2004, 24(5): 588-591. YAN Ying, YUAN Xing, FAN Hong-na. Influence of five pesticides on invertase activity in soil[J]. China Environmental Science, 2004, 24(5): 588-591. |
| [25] |
田海霞, 和文祥, 孔龙, 等. 全氟辛酸铵盐(PFOA)对土壤酶活性影响的初步研究[J]. 农业环境科学学报, 2010, 29(5): 936-941. TIAN Hai-xia, HE Wen-xiang, KONG Long, et al. The effect of perfluorooctanoic acid ammonium salt an soil enzyme activities[J]. Journal of Agro-Environment Science, 2010, 29(5): 936-941. |
| [26] |
Shen G Q, Lu Y T, Hong J B. Combined effect of heavy metals and polycyclic aromatic hydrocarbons on urease activity in soil[J]. Environmental Safety, 2006, 63(3): 474-480. DOI:10.1016/j.ecoenv.2005.01.009 |
 2017, Vol. 36
2017, Vol. 36