文章信息
- 罗萃, 黄怿扬, 黄冬根, 刘苗, 熊伟, 郭勤, 杨天资
- LUO Cui, HUANG Yi-yang, HUANG Dong-gen, LIU Miao, XIONG Wei, GUO Qin, YANG Tian-zi
- 植物-土壤系统中氯硝柳胺迁移转化特征
- The migration and transformation characteristic of niclosamide in plant-soil system
- 农业环境科学学报, 2017, 36(12): 2453-2461
- Journal of Agro-Environment Science, 2017, 36(12): 2453-2461
- http://dx.doi.org/10.11654/jaes.2017-0683
文章历史
- 收稿日期: 2017-05-10
- 录用日期: 2017-05-06
2. 北京林业大学环境科学与工程学院, 北京 100083
2. College of Environmental Science and Engineering, Beijing Forestry University, Beijing 100083, China
鄱阳湖流域是江西省血吸虫病的主要流行区,氯硝柳胺(2′,5-二氯-4′-硝基水杨酸酰替苯胺,Niclosamide)杀灭血吸虫尾蚴、毛蚴和用于驱除人体及动物绦虫,在鄱阳湖流域已经连续使用20多年。每年有超过200 t(制剂量)氯硝柳胺在鄱阳湖流域使用,其降解完全依赖于自然环境,如扩散迁移、水解、光解、生物降解等途径。
沉积物/土壤对氯硝柳胺具有较强的吸附性能。土壤有机质含量、粘土成分等对氯硝柳胺的吸附有较大的影响[1],氯硝柳胺可通过水的淋溶在土壤中扩散迁移[2],湖滩草地土壤中的氯硝柳胺通过化学[3-4]、光解[5-7]等形式在环境中降解。生物降解是氯硝柳胺在土壤中自然降解的主要形式,好氧或厌氧驯化的微生物对氯硝柳胺具有良好的降解作用[8]。
湖滩草地植物根系不仅从环境中摄取养分和水分,同时也不断地向生长介质中分泌大量的低分子有机化合物(如糖类、有机酸、氨基酸、脂肪等),改变了根际土壤的物理性质和化学性质,使根际微生物根际土壤的代谢活动比非根际微生物高。根际土对农药等污染物有加速降解作用[9-10]。
目前国内对氯硝柳胺的研究主要为施药后在土壤中的持效时间以及毒性分析,对氯硝柳胺在植物-土壤环境中的迁移转化研究较少。本文以鄱阳湖流域连续使用20多年的氯硝柳胺灭螺剂为模拟污染物,以流域典型植物苔草、藜蒿所组成的植物-土壤环境系统为研究对象,研究氯硝柳胺在植物-土壤系统中植物根际土壤中的降解规律,及其在土壤-根部-茎部系统中迁移转化特性,为血吸虫防治区使用氯硝柳胺灭螺可能产生环境风险的评价提供基础数据。
1 材料和方法 1.1 实验试剂实验用氯硝柳胺(成都格雷西亚化学技术有限公司),氯硝柳胺可湿性粉剂(安徽东盛制药有限公司),2,5-二羟基苯甲酸(AR),2-氯-4-硝基苯胺(AR),2-氯-4-硝基苯酚(AR),5-氯水杨酸(AR,山东Xiya reagent研究中心)。
1.2 实验土壤土壤采于鄱阳湖流域的南昌市新建区南矶山乡矶山草地下面3~10 cm处,理化性质:有机质9.8 g·kg-1,阳离子交换量16.58 cmol·kg-1,pH 6.88,速效N、P、K分别为56、11、46 mg·kg-1,含水率19.43%。土样采集风干后,过3 mm筛,喷射氯硝柳胺甲醇溶液,充分混合均匀,待甲醇挥发后,再次搅拌混匀,制备得到氯硝柳胺浓度为2.0 mg·kg-1的实验用土壤。
1.3 实验植物实验植物为鄱阳湖流域的南昌市新建区南矶山典型植物藜蒿(Artemisia selengensis)和苔草(Carex)。
1.4 盆栽实验将实验土壤分装入24个直径为15 cm,高度为20 cm的塑料圆柱形装置(底部带小孔,0.4 kg·个-1)中;实验植物藜蒿和苔草各8组,根部泥土清洗后,分别栽入塑料装置中,另外8个不种植植物用于空白对照实验。实验过程中,通过称重法,每日定时补水,使后续盆栽含水率保持与初始土壤一致。
1.5 土壤样品处理分别于种植后1、2、3、6、10、16、25、43 d对苔草、藜蒿盆栽进行采样,将整桶土倒出,取出植株,先轻轻抖动去掉松散附着在根系上的土壤作为非根际土壤,然后用力抖动收集紧密附着在根上的土壤(用小毛刷将不能抖落的粘附在根上的土轻轻刷下一并装入土袋)作为根际土壤,同时在对照组取同深度(10 cm)土壤5 g。经过3次“100 mL甲醇超声萃取+高速离心分离”处理后的离心上清液,定量滤纸过滤后,旋转蒸发(60 ℃),浓缩至干,用4 mL甲醇溶解,经0.45 μm微孔滤膜过滤后,用于氯硝柳胺残留及降解中间产物的测定。
1.6 植物样品处理取种植1、6、10、16 d后盆栽中的苔草和藜蒿分别用自来水冲洗叶子及其根茎部至其表面无杂物,经蒸馏水冲洗后,用干净的牛皮纸包裹烘干(50 ℃)至恒重。将苔草、藜蒿地上和地下部分分别研磨至粉末状,称取5 g样品,100 mL甲醇超声萃取60 min,4000 r·min-1离心30 min,离心上清液用定量滤纸过滤,重复3次,滤液合并后,旋转蒸发,浓缩至干,用4 mL甲醇溶解,经0.45 μm微孔滤膜过滤后,用于氯硝柳胺残留及降解中间产物的测定。
1.7 分析测试 1.7.1 氯硝柳胺残留及降解产物分析采用高效液相色谱法(HPLC)、高效液相/质谱/质谱法(LC/MS/MS)分析土壤和植物样品中氯硝柳胺残留量及降解中间产物。
高效液相色谱法:W2996/2695高效液相色谱仪(Waters公司);色谱柱C18,150×4.6/5 μm(Waters);流动相为0.2%甲酸的甲醇溶液(A)和水(B);梯度洗脱程序,0~4 min,A:B=50:50(体积比);4~10 min,A:B=60:40;10~13 min,A:B=100:0;14~16 min,A:B=50:50;通道20.0 Minutes W2996 330.0 nm-1.2;流速1 mL·min-1;进样量10 μL;采用外标法进行氯硝柳胺残留量及降解中间产物的定量分析。
高效液相/质谱/质谱法:Agilent 6538 Q-TOF高效液相色谱/质谱/质谱仪(Agilent公司)。流动相为甲醇:0.1%甲酸=70:30(体积比);流速0.2 mL·min-1;进样量5 μL(无分流);质谱检测采用电喷雾离子源(ESI),负离子模式/正离子模式下全扫描,质荷比设置范围50~500。干燥气体为氮气,干燥气体温度350 ℃,干燥气体流量:10 L·min-1;喷雾器275.8 kPa;毛细管电压3500 V;Fragmentor 120 V;除油船65 V;碰撞气体为高纯氮气。
1.7.2 微生物测定采用稀释平板法测定根际土壤中细菌、真菌、放线菌等微生物的量。细菌采用营养琼脂培养基,放线菌采用孟加拉红培养基,真菌采用高氏Ⅰ号培养基。
菌数(CFU·g-1 DW)=培养皿平均菌落数×稀释倍数/土壤干质量(g)
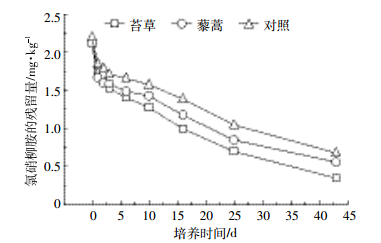
2 结果与分析 2.1 氯硝柳胺在不同植物根际土壤中降解采用HPLC法分析了苔草、藜蒿盆栽培养1、2、3、6、10、16、25、43 d后根际土壤和对照组土壤样品氯硝柳胺残留浓度。图 1是不同培养时间苔草、藜蒿根际土壤中及对照组的氯硝柳胺残留量。可以看出,随着培养时间的延长,苔草、藜蒿根际土壤和对照组同深度土壤中氯硝柳胺的残留量均有不同程度的降低。盆栽43 d时,氯硝柳胺在苔草、藜蒿根际土壤和对照组同深度土壤中降解率分别达到79.8%、73.6%、67.9%。
|
| 图 1 根际土壤中氯硝柳胺残留浓度与培养时间的关系 Figure 1 Relationship between niclosamide residual concentration and cultured time in rhizosphere soil |
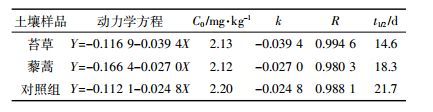
根据Hamaker[11]提出的农药等有机化合物降解动力模型,对苔草、藜蒿根际及空白对照土壤在不同盆栽时间的氯硝柳胺残留量进行数据拟合处理,氯硝柳胺在苔草、藜蒿根际土壤中降解符合一级动力学特征,在根际土壤中的残留量(Y)与降解时间(T)之间具有良好的线性关系。具体参数见表 1。
|
将配制的不同浓度的标准溶液,在本实验确定的最佳色谱条件下用HPLC进行分析测定,以峰面积y与对应的浓度x(mg·L-1)作标准曲线,按S/N=3计算检出限(LOD),S/N=10计算定量限(LOQ);线性回归方程为y=7194x+24 654,检出限为0.3 μg·kg-1,定量限为0.9 μg·kg-1。研究表明氯硝柳胺在0~10 mg·L-1范围内呈现良好的线性关系(r2=0.998 73)。
采用不含氯硝柳胺的空白土壤样品按照方法1.5进行加标回收实验。土壤样品分别设置三个加标水平(0.2、1、5 mg·kg-1),每个浓度平行测定4份,计算方法回收率。土壤样品3个加标浓度水平下,回收率分别为75.3%~82.1%、76.4%~92.8%、73.1%~76.4%,相对标准偏差分别为:8.74%、9.63%、5.27%。
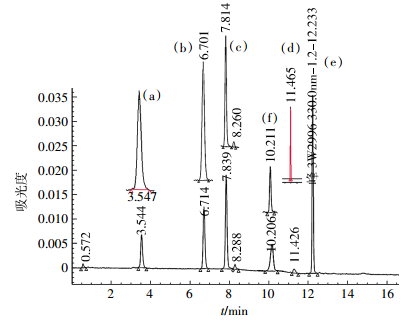
根据氯硝柳胺自然降解可能产生的中间产物[1, 4-8],在相同的HPLC分析条件下,根据单一标准样品、混合标准样品的出峰保留时间,对盆栽样品氯硝柳胺降解中间产物及其残留进行了定性分析。图 2是单一标准样品、混合标准样品HPLC谱图,从图 2中可以看出,氯硝柳胺母体及自然降解可能的中间产物为2,5-二羟基苯甲酸、2-氯-4-硝基苯胺、2-氯-4-硝基苯酚、氨基氯硝柳胺、5-氯水杨酸等在所设定的仪器分析条件下,分离效果好,在330 nm时均有较好的响应值。图 2结果表明,所选定的HPLC分析条件可以进行氯硝柳胺降解中间产物及残留的定性、定量分析。
|
| (a)2,5-二羟基苯甲酸(5 mg·L-1),(b)2-氯-4-硝基苯胺(5 mg·L-1),(c)2-氯-4-硝基苯酚(5 mg·L-1),(d)5-氯水杨酸(5 mg·L-1),(e)氯硝柳胺(5 mg·L-1),(f)氨基氯硝柳胺(2 mg·L-1) 图 2 氯硝柳胺及其可能中间产物标准样品的高效液相色谱图 Figure 2 HPLC spectrogram of niclosamide and possible intermediate standard samples |
在盆栽过程中,植物根际土壤中,氯硝柳胺转化产生许多中间产物。图 3、图 4分别为盆栽第6 d苔草根际土壤中氯硝柳胺降解中间产物LC/MS/MS分析的总离子流图(-ESI,TIC)和质谱图。从图 4中可以看出,m/z为152.894 2的物质可能为2,5-二羟基苯甲酸(154);m/z为170.884 7的物质可能为2-氯-4-硝基苯胺(172.57)、2-氯-4-硝基苯酚(172.5)或5-氯水杨酸(172.5);m/z为297.152 3的物质可能为氨基氯硝柳胺;m/z为325.183 0的物质可能为氯硝柳胺。综合HPLC和LC/MS/MS分析结果,氯硝柳胺降解过程中产生了多种中间产物,其中包括2,5-二羟基苯甲酸、2-氯-4-硝基苯胺、2-氯-4-硝基苯酚、氨基氯硝柳胺、5-氯水杨酸。

|
| 图 3 盆栽第6 d苔草根际土壤中氯硝柳胺降解中间产物总离子流色谱图 Figure 3 Total ion current of niclosamide degradated products in Carex rhizosphere soil after culture for sixth days |

|
| (a)2,5-二羟基苯甲酸或5-氯水杨酸;(b)2-氯-4-硝基苯胺或2-氯-4-硝基苯酚;(c)氨基氯硝柳胺;(d)氯硝柳胺 图 4 盆栽第6 d苔草根际土壤中氯硝柳胺降解中间产物高效液相/质谱图 Figure 4 LC/MS/MS spectrogram of niclosamide degradated intermediate products in Carex rhizosphere soil after culture for sixth days |
图 5为盆栽第6 d苔草根际土壤中氯硝柳胺降解中间产物HPLC谱图。与标准物质的HPLC谱图对比可以看出,盆栽第6 d有2,5-二羟基苯甲酸(3.541 min)、2-氯-4-硝基苯胺(6.743 min)、2-氯-4-硝基苯酚(7.832 min)、氨基氯硝柳胺(10.397 min),5-氯水杨酸(11.415 min)产生,及氯硝柳胺残留(12.239 min)。因分析条件等原因,在保留时间为2.467、4.316、9.554、15.383、15.770 min等峰所对应的物质没有定性。
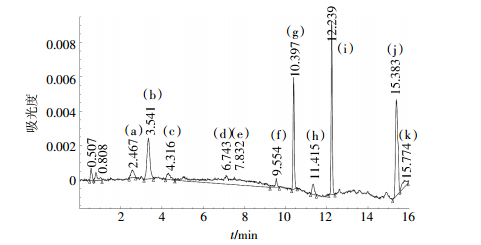
|
| (a)(c)(f)(j)(k)未知物;(b)2,5-二羟基苯甲酸;(d)2-氯-4-硝基苯胺;(e)2-氯-4-硝基苯酚;(g)氨基氯硝柳胺;(h)5-氯水杨酸;(i)氯硝柳胺 图 5 盆栽第6 d苔草根际土壤中氯硝柳胺降解中间产物HPLC谱图 Figure 5 HPLC spectrogram of NCL degradated intermediate products in Carex rhizosphere soil after culture for sixth days |
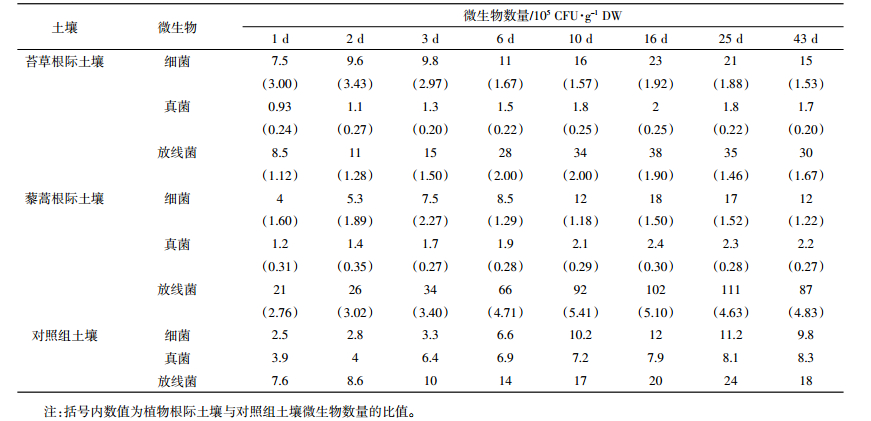
在植物-土壤系统中,土壤中的细菌、真菌、放线菌等微生物及菌群数量对有机污染物的降解起重要作用[12-13]。在盆栽过程中,苔草、藜蒿根际土壤及对照组同深度土壤中细菌、真菌和放线菌数量随时间的不同而变化,不同土壤中微生物数量及其与对照组微生物数量的关系见表 2。
表 2的数据表明,苔草、藜蒿根际土壤和对照组同深度土壤中的细菌、真菌、放线菌含量均呈现先上升后下降的趋势,在苔草根际土壤中,细菌、真菌、放线菌在培养第16 d数量达到最高,在藜蒿根际土壤中,细菌、真菌在培养第16 d数量达到了最高,放线菌数量第25 d达到最高。两种植物根际土壤细菌、放线菌的数量均大于对照组,说明植物根际环境中,苔草、藜蒿根系分泌物对细菌、放线菌的生长和活性有促进作用。
2.4 根际土壤中氯硝柳胺残留量与微生物数量的相关性选取苔草和藜蒿的植物根际土壤中氯硝柳胺的残留量和所对应的细菌、真菌和放线菌数量的自然对数为指标,分析根际土壤中氯硝柳胺残留量与微生物数量的关系,结果见图 6、图 7。由图可知,苔草和藜蒿根际土壤中氯硝柳胺残留量与三种微生物数量均呈显著负相关(P<0.05),考虑到对照组中微生物数量,结合在苔草、藜蒿以及对照组根际土壤中氯硝柳胺残留量,可得出,在根际土壤中,微生物的数量越多,氯硝柳胺的残留量就越少,说明微生物对氯硝柳胺在根际土壤中的降解有重要作用。

|
| 图 6 苔草根际土壤中氯硝柳胺残留与微生物的关系 Figure 6 Relationship between niclosamide residues and microbial populations in Carex rhizosphere soil |

|
| 图 7 藜蒿根际土壤中氯硝柳胺残留与微生物的关系 Figure 7 Correlation between nidosamide residue and microbial populations in Artemisia selengensis rhizosphere soil |
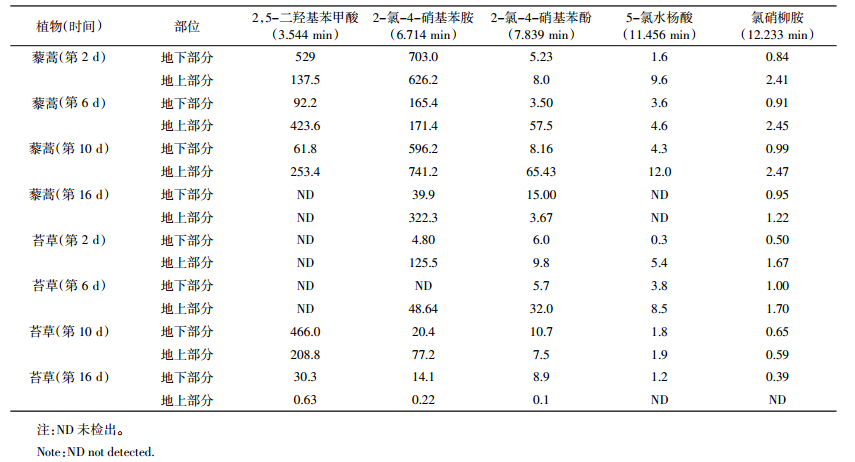
盆栽实验过程中,对氯硝柳胺在植物地上、地下部分的残留及降解的中间产物进行定性和定量分析,结果见图 8、表 3。从图 8可以看出,没有进行盆栽的苔草,在样品HPLC分析前的制样过程中,会产生多种萃取产物;盆栽6 d苔草的地上部分产生2,5-二羟基苯甲酸(3.478 min),2-氯-4-硝基苯胺(6.788 min),2-氯-4-硝基苯酚(7.886 min)、5-氯水杨酸(11.425 min)及氯硝柳胺残留(12.271 min);因分析条件等原因,在保留时间为3.177、4.328、7.516、8.791、13.431、14.727 min等峰所对应的物质没有定性。图 8的结果表明,盆栽过程中氯硝柳胺可以在植物中降解,并产生多种降解产物。
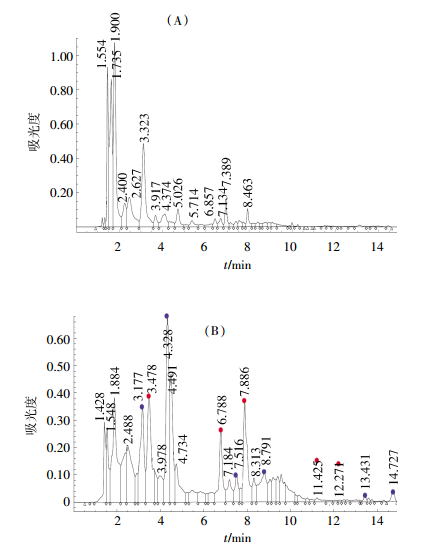
|
| (A)盆栽前,苔草地上部分;(B)盆栽6 d后,苔草地上部分 图 8 氯硝柳胺在苔草中的残留及可能的中间产物HPLC谱图 Figure 8 HPLC spectrogram of niclosamide residue and possible intermediate in Carex |
|
表 3分析结果表明,不同的时间,氯硝柳胺在不同的植物中残留及中间产物浓度不同;在相同的时间,氯硝柳胺在同种植物地上与地下部分的残留及中间产物浓度也不同;藜蒿和苔草的地上、地下部分对土壤中氯硝柳胺均有不同程度的吸收作用,而且,氯硝柳胺的残留量及代谢的中间产物的浓度,随着时间的延长,存在显著差异。在盆栽的前6 d,两种植物地上和地下部分氯硝柳胺的含量均有不同程度的增长;在盆栽6 d之后,苔草和藜蒿的地上部分均有不同程度的减少。黎蒿地上、地下部分的最大残留浓度分别为2.47、0.99 mg·kg-1,均出现在盆栽的第10 d;在苔草地上、地下的最大残留浓度分别为1.7、1.0 mg·kg-1,均出现在盆栽的第6 d。可食植物藜蒿在盆栽16 d后,仍有氯硝柳胺及其降解的中间产物残留。表 3的结果表明,氯硝柳胺通过植物的根部,从土壤中逐步向茎部和叶部迁移。
2.6 植物体内氯硝柳胺残留风险分析目前,中国、美国、欧盟以及联合国粮食及农业组织(FAO)、世界卫生组织(WHO)等均未制定氯硝柳胺在可食植物中的最高允许残留量(MRL)。根据我国制定的氯硝柳胺在大米中的MRL值为3.00 mg·kg-1的标准[14],本研究氯硝柳胺施药期间可食植物藜蒿中的残留量在标准规定的范围内,但最大残留量接近标准要求,存在一定的风险。
氯硝柳胺降解过程中会产生许多中间产物,其中包括2-氯-4-硝基苯胺和2-氯-4-硝基苯酚等。2-氯-4-硝基苯胺,CAS号121-87-9,大鼠经口LD50为6340 mg·kg-1,小鼠经口LD50为1250 mg·kg-1;2-氯-4-硝基苯酚,CAS号619-08-9,毒性分级属于高毒,大鼠经口LD50为900 mg·kg-1。氯硝柳胺在施药后的降解过程中,2-氯-4-硝基苯胺和2-氯-4-硝基苯酚在可食植物藜蒿中的残留时间较长,所以具有一定的食用风险。
3 讨论 3.1 盆栽时间对氯硝柳胺在不同植物根际土壤中降解的影响从苔草、藜蒿根际土壤中不同盆栽培养时间及其对照组的氯硝柳胺残留量分析结果(图 1)可以看出,在盆栽培养的前3 d,氯硝柳胺在三种土壤样品中的降解速率最快,第3 d氯硝柳胺在苔草、藜蒿根际土壤和对照组同深度土壤中降解率就分别达到了27.7%、23.1%、18.9%。这段时间内,氯硝柳胺在潮湿的土壤中主要发生水解反应[8];第3 d后,三种土壤中氯硝柳胺去除率的变化呈现“慢-逐渐加快-逐渐减慢”的非单调变化,符合微生物参与的降解有机物的特征[6],这一时期内,根际土壤中的微生物参与了氯硝柳胺的降解;盆栽43 d时,氯硝柳胺在苔草、藜蒿根际土壤和对照组同深度土壤中降解率分别达到79.8%、73.6%、67.9%。随着盆栽时间的延长,氯硝柳胺在根际土壤中的浓度逐渐降低。
3.2 盆栽过程中土壤微生物变化规律及功能分析在盆栽过程中,苔草、藜蒿根际土壤及对照组同深度土壤中细菌、真菌和放线菌数量呈现先上升后下降的趋势,两种植物根际土壤细菌、放线菌的数量均大于空白对照组;而两者真菌的数量均小于对照组同深度土壤。土壤真菌的数量增多时,会导致土壤的理化性质变差,说明苔草、藜蒿根系分泌物对土壤的理化性质具有一定的调节作用。
从植物样品微生物的数量与对照组微生物数量的比值可以看出,苔草根际细菌大于藜蒿根际,藜蒿根际放线菌的比值大于苔草根际,而对于真菌,两种植物根际土壤中的数量均远小于对照组土壤。结合氯硝柳胺在苔草和藜蒿根际土壤中降解的速度大于对照组同深度土壤,这说明氯硝柳胺在植物根际土壤中降解的过程中,三大微生物中主要贡献菌种为细菌和放线菌,即这两种菌种数量越多,氯硝柳胺降解就越快。由于氯硝柳胺在苔草根际土壤中降解比在藜蒿根际土壤中快,说明在根系分泌物的作用下,苔草根际起主导作用的细菌,比在藜蒿根际起主导作用的放线菌对根际土壤中降解氯硝柳胺的贡献大,说明植物根际土壤中对氯硝柳胺降解起主导作用的是细菌,其次是放线菌,最后是真菌。
3.3 氯硝柳胺在不同植物中迁移转化特性分析在盆栽的植物-土壤系统中,由于氯硝柳胺蒸气压极低(8×10-11 Pa,20 ℃),土壤中氯硝柳胺主要是通过植物根部向茎部和叶部迁移。吸入植物体内的有机污染物可以通过质外体和共质体途径输送到植物的其他组织中[15-16]。当植物吸收的污染物不能被快速和完全降解时就会积累在植物体内[17]。污染物进入植物体后,在植物体内酶的作用下发生水解、氧化、羟基化等反应[16, 18-19]。被黎蒿、苔草吸收的氯硝柳胺在植物体内酶的作用下,发生水解反应生成5-氯水杨酸和2-氯-4-硝基苯胺,再发生羟基化反应生成2,5-二羟基苯甲酸和2-氯-4-硝基苯酚等,通过代谢或氧化作用,进一步转化为二氧化碳和水。
3.4 氯硝柳胺在不同植物根际土壤中的降解动力学分析表 1中降解速率常数k值表明,氯硝柳胺在苔草根际土壤中的降解速率最大,藜蒿次之,对照组土壤最小;从相关系数R值可看出,植物根际土壤中的氯硝柳胺降解动态更符合一级动力学,并且苔草根际土壤较藜蒿更符合。
从表 1可以看出,苔草根际土壤中氯硝柳胺的降解速率大于藜蒿根际土壤,而氯硝柳胺在植物根际土壤中降解速率又大于其在未种植物的对照组土壤,其半衰期分别为14.6、18.3、21.7 d。实验结果表明,苔草和藜蒿两种植物对氯硝柳胺的降解有促进作用,而且苔草较藜蒿的促进作用更为明显。其原因可能是植物根际土壤环境中植物根系分泌物与微生物的相互作用以及植物本体对氯硝柳胺的吸收转化。
4 结论(1)氯硝柳胺在根际土壤中的降解符合一级动力学方程,苔草和藜蒿根际对氯硝柳胺迁移转化具有促进作用,且苔草的促进作用高于藜蒿。
(2)在植物-土壤系统中,根际土壤中微生物的数量越多,氯硝柳胺的残留量就越少,微生物对氯硝柳胺在根际土壤中的降解有重要贡献。
(3)苔草根际土壤微生物以细菌为主,藜蒿根际土壤微生物则主要是放线菌,对照组以真菌居多。植物对土壤理化性质具有一定的调节作用。氯硝柳胺在苔草根际土壤中降解半衰期比藜蒿根际土壤中短,细菌对氯硝柳胺的降解更加有利。
(4)氯硝柳胺在苔草中长期的残留量主要存在于地下部分,而在藜蒿中地上部分与地下部分残留量差别不大。
(5)氯硝柳胺及其降解的中间产物在植物中残留时间较长,施药期间食用可食植物会存在一定的风险。
| [1] |
Muir D C G, Yarechewski A L. Degradation of niclosamide(2', 5-dichloro-4'-nitrosalicylanilide) in sediment and water systems[J]. Journal of Agricultural and Food Chemistry, 1982, 30(6): 1028-1032. DOI:10.1021/jf00114a005 |
| [2] |
何明祯, 周艺彪, 周颖, 等. 堆敷灭螺法土壤中氯硝柳胺含量动态变化及其实验室灭螺效果[J]. 复旦学报(医学版), 2010, 37(1): 16-19. HE Ming-zhen, ZHOU Yi-biao, ZHOU Ying, et al. Change of niclosamide concentration in soil through heaping and the effect of Oncomelania control[J]. Fudan University Journal Medicine Science, 2010, 37(1): 16-19. |
| [3] |
El-Dib M A, Aly O A. Persistence of some phenylamide pesticides in the aquatic environment:Ⅰ. Hydrolysis[J]. Water Research, 1976, 10: 1047-1050. DOI:10.1016/0043-1354(76)90033-6 |
| [4] |
Schultz D P, Harman P D. Hydrolysis and photolysis of the lampricide 2', 5-dichloro-4'-nitrosalicylanilide(Bayer 73)[R]. Washington D C:US Fish and wildlife Service, 1978. http://agris.fao.org/agris-search/search.do?recordID=US201300729233
|
| [5] |
Graebing P W, Chib J S, Hubert T D, et al. Aqueous photolysis of niclosamide[J]. Journal of Agricultural and Food Chemistry, 2004, 52(4): 870-878. DOI:10.1021/jf030520o |
| [6] |
Frank M P, Graebing P, Chib J S. Effect of soil moisture and sample depth on pesticide photolysis[J]. Journal of Agricultural and Food Chemistry, 2002, 50(9): 2607-2614. DOI:10.1021/jf0115746 |
| [7] |
Graebing P, Frank M P, Chib J S. Effects of fertilizer and soil components on pesticide photolysis[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7332-7339. DOI:10.1021/jf020488i |
| [8] |
Graebing P W, Chib J S. Metabolism of niclosamide in sediment and water systems[J]. Journal of Agricultural and Food Chemistry, 2004, 52(19): 5924-5932. DOI:10.1021/jf0401524 |
| [9] |
胡立芳, 沈东升, 贺永华. 接种Penicillium sp.和根际分泌物对土壤甲磺隆的协同降解研究[J]. 环境科学, 2007, 28(1): 199-203. HU Li-fang, SHEN Dong-sheng, HE Yong-hua. Synergistic degradation of metsulfuron methylin Penicillium sp. inoculated wheat rhizosphere soil[J]. Environmental Science, 2007, 28(1): 199-203. |
| [10] |
Shimp J F, Tracy J C, Davis L C, et al. Beneficial effects of plants in the remediation of soil and groundwater contaminated with organic materials[J]. Environmental Science & Technology, 1993, 23(1): 41-77. |
| [11] |
Hamaker J W. Decomposition:quantitative aspects[M]//Goring C A I, Hamaker J W. Organic chemical in the solid environment. New York:Dekker, 1972:253-340.
|
| [12] |
Johnson D L, Anderson D R, McGratha S P. Soil microbial response during the phytoremediation of a PAH contaminated soil[J]. Soil Biology & Biochemistry, 2005, 37(12): 2334-2336. |
| [13] |
Tripathi P, Singh P C, Mishra A, et al. Trichoderma:A potential bioremediator for environmental clean up[J]. Clean Technologies and Environmental Policy, 2013, 15(4): 541-550. DOI:10.1007/s10098-012-0553-7 |
| [14] |
张志恒. 农药合理使用规范和最高残留限量标准[M]. 北京: 化学工业出版社, 2007. ZHANG Zhi-heng. Standards of rational use of pesticides and maximum residue limit[M]. Beijing: Chemical Industry Press, 2007. |
| [15] |
Kang F X, Chen D S, Gao Y Z, et al. Distribution of polycyclic aromatic hydrocarbons in subcellular root tissues of ryegrass(Lolium multiflorum Lam)[J]. BMC Plant Biology, 2010, 10(1): 210-216. DOI:10.1186/1471-2229-10-210 |
| [16] |
Gao Y Z, Zhang Y, Liu J, et al. Metabolism and subcellular distribution of anthracene in tall fescue(Festuca arundinacea Schreb)[J]. Plant Soil, 2013, 365(1/2): 171-182. |
| [17] |
林道辉, 朱利中, 高彦征. 土壤有机污染植物修复的机理与影响因素[J]. 应用生态学报, 2003, 14(10): 1799-1803. LIN Dao-hui, ZHU Li-zhong, GAO Yan-zheng. Main mechanism and affecting factor of phytorediation of organic contaminated soil[J]. Chinese Journal of Applied Ecology, 2003, 14(10): 1799-1803. DOI:10.3321/j.issn:1001-9332.2003.10.047 |
| [18] |
Kvesitadze E, Sadunishvili T, Kvesitadze G. Mechanisms of organic contaminants uptake and degradation in plants[J]. Proceedings of World Academy of Science, Engineering and Technology, 2009, 55: 458-468. |
| [19] |
Brady Cal, Gill R A, Lynch P T. Preliminary evidence for the metabolism of benzo(a) pyrene by Plantago lanceolata[J]. Environmental Geochemistry and Health, 2003, 25(1): 131-137. DOI:10.1023/A:1021240730266 |
 2017, Vol. 36
2017, Vol. 36