文章信息
- 程雄, 王利英, 李文彦, 张海春, 李永涛, 张玉龙
- CHENG Xiong, WANG Li-ying, LI Wen-yan, ZHANG Hai-chun, LI Yong-tao, ZHANG Yu-long
- 猪场废弃物和解磷菌、蚯蚓联合施用对旱坡地土壤碳循环相关酶的影响
- Effects of pig farm waste, phosphate-solubilizing bacteria, and earthworms on enzymes related to soil C cycling in arid hillside land
- 农业环境科学学报, 2017, 36(12): 2479-2485
- Journal of Agro-Environment Science, 2017, 36(12): 2479-2485
- http://dx.doi.org/10.11654/jaes.2017-0686
文章历史
- 收稿日期: 2017-05-11
- 录用日期: 2017-05-06
2. 华南农业大学新农村发展研究院, 广州 510642;
3. 华南农业大学华南农业博物馆筹建办公室, 广州 510642
2. The New Countryside Development Institute of South China Agricultural University, Guangzhou 510642, China;
3. Preparation Office of Southern China Agricultural Museum of South China Agricultural University, Guangzhou 510642, China
畜禽养殖业快速规模化的发展产生了大量而集中的畜禽废弃物[1],其引起的污染已成为普遍关注的焦点[2]。养殖废弃物含有大量养分,肥料化利用是其资源化的重要方式之一。在施用养殖废弃物培肥贫瘠土壤过程中,土壤微生物和酶的作用非常关键。土壤微生物和酶是土壤生态系统的重要组成部分,二者几乎参与了所有的土壤生物化学过程[3]。土壤微生物是土壤中物质转化的动力,酶是土壤新陈代谢的主要因素,二者共同参与土壤中C、N、P等元素的循环和转化,而且能加速土壤中养殖废弃物的分解,有利于有机物质的转化,促进养分的释放。因此,探明培肥过程中土壤微生物及其相关酶的变化规律具有重要意义。
蚯蚓和解磷菌能促进土壤微生物活动,影响土壤培肥效果。蚯蚓被称为“生态系统的工程师”[4],是一种杂食性的低等腐生动物,在碳循环和维持土壤结构方面具有重要作用[5-6]。有研究表明,蚯蚓能直接生长于畜粪中,消耗大量的有机废弃物[7],对进入其消化道的微生物重新进行调整,并能调节土壤微生物群落、增加活性微生物量[8]。解磷菌能活化土壤养分,提高土壤磷和氮有效性,改善土壤微生物群落组成,提高土壤微生物群落多样性、均匀度和代谢活性等[9]。目前,蚯蚓单独作用于猪粪影响土壤微生物[10-11]和土壤酶[12]活性的研究已有报道,而同时结合微生物菌剂的研究鲜有报道。本试验在施用猪粪、沼液基础上,选用赤子爱胜蚓(Eisenia foetida)、壮伟环毛蚓(Amynthas robustus)和由枯草芽孢杆菌、蜡质芽孢杆菌组成的复合解磷菌剂来研究参与土壤碳循环的蔗糖酶、纤维素酶、淀粉酶和β-葡萄糖苷酶在施加外源有机质和功能生物条件下的动态变化。此外,在试验区种植黄粱木,该速生树种能够快速消纳粪肥释放的养分,减少坡地水土流失和养分流失。本研究将为猪场废弃物的合理资源化利用提供理论依据。
1 材料与方法 1.1 试验地点和材料本试验区位于广东省云浮市新兴县东成镇罗陈华农温氏猪场(22°40′N,111°17′E)。供试土壤为赤红壤,其基本理化性质:pH 4.60,有机碳10.4 g·kg-1,全氮0.88 g·kg-1,全磷0.29 g·kg-1,全钾1.70 g·kg-1。
猪粪取自罗陈华农温氏猪场(pH 7.50,有机碳401 g·kg-1,全氮18.4 g·kg-1);沼液采自猪场内四级氧化塘(pH 7.26~8.05);蚯蚓为表层种赤子爱胜蚓(Eisenia foetida,体长30~50 mm,重0.25±0.05 g)和内层种壮伟环毛蚓(Amynthas robustus,体长85~125 mm,重0.70±0.15 g);菌剂活性菌为枯草芽孢杆菌a15和蜡质芽孢杆菌a16(专利号:ZL201110282657.8)。
1.2 方法 1.2.1 大田试验试验区总面积为1000 m2,种植植物为黄粱木。根据试验区坡地不同高度,采用完全随机区组试验设计,设置6个处理,分别为:不施猪粪对照处理CK,只施猪粪处理Pm,施猪粪和沼液处理(Pm+S)/T,施猪粪、沼液和蚯蚓处理Te,施猪粪、沼液和菌剂处理Tb,施猪粪、沼液、蚯蚓和菌剂处理T(e+b)。试验材料具体施用量见表 1。
选择在距离树杆20 cm的上坡方向挖一20 cm深的环形沟,将猪粪均匀地撒入其中,覆土填埋;沼液抽自猪场内四级氧化塘,采用滴灌技术进行灌溉,2013年8月开始施用,平均一周施1次(约15 L),雨天除外,不施沼液处理施等量水代替;环形沟施猪粪后铺一层土将蚯蚓放入其中,再覆土填埋;菌剂制成菌液采用浇灌方式施加,施用量每次每株植物0.5 L(含菌量2×108 cfu·mL-1)。2013年8月施猪粪一次(约15 kg·株-1),施蚯蚓一次(30条壮伟环毛蚓、150条赤子爱胜蚓),施菌液一次(0.5 L·株-1);2013年11月施猪粪、蚯蚓和菌液一次;2014年2月和2014年5月分别施蚯蚓和菌液一次;2014年8月施猪粪、蚯蚓和菌液一次。
1.2.3 样品采集与测定2013年8月、11月,2014年2月、5月和8月分别于试验布置前,在田间距离树主干20 cm处采用土钻随机多点(6~8点)采集0~20 cm土壤样品,所得土壤混匀后用无菌塑料封口袋封装。每个处理16份土壤样品(4次重复×4个区组),6个处理共计96份土样。将每个处理不同区组间的4个土样取相同质量的土壤进行混合,得到4个新的混合土样,共计24份土壤样品,随后对所得24份土壤样品风干过2 mm筛后装密封袋保存。
土壤微生物量碳的测定采用氯仿熏蒸-K2SO4浸提法[13];蔗糖酶、淀粉酶和纤维素酶均采用3,5-二硝基水杨酸比色法[14],蔗糖酶活性以24 h后1 g土壤葡萄糖的毫克数表示,淀粉酶活性以24 h后1 g土壤麦芽糖的毫克数表示,纤维素酶活性以24 h后1 g土壤葡萄糖毫克数表示;β-葡萄糖苷酶的测定采用硝基酚比色法[15],其活性以1 h后1 g土壤生成对硝基酚毫克数表示。
1.2.4 数据分析采用Microsoft office Excel 2010处理数据和作图,采用SPSS 20.0软件进行统计分析,测定数据以平均值±标准差的形式表示,不同施肥处理之间采用Duncan′s新复极差法进行多重比较(P=0.05)。
2 结果与分析 2.1 土壤MBC含量的变化由图 1(a)可知,试验布置前,处理CK、Pm和Pm+S土壤MBC含量分别为95.4、85.3、106 mg·kg-1。试验布置1年后,与CK相比,Pm、Pm+S土壤MBC含量没有显著的变化。2014年5月和8月,试验区温度较高,降雨量也增多,且土壤微生物生物量对土壤含水量[16]和土壤温度[17]很敏感,因此这两个月土壤微生物量碳含量较之前几个月高。由图 1(b)可知,试验布置前,处理T、Te、Tb和T(e+b)土壤MBC含量分别为106、95.9、78.4、121 mg·kg-1。试验布置后,与T相比,处理Te、Tb和T(e+b)土壤MBC含量提高了14.0%~124%,其中以功能生物蚯蚓和菌剂配施效果最好;2014年2月,单施菌剂处理Tb土壤MBC含量显著提高103%,但未表现出持续性。这说明蚯蚓和菌剂配施效果好于单施蚯蚓或菌剂,可能是由于二者之间存在某种协同作用。
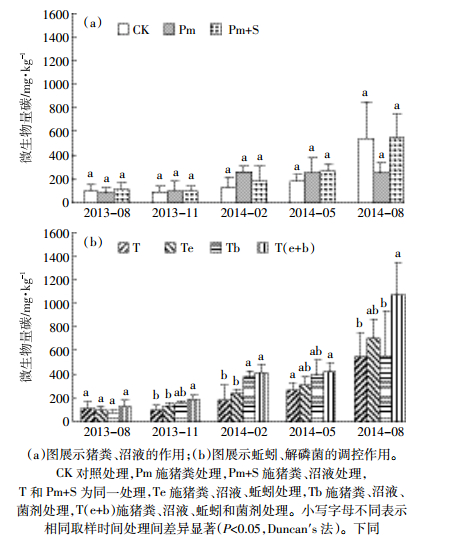
|
|
(a)图展示猪粪、沼液的作用;(b)图展示蚯蚓、解磷菌的调控作用。 CK对照处理,Pm施猪粪处理,Pm+S施猪粪、沼液处理,T和Pm+S为同一处理,Te施猪粪、沼液、蚯蚓处理,Tb施猪粪、沼液、菌剂处理,T(e+b)施猪粪、沼液、蚯蚓和菌剂处理。小写字母不同表示相同取样时间处理间差异显著(P<0.05,Duncan′s法)。下同 图 1 土壤微生物生物量碳含量的动态变化 Figure 1 Dynamic changes of soil MBC |
土壤蔗糖酶将土壤中的蔗糖分解为有利于微生物吸收利用的葡萄糖和果糖,可以反映土壤有机碳的转化和呼吸强度[18],其强弱直接反映了土壤熟化程度和肥力的水平[19],但在反映土壤肥沃状况的同时比其他酶更明显[20]。如图 2(a)所示,试验布置前,处理CK、Pm和Pm+S土壤蔗糖酶活性分别为4.34、3.91、3.89 mg·kg-1。1年内,Pm和Pm+S土壤蔗糖酶活性无显著变化。由图 2(b)可知,试验布置前,各处理土壤蔗糖酶活性在3.90 mg·kg-1左右。试验布置1年后,与T相比,Te土壤蔗糖酶活性无显著变化,Tb土壤蔗糖酶活性提高了73.3%,与T差异达显著水平,T(e+b)土壤蔗糖酶活性显著提高95.2%~216%。说明在猪粪和沼液混施条件下,蚯蚓活动促成猪粪与土壤更好地接触,加速其转化,提高土壤微生物量和活性,有利于土壤酶活性的增强,而蔗糖酶活性的增强可能是因为土壤微生物活性的增强和土壤中基质浓度的增加。

|
| 图 2 土壤蔗糖酶活性的动态变化 Figure 2 Dynamic changes of soil invertase activity |
纤维素酶活性表征着土壤碳循环速度和土壤腐殖质的再合成强度[21-22]。有研究表明,在有作物生长时,长期使用有机肥可使土壤纤维素酶活性增加40%[23]。由图 3(a)可知,试验布置前,处理CK、Pm和Pm+S土壤纤维素酶活性分别为125、127、126 mg·kg-1。试验布置1年后,Pm和Pm+S土壤纤维素酶活性未表现出显著变化。虽然在2014年2月监测到Pm+S土壤纤维素酶活性显著高于对照CK,但未表现出持续性。说明短时间内施用猪粪、沼液对土壤纤维素酶活性影响不大。由图 3(b)可知,试验布置前,处理T、Te、Tb和T(e+b)其土壤纤维素酶活性分别为126、136、128、112 mg·kg-1。从2014年2月开始,除Te处理土壤纤维素酶活性略有下降外,其他各处理土壤纤维素酶活性提高了4.85%~60.4%。说明短期内猪粪中添加蚯蚓和解磷菌可增强土壤纤维素酶活性,但效果不显著。
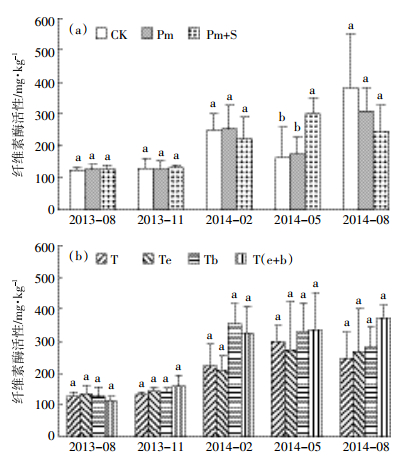
|
| 图 3 土壤纤维素酶活性的动态变化 Figure 3 Dynamic changes of soil cellulase activity |
淀粉酶能使淀粉水解成糊精和麦芽糖,且随着土壤有机质含量的增多而增加,是参与自然界碳素循环不可缺少的一种重要酶[24]。由图 4(a)可知,试验布置前,处理CK、Pm和Pm+S土壤蔗淀粉活性分别为143、157、231 mg·kg-1。试验布置1年后,单施猪粪处理淀粉酶活性提高了50.5%,达显著水平,说明猪粪农用对土壤淀粉酶活性有提升作用。图 4(b)显示,试验布置1年后,与T相比,处理Tb淀粉酶活性无显著变化,但当蚯蚓和菌剂同时施用时,其淀粉酶活性却提高了66.8%,达显著水平(P<0.05)。说明功能生物蚯蚓和解磷菌配施对土壤淀粉酶活性提升作用好于单施蚯蚓或菌剂。

|
| 图 4 土壤淀粉酶活性的动态变化 Figure 4 Dynamic changes of soil amylase activity |
β-葡萄糖苷酶是土壤中的重要胞外酶之一,是土壤生物性质变化的早期指示指标[25],更可对有机质等级和流通量的变化起到指示作用,在土壤有机质的矿化过程中扮演重要角色[26]。不同施肥处理β-葡萄糖苷酶活性呈现显著的分级[27],有机肥处理土壤β-葡萄糖苷酶活性较高[28]。由图 5(a)可知,试验布置前,处理CK、Pm和Pm+S土壤β-葡萄糖苷酶活性分别为147、127、129 mg·kg-1。与CK相比,从试验布置9个月开始,Pm土壤β-葡萄糖苷酶活性显著增强,分别提高了55.9%、30.2%。说明旱坡地上施用猪粪可以提高土壤β-葡萄糖苷酶活性。从试验布置6个月开始,Pm+S土壤β-葡萄糖苷酶活性分别显著提高了22.8%、37.6%(P<0.05),但未表现出持续性,到12个月的时候与CK相比反而降低了8.24%。说明1年内,单施猪粪可增强土壤β-葡萄糖苷酶活性,而配施猪粪、沼液却未表现出此效果。图 5(b)显示,与T相比,Te和Tb土壤β-葡萄糖苷酶活性均无显著变化(除2014年8月外)。但是蚯蚓和菌肥配施却能显著提高土壤β-葡萄糖苷酶活性,T(e+b)的土壤β-葡萄糖苷酶活性在6个月时是695 mg·kg-1,提高了70.2%;9个月时为853 mg·kg-1,提高了65.3%;12个月时为1281 mg·kg-1,提高了118%。说明当功能生物蚯蚓和解磷菌共同作用时,对土壤β-葡萄糖苷酶活性影响最大。
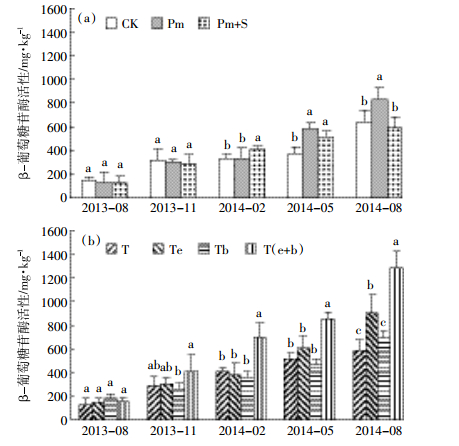
|
| 图 5 土壤β-葡萄糖苷酶活性的动态变化 Figure 5 Dynamic changes of soil β-glucosidase activity |
MBC是土壤有机质中最活跃和最易变化的部分。微生物控制着土壤中有机成分的转化,从而影响C循环[29]。MBC反映了土壤中能量的循环、营养转化和运输。在本试验中,添加解磷菌处理对MBC有显著影响,可能有两方面的原因:一是解磷菌本身就是MBC的组成部分,而且它释放的无机P可以喂食土壤中的土著微生物[30],所以前几个月Tb处理MBC含量显著增加;二是猪粪为微生物的激增提供C基质,部分原因是蚯蚓加速了猪粪的分解。功能生物蚯蚓和解磷菌共同作用于猪粪,对MBC作用效果显著是因为蚯蚓对土壤微生物的分解活动具有促进作用[31],其取食使得凋落物破碎,加速猪粪分解的同时利于土壤微生物的定着和分解[5],最终结果是土壤中MBC含量显著增加。
3.2 施用猪场废弃物对土壤酶活性的影响土壤酶活性由于能收集微生物状况和土壤理化条件信息而被称为土壤有机质分解的“传感器”[32],它主要来自土壤微生物与植物根系的分泌作用,是土壤肥力的一个重要指标,也是土壤有机养分转化的一个重要因素[33],其活性高低可以反映土壤养分转化能力的强弱。本研究结果表明,施猪粪、沼液处理其蔗糖酶活性前期(6个月前)均低于对照处理,后期(9个月后)高于对照处理。纤维素酶活性表现出相似的规律。β-葡萄糖苷酶活性在试验布置6个月后显著增强。而淀粉酶活性则还未表现出规律性变化。这可能是因为试验布置3个月(2014年11月)和6个月(2015年2月)时气温较低,降雨少,土壤较干旱,土壤中微生物活动量降低,其分泌的活性物质也有所减少,从而影响了土壤酶的活性。但到2014年5月和8月时,温度升高,降雨量也增多,微生物数量增多,因此四种酶活性整体增强。施加猪粪、沼液的处理表现出明显的优势,主要是因为施用猪粪提高了土壤有机质和N、P等养分含量,有利于黄梁木根系的发育,增强根系活力,从而增强酶活性。猪粪施入土壤后,一方面为土壤微生物提供了新能源,使微生物在种群数量上发生较大变化;另一方面,猪粪本身也带入大量活的微生物[34],在某种程度上起到了“接种”的作用[35]。因此,猪粪施用可以提高酶的活性和促进微生物的活动,是较为理想的培肥方式。相关研究表明,施用有机肥增加了土壤酶活性,主要是施用的有机物质刺激了微生物的活性,从而引起酶活性的变化[36]。
3.3 添加蚯蚓和解磷菌对土壤酶活性的影响单施蚯蚓或解磷菌的处理均未表现出明显优势,但当二者同时施用时对蔗糖酶、淀粉酶和β-葡萄糖苷酶活性有显著提升作用。这是因为蚯蚓粪和解磷菌中的微生物均能显著提高根际土壤酶活性,与武雪萍等[37]在植烟上的研究结果一致。这主要是因为蚯蚓通过自身活动可以加速猪粪的降解与转化,另外自身排放出的蚓粪不仅可以为土壤酶提供更多、更丰富的酶促基质,发挥底物诱导作用,而且还能提高腐殖质含量,而腐殖质能够通过离子交换、离子键或共价键等与土壤酶结合,固定土壤酶[38]。
4 结论短期内(1年),旱坡地上施用猪场废弃物可以增强土壤淀粉酶和β-葡萄糖苷酶活性。添加外源解磷菌可以提高土壤MBC含量和增强蔗糖酶活性。功能生物蚯蚓和外源解磷菌联合施用不仅提高土壤MBC含量,还增强土壤蔗糖酶、淀粉酶和β-葡萄糖苷酶活性,且二者之间存在显著的协同作用。这说明蚯蚓、解磷菌联合施用对于进一步提高粪肥有机质的转化效率,进而促进土壤消纳、补给植物养分,实现废弃物高效利用具有重要作用。
| [1] |
吴根义, 廖新俤, 贺德春, 等. 我国畜禽养殖污染防治现状及对策[J]. 农业环境科学学报, 2014, 33(7): 1261-1264. WU Gen-yi, LIAO Xin-di, HE De-chun, et al. Current situation and countermeasures of livestock industry pollution control in China[J]. Journal of Agro-Environment Science, 2014, 33(7): 1261-1264. DOI:10.11654/jaes.2014.07.001 |
| [2] |
Cambra-Lopez M, Aarnink A J A, Zhao Y, et al. Airborne particulate matter from livestock production systems:A review of an air pollution problem[J]. Environmental Pollution, 2010, 158(1): 1-17. DOI:10.1016/j.envpol.2009.07.011 |
| [3] |
李晨华, 贾仲君, 唐立松, 等. 不同施肥模式对绿洲农田土壤微生物群落丰度与酶活性的影响[J]. 土壤学报, 2012, 49(3): 567-574. LI Chen-hua, JIA Zhong-jun, TANG Li-song, et al. Effect of model of fertilization on microbial abundance and enzyme activity in oasis farmland soil[J]. Acta Pedologica Sinica, 2012, 49(3): 567-574. DOI:10.11766/trxb201101070011 |
| [4] |
Lavelle P, Bignell D, Lepage M, et al. Soil function in a changing world:The role of invertebrate ecosystem engineers[J]. European Journal of Soil Biology, 1997, 33(4): 159-193. |
| [5] |
Topoliantz S, Ponge J O, Viaux P. Earthworm and enchytraeid activity under different arable farming systems, as exemplified by biogenic structures[J]. Plant and Soil, 2000, 225(1): 39-51. |
| [6] |
Lachnicht S L, Parmelee R W, Mccartney D, et al. Characteristics of macroporosity in a reduced tillage agroecosystem with manipulated earthworm populations:Implications for infiltration and nutrient transport[J]. Soil Biology and Biochemistry, 1997, 29(3/4): 493-498. |
| [7] |
Gunadi B, Blount C, Edwards C A. The growth and fecundity of Eisenia fetida(Savigny) in cattle solids pre-composted for different periods[J]. Pedobiologia-International Journal of Soil Biology, 2002, 46(1): 15-23. |
| [8] |
Lachnicht S L, Hendrix P F. Interaction of the earthworm Diplocardia mississippiensis(Megascolecidae) with microbial and nutrient dynamics in a subtropical Spodosol[J]. Soil Biology and Biochemistry, 2001, 33(10): 1411-1417. DOI:10.1016/S0038-0717(01)00049-9 |
| [9] |
陈令, 蔡燕飞, 吴荣辉, 等. 枯草芽孢杆菌HL-1解磷发酵条件的优化[J]. 广东农业科学, 2014, 41(13): 71-76. CHEN Ling, CAI Yan-fei, WU Rong-hui, et al. Optimization of phosphate-solubilizing fermentation conditions of HL-1[J]. Guangdong Agricultural Sciences, 2014, 41(13): 71-76. DOI:10.3969/j.issn.1004-874X.2014.13.017 |
| [10] |
Wu J, Li H, Li F, et al. Distribution and fractionation of cadmium in soil aggregates affected by earthworms(Eisenia fetida) and manure compost[J]. Journal of Soils and Sediments, 2016, 16(9): 2286-2295. DOI:10.1007/s11368-016-1433-2 |
| [11] |
Zhang C, Mora P, Dai J, et al. Earthworm and organic amendment effects on microbial activities and metal availability in a contaminated soil from China[J]. Applied Soil Ecology, 2016, 104: 54-66. DOI:10.1016/j.apsoil.2016.03.006 |
| [12] |
de Cima D S, Tein B, Eremeev V, et al. Winter cover crop effects on soil structural stability and microbiological activity in organic farming[J]. Biological Agriculture & Horticulture, 2016, 32(3): 170-181. |
| [13] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6 |
| [14] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986, 274-294. GUAN Song-yin. Soil enzymes and their research methods[M]. Beijing: Agriculture Press, 1986, 274-294. |
| [15] |
Tabatabai F E M. Factors affecting glucosidase and galactosidase activities in soils[J]. Soil Biology and Biochemistry, 1990, 22(7): 891-897. DOI:10.1016/0038-0717(90)90126-K |
| [16] |
Skopp J, Jawson M D, Doran J W. Steady-state aerobic microbial activity as a function of soil water content[J]. Soil Science Society of America Journal, 1990, 54(6): 1619. DOI:10.2136/sssaj1990.03615995005400060018x |
| [17] |
Alvarez R, Santanatoglia O J, Garc A R. Effect of temperature on soil microbial biomass and its metabolic quotient in situ under different tillage systems[J]. Biology and Fertility of Soils, 1995, 19(2/3): 227-230. |
| [18] |
匡石滋, 田世尧, 李春雨, 等. 香蕉间作模式和香蕉茎秆堆沤还田对土壤酶活性的影响[J]. 中国生态农业学报, 2010, 18(3): 617-621. KUANG Shi-zi, TIAN Shi-yao, LI Chun-yu, et al. Effect of banana intercropping pattern and straw compost-return on soil enzyme activity[J]. Chinese Journal of Eco-Agriculture, 2010, 18(3): 617-621. |
| [19] |
Salam A K, Katayama A, Kimura M. Activities of some soil enzymes in different land use systems after deforestation in hilly areas of West Lampung, South Sumatra, Indonesia[J]. Soil Science and Plant Nutrition, 1998, 44(1): 93-103. DOI:10.1080/00380768.1998.10414429 |
| [20] |
熊明彪, 田应兵, 雷孝章, 等. 小麦生长期内土壤养分与土壤酶活性变化及其相关性研究[J]. 水土保持学报, 2003, 17(4): 27-30. XIONG Ming-biao, TIAN Ying-bing, LEI Xiao-zhang, et al. Dynamics of soil nutrition and soil enzyme activity and their relationships during wheat growth[J]. Journal of Soil and Water Conservation, 2003, 17(4): 27-30. |
| [21] |
彭岳林, 钱成, 蔡晓布, 等. 西藏不同退化高寒草地土壤酶的活性[J]. 山地学报, 2007, 25(3): 344-350. PENG Yue-lin, QIAN Cheng, CAI Xiao-bu, et al. Soil enzyme activities in different degraded alpine grass land of Tibet[J]. Journal of Mountain Science, 2007, 25(3): 344-350. |
| [22] |
薛立, 邝立刚, 陈红跃, 等. 不同林分土壤养分、微生物与酶活性的研究[J]. 土壤学报, 2003, 40(2): 280-285. XUE Li, KUANG Li-gang, CHEN Hong-yue, et al. Soil nutrients microorganisms and enzyme activies of different stands[J]. Acta Pedologica Sinica, 2003, 40(2): 280-285. DOI:10.11766/trxb200103200218 |
| [23] |
Debosz K, Rasmussen P H, Pedersen A R. Temporal variations in microbial biomass C and cellulolytic enzyme activity in arable soils:Effects of organic matter input[J]. Applied Soil Ecology, 1999, 13(3): 209-218. DOI:10.1016/S0929-1393(99)00034-7 |
| [24] |
周世萍, 段昌群, 余泽芬, 等. 毒死蜱对土壤酶活性的影响[J]. 土壤通报, 2008, 39(6): 1486-1488. ZHOU Shi-ping, DUAN Chang-qun, YU Ze-fen, et al. Effects of chlorpyrifos stress on soil enzymes[J]. Chinese Journal of Soil Science, 2008, 39(6): 1486-1488. |
| [25] |
Ekenler M, Tabatabai M A. Effects of liming and tillage systems on microbial biomass and glycosidases in soils[J]. Biology and Fertility of Soils, 2003, 39(1): 51-61. DOI:10.1007/s00374-003-0664-8 |
| [26] |
Li Y, Rouland C, Benedetti M, et al. Microbial biomass, enzyme and mineralization activity in relation to soil organic C, N and P turnover influenced by acid metal stress[J]. Soil Biology and Biochemistry, 2009, 41(5): 969-977. DOI:10.1016/j.soilbio.2009.01.021 |
| [27] |
Bohme L, Bohme F. Soil microbiological and biochemical properties affected by plant growth and different long-term fertilization[J]. European Journal of Soil Biology, 2006, 42(1): 1-12. DOI:10.1016/j.ejsobi.2005.08.001 |
| [28] |
Mijangos I, Perez R, Albizu I, et al. Effects of fertilization and tillage on soil biological parameters[J]. Enzyme and Microbial Technology, 2006, 40(1SI): 100-106. |
| [29] |
Rinna J, Warning B, Meyers P A, et al. Combined organic and inorganic geochemical reconstruction of paleodepositional conditions of a Pliocene sapropel from the eastern Mediterranean Sea[J]. Geochimica et Cosmochimica Acta, 2002, 66(11): 1969-1986. DOI:10.1016/S0016-7037(02)00826-8 |
| [30] |
Zhang Y L, Wang L Y, Li W Y, et al. Earthworms and phosphate-solubilizing bacteria enhance carbon accumulation in manure-amended soils[J]. Journal of Soils and Sediments, 2017, 17(1): 220-228. DOI:10.1007/s11368-016-1482-6 |
| [31] |
宋日, 吴春胜, 郭继勋. 东北草原植物残体腐解动态研究(简报)[J]. 草业学报, 2002, 11(2): 105-108. SONG Ri, WU Chun-sheng, GUO Ji-xun, et al. Decomposition dynamics of plant residues in natural meadow in northeast China[J]. Acta Prataculturae Sinica, 2002, 11(2): 105-108. |
| [32] |
Baum C, Leinweber P, Schlichting A. Effects of chemical conditions in re-wetted peats on temporal variation in microbial biomass and acid phosphatase activity within the growing season[J]. Applied Soil Ecology, 2003, 22(2): 167-174. DOI:10.1016/S0929-1393(02)00129-4 |
| [33] |
Tadano T, Ozawa K, Sakai H, et al. Secretion of acid phosphatase by the roots of crop plants under phosphorus-deficient conditions and some properties of the enzyme secreted by lupin roots[J]. Plant and Soil, 1993, 155/156(1): 95-98. DOI:10.1007/BF00024992 |
| [34] |
Tomati U, Grappelli A, Galli E. The hormone-like effect of earthworm casts on plant growth[J]. Biology and Fertility of Soils, 1988, 5(4): 288-294. |
| [35] |
周东兴, 宁玉翠, 徐明明, 等. 蚯蚓粪对温室黑土土壤酶活性及细菌多样性的影响[J]. 土壤通报, 2014, 45(4): 835-840. ZHOU Dong-xing, NING Yu-cui, XU Ming-ming, et al. Effects of vermicompost on soil enzyme activity and bacterial diversity of black soil in greenhouse[J]. Chinese Journal of Soil Science, 2014, 45(4): 835-840. |
| [36] |
Bandick A K, Dick R P. Field management effects on soil enzyme activities[J]. Soil Biology and Biochemistry, 1999, 31(11): 1471-1479. DOI:10.1016/S0038-0717(99)00051-6 |
| [37] |
武雪萍, 刘增俊, 赵跃华, 等. 施用芝麻饼肥对植烟根际土壤酶活性和微生物碳、氮的影响[J]. 植物营养与肥料学报, 2005, 11(4): 541-546. WU Xue-ping, LIU Zeng-jun, ZHAO Yue-hua, et al. Effects of sesame cake fertilizer on soil enzyme activities and microbial C and N at rhizosphere of tobacco[J]. Plant Nutrition and Fertilizer Science, 2005, 11(4): 541-546. DOI:10.11674/zwyf.2005.0419 |
| [38] |
Eivazi F, Bayan M R, Schmidt K. Select soil enzyme activities in the historic sanborn field as affected by long-term cropping systems[J]. Communications in Soil Science and Plant Analysis, 2003, 34(15/16): 2259-2275. |
 2017, Vol. 36
2017, Vol. 36





