文章信息
- 印亮, 张丽丽, 陈鹭, 王贤凤, 黄幸然, 方熊, 易志刚
- YIN Liang, ZHANG Li-li, CHEN Lu, WANG Xian-feng, HUANG Xing-ran, FANG Xiong, YI Zhi-gang
- 不同环境因子对南方典型蔗田土壤羰基硫通量的影响
- Effects of various environmental factors on carbonyl sulfide fluxes from typical sugarcane field soils in southern China
- 农业环境科学学报, 2017, 36(12): 2493-2499
- Journal of Agro-Environment Science, 2017, 36(12): 2493-2499
- http://dx.doi.org/10.11654/jaes.2017-0666
文章历史
- 收稿日期: 2017-05-08
- 录用日期: 2017-05-06
挥发性有机硫化合物是大气中重要的微量气体成分,对地球气候、大气光化学过程及环境质量均有重要的影响[1]。羰基硫(COS)是含量最丰富、最难降解的还原态挥发性含硫气体之一。COS在对流层活性低、反应慢,但是当其通过某些介质上升到平流层后,易通过光化学反应等最终转化为颗粒相硫酸和硫酸盐,从而导致大气环境酸化并加剧形成气溶胶颗粒,甚至影响地表气温,同时通过干、湿沉降到达地表的硫,也会影响土壤、水体的地球化学循环过程,甚至破坏生态系统平衡[2-3]。此外COS进入臭氧层后,由于其具有强还原性,会在光照条件下与臭氧发生反应,从而破坏并损害臭氧层[4]。陆地生态系统释放与吸收含硫气体是一个长期争论的课题,研究表明旱地土壤是大气COS重要的“汇”[5],但易受环境因素的影响造成时空变异大,导致全球硫循环中的硫难以估算。
影响土壤COS通量的因素主要分为生物因素和非生物因素。生物因素主要是土壤微生物的作用过程,如:刘俊峰等[6]研究北京地区草地土壤经过高温灭菌后,即使土壤温度湿度达到最佳,COS通量也不会产生明显变化。非生物因素主要包括温度、湿度、土壤pH、Eh值以及空气COS浓度等。随着全球以CO2为代表的温室气体浓度逐年增加,全球增温呈现明显加快趋势,预计21世纪将上升1.8~4.0 ℃[7]。温度是土壤COS通量的重要影响因子,有关研究表明在最适温度条件下土壤COS通量会达到最大值,如:Kesselmeier等[8]报道欧洲旱地土壤在15~20 ℃时COS吸收达到最大值,刘俊峰等[6]报道的北京草地土壤吸收COS最适温度为25 ℃。全球暴雨、干旱等极端天气频繁发生[7],土壤含水率因而也发生改变。土壤含水率是影响土壤COS通量的另一个重要因子,土壤释放、吸收COS也均存在最佳湿度[5-6, 9-10]。有研究表明土壤含水率的改变会影响土壤释放、吸收COS的形式,Yi等[11]在研究南方水稻土时发现土壤较干时会吸收COS,完全淹水状态会释放COS。部分室内模拟实验采用过筛土进行培育[8],过筛过程往往会破坏土壤的物理结构,主要体现在土壤三相值(固相、液相和气相)比例的变化,进而改变土壤环境[12],比较原位、异位土壤可以更好地研究土壤结构对土壤COS通量的影响。目前有关旱地土壤COS通量的研究引起了广泛关注,主要集中在温带地区,刘俊峰等[6]研究了我国北方地区COS在5种富氧型旱地土壤(北京麦田土壤、山东麦田土壤、人工草坪土壤、天然草坪土壤和森林土壤)中的吸收与转化,发现温度、含水率等环境因子对旱地土壤COS通量有显著影响。我国亚热带地区旱田面积很大[13],环境因子造成旱田COS通量的改变,对全球硫循环产生的影响也不容忽视,但目前有关环境因子对南方旱田COS通量的研究相对较少。因此本研究以亚热带典型的甘蔗田土壤为研究对象,通过室内模拟实验,分别观测不同环境因子对土壤COS通量的影响,对全球变化背景下土壤COS通量精确估算有重要意义。
1 材料与方法 1.1 土壤样品采集与理化性质实验所用土壤取自福建省福州市闽侯县一甘蔗农田(26°26′N,119°14′E),近两个月无施肥、翻耕等行为,甘蔗处于成熟期。福州是典型的亚热带季风气候,年均降水量为900~2100 mm,年均温度20~25 ℃[12]。其中两种土壤处理方式分别为:原位土采用圆柱形土钻(内径为11 cm,高为12 cm)无破坏取样,带回实验室后立即套入自制亚克力材料圆柱形培养罐(内径为11 cm,高为15 cm)。异位土则是将土壤分层采集(0~5 cm和5~12 cm),带回实验室,风干后过8 mm筛,去除砂石和植物残体及根系,分层装入上述培养罐中,填充高度和原位土柱保持一致。蔗田土壤基本理化性质如下:土壤pH为5.39±0.08,含水率为9.00%,有机质为(44.80±1.64)g·kg-1,水解氮(72.76±1.45)mg·kg-1,全氮(1.85±0.06)g·kg-1,全磷0.13 g·kg-1,土壤三相值见表 1,详细参数见胡宝叶等[14]。
土柱含水率分别调节至最大持水量(Water holding capacity maximum,MWHC)的20%、50%和80%(通过每天人工加蒸馏水保持土柱湿度稳定),在自制恒温冰箱中以25 ℃培养7 d。实验考察4种影响因素:
① 灭菌对异位土COS通量的影响:使用高压蒸汽对异位土进行3次灭菌处理后,保持异位土壤含水率为接近自然状态的20%MWHC,温度为25 ℃,设置3个不同COS进气浓度(418±206)ng·m-3(AIR)、(6696±134)ng·m-3(COS-1)和(13 393±263)ng·m-3(COS-2),分别为当前空气COS浓度0.3、5和10倍。土柱在设定温度和含水率下预培养24 h后进行气体采样,每个处理设置3个重复。
② 不同温度对原位、异位土COS通量的影响:保持土壤含水率20%MWHC,分别设置3个温度(15、25 ℃和35 ℃)处理和3个不同进气COS浓度(同上)。土柱在设定温度和含水率下预培养24 h后进行气体采样,每个处理3个重复。
③ 不同含水率对原位、异位土壤COS通量的影响:保持培养温度为25 ℃,分别设置3个不同含水率(20%、50%和80%MWHC)和3个不同COS进气浓度(同上),土柱在设定温度和含水率下预培养24 h后进行气体采样,每个处理3个重复。
④ 不同CO2浓度对原位土COS通量的影响:保持原位土壤含水率为50%MWHC,温度25 ℃(COS释放最大),进气COS浓度控制在(418±206)ng·m-3,调节进气CO2浓度为0、393、1375、2357、4321 mg·m-3和8520 mg·m-3,分别为0和当前大气CO2浓度的0.5、2、3、6倍和10倍),土柱在设定温度和含水率下预培养24 h后进行气体采样,每个处理设置3个重复。
1.3 气体样品采集和处理气体样品采集使用动态箱法,进气30 min保证容器内的气体混合均匀,气体通过流量计控制在1.3 L·min-1。气体样品收集于Teflon气袋中避光保存,用于COS分析。
COS测定在郑丽丽等[15]基础上进行调整,采用预浓缩法进样方式,连接7890B-5977A GC-MS进行测定。将Teflon采样袋接入预浓缩系统,经三级液氮冷肼,去除样品中的H2O和CO2,并经-150 ℃冷聚焦进行分离检测。色谱条件:采用HP-5色谱柱;升温程序为:初始温度10 ℃,保持3 min,后以5 ℃·min-1升到120 ℃,再以10 ℃·min-1升到250 ℃保持20 min。质谱条件:EI电离源。每个样品有3个重复,每个样品测1次,数据采集采用单扫模式(SIM),然后采用标准质谱图库(NIST11)、标准气体保留时间双重定性,在获得总离子(TIC)质谱图后,采用NIST标准图谱进行自动检索,筛选匹配度大于80%的物质,并将标气质谱图保留时间及特征离子进行比对,从而确定被测化合物。本研究中目标化合物与标气中的目标化合物匹配度大于80%,保留时间窗口阈值低于30 s。采用峰面积-浓度标准曲线内标法进行定量。
1.4 数据分析COS通量指单位时间单位面积箱内该气体流通量,正值表示土壤作为“源”,即土壤释放该气体;负值表示土壤作为“汇”,即土壤吸收该气体[11],具体计算公式如下:
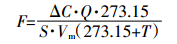 (1)
(1) 式中:F为气体通量,pmol·m-2·s-1;ΔC为进出气口浓度差,pmol·mol-1;Q表示进气口流量,L·s-1;S表示土壤面积,m2;Vm表示标准气体下摩尔体积,22.44 L·mol-1;T为土壤温度,℃。
利用SPSS 18.0进行单因素方差分析(ANOVA),以Duncan多重检验法检验不同处理对COS通量的影响。使用Sigmaplot 12.5进行绘图。
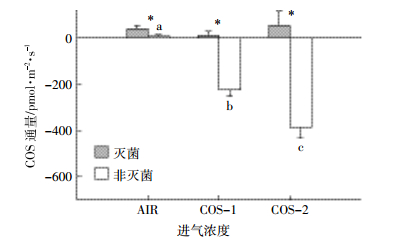
2 结果与分析 2.1 灭菌对COS通量的影响如图 1所示,当进气浓度为AIR时,灭菌土COS释放较多,为(39.78±16.84)pmol·m-2·s-1,且显著高于非灭菌土(P<0.05);进气浓度分别为COS-1、COS-2,灭菌土壤释放COS分别为(11.53±19.69)、(53.29±63.36)pmol·m-2·s-1,且显著高于非灭菌土(P<0.05)。无论COS进气浓度如何变化,灭菌土COS释放无明显变化,而非灭菌土COS释放随进气COS浓度升高显著降低(P<0.05)。
|
| 不同小写字母表示非灭菌土不同COS浓度间具有显著性差异;*表示同一COS浓度下灭菌、非灭菌土间具有显著性差异(P<0.05) Different lowercase letters indicate significant difference among different COS concentrations for not sterilization soils; *indicate significant difference between sterilization and not sterilization soils(P < 0.05) 图 1 灭菌对异位土COS通量的影响(均值±标准差,n=3) Figure 1 Effect of sterilization on disturbed soil COS fluxes(mean±SD, n=3) |
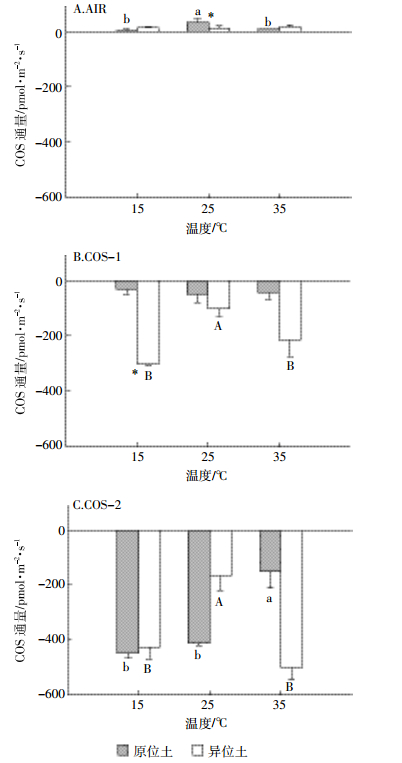
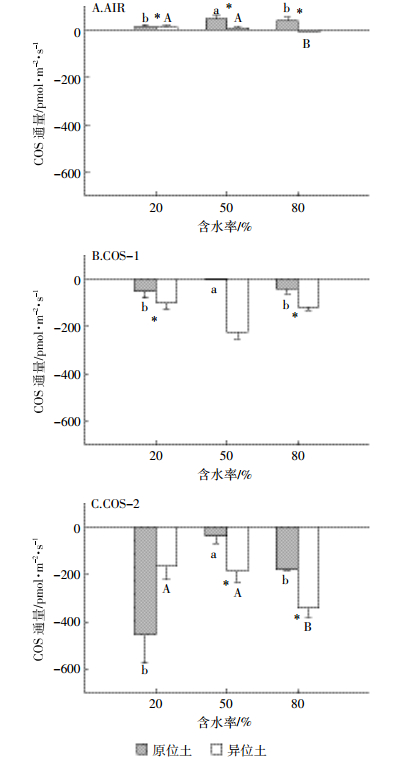
整体而言,原位土释放COS略高于异位土,吸收COS低于异位土。控制土壤含水率为20%MWHC,当进气浓度为AIR,温度为25 ℃时,原位土COS释放显著高于异位土(P<0.05)(图 2A);当进气浓度为COS-1,温度为15 ℃,原位土COS吸收显著低于异位土(P<0.05)(图 2B)。控制温度为25 ℃,当进气浓度为AIR时,原位土释放均显著高于异位土(P<0.05)(图 3A);当进气浓度COS-1,含水率为20%和80%MWHC,以及进气浓度为COS-2,含水率为50%和80% MWHC时,原位土COS吸收显著低于异位土(P<0.05)(图 3B、图 3C)。
|
| 原位土异位土不同小写字母表示原位土不同温度间具有显著性差异;不同大写字母表示异位土不同温度间具有显著性差异;*表示原位、异位土间具有显著性差异(P<0.05) Different lowercase letters indicate significant difference among different soil temperature for intact soils; Different capital letters indicate significant difference among different temperature for disturbed soils; *indicate significant difference between intact and disturbed soils(P < 0.05) 图 2 温度对COS通量影响(均值±标准差,n=3) Figure 2 Effect of temperature on soil COS fluxes(mean±SD, n=3) |
|
| 不同小写字母表示原位土不同含水率间具有显著性差异;不同大写字母表示异位土不同含水率之间具有显著性差异;*表示原位、异位土间具有显著性差异(P<0.05) Different lowercase letters indicate significant difference among different soil water content for intact soils; Different capital letters indicate significant difference among different water content for disturbed soils; *indicate significant difference between intact and disturbed soils(P < 0.05) 图 3 土壤含水率对土壤COS通量的影响(均值±标准差,n=3) Figure 3 Effect of soil water content on soil COS fluxes(mean±SD, n=3) |
控制土壤含水率为20%MWHC,当进气浓度为AIR(图 2A),温度为25 ℃时,原位土的释放最多,为(33±11.03)pmol·m-2·s-1,且显著高于其他两个温度(P<0.05);而在此条件下异位土COS的通量几乎没有变化。当进气浓度为COS-1(图 2B),原位土COS的吸收几乎相同;当温度为25 ℃时,异位土COS的吸收最少,为(100.37±28.98)pmol·m-2·s-1,且显著低于其他两个温度(P<0.05)。当进气浓度为COS-2(图 2C),温度为35 ℃时,原位土COS的吸收显著被抑制(P<0.05)。当温度为25 ℃时,异位土COS的吸收最少,为(164.90±55.44)pmol·m-2·s-1,且显著低于其他两个温度(P<0.05)。
2.4 COS通量对土壤湿度变化的响应控制土壤温度为25 ℃,当进气浓度为AIR(图 3A),含水率为50%MWHC时,原位土COS的释放最多,为(46.97±14.84)pmol·m-2·s-1,且显著高于其他两个含水率(P<0.05);当含水率为80%MWHC时,异位土COS的通量显著低于其他两个含水率(P<0.05),且此时由释放转变为吸收。当进气浓度为COS-1、COS-2(图 3B、图 3C),含水率为50%MWHC时,原位土COS的吸收均最少,分别为(-1.20±0.52)、(-36.5±33.52)pmol·m-2·s-1,且显著低于其他两个含水率(P<0.05);当进气浓度为COS-2,含水率为80% MWHC时,异位土COS的吸收显著增加(P<0.05)。
2.5 COS通量对大气CO2浓度变化的响应如图 4所示,当进气CO2浓度为0时,COS释放最大,为(64.42±13.40)pmol·m-2·s-1,当进气CO2浓度为8520 mg·m-3时,COS释放最小,为(11.50±6.85)pmol·m-2·s-1。随着进气CO2浓度的上升,土壤释放COS呈现下降的趋势,尤其与0 mg·m-3比较时,其他CO2浓度下COS释放均显著被抑制(P<0.05)。
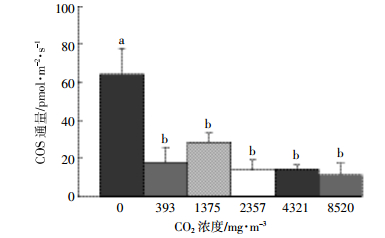
|
| 不同小写字母表示原位土COS通量在不同CO2浓度之间具有显著性差异(P<0.05) Lowercase letters indicate significant difference among different CO2 concentration for intact soils COS fluxes(P < 0.05) 图 4 CO2浓度对原位土COS通量的影响(均值±标准差,n=3) Figure 4 Effect of CO2 concentration on intact soil COS fluxes(mean±SD, n=3) |
已有研究发现微生物是影响土壤释放或吸收COS的主要因素[8, 16]。本研究结果显示灭菌土COS的释放均显著高于非灭菌土(图 1),这表明土壤释放/吸收COS均是重要的生物过程,尤其是土壤对COS的吸收。诸多研究表明,影响土壤吸收COS的碳酸酐(Carbonic anhydrase,CA)酶确实存在并会参与到COS的吸收,Kesselmeier等[8]将CA酶抑制剂加入土壤后发现土壤COS的吸收显著降低,这与本研究结论一致。土壤COS在CA酶参与下分解生成H2S和CO2,这个过程易受到土壤温、湿度等因素的影响,因此有关土壤COS通量的研究常常会重点关注各种环境因子的变化。
3.2 土壤结构破坏对COS通量的影响目前有关COS通量研究大多采用过筛土进行室内模拟实验[8],本研究结果显示原位土释放COS显著大于异位土,吸收COS显著低于异位土(图 2、图 3)。异位土在风干和过筛过程中会对土壤结构造成破坏(表 1),原位土气、液相比例小于异位土,固相比例大于异位土,土壤含水率和土壤中液相与固相之比成正比关系,因此原位土实际含水率小于异位土。这造成土壤微生物生存的环境发生变化,进而影响土壤COS的通量。目前有关COS通量与土壤结构关系的研究相对较少,但针对其他气体的研究时有报道。例如:胡宝叶等[14]研究南方蔗田土壤NO通量变化发现,土壤结构破坏后NO通量显著降低;Porre等[17]研究农田土壤结构对N2O的影响发现,土壤结构对CO2以及N2O通量有显著影响。这些研究均说明土壤结构对气体通量有影响,考虑到原位土更接近野外实际状况,因此用模型估算COS通量时要尽可能选择原位土。
3.3 温度对COS通量的影响温度对COS通量的影响已有较多报道[8-9, 18],本研究发现原位土最佳释放COS的温度为25 ℃,最佳吸收COS的温度介于15 ℃到25 ℃(图 2)。温度对于所有生物过程的影响均很大,适宜的温度会促进微生物的生长,温度过高或过低均会使微生物活性发生变化而抑制土壤COS的通量。本研究通过改变进气COS浓度使土壤表现为释放或吸收,土壤释放COS主要来自微生物硫酸盐的还原以及含硫氨基酸的降解[16],土壤吸收COS主要受CA酶活性的影响[8],影响土壤释放与吸收的微生物种类不同,因此最佳温度可能也不一致。温带地区报道的最佳温度介于15~20 ℃之间[8],本研究地区处于亚热带,因此最佳温度略高于温带地区。
异位土在同一含水率、不同温度下COS的释放、吸收与原位土的表现趋势不同(图 2A),当土壤释放COS时,异位土不存在最佳释放温度,主要原因是前文提到的土壤结构破坏对土壤COS的影响。异位土实际含水率大于原位土,因此当土壤含水率超过一定限度后,土壤含水率对土壤释放COS可能发挥了更重要的作用,进而掩盖了温度对土壤COS通量的影响。李新华等[16]研究黄河三角洲翅碱篷湿地COS释放动态时发现土壤含水率是影响土壤释放COS的主要因素,温度是次要因素。温度为25 ℃时异位土COS的吸收反而被抑制(图 2B、图 2C),这与部分研究结论相反[7-8]。一方面,前人研究进气类型采用的是普通空气,本研究中进气COS浓度突然升高,土壤微生物及酶可能需要适应过程,导致微生物及酶对土壤吸收COS的影响减弱;另一方面,土壤吸收COS主要存在于土壤表层[16],随着含水率的提升,水会在土壤和空气交换层形成膜[18],此时可能主要是水参与吸收COS。
3.4 含水率对COS通量的影响原位土释放COS的最佳含水率为50%MWHC(图 3),说明含水率是影响土壤COS通量的另一个重要因素。当含水率较低时,土壤微生物基本所需水分得不到满足;当含水率超过一定限度后,会影响土壤中O2的可利用率以及气体扩散率,进而影响土壤中微生物的活性[19]。COS-1和COS-2处理,原位土吸收COS在50%MWHC时显著被抑制(图 3)。这主要原因是当含水率在较低水平时,20%MWHC可能成为微生物比较适应的含水率,随着含水率升高直接影响了土壤中可利用的O2,进而抑制了土壤中微生物及酶的活性。kuhn等[5]研究发现含水饱和土壤吸收COS高于未饱和土壤84%,其原因主要是饱和土壤Eh值低于未饱和土壤,这同样适用于本研究。Devai等[20]发现在低Eh值状态下,土壤微生物活性更高,因此土壤中CA酶活性可能随之升高,从而促进了土壤吸收COS。较高进气COS浓度下含水率为80%MWHC时,异位土吸收COS显著上升同样用此机理解释(图 3C)。
在AIR处理时(图 3A),异位土含水率在20%MWHC和50%MWHC时释放COS,尤其当含水率为80%MWHC时,土壤由释放变成了吸收COS,这与前人研究不一致,Yi等[11]发现水稻土壤较干时会吸收COS,完全淹水状态会释放COS。这主要由于实验的采样方式不同,其采用进气方式是普通空气,而本研究是通过降低COS浓度使蔗田土壤表现为释放COS,大气与土壤之间原本就存在浓度差,因此造成土壤释放COS的最主要因素是物理因素(大气COS浓度),随着含水率继续增加,生物因素又占主导因素;另外Yi等[11]实验的土壤长期处于淹水状态,土壤主要利用方式的不同也有可能是造成这种差异的原因。
3.5 CO2浓度对COS通量的影响高浓度的大气CO2能够影响土壤COS的通量以及土壤呼吸[21]。本研究发现随着大气CO2浓度的上升,土壤释放COS显著被抑制(图 4)。COS与CO2的结构相似,且以相似的途径进入植物叶片中,因此部分研究使用COS代替CO2来研究植物光合作用过程[22]。土壤释放COS机理虽然还不是十分清楚,但一般认为与分解土壤硫化物的微生物有关,因此高浓度的CO2可能会与COS竞争土壤微生物,从而抑制土壤释放COS。另外,有研究发现大气CO2浓度的上升会对土壤微生物活性产生影响,Kampichler等[23]研究高浓度CO2对土壤微生物响应时发现土壤蛋白酶、木聚糖酶显著受到抑制,但大气CO2浓度上升是否也会抑制分解土壤硫化物微生物及酶的活性值得进一步去研究。
4 结论(1)原位土释放COS高于异位土,吸收COS低于异位土,过筛土模拟实验可能低估了土壤COS释放量。
(2)土壤微生物是影响土壤COS通量的最主要因素,温度、含水率和大气CO2浓度会影响微生物活性从而影响土壤COS通量。灭菌后土壤COS的释放显著高于灭菌前;25 ℃是蔗田土壤释放COS的最佳温度;最佳吸收COS的温度在15~25 ℃之间;50%土壤最大持水量是释放COS的最佳含水率;在一定CO2浓度范围内,土壤COS释放随大气CO2浓度上升而下降。
| [1] |
易志刚. 珠江三角洲典型陆地生态系统挥发性有机硫化合物地气交换通量研究[D]. 广州: 中国科学院研究生院广州地球化学研究所, 2006. YI Zhi-gang. Exchange fluxes of volatile organic sulfur compounds between land surfaces and atmosphere in selected typical terrestrial ecosystems in the Pearl River Delta[D]. Guangzhou:China Academy of Sciences Guangdong Institute of Geochemistry, 2006. http://d.wanfangdata.com.cn/Thesis/Y1631508 |
| [2] |
Xu L, Baldocchi D D. Seasonal variation in carbon dioxide exchange over a Mediterranean annual grassland in California[J]. Agricultural & Forest Meteorology, 2004, 123(1/2): 79-96. |
| [3] |
Vet R, Artz R S, Carou S, et al. A global assessment of precipitation chemistry and deposition of sulfur, nitrogen, sea salt, base cations, organic acids, acidity and pH, and phosphorus[J]. Atmospheric Environment, 2014, 93(3/4): 3-100. |
| [4] |
Kitz F, Gerdel K, Hammerle A, et al. In situ soil COS exchange of a temperate mountain grassland under simulated drought[J]. Oecologia, 2017, 183(3): 851-860. DOI:10.1007/s00442-016-3805-0 |
| [5] |
Kuhn U, Ammann C, Wolf A, et al. Carbonyl sulfide exchange on an ecosystem scale:Soil represents a dominant sink for atmospheric COS[J]. Atmospheric Environment, 1999, 33(6): 995-1008. DOI:10.1016/S1352-2310(98)00211-8 |
| [6] |
刘俊锋, 耿春梅, 牟玉静, 等. 羰基硫(COS)在土壤中的吸收与转化[J]. 环境化学, 2004, 23(6): 615-620. LIU Jun-feng, GENG Chun-Mei, MOU Yu-jing, et al. Uptake and conversion of carbonyl sulfide(COS) by soil[J]. Environmental Chemistry, 2004, 23(6): 615-620. |
| [7] |
IPCC. Climate change:The physical science basis[R]. Cambridge:Cambridge University Press, 2013.
|
| [8] |
Kesselmeier J, Teusch N, Kuhn U. Controlling variables for the uptake of atmospheric carbonyl sulfide by soil[J]. Journal of Geophysical Research Atmospheres, 1999, 104(D9): 11577-11584. DOI:10.1029/1999JD900090 |
| [9] |
Whelan M E, Min D H, Rhew R C. Salt marsh vegetation as a carbonyl sulfide(COS) source to the atmosphere[J]. Atmospheric Environment, 2013, 73(6): 131-137. |
| [10] |
Li X H, Zhu Z, Yang L, et al. Emissions of biogenic sulfur gases(H2S, COS) from Phragmites australis, coastal marsh in the Yellow River estuary of China[J]. Chinese Geographical Science, 2016, 26(6): 770-778. DOI:10.1007/s11769-016-0836-8 |
| [11] |
Yi Z G, Wang X M, Sheng G, et al. Exchange of carbonyl sulfide(COS) and dimethyl sulfide(DMS) between rice paddy fields and the atmosphere in subtropical China[J]. Agriculture Ecosystems & Environment, 2008, 123(1): 116-124. |
| [12] |
Chen Z, Cui Y L, Liu F P, et al. Effect of irrigation and fertilization on soil three phase composition change[J]. Water Saving Irrigation, 2014, 69(3): 131-138. |
| [13] |
Quan X U, Rui W Y, Bian X M, et al. Regional differences and characteristics of soil organic carbon density between dry land and paddy field in China[J]. Journal of Integrative Agriculture, 2007, 6(8): 981-987. |
| [14] |
胡宝叶, 王贤凤, 陈鹭, 等. 不同环境因子对南方典型蔗田原位和异位土壤NO通量的影响[J]. 农业环境科学学报, 2016, 35(9): 1824-1828. HU Bao-ye, WANG Xian-feng, CHEN Lu, et al. Effects of different environment factors on NO fluxes from intact and disturbed soils from the typical sugarcane field in southern China[J]. Journal of Agro-Environment Science, 2016, 35(9): 1824-1828. DOI:10.11654/jaes.2016-0818 |
| [15] |
郑丽丽, 郭萍萍, 易志刚. 鼎湖山典型森林土壤苯系物通量对模拟氮沉降的响应[J]. 生态环境学报, 2015, 24(3): 396-401. ZHENG Li-li, GUO Ping-ping, YI Zhi-gang. Responses of soil BTEX fluxes to stimulated nitrogen desposition in two domainated forests of Dinghushan, China[J]. Ecology and Environmental Sciences, 2015, 24(3): 396-401. |
| [16] |
李新华, 郭洪海, 杨丽萍, 等. 黄河三角洲翅碱篷湿地硫化氢和羰基硫排放动态研究[J]. 环境科学, 2014, 35(2): 786-791. LI Xin-hua, GUO Hong-hai, YANG Li-ping, et al. Study on dynamics of hydrogen sulfide and carbonyl sulfide emission fluxes from Suaeda salsa marsh in the Yellow River estuary[J]. Environmental Science, 2014, 35(2): 786-791. |
| [17] |
Porre R J, Groenigen J W V, Deyn G B D, et al. Exploring the relationship between soil mesofauna, soil structure and N2O emissions[J]. Soil Biology & Biochemistry, 2016, 96: 55-64. |
| [18] |
Kenichi K, Haruo T, Katsuyuki M. Emission of dimethyl sulfide, carbonyl sulfide, and carbon bisulfide from paddy fields[J]. Soil Science and Plant Nutrition, 1992, 38(4): 709-716. DOI:10.1080/00380768.1992.10416701 |
| [19] |
Whelan M E, Hilton T W, Berry J A, et al. Carbonyl sulfide exchange in soils for better estimates of ecosystem carbon uptake[J]. Atmospheric Chemistry & Physics, 2016, 16: 3711-3726. |
| [20] |
Devai I, Delaune R D. Formation of volatile sulfur compounds in salt marsh sediment as influenced by soil redox condition[J]. Organic Geochemistry, 1995, 23(4): 283-287. DOI:10.1016/0146-6380(95)00024-9 |
| [21] |
Kesselmeier J, Hubert A. Exchange of reduced volatile sulfur compounds between leaf litter and the atmosphere[J]. Atmospheric Environment, 2002, 36(29): 4679-4686. DOI:10.1016/S1352-2310(02)00413-2 |
| [22] |
Berry J, Wolf A, Campbell J E, et al. A coupled model of the global cycles of carbonyl sulfide and CO2:A possible new window on the carbon cycle[J]. Journal of Geophysical Research Biogeosciences, 2013, 118(2): 842-848. DOI:10.1002/jgrg.20068 |
| [23] |
Kampichler C, Kandeler E, Bardgett R D, et al. Impact of elevated atmospheric CO2 concentration on soil microbial biomass and activity in a complex, weedy field model ecosystem[J]. Global Change Biology, 1998, 4(3): 335-346. DOI:10.1046/j.1365-2486.1998.00157.x |
 2017, Vol. 36
2017, Vol. 36





