文章信息
- 席瑞泽, 付庆灵, 杨永强, 尤锦伟, 朱俊, 胡红青, 叶磊
- XI Rui-ze, FU Qing-ling, YANG Yong-qiang, YOU Jin-wei, ZHU Jun, HU Hong-qing, YE Lei
- 氮肥品种和含水量对水稻土N2O排放速率及排放过程的影响
- Effects of nitrogen fertilization and water content on the process and rate of N2O emission in paddy soils
- 农业环境科学学报, 2017, 36(12): 2553-2560
- Journal of Agro-Environment Science, 2017, 36(12): 2553-2560
- http://dx.doi.org/10.11654/jaes.2017-0768
文章历史
- 收稿日期: 2017-05-31
- 录用日期: 2017-08-09
2. 荆门市漳河管理局团林灌溉试验站, 湖北 荆门 448800
2. Tuanlin Irrigation Experimental Station, Zhanghe Water Engineering Authority, Jingmen 448800, China
氧化亚氮(N2O)是除CO2、CH4之外的第三大温室气体,会破坏臭氧层增加紫外线辐射,对全球总辐射的贡献为6.2%。2014年全球大气中N2O浓度为327.1 mm3·m-3,是工业革命前的121%[1]。土壤是N2O的主要释放源[2]。N2O在土壤中有多种产生途径,包括硝化作用、硝化细菌反硝化、硝化耦合反硝化、异养反硝化等生物作用[3],以及羟胺的分解、铁的还原等非生物作用[4-5]。已有研究表明在低含水量下N2O的产生途径主要是硝化作用,而高含水量下产生途径主要是反硝化作用[6]。Bouwman等[3]指出,土壤微生物主导的硝化-反硝化作用产生的N2O约占全球大气中N2O总量的90%。传统认为硝化作用只有自养硝化,然而现在越来越多的证据表明异养硝化在硝化作用中占据重要的地位[7]。虽然土壤中N2O的释放是由微生物主导的,但Webster等[8]发现,经高温灭菌的土壤也可以产生少量的N2O。
我国是世界上最大的产稻国,水稻种植面积达2.53×107 hm2,占粮食耕地面积的29%[9]。为了提高耕地的利用效率、增加农作物产量,农田土壤投入了大量氮肥,使得农田土壤释放大量的N2O,然而当氮肥导致土壤氮的有效性发生改变后,加之稻田在耕作过程中强烈的水分变化,对土壤中N2O的产生量和产生途径会产生什么样的影响,对自养硝化、异养硝化与非生物作用释放N2O的影响尚不明确。本文采用10 Pa(0.01% V/V)乙炔区分自养硝化和异养硝化[10]、结合100 kPa氧气抑制反硝化作用,同时采用高压蒸汽灭菌土壤测定非生物过程N2O产量。通过室内模拟水稻生产过程中土壤水分以及氮肥施用情况,分析了水分变化及氮肥种类对不同途径N2O产生速率的影响,为合理施肥,采取适当的管理措施减少稻田N2O排放提供科学依据。
1 材料与方法 1.1 土壤样品采集供试土壤样品取自湖北省荆门市团林镇石龙村水稻-油菜轮作田(北纬30°51′,东经121°6′,海拔25.4 m)。该地区属于亚热带温暖季风型气候,年平均气温16.1 ℃,年均降水量949.4 mm,年日照2000 h左右。稻田土壤类型为第四纪Q3发育而成的黄棕壤。供试土壤pH 5.5,有机质51.5 g·kg-1,全氮2.51 g·kg-1,铵态氮11.96 mg·kg-1,硝态氮50.61 mg·kg-1,土壤持水能力[11](WHC)62.5%,土壤基本性质的测定方法参照土壤农化分析[12]。
1.2 室内培养试验取一定质量的土壤样品于密闭容器中,放入恒温培养箱预培养,设定温度25 ℃、避光,每天定时敞口保证微生物的氧气需求,培养至第6 d测定土壤含水量,一般为土壤最大持水量的30%~40%,预培养至第7 d结束,取出土样进行室内培养。
实验设置两种施氮处理:尿素、硫酸铵,施肥量相当于当地大田施用量(150 kg N·hm-2),并做不施肥对照(CK)。同时施氮和对照都设置四种抑制剂处理,分别为:处理Ⅰ土壤;处理Ⅱ土壤+100 kPa O2;处理Ⅲ土壤+10 Pa C2H2+100 kPa O2;处理Ⅳ灭菌土壤。各处理设置3次重复。取相当于20 g烘干重的预培养土壤置于300 mL的培养瓶中,称重法调节土壤含水量分别为30%、50%、60%、70%、80%、100%,对应为土壤WHC的48%、80%、96%、112%、128%、160%,随后用橡胶塞密封培养瓶,添加抑制剂后放入25 ℃恒温培养箱避光培养24 h。分别在培养的第0、12、24 h使用气密性注射器抽取5 mL气体,在进行测定的24 h内,培养瓶中N2O并未达到饱和。
1.3 计算方法采用差减法计算不同过程N2O排放速率。处理Ⅰ不添加抑制气体,即为总的N2O排放速率。处理Ⅱ加入高浓度氧气,抑制了硝化反硝化和反硝化的N2O排放速率。处理Ⅲ在处理Ⅱ的基础上加入了乙炔,抑制了自养硝化、硝化反硝化和反硝化的N2O排放速率。处理Ⅳ经过灭菌作用,即为非生物作用的N2O排放速率。
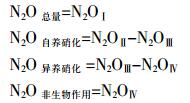
以上N2OⅠ、N2OⅡ、N2OⅢ、N2OⅣ分别表示处理Ⅰ、Ⅱ、Ⅲ、Ⅳ的N2O排放速率。
通过测定第0、12、24 h N2O的产生量(μL·L-1),应用Slope函数,求得N2O浓度随时间变化的回归曲线斜率(dc/dt),然后按下式计算N2O产生率。
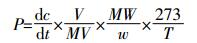
式中:P为N2O产生率,μg·kg-1·h-1;dc/dt为培养瓶内N2O浓度随时间变化的回归曲线斜率,μL·L-1·h-1[培养时间段,瓶内N2O气体呈线性增加(R2>0.9)];V为培养瓶内气体体积,L;W为干土重,g;MW为N2O的质量,g;MV为标准状态下1 mol气体的体积,L;T为培养温度,K。
1.4 数据处理与分析运用Origin 8. 0软件作图、SAS v8进行方差分析和最小显著差异法(LSD)比较不同处理的N2O排放通量与累积排放量的差异。
2 结果与分析 2.1 氮肥种类和水分对N2O总排放速率的影响由图 1可见,四种处理下,对照、施尿素、硫酸铵N2O排放速率均随着土壤含水量的增加而增加。四种处理在同一施肥条件下N2O排放速率趋势相同,都为Ⅰ>Ⅱ>Ⅲ>Ⅳ。处理Ⅳ经过灭菌,非生物作用N2O排放速率最低,处理Ⅲ加入氧气和乙炔,抑制了硝化反硝化、反硝化和自养硝化的N2O排放,相较于处理Ⅱ只抑制硝化反硝化和反硝化的N2O排放,处理Ⅲ的N2O排放速率要低于处理Ⅱ。
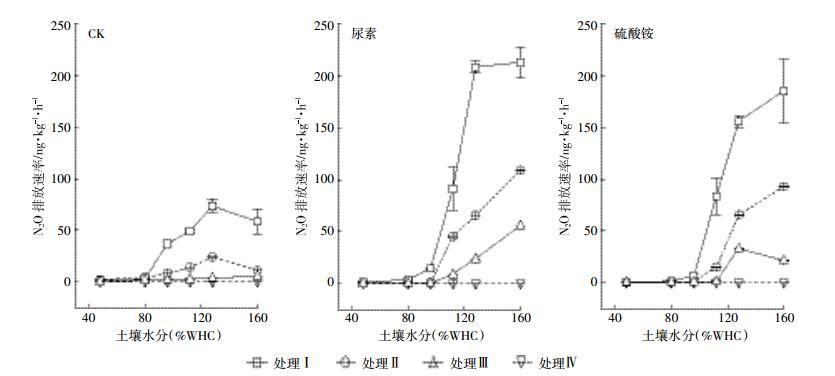
|
| 图 1 不同水分状态下施氮的N2O排放速率变化 Figure 1 The N2O emission flux changes with the moisture content of different N treatment |
处理Ⅰ即为总的N2O排放速率,CK处理在不同水分之间N2O排放速率为0.67~73.43 ng·kg-1·h-1,施尿素处理在不同水分之间排放速率为1.51~212.55 ng·kg-1·h-1,施硫酸铵则为0.87~184.99 ng·kg-1·h-1。显然,同一施氮处理的不同水分间N2O排放速率差异极显著(P < 0.01)。在低于96%(WHC)时,施氮处理与空白间N2O总排放速率相差不大,但施氮处理排放量要高于对照。随着土壤含水量的增加,对照处理N2O总排放速率在96%(WHC)下开始增加,在128%(WHC)下达最高值73.43 ng·kg-1·h-1,随后开始下降,其变化趋势呈抛物线型。施氮处理的土壤N2O总排放速率在112%(WHC)下开始显著增加,128%(WHC)后依然上升,但增速变缓,在160%(WHC)下N2O总排放速率均达最高峰,分别为尿素处理212.55 ng·kg-1·h-1,硫酸铵处理184.99 ng·kg-1·h-1。施氮可显著提升N2O总排放速率,尿素排放速率大于硫酸铵,但两者无显著差异(P>0.05)。
2.2 土壤铵态氮、硝态氮含量变化对于铵态氮,在对照组中,处理Ⅳ铵态氮含量远高于其他三种处理,可能是因为经过灭菌处理,没有微生物活动,使得铵态氮无法进行硝化作用而保存下来。施用尿素的土壤中铵态氮含量依次是Ⅲ>Ⅱ>Ⅰ>Ⅳ。与处理Ⅲ中乙炔抑制了自养硝化,而处理Ⅱ中氧气抑制了反硝化作用有关。施用硫酸铵的土壤中铵态氮含量依次是Ⅳ>Ⅲ>Ⅰ、Ⅱ,处理Ⅳ经过灭菌,铵态氮含量最高,处理Ⅲ乙炔抑制了自养硝化,铵态氮消耗减少(图 2)。
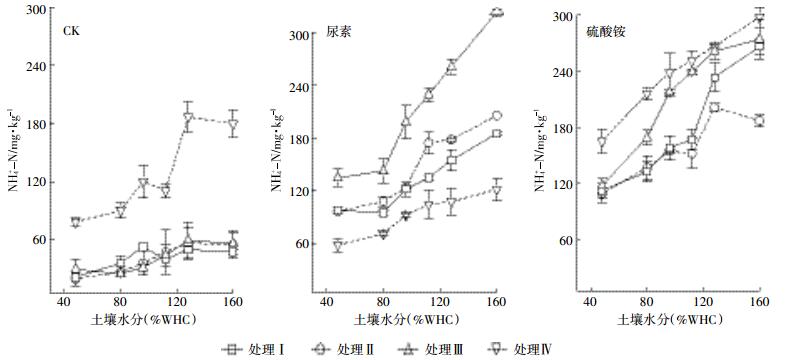
|
| 图 2 不同施氮处理铵态氮随水分状况变化 Figure 2 Different fertilization treatments ammonium nitrogen changes with the water moisture |
对于硝态氮,施肥的土壤四种处理的硝态氮含量依次是Ⅱ>Ⅰ>Ⅲ>Ⅳ。处理Ⅱ中氧气抑制了反硝化作用,使硝态氮大量积累,处理Ⅲ乙炔抑制自养硝化,使得硝态氮的来源减少,含量少于处理Ⅰ未加抑制剂的土壤,处理Ⅳ土壤中,没有微生物活动,在所有处理中的硝态氮含量最低(图 3)。
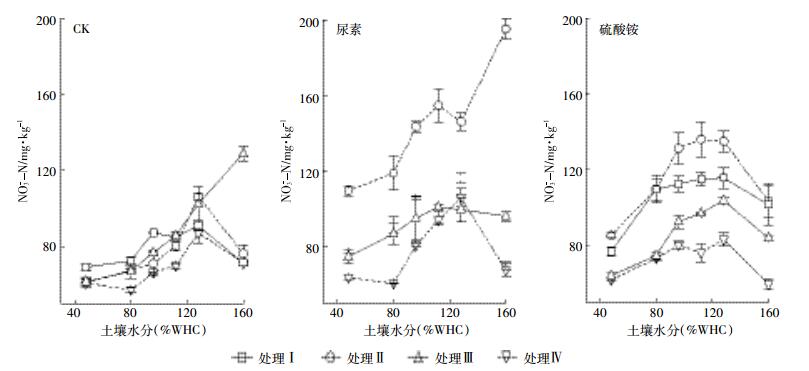
|
| 图 3 不同施氮处理土壤硝态氮随水分状况变化 Figure 3 Different fertilization treatments nitrate nitrogen changes with the water moisture |
空白处理N2O排放速率在含水量112%(WHC)时最高,为20.06 ng·kg-1·h-1。施用尿素在含水量低于96%(WHC)时N2O排放速率无显著变化(P>0.05),当含水量增加至112%(WHC)时,N2O排放速率显著增加,在含水量160%(WHC)达到峰值53.29 ng·kg-1·h-1。施用硫酸铵处理与尿素处理相同,低于96%(WHC)时N2O排放速率无显著变化,但在160%(WHC)时N2O排放速率最高,为71.22 ng·kg-1·h-1(图 4)。通过双因素方差分析可知,施氮处理的土壤N2O排放速率要显著高于空白对照(P < 0.01),各施氮不同水分处理下存在极显著差异(P < 0.01)。
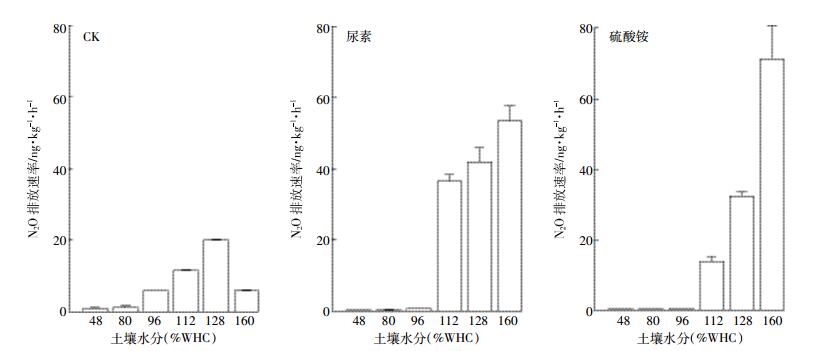
|
| 图 4 自养硝化N2O排放速率在不同施肥下随水分状况变化 Figure 4 Autotrophic nitrification emission fluxes of N2O in different fertilizer with moisture content |
自养硝化在施用氮肥后不仅会增加N2O排放速率,对总N2O排放速率的贡献也会增加。施用尿素后在112%(WHC)时最高为40%,施用硫酸铵则在160%(WHC)时贡献达到最高38.5%。除112%(WHC)外,其余水分含量下施用硫酸铵自养硝化贡献增加量比尿素多,在80%(WHC)时,硫酸铵贡献是尿素的2.3倍。空白处理对N2O贡献比例随水分含量增加而减小,硫酸铵则是先减后增,在96%(WHC)时最低。
2.4 氮肥种类和水分对异养硝化N2O排放速率的影响对于异养硝化N2O排放速率,空白处理N2O排放速率随水分增加而增加,160%(WHC)时达到最高5.00 ng·kg-1·h-1,尿素N2O排放速率在较低水分含量时无显著差异,当水分增至112%(WHC)时显著升高,160%(WHC)达到最高55.37 ng·kg-1·h-1。硫酸铵N2O排放速率处理则在低于112%(WHC)时无显著差异,128%(WHC)增至最高32.71 ng·kg-1·h-1(图 5)。施氮同样可以提高异养硝化N2O排放速率。通过双因素方差分析,空白处理与不同施氮存在显著差异(P < 0.05),各施氮不同水分处理下存在极显著差异(P < 0.01)。
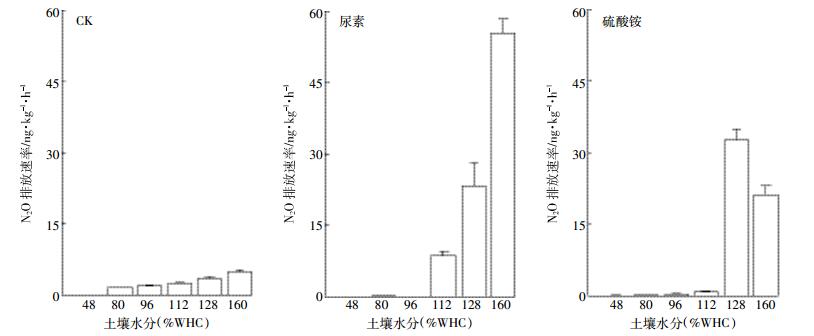
|
| 图 5 异养硝化N2O排放速率在不同施肥下随水分状况变化 Figure 5 Heterotrophic nitrification emission fluxes of N2O in different fertilizer with moisture content |
不同氮肥对异养硝化对总N2O排放速率的贡献的影响不相同,对于CK,随着水分含量增加,呈现先增后减的趋势,在80%(WHC)贡献最高为131%,128%(WHC)贡献最低为4.9%,施用氮肥后,异养硝化对总N2O排放速率贡献增加,尿素随含水量增加贡献增加,160%(WHC)贡献最高26.1%。硫酸铵对N2O排放速率贡献随水分增加呈现先减少后增加的趋势,在128%(WHC)时贡献最高,为21%、96%(WHC)时贡献最低,为7.3%,除160%(WHC)外,其余水分含量硫酸铵对异养硝化贡献量都比尿素多。
2.5 氮肥种类和水分对非生物作用N2O排放速率的影响在不同含水量下,空白处理释放量为0.26~0.39 ng·kg-1·h-1,与不同氮肥无显著差异。非生物作用产生的N2O相比于生物作用很少。三个处理N2O排放速率受水分影响所呈现趋势不同。CK处理N2O排放速率随水分增加呈现增加的趋势,在160%(WHC)最高为0.39 ng·kg-1·h-1。尿素与硫酸铵随水分含量增加变化趋势相同,都是先增后减,均在112%(WHC)时N2O排放速率最高,分别为0.37、0.35 ng·kg-1·h-1(图 6)。不同氮肥的非生物作用N2O排放速率差异不大。
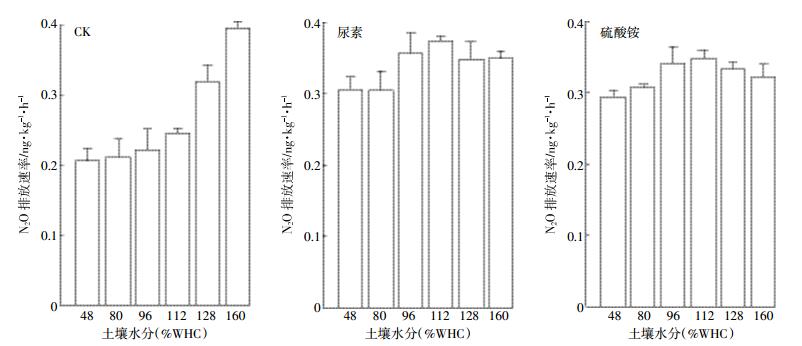
|
| 图 6 非生物作用N2O排放速率在不同施肥下随水分状况变化情况 Figure 6 Abiotic emission fluxes of N2O in different fertilizer with moisture content |
各个处理对N2O的贡献都随着水分含量的增加而降低,在48%(WHC)时都为最高,分别是CK 23.6%,尿素20.2%,硫酸铵43.7%。尿素与硫酸铵处理在160%(WHC)贡献最低,分别为0.16%、0.17%。
3 讨论氮肥处理和水分状况对土壤N2O释放的不同过程产生相应的影响,本实验研究表明施用尿素和硫酸铵可以显著增加总N2O排放速率,以及自养硝化与异养硝化N2O排放速率和排放贡献。很多大田实验也表明,大部分季节性的N2O排放速率在施入氮肥后增加[13-14]。Zhu等[15]研究发现,施用尿素N2O排放通量是硫酸铵的1.2~5.5倍,与本实验结果趋势大致相同。研究表明施用氮肥后土壤中硝化微生物的活性增强[16]。这是因为施氮后可以增加土壤氮素有效性含量,为硝化过程提供底物NH4+[17]。Cai等[18]证明施用氮肥后硝化速率加快。随着水分含量的增加,施用尿素与硫酸铵后N2O排放速率呈一直增加的趋势,但硫酸铵的增幅大于尿素,可能是因为参与自养硝化微生物对酰胺态氮(尿素)和铵态氮(硫酸铵)的利用情况不同。尿素的酰胺态氮需要经过矿化作用变为铵态氮,才可供微生物利用,而硫酸铵水解直接提供铵态氮。Werner等[19]研究发现,土壤N2O短期排放变化与土壤水分状况密切相关。土壤水分会通过影响氧气扩散率来影响N2O排放速率,土壤含水量低时含氧量高,硝化微生物活跃。Avrahami等[20]研究发现在20 ℃时,土壤硝化细菌(AOB)的丰度随着水分的增加而增加,并在60%含水量时最高。Bateman等[21]发现在不受氧气限制的情况下70%含水量时硝化速率最大。氮肥处理在低含水量下的自养硝化过程是N2O产生的主要贡献者,随着含水量增加,尿素处理的自养硝化贡献降低,与Bateman[21]的结果相同。Inubushi等[22]通过对暗色土不同过程N2O定量分析也发现,在小于100%(WHC)水分含量下自养硝化是N2O产生的主要贡献过程。Zhu等[15]通过对不同氧气浓度下自养硝化过程N2O释放得到相同的结论,即施用尿素与硫酸铵可以显著增加自养硝化N2O释放贡献。除112%水分含量外,其余水分含量下施用硫酸铵时N2O释放贡献显著高于尿素,可能是因为铵态氮可以直接被硝化微生物利用,而有机态氮易被其他异养微生物利用。
异养硝化N2O排放速率在不同氮源之间无显著差异,可能是因为异养硝化微生物对有机态氮和无机态氮均可利用[23]。本实验土壤有机质含量较高,异养硝化微生物在硝化时可以分解有机物产生能量,无机态氮就变为次要硝化原料,使得无机态氮利用较少,尿素与硫酸铵之间差异较小。随着含水量增加,异养硝化对N2O释放的贡献呈增加的趋势,可能与此土壤长期施用铵态氮肥导致pH变低,并且土壤本身有机质含量高有关。Zhang等[7]研究发现,在pH < 4.5的森林土壤中,异养硝化N2O释放的贡献最高达25.4%。Weber等[24]研究发现,低pH会抑制自养硝化细菌的活性,异养硝化就会成为主要贡献者。此外异养硝化细菌和真菌对水分的响应也可能导致这种现象的产生,但是国内外对异养硝化菌的生物多样性了解不足,应加强相关微生物机制的研究。Cai等[25]研究发现,在70%(WHC)和25 ℃的培养条件下,异养硝化对土壤N2O排放的贡献为38%,而本实验异养硝化的贡献最高为26.1%。
施用氮肥后,非生物作用N2O排放量增加,原因是施用氮肥提供了大量的NH4+。由于本实验为控制变量,都充入了大量氧气,土壤中会发生如下反应:
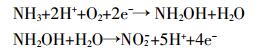
NH3在矿化过程中也会产生亚硝酸根[26]。与此同时在含水量较高时,土壤处于还原状态,土壤中的Fe2+、MnO2会发生氧化还原反应[27],将土壤中的亚硝酸根还原为N2O。Flowers等[28]指出,土壤氧化还原电位主要决定于土壤水分条件,淹水时土壤Eh很低,落干时土壤Eh则较高。由此可推断,土壤含水量越高,更多的区域处于还原状态,非生物作用产生的N2O就会越多。本研究空白处理随着水分的增加N2O排放速率增加,即证明了此点。施用氮肥N2O排放速率则随着水分含量的增加呈现先增加后减少的趋势,可能是因为高含水量时,土壤处于淹水状态,氮肥溶解在水中,一部分与土壤不接触造成的。在低水分含量时,土壤中存在一定的氧气,当水分增加至96%(WHC)时,灭菌后的土壤条件趋于一致,总的N2O排放速率的增幅远大于非生物作用的增幅,使得非生物作用N2O的贡献比例随着水分含量的增加而减少,至96%水分含量后趋于稳定。Ding W[29]等在25 ℃、60%WFPS培养,在施用有机肥后非生物贡献最高为3.4%,而Kesik等[30]、Nägele等[31]研究非生物作用贡献最高分别为0.8%、6%。本实验在低含水量下非生物作用贡献较高,高含水量下则与普遍的研究得出相同结论,非生物作用对N2O释放的贡献很少。
4 结论施氮和水分含量的增加可以显著提高总N2O排放速率以及自养硝化、异养硝化N2O排放速率,但对非生物过程主导的N2O排放速率无显著影响。对于总N2O排放速率,施氮处理随着水分含量的增加呈现相同的趋势,但尿素的释放速率要高于硫酸铵,而CK处理则先增加后降低;对于自养硝化N2O排放速率,施氮处理随着水分含量的增加同样呈现相同的增加趋势,尿素在160%(WHC)N2O排放速率低于硫酸铵,其余含水量下N2O排放速率均高于硫酸铵;对于异养硝化随着水分含量的增加,CK与尿素处理N2O排放速率均呈现一直增加的趋势,而硫酸铵则先增加后减少;对于非生物作用,施氮处理N2O排放速率随水分含量增加呈现先增加后减少的趋势,CK则一直增加。供试水稻土自养硝化对N2O排放速率的贡献大于异养硝化,非生物作用贡献只占很小比重。
| [1] |
中国气象局. 中国温室气体公报[EB/OL]. http://www.cma.gov.cn/root7/auto13139/201612/t20161228_359554.html China Meteorological Administration. China greenhouse gas Bulletin[EB/OL]. http://www.cma.gov.cn/root7/auto13139/201612/t20161228_359554.html |
| [2] |
廖千家骅, 颜晓元. 农业土壤氧化亚氮排放模型研究进展[J]. 农业环境科学学报, 2010, 29(5): 817-825. LIAO Qian-Jia-hua, YAN Xiao-yuan. Models of N2O Emission from Agricultural Fields:A review[J]. Journal of Agro-Environment Science, 2010, 29(5): 817-825. |
| [3] |
Bouwman A F. Exchange of greenhouse gases between terrestrial ecosystems and the atmosphere[J]. Soils and the Greenhouse Effect, 1990, 61-127. |
| [4] |
Firestone M K, Davidson E A. Microbiological basis of NO and N2O production and consumption in soil[J]. Exchange of Trace Gases between Terrestrial Ecosystems and the Atmosphere, 1989, 47: 7-21. |
| [5] |
Gaseous loss of nitrogen from plant-soil systems[M]. Springer Science & Business Media, 2013.
|
| [6] |
朱永官, 王晓辉, 杨小茹, 等. 农田土壤N2O产生的关键微生物过程及减排措施[J]. 环境科学, 2014(2): 792-800. ZHU Yong-guan, WANG Xiao-hui, YANG Xiao-ru, et al. Key microbial processes in nitrous oxide emissions of agricultural soil and mitigation strategies[J]. Environmental Science, 2014(2): 792-800. |
| [7] |
Zhang J, Cai Z, Zhu T. N2O production pathways in the subtropical acid forest soils in China[J]. Environmental Research, 2011, 111(5): 643-649. DOI:10.1016/j.envres.2011.04.005 |
| [8] |
Webster F A, Hopkins D W. Contributions from different microbial processes to N2O emission from soil under different moisture regimes[J]. Biology and Fertility of Soils, 1996, 22(4): 331-335. DOI:10.1007/BF00334578 |
| [9] |
黄进宝, 范晓晖, 张绍林. 太湖地区铁渗水耕人为土稻季上氮肥的氨挥发[J]. 土壤学报, 2006(5): 786-792. HUANG Jin-bao, FAN Xiao-hui, ZHANG Shao-lin. Ammonia volatilization from nitrogen fertilizer in the rice field of Fe-leachi-stagnic anthrosols in the Taihu lake region[J]. Acta Pedologica Sinica, 2006(5): 786-792. |
| [10] |
Berg P, Klemedtsson L, Rosswall T. Inhibitory effect of low partial pressures of acetylene on nitrification[J]. Soil Biology and Biochemistry, 1982, 14(3): 301-303. DOI:10.1016/0038-0717(82)90041-4 |
| [11] |
蔡祖聪, ArivnRMosier. 土壤水分状况对CH4氧化, N2O和CO2排放的影响[J]. 土壤, 1999(6): 289-294, 298. CAI Zu-cong, ArivnR Mosier. Effects of soil water condition on CH4 oxidation, N2O and CO2 emissions[J]. Soils, 1999(6): 289-294, 298. |
| [12] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. BAO Shi-dan. Analysis of soil agricultural chemistry[M]. Beijing: China Agriculture Press, 2000. |
| [13] |
Senbayram M, Chen R, Mühling K H, et al. Contribution of nitrification and denitrification to nitrous oxide emissions from soils after application of biogas waste and other fertilizers[J]. Rapid Communications in Mass Spectrometry, 2009, 23(16): 2489-2498. DOI:10.1002/rcm.v23:16 |
| [14] |
Venterea R T, Burger M, Spokas K A. Nitrogen oxide and methane emissions under varying tillage and fertilizer management[J]. Journal of Environmental Quality, 2005, 34(5): 1467-1477. DOI:10.2134/jeq2005.0018 |
| [15] |
Zhu X, Burger M, Doane T A, et al. Ammonia oxidation pathways and nitrifier denitrification are significant sources of N2O and NO under low oxygen availability[J]. Proceedings of the National Academy of Sciences, 2013, 110(16): 6328-6333. DOI:10.1073/pnas.1219993110 |
| [16] |
Lu X, Bottomley P J, Myrold D D. Contributions of ammonia-oxidizing archaea and bacteria to nitrification in Oregon forest soils[J]. Soil Biology and Biochemistry, 2015, 85: 54-62. DOI:10.1016/j.soilbio.2015.02.034 |
| [17] |
Huang Y, Tang Y. An estimate of greenhouse gas(N2O and CO2) mitigation potential under various scenarios of nitrogen use efficiency in Chinese croplands[J]. Global Change Biology, 2010, 16(11): 2958-2970. |
| [18] |
蔡祖聪, 赵维. 土地利用方式对湿润亚热带土壤硝化作用的影响[J]. 土壤学报, 2009, 46(5): 795-801. CAI Zu-cong, ZHAO Wei. Effects of land use types on nitrification in humid subtropical soils of China[J]. Acta Pedologica Sinica, 2009, 46(5): 795-801. DOI:10.11766/trxb200810280506 |
| [19] |
Werner C, Zheng X, Tang J, et al. N2O, CH4 and CO2 emissions from seasonal tropical rainforests and a rubber plantation in Southwest China[J]. Plant and Soil, 2006, 289(1/2): 335-353. |
| [20] |
Avrahami S, Bohannan B J M. N2O emission rates in a California meadow soil are influenced by fertilizer level, soil moisture and the community structure of ammonia-oxidizing bacteria[J]. Global Change Biology, 2009, 15(3): 643-655. DOI:10.1111/gcb.2009.15.issue-3 |
| [21] |
Bateman E J, Baggs E M. Contributions of nitrification and denitrification to N2O emissions from soils at different water-filled pore space[J]. Biology and Fertility of Soils, 2005, 41(6): 379-388. DOI:10.1007/s00374-005-0858-3 |
| [22] |
Inubushi K, Naganuma H, Kitahara S. Contribution of denitrification and autotrophic and heterotrophic nitrification to nitrous oxide production in andosols[J]. Biology and Fertility of Soils, 1996, 23(3): 292-298. DOI:10.1007/BF00335957 |
| [23] |
Zhang J, Sun W, Zhong W, et al. The substrate is an important factor in controlling the significance of heterotrophic nitrification in acidic forest soils[J]. Soil Biology and Biochemistry, 2014, 76: 143-148. DOI:10.1016/j.soilbio.2014.05.001 |
| [24] |
Weber D F, Gainey P L. Relative sensitivity of nitrifying organisms to hydrogen ions in soils and solutions[J]. Soil Science, 1962, 94(3): 138-145. DOI:10.1097/00010694-196209000-00002 |
| [25] |
Cai Y, Ding W, Zhang X, et al. Contribution of heterotrophic nitrification to nitrous oxide production in a long-term N-fertilized arable black soil[J]. Communications in Soil Science and Plant Analysis, 2010, 41(19): 2264-2278. DOI:10.1080/00103624.2010.507833 |
| [26] |
Heil J, Vereecken H, Brüggemann N. A review of chemical reactions of nitrification intermediates and their role in nitrogen cycling and nitrogen trace gas formation in soil[J]. European Journal of Soil Science, 2016, 67(1): 23-39. DOI:10.1111/ejss.2016.67.issue-1 |
| [27] |
Yang W H, Weber K A, Silver W L. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction[J]. Nature Geoscience, 2012, 5(8): 538-541. DOI:10.1038/ngeo1530 |
| [28] |
Flowers T H, O'Callaghan J R. Nitrification in soils incubated with pig slurry or ammonium sulphate[J]. Soil Biology and Biochemistry, 1983, 15(3): 337-342. DOI:10.1016/0038-0717(83)90080-9 |
| [29] |
Ding W, Yagi K, Cai Z, et al. Impact of long-term application of fertilizers on N2O and NO production potential in an intensively cultivated sandy loam soil[J]. Water, Air, & Soil Pollution, 2010, 212(1/2/3/4): 141-153. |
| [30] |
Kesik M, Blagodatsky S, Papen H, et al. Effect of pH, temperature and substrate on N2O, NO and CO2 production by Alcaligenes faecalis p.[J]. Journal of Applied Microbiology, 2006, 101(3): 655-667. DOI:10.1111/jam.2006.101.issue-3 |
| [31] |
Nägele W, Conrad R. Influence of soil pH on the nitrate-reducing microbial populations and their potential to reduce nitrate to NO and N2O[J]. Fems Microbiology Letters, 1990, 74(1): 49-57. DOI:10.1111/fml.1990.74.issue-1 |
 2017, Vol. 36
2017, Vol. 36




