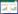文章信息
- 李祖然, 梁妮
- LI Zu-ran, LIANG Ni
- 氧氟沙星与Cu2+复合物对非洲绿猴肾细胞(Vero) 的毒性效应
- The toxicity effect of Cu2+-ofloxacin complex on Vero cell
- 农业环境科学学报, 2017, 36(2): 241-245
- Journal of Agro-Environment Science, 2017, 36(2): 241-245
- http://dx.doi.org/10.11654/jaes.2016-1108
文章历史
- 收稿日期: 2016-08-27
氧氟沙星(OFL)是第三代喹诺酮类抗菌药物,由于具有抗菌谱广、抗菌活性强、生物利用率高、与其他抗菌药物无交叉耐药性和毒副作用小等特点,被广泛应用于畜牧、水产等养殖业中,但同时导致了滥用和动物源食品中的残留[1-2]。OFL具有促进大鼠结肠粘膜分泌Cl-的作用[3],并且在质量浓度为其临床治疗质量浓度的八分之一以上时,能通过诱导细胞周期阻滞和细胞凋亡对HCEP细胞产生显著细胞毒性[4];OFL可能通过影响关节软骨细胞的β1整合素功能而抑制了ERK/MAPK信号通路,从而最终导致凋亡[5]。重金属在环境中普遍存在,动物饲料中通常添加Cu2+。重金属Cu2+对细胞的毒性研究较多,过量的Cu2+可导致Caco-2细胞氧化损伤,从而引起更广泛的细胞毒性效应[6]。在众多研究中,单一OFL或Cu2+污染对细胞毒性效应的研究较多,而两者复合污染对细胞毒性效应的研究报道较少,仅见OFL与Cu2+复合形成的配位体的特性、DNA结合特征、生物活性与细胞毒性的研究[7-9]。关于OFL与Cu2+复合污染对Vero细胞产生毒性效应的研究未见报道[10]。在自然界中,动物细胞受到的胁迫以复合污染居多[11-13],如动物疾病控制时使用抗生素,而饲料中添加Cu2+,就构成了两者之间的复合污染。在复合污染体系中,几种污染物导致的风险通常不是单一污染物风险的简单累加,而可能是受到污染物间物理或化学作用结果的影响。OFL、左氧氟沙星等属喹诺酮类药物,其3位羧基和4位羰基的氧原子均有很强的配位作用,容易与Cu2+结合,形成复合污染物。不同类型的Cu2+与喹诺酮类抗生素在DNA和蛋白质上的结合具有明显的区别[11]。这种复合污染物对细胞的影响值得特别关注[2]。Vero细胞作为细胞毒理实验的模式细胞,被广泛应用于生产人用病毒疫苗,可用作生物制品生产时的候选细胞基质。复合污染物对Vero细胞毒性效应的研究较少,仅见Andrews等[14]报道了重金属和螯合物对Vero细胞的生物毒性。而OFL与Cu2+对Vero细胞复合污染的研究未见报道。本研究选用抗生素OFL与Cu2+作为污染物代表,对非洲绿猴肾细胞进行毒性实验,研究单一污染和复合污染对非洲绿猴肾细胞生长的抑制特征及细胞毒性,对了解自然条件下抗生素与重金属复合污染物对动物细胞的影响具有重要的参考价值。
1 材料与方法 1.1 实验材料Vero细胞即非洲绿猴肾细胞由昆明理工大学生命科学与技术学院提供。试剂为三水合硝酸铜(Cu(NO3)2·3H2O,Alfa Aesar Company,分析纯)、氧氟沙星(OFL,沈阳新马药业有限公司,分析纯)、DMEM高糖培养基(HyClone Company,DMEM/High Glucose)。
1.2 细胞培养Vero细胞按常规方法[15],用DMEM高糖培养基在培养瓶中培养,置于37 ℃、CO2浓度为5%的CO2恒温培养箱中维持生长。传代及细胞完全贴壁后均使用DMEM高糖培养基维持培养。
1.3 氧氟沙星(OFL)与Cu处理将5% CO2、37 ℃培养的Vero细胞,以2.5×104/孔接种于96孔培养板内,培养12~24 h,待细胞长成单层后,吸弃培养液,分别加入浓度为2.75、6.88、859、1718、3437、6875、13 750 mg·L-1的Cu2+溶液(以Cu(NO3)2·3H2O配制),浓度为0.63、1.25、2.5、5.0、10 mg·L-1的OFL溶液。2.75 mg·L-1和6.88 mg·L-1 Cu2+分别与OFL形成复合物(OFL浓度分别为0.63、1.25、2.5、5.0、10 mg·L-1),同时设正常细胞及空白对照,每处理3个重复。将培养板置于5% CO2、37 ℃培养箱中培养1 h后,每孔补加MTT液10 μL,在5%CO2、37 ℃培养箱中反应4 h,吸弃上清液。
1.4 指标测定用显微镜观察不同处理条件下的Vero细胞形态变化。
每孔加入DMSO(二甲基亚枫)100 μL,于振荡器上振荡10 min,用酶标仪于492 nm波长下测定光吸收值(OD),然后计算细胞抑制率。
细胞抑制率=1-(污染物处理细胞存活率/对照细胞存活率)×100%
1.5 统计分析采用SPSS 10.0统计软件进行t检验,P < 0.05为显著差异,具有统计学意义。采用Excel 2007软件进行数据处理、图形绘制。
2 结果分析 2.1 不同污染物致Vero细胞的形态变化在细胞密度稳定和未加入污染物时,Vero细胞呈现出正常细胞形态,细胞完整,均匀分布。在加入OFL、Cu2+及其复合物之后,不论污染物是何种类型与浓度,均可观察到Vero细胞形态变化(细胞破碎,贴壁率降低),表明添加不同污染物后Vero细胞形态发生改变。
2.2 Cu2+对Vero细胞生长的抑制率随着Cu2+浓度的增加,Vero细胞生长抑制率逐渐上升。当Cu2+浓度为2.75 mg·L-1和6.88 mg·L-1时,Vero细胞生长抑制率分别为32.4%和31%;当Cu2+浓度为6875 mg·L-1时,Vero细胞生长抑制率为87.5%,且开始呈现稳定趋势。最高Cu2+浓度下Vero细胞生长抑制率比最低浓度时高56.5%。因此,后续实验使用的Cu2+浓度为2.75 mg·L-1和6.88 mg·L-1(图 1)。

|
| 图 1 Cu2+对Vero细胞生长抑制率的影响 Figure 1 The inhibiting rate of Cu2+ on growth of Vero cell |
在OFL浓度为0.63~2.5 mg·L-1时,Vero细胞生长的抑制率呈现负值,说明Vero细胞的生长得到了促进;而当OFL浓度逐渐增加到5 mg·L-1后,Vero细胞生长的抑制率为正值,说明高浓度OFL对细胞生长产生抑制,且在浓度为5 mg·L-1时达到峰值,为14.75%(图 2)。
|
| 图 2 OFL对Vero细胞生长的抑制率 Figure 2 The inhibiting rate of OFL on growth of Vero cell |
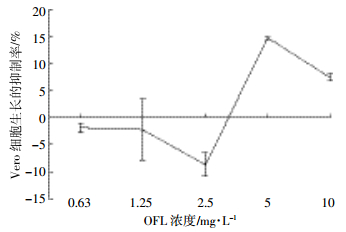
2.75 mg·L-1 Cu2+与不同浓度OFL复合物对细胞生长的抑制率如图 3所示。在OFL浓度为0.63 mg·L-1和1.25 mg·L-1时,OFL与Cu2+的复合物对细胞的抑制率与OFL、Cu2+单一抑制率之和没有显著差异;当OFL浓度为2.5、5、10 mg·L-1时,Cu2+与OFL的复合物对细胞的抑制率与OFL、Cu2+单一抑制率之和有显著差异。OFL浓度为2.5 mg·L-1时,OFL与Cu2+的复合物对细胞的抑制率比OFL、Cu2+单一抑制率之和高11.8%;OFL浓度为5 mg·L-1和10 mg·L-1时,OFL与Cu2+的复合物对细胞的抑制率又比OFL、Cu2+单一抑制率之和分别低了11.3%和9.8%。并且,在此Cu2+浓度下,OFL与Cu2+的复合物对细胞的抑制率在30%~36%之间,但随OFL浓度的变化没有显著差异。
|
| 图 3 2.75 mg·L-1 Cu2+与不同浓度OFL复合物对细胞生长的抑制率 Figure 3 The inhibiting rate of Cu2+-ofloxacin complex on growth of Vero cell under 2.75 mg·L-1 Cu2+ |
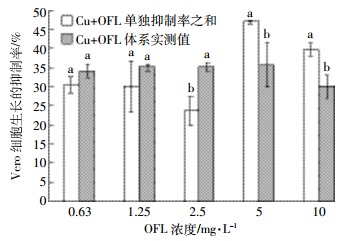
图 4显示了6.88 mg·L-1 Cu2+与不同浓度OFL复合物对细胞生长的抑制率。OFL浓度为1.25、2.5 mg·L-1时,OFL与Cu2+的复合物对细胞抑制率的实测值与OFL、Cu2+单一抑制率之和之间没有显著差异;而当OFL浓度为0.63、5、10 mg·L-1时,OFL与Cu2+的复合物对细胞抑制率的实测值显著低于OFL、Cu2+单一抑制率之和。OFL与Cu2+的复合物对细胞的抑制率随着OFL浓度的增加而增加。
|
| 图 4 6.88 mg·L-1 Cu2+与不同浓度OFL复合物对细胞生长的抑制率(%) Figure 4 The inhibiting rate of Cu2+-ofloxacin complex on growth of Vero cell under 6.88 mg·L-1 Cu2+ |
本研究表明抗生素OFL与重金属Cu2+的复合物对Vero细胞产生了毒性效应,并表现为抑制细胞生长,OFL与Cu2+的复合物会对细胞产生复合污染。实验表明Vero细胞在污染物毒性作用下出现了破碎的现象,污染物使Vero细胞的形态发生了改变,抑制了细胞生长。这与石艳玲等报道的细胞形态毒性响应主要以贴壁细胞减少为主[10],具有明显的差别。OFL与Cu2+复合污染和OFL、Cu2+单一污染对Vero细胞抑制率都具有显著差异,且复合污染对Vero细胞的抑制率并不是OFL、Cu2+单一污染对Vero细胞抑制率之和。在OFL与Cu2+复合形成的配位体特性、DNA结合特征、生物活性与细胞毒性研究的基础上[7-9],深入研究OFL与Cu2+复合污染对Vero细胞产生的毒性效应是十分新颖的[10],值得探索,具有重要的理论意义。
OFL与Cu2+的复合物与OFL、Cu2+单一污染均会对细胞生长产生抑制,对细胞产生毒性效应。在复合物浓度较低时,受OFL的影响,复合物溶液会使污染物对细胞生长抑制率降低。在OFL浓度较低时,OFL对细胞生长的抑制率是负值,说明OFL作为抗生素,在合理浓度范围内可能对细胞生长的影响较小且会促进部分细胞生长[3]。OFL与Cu2+的复合物对细胞抑制率与OFL、Cu2+单一抑制率之和具有显著差异,OFL与Cu2+的复合物对细胞的抑制率比OFL、Cu2+单一抑制率之和低,表明OFL与Cu2+对细胞生长的复合污染表现出拮抗作用,导致OFL与Cu2+的复合物比OFL、Cu2+单一污染时毒性降低。OFL与Cu2+的复合物中,除了游离的Cu2+与游离的OFL外还存在两者的复合物,如络合反应产生的络合物,以及OFL与Cu2+和DMEM培养液中其他物质发生反应生成的产物,都可能影响细胞的生长,所以OFL与Cu2+的复合物对细胞的影响并不单纯的等于两种污染物毒性之和[16-18];同时,低浓度Cu2+条件下,OFL与Cu2+的复合物对细胞的抑制率随OFL浓度的变化没有显著差异。由此可见,在DMEM培养液中,OFL与Cu2+的络合反应受其他因素影响较大[19]。
在自然环境中,抗生素的滥用和饲料中金属元素的过度添加,使得动物细胞受到复合污染的情况增多[11-13],且在复合污染体系中,受污染物间物理或化学作用的影响,复合污染体系的风险并不能简单的认为是单一污染物风险的累加。为了进一步探讨复合污染对细胞生长的影响,构建复合物反应体系具有重要的意义。在不同环境体系中,由于受不同环境的影响,复合污染物各组分间浓度配比会发生改变[20-21],进一步探讨在不同背景下各组分之间的配比,构建系统的污染物配比方案,进一步确定复合污染物的复合污染特征,系统阐明复合污染对细胞生长的影响及其机理,是十分必要的。针对OFL与Cu2+复合物对非洲绿猴肾细胞(Vero)的毒性效应,我们获得的知识仍然相当有限,应该引起高度关注,开展更加深入的研究。
4 结论本文研究了氧氟沙星与Cu2+对细胞生长复合污染的毒性效应。结果表明,氧氟沙星与Cu2+对细胞生长的复合污染的抑制率小于氧氟沙星与Cu2+单独对细胞生长抑制率之和,表明氧氟沙星与Cu2+对细胞生长的复合污染表现出拮抗作用。
| [1] | 钟惠萍, 陈素艳, 邓清莲. 铜-氧氟沙星荧光体系测定氧氟沙星[J]. 光谱实验室, 2012, 29(6) : 3931–3933. ZHONG Hui-ping, CHEN Su-yan, DENG Qing-Lian. Determination of ofloxacin by the cuprum (Ⅱ) ion fluorescence probe[J]. Chinese Journal of Spectroscopy Laboratory, 2012, 29(6) : 3931–3933. |
| [2] | 吴国娟, 吴敏, 韩雪娇, 等. 荧光猝灭法研究氧氟沙星与Cu2+的络合[J]. 化学通报, 2013, 76(11) : 1045–1048. WU Guo-juan, WU Min, HAN Xue-jiao, et al. Study of Cu2+-ofloxacin complexation by fluorescence quenching method[J]. Chemistry Bulletin, 2013, 76(11) : 1045–1048. |
| [3] | 阎明, 朱进霞, 赵文超, 等. 氧氟沙星对大鼠结肠上皮细胞分泌Cl-的影响[J]. 郑州大学学报(医学版), 2005, 40(4) : 633–636. YAN Ming, ZHU Jin-xia, ZHAO Wen-chao, et al. Effects of ofloxacin on rat distal colonic mucosa secreating Cl-[J]. Joumal of Zhengzhou University (Medical Scienses), 2005, 40(4) : 633–636. |
| [4] | 王德平, 樊文艺, 温茜, 等. 氧氟沙星对人角膜上皮细胞的毒性作用及其细胞与分子机理研究[J]. 山东大学学报(理学版), 2016, 51(5) : 11–17. WANG De-ping, FAN Wen-yi, WEN Qian, et al. Cytotoxicity of ofloxacin to human corneal epithelial cells and its cellular and molecular mechanisms[J]. Journal of Shandong University (Natural Science), 2016, 51(5) : 11–17. |
| [5] | 盛治国, 彭双清, 王常勇, 等. 氧氟沙星通过抑制β1整合素诱导关节软骨的细胞凋亡[J]. 毒理学杂志, 2007, 21(4) : 341. SHENG Zhi-guo, PENG Shuang-qing, WANG Chang-yong, et al. Chondrocyte apoptosis with ofloxacin inhibiting β1 integrin[J]. Journal of Toxicology, 2007, 21(4) : 341. |
| [6] | 刘志伟, 陈佳琳, 陈秉衡. 铜对人类肠道上皮Caco-2细胞的毒性研究[J]. 卫生研究, 2004, 33(3) : 284–287. LIU Zhi-wei, CHEN Jia-lin, CHEN Bing-heng. Toxicological effects of copper on human intestinal Caco-2 cells[J]. Journal of Hygiene Research, 2004, 33(3) : 284–287. |
| [7] | Živec P, Perdih F, Turel I, et al. Different types of copper complexes with the quinolone antimicrobial drugs ofloxacin and norfloxacin:Structure, DNA-and albumin-binding[J]. Journal of Inorganic Biochemistry, 2012, 117 : 35–47. DOI:10.1016/j.jinorgbio.2012.08.008 |
| [8] | Chen C Y, Chen Q Z, Wang X F, et al. Synthesis, characterization, DNA binding properties, and biological activities of a mixed ligand copper (Ⅱ) complex of ofloxacin[J]. Transition Metal Chemistry, 2009, 34 : 757–763. DOI:10.1007/s11243-009-9259-z |
| [9] | Karia Parag S, Vekariya Pankajkumar A, Patidar Anshul P, et al. Copper (Ⅱ) complexes with N, O-ligands and ofloxacin drug as antibacterial, DNA interacting, cytotoxic and SOD mimic agent[J]. Indian Journal of Microbiology, 2015, 55 : 302–312. DOI:10.1007/s12088-015-0525-9 |
| [10] | 石艳玲, 王磊, 周琪. Vero细胞对2, 4, 6-三氯苯酚的毒性响应特征和敏感性分析[J]. 生态毒理学报, 2008, 3(5) : 479–487. SHI Yan-ling, WANG Lei, ZHOU Qi. Cytotoxic response characteristics and sensitivity in mammalian Vero cells exposed to 2, 4, 6-trichlorophenol[J]. Asian Journal of Ecotoxicogy, 2008, 3(5) : 479–487. |
| [11] | 陈永红, 邹志飞, 黄夏宁, 等. 曲酸对Vero及CHO-K1细胞毒性作用[J]. 中国公共卫生, 2010, 26(11) : 1467–1468. CHEN Yong-hong, ZOU Zhi-fei, HUANG Xia-ning, et al. Cyotoxic effects of kojic acid on cell lines[J]. Chinese Journal of Public Health, 2010, 26(11) : 1467–1468. |
| [12] | Gu M M, He Y F, Han C Y, et al. Cytotoxicity effects of rhizoma coptidis on L929 murine fibroblast cells[J]. Journal of Chinese Pharmaceutical Sciences, 2015 : 111–120. |
| [13] | 于静波, 王璐, 张明磊, 等. 人型支原体拓扑异构酶Ⅳ氨基酸变异与喹诺酮耐药关系的研究[J]. 国际检验医学杂志, 2011, 32(16) : 1792–1796. YU Jing-bo, WANG Lu, Zhang Ming-lei, et al. Correlation between the variation of DNA topoisomerase Ⅳ and the resistance to quinolone of mycoplasma hominis[J]. International Journal of Laboratory Medicine, 2011, 32(16) : 1792–1796. |
| [14] | Andrews T K, Thompson B B, Wincek M A, et al. Toxicity of heavy-metals and chelons in Vero cells[J]. In Vitro-journal of the Tissue Culture Association, 1978, 14(4) : 381. |
| [15] | 司徒镇强, 吴军正. 细胞培养[M]. 北京: 世界图书出版社, 2007. SITU Zhen-qiang, WU Jun-zhong. Cell culture[M]. Beijing: World Publishing Corporation, 2007. |
| [16] | 刘海燕. 左氧氟沙星对肺结核患者血清细胞因子及游离氨基酸的影响研究[J]. 海南医学院学报, 2013, 19(8) : 1099–1105. LIU Hai-yan. Influence of levofloxacin on levels of cytokines and free amino acids in tuberculosis patients[J]. Journal of Hainan Medical University, 2013, 19(8) : 1099–1105. |
| [17] | 段慧, 刘忠芳, 胡小莉, 等. KIO3-溴化钾-甲基紫体系共振瑞利散射法测定青霉素类抗生素[J]. 西南大学学报(自然科学版), 2008, 30(5) : 31–35. DUAN Hui, LIU Zhong-fang, HU Xiao-li, et al. Determination of penicillin antibiotics by resonance Rayleigh scattering method with KIO3-KBr-Methyl violet[J]. Journal of Southwest University (Natural Science Edition), 2008, 30(5) : 31–35. |
| [18] | 屈晨, 王萍, 徐艳, 等. 氢氧化钙及三重抗生素糊剂联合用于根管消毒的临床疗效观察[J]. 解放军医学杂志, 2014, 39(2) : 138–143. QU Chen, WANG Ping, XU Yan, et al. Clinical effect of calcium hydroxide paste combined with triple antibiotic paste on root canal disinfection[J]. Medical Journal of Chinese People's Liberation Army, 2014, 39(2) : 138–143. |
| [19] | 周宝宣, 袁琦, 秦夕淳, 等. 基于离子选择性电极的土壤重金属检测系统研究[J]. 环境科学与技术, 2015, 38(11) : 179–183. ZHOU Bao-xuan, YUAN Qi, QIN Xi-chun, et al. Study on heavy metal detection system of soil based on ion selective electrode[J]. Environmental Science and Technology, 2015, 38(11) : 179–183. |
| [20] | 潘自红, 李青彬, 王亚波, 等. 铁络合光度法测定氧氟沙星和诺氟沙星含量[J]. 化学研究, 2014, 25(4) : 394–397. PAN Zi-hong, LI Qing-bin, WANG Ya-bo, et al. Determination of ofloxacin and norfloxacin by ferrous complexing spectrophotometric method[J]. Chemical Research, 2014, 25(4) : 394–397. |
| [21] | 全玉莲. 离子选择电极法测定电镀废水中铜含量[J]. 中国环境管理干部学院学报, 2016, 26(3) : 80–82. QUAN Yu-lian. Determination of copper in electroplating wastewater by Ion-selective electrode[J]. Journal of EMCC, 2016, 26(3) : 80–82. |
 2017, Vol. 36
2017, Vol. 36