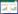文章信息
- 王朝阳, 马婷婷, 周通, 李柱, 吴龙华, 周守标, 骆永明
- WANG Zhao-yang, MA Ting-ting, ZHOU Tong, LI Zhu, WU Long-hua, ZHOU Shou-biao, LUO Yong-ming
- 不同浓度及不同来源纳米银对伴矿景天生长及重金属吸收的影响研究
- Effects of different concentrations and sources of silver nanoparticles on growth and metal uptake by Sedum plumbizincicola
- 农业环境科学学报, 2017, 36(2): 250-256
- Journal of Agro-Environment Science, 2017, 36(2): 250-256
- http://dx.doi.org/10.11654/jaes.2016-1039
文章历史
- 收稿日期: 2016-08-11
2. 中国科学院南京土壤研究所 土壤环境与污染修复重点实验室, 南京 210008;
3. 湖北文理学院汉江研究院, 湖北 襄阳 441053
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Sciences, Chinese Academy of Sciences, Nanjing 210008, China;
3. Institute of Hanjiang, Hubei University of Arts and Sciences, Xiangyang 441053, China
纳米材料是指三维结构中至少有一维处于1~100 nm之间[1]。由于纳米银(AgNPs)的独特性质及纳米技术的发展,AgNPs在全球的使用量逐年增加[2-3]。AgNPs在生产、使用和丢弃的过程中会不可避免地进入污水处理系统,并随污水污泥进入自然生态系统。通过食物链进行传递,对人体健康造成危害[4]。进入污水处理厂的AgNPs约有85%吸附在污泥上[5],污泥处置是影响AgNPs环境行为的关键环节。污泥的处置方式主要有卫生填埋、焚烧、土地利用等,每个国家根据自身的发展状况选择适合本国国情的处置方式。美国环保局的一项研究显示,污泥中Ag的浓度在1.94~856 mg·kg-1之间,73%的污泥样品处于1~20 mg·kg-1之间[6]。我国有关污泥中AgNPs的存在浓度尚未见报道。在一些欧美国家,约有60%含有纳米材料的污泥通过农用施肥过程进入土壤,此类污泥的长期施用必然导致土壤中纳米材料含量的增加[7]。同时,杀虫剂的使用和污水灌溉等也成为AgNPs进入土壤的可能途径。相比AgNPs的研发和应用,其生态环境影响研究起步较晚,目前主要集中在微生物[8-9]和动物[10-11]领域,其对于植物的影响研究尤为少见[12, 14]。
AgNPs粒径微小,进入土壤后易被植物吸收并在体内积累,从而对植物产生毒害作用,或通过食物链传递对人体产生危害[15-16]。但目前关于AgNPs的植物毒害及其机理研究尚不多见,且多数为水培或短期试验。研究发现,AgNPs对植物生物量、种子萌发、根系形态及根系活力等均有影响:2.5 mg·kg-1的AgNPs(10 nm)对小麦的根长和生物量产生了明显的抑制作用[17];大于20 mg·kg-1的AgNPs(15 nm)会对黑麦草生长产生抑制作用,同时也降低了其根长、根尖数及根系活力[18]。关于AgNPs对重金属超积累植物生长及其重金属修复效率的影响方面未见报道。
本文拟采用盆栽试验的方法,研究不同浓度和不同来源的AgNPs对镉/锌(Cd/Zn)超积累植物伴矿景天(Sedum plumbizincicola)生长以及Ag、Cd、Zn等重金属吸收性的影响,探讨目前用量巨大的纳米材料在环境中残留引起的生态效应问题,以期为农田土壤重金属污染的控制与修复提供理论依据。
1 材料与方法 1.1 供试材料供试土壤为江西省鹰潭市的水耕人为土,采集0~15 cm耕层土壤,风干、过2 mm尼龙筛,备用,其基本理化性质见表 1。供试污泥为采自江苏省苏州市福星污水处理厂的脱水污泥,污泥含水率为78%,其基本性质见表 2。
供试伴矿景天采自浙江省杭州郊区某重金属污染修复农田。每盆扦插4株,平均生物量为1.08 g·盆-1(干重)。扦插前伴矿景天植株的Cd浓度为29.7 mg·kg-1,锌浓度为3133 mg·kg-1。
试验所用AgNPs溶液(纯度99.9%)购于南京先丰纳米材料有限公司。储备液中AgNPs粒子的平均粒径为10 nm,Ag浓度为1 g·L-1;透射电子显微镜检测结果显示,AgNPs粒子的粒径大多数集中在6~8 nm,绝大多数小于10 nm;激光粒度分析仪对AgNPs悬液中Ag粒子的粒径分布进行分析发现,AgNPs的粒径多分布于6.8 nm处。试验所用试剂均为优级纯,用水均为超纯水。
1.2 试验设计与实施盆栽试验于2016年4月26日至7月5日在中国科学院南京土壤研究所温室进行,共设10个处理,其中施加AgNPs浓度分别为0、1、4、7、10 mg·kg-1共5个梯度,分施污泥与不施污泥2类处理。每处理4次重复,共40盆,随机排列并定期调换位置以减少光照等差别带来的影响。
每盆装土2 kg(烘干基),将AgNPs溶液均匀喷洒到土壤后充分混匀;施加污泥的处理组污泥用量为1.6%(烘干基),分别添加0、2、8、14、20 mL的AgNPs储备液到污泥中,充分搅拌后放置一周,然后分别添加到各个盆栽,搅拌均匀。
盆栽试验不施基肥,分别于5月14日和6月14日各追肥一次,每次每盆均匀施加1.5 g尿素和1.5 g磷酸二氢钾。每天浇灌去离子水,保持土壤含水量为最大持水量的60%左右。
1.3 样品采集与测定样品采集与处理:试验结束时,将收获的伴矿景天用自来水和去离子水洗净,吸水纸吸干水滴,置于烘箱中105 ℃杀青30 min、75 ℃烘至恒重,称重后用不锈钢植物粉碎机磨碎,备用。同时采集土样,风干、过100目尼龙筛,用于土壤中重金属全量的测定。
样品消化:称取0.200 0 g土壤样品,置于消煮罐内,加10 mL HCl-HNO3混合液(体积比为1:1);称取植物烘干样0.500 0 g,加入8 mL H2O2-HCl的混合溶液(体积比为1:3)。将样品置于105 ℃烘箱中消煮6 h,冷却后将消煮罐中的聚四氟乙烯坩埚放在电热板上进行赶酸,直至溶液剩余1 mL左右。将溶液转移、定容、过滤,测定元素浓度。
样品测定:植物与土壤消煮液中Ag采用电感耦合等离子体质谱仪(Varian Ultramass;Varian,Palo Alto,CA)测定,Cd采用石墨炉原子吸收分光光度计(Varian SpectrAA 220Z;Varian,Palo Alto,CA)测定,Zn采用火焰原子吸收分光光度计(Varian SpectrAA 220FS;Varian,Palo Alto,CA)测定。
测定过程的质控:土壤、植物测定过程采用国家标准参比物质(土壤:GBW07406;植物:GBW07603)进行质量控制,标准样品测定结果均在允许范围内。
1.4 富集系数和转移系数富集系数(Bioconcentration coefficient,BCF)指植物地上部重金属浓度与相应土壤中重金属浓度的比值;转运系数(Translocation coefficient,TF)是指植物地上部重金属浓度与地下部重金属浓度的比值。计算BCF、TF,两者可综合反映植物对土壤重金属的吸收和转运能力。
1.5 数据处理与分析试验数据采用Excel 2007和SPSS 19.0进行处理和作图,不同AgNPs处理间数据的差异性分析采用ANOVA方差分析,AgNPs +污泥与单独AgNPs处理之间的差异性进行t检验比较,显著性水平为0.05。
2 结果与分析 2.1 不同处理对伴矿景天地上部生物量变化的影响试验收获时每盆伴矿景天地上部干重与开始时扦插入盆栽的伴矿景天生物量干重的差值,为生物量增量。未添加污泥处理伴矿景天地上部生物量增量在3.25~4.46 g·盆-1之间,添加污泥的处理伴矿景天地上部生物量增量在1.20~2.13 g·盆-1之间(表 3)。不同浓度AgNPs处理下,伴矿景天地上部生物量增量无显著差异,但未添加污泥的各处理伴矿景天地上部生物量增量显著高于添加污泥的处理(P < 0.05)。
|
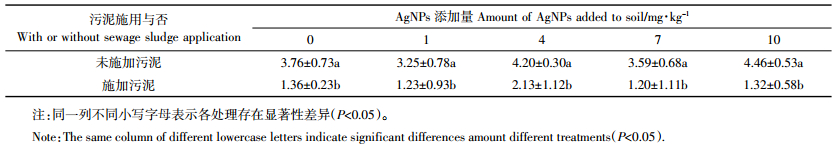
是否添加污泥对伴矿景天地上部Ag浓度未产生显著影响(表 4)。未添加污泥的各处理组,随AgNPs处理浓度的升高,伴矿景天地上部Ag浓度呈先降后升的现象。在1 mg·kg-1 AgNPs处理下,伴矿景天地上部Ag浓度达到最低值4.12 μg·kg-1;而10 mg·kg-1 AgNPs处理下,伴矿景天地上部Ag浓度达到最大值7.49 μg·kg-1,但各处理组间Ag浓度无显著差异。添加污泥的各处理,随着AgNPs浓度的升高,伴矿景天地上部Ag浓度呈现出与未添加污泥处理组相反的现象,在7 mg·kg-1 AgNPs处理组,伴矿景天地上部Ag浓度达到最大值7.49 μg·kg-1,但各处理间差异并不显著。
|
污泥添加与否对伴矿景天地上部Cd浓度影响明显,未添加污泥的各处理伴矿景天地上部Cd浓度均大于添加污泥的处理(表 4)。在未添加污泥的处理中,随着AgNPs浓度的升高,伴矿景天地上部Cd浓度有升高的现象,并在4 mg·kg-1 AgNPs处理时达到最大值20.3 mg·kg-1,但处理间差异不显著。在添加污泥的处理中,随着AgNPs浓度的升高,伴矿景天地上部Cd浓度出现了下降的现象,并在7 mg·kg-1 AgNPs浓度处理时达到了最小值9.79 mg·kg-1,各处理间差异也不显著。
未添加污泥时,伴矿景天地上部Zn浓度小于添加污泥的各处理(表 4),且随着AgNPs浓度的升高,其地上部Zn浓度有下降的现象,在4 mg·kg-1 AgNPs浓度下达到了最小值1655 mg·kg-1,但处理间差异不显著。在添加污泥的条件下,随着AgNPs浓度的升高,伴矿景天地上部Zn浓度也呈下降趋势,在7 mg·kg-1 AgNPs处理时达到最小值2014 mg·kg-1,各处理间差异亦不显著。
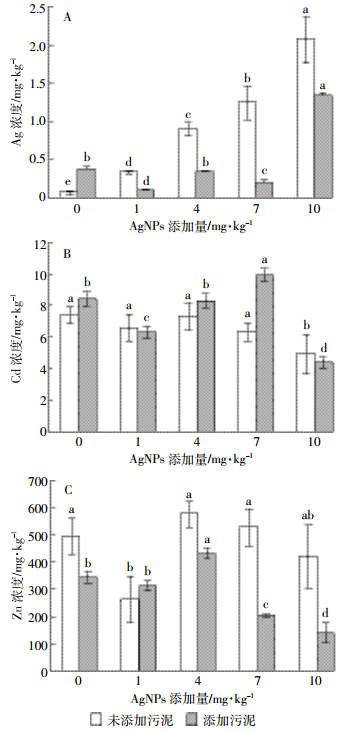
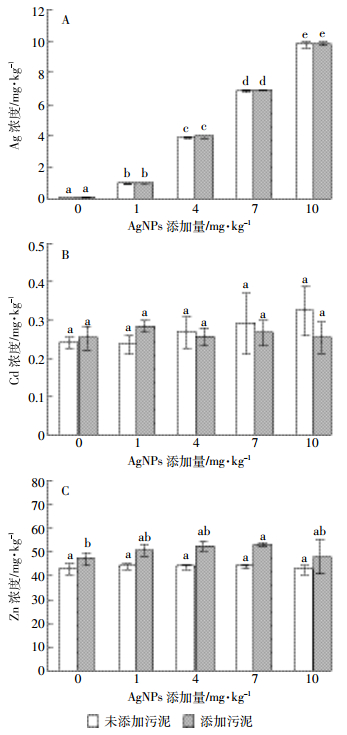
2.3 不同处理对伴矿景天根中重金属浓度变化的影响未添加污泥处理组,伴矿景天根中Ag浓度明显高于添加污泥的各处理(图 1),但污泥施用与否并未对伴矿景天根中Cd、Zn浓度产生显著影响。未添加污泥的各处理,随着AgNPs处理浓度的增大,伴矿景天根中Ag浓度呈明显上升趋势(图 1A);但Zn浓度则呈下降趋势,在1 mg·kg-1 AgNPs浓度处理时,根中Zn达到最小值261 mg·kg-1(图 1C);Cd浓度的变化趋势与Zn类似,当AgNPs浓度增加到10 mg·kg-1时,根中Cd达到最小值4.90 mg·kg-1(图 1B)。添加污泥的各处理,随着AgNPs浓度的增加,伴矿景天根中Ag浓度逐渐上升,各处理间差异显著(P < 0.05,图 1A);但Zn和Cd浓度都呈现先升高后下降的趋势,在AgNPs浓度达4 mg·kg-1时,根中Zn浓度达到最大值433 mg·kg-1;根中Cd浓度则是在AgNPs浓度达7 mg·kg-1时,达到最大值9.91 mg·kg-1(图 1B,1C)。
|
| 图 1 AgNPs对伴矿景天根部重金属浓度的影响 Figure 1 Effect of AgNPs on heavy metal concentrations in Sedum plumbizincicola root 图中不同小写字母表示各处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant differences (P < 0.05) among different treatments. The same below |
在伴矿景天收获后,土壤中Ag浓度随着AgNPs添加浓度的增加而升高(图 2A),但Cd和Zn浓度并未发生太大变化(图 2B,2C),与种植植物前供试土壤的Cd、Zn浓度相近。相同浓度的AgNPs处理中,添加污泥的各处理,其土壤中Ag和Zn浓度均高于未添加污泥的处理,Cd浓度与其正好相反。因此,本试验条件下AgNPs对伴矿景天对土壤Cd、Zn的吸收去除率无显著影响。
|
| 图 2 不同处理组土壤中重金属浓度 Figure 2 Heavy metal concentrations in soil of different treatments |
AgNPs对植物的毒害作用与AgNPs的粒径、浓度及氧化态Ag离子等有关。同时,进入土壤中的AgNPs会与土壤中的矿物质、有机质及土壤溶液发生反应,从而影响AgNPs的毒性。本研究发现,不同浓度AgNPs处理(0~10 mg·kg-1)并未对伴矿景天的生物量产生影响,与Wang等[19]的研究结果相似。也有研究发现,土培条件下,低浓度( < 20 mg·kg-1)AgNPs(15 nm)对黑麦草的生长有促进作用,高浓度(>20 mg·kg-1)AgNPs(15 nm)对黑麦草生长有抑制作用[18],表明AgNPs的植物毒性可能与AgNPs浓度有关。由于伴矿景天为超积累植物,可能对重金属的耐性较强,因而未对AgNPs表现出明显的毒害作用。有研究发现,添加污泥后小麦和油菜的生物量有明显的下降[20]。本研究也发现,添加污泥的处理组伴矿景天的生物量明显低于未添加污泥处理组。这可能是由于污泥是非常复杂的混合体,其中含有大量的有机质、病原菌等,污泥中毒害物质及AgNPs的双重作用对伴矿景天的生长产生了显著的抑制作用;或是添加污泥带入了大量微生物,这些微生物可能改变了土壤的理化性质,如离子和配体的浓度等,从而增加土壤中Ag离子释放,导致其毒性增强[21]。伴矿景天对AgNPs的毒性响应及机制还不甚清晰,有待深入研究。
3.2 AgNPs在伴矿景天根部的富集本试验发现,单独AgNPs处理并未明显增大伴矿景天地上部的Ag浓度,仅使Ag在伴矿景天根部累积,且随AgNPs处理浓度的增加,伴矿景天根中Ag浓度逐渐增大,最高达2.07 mg·kg-1,说明伴矿景天根系对AgNPs有吸收作用,但吸收的Ag并未向地上部转运。这种现象也有类似的文献报道,随着AgNPs(60~120 nm)浓度的增加,玉米根中Ag浓度逐渐增大,但地上部Ag仍低于检测限,说明AgNPs并没有通过玉米的根系转运到地上部[22]。AgNPs在植物体内的转运途径、机制目前尚不清楚,可能与植物种类、纳米材料粒径、暴露方式及作用时间等密切相关。由于金属具有氧化态和还原态,其在植物体内可能会经历不同的氧化还原过程。Yin等[23]发现,被包裹的AgNPs在多花黑麦草体内会发生氧化反应,并最终以氧化态形式存在。根据伴矿景天地上部、根及土壤中Ag浓度,计算得到伴矿景天根系对AgNPs的富集系数介于0.177~0.330之间,转运系数介于0.004 01~0.102之间。本课题组的污泥长期农用盆栽试验结果显示,供试水稻和小麦地上部对AgNPs的富集系数分别为0.003 04~0.015 1和0.009 03~0.014 1(本组未发表数据)。这表明植物根系对AgNPs有一定的吸收性,但无论是超积累植物还是普通农作物,其地上部AgNPs吸收性都很小。
3.3 AgNPs对伴矿景天Zn、Cd镉吸取修复作用的影响本试验结果显示,AgNPs的两种添加方式均未影响伴矿景天的Cd、Zn吸收性。这与AgNPs对玉米作用效应的研究结果一致,玉米地上部的N、Zn、Fe并未受到AgNPs添加的影响[22]。但也有报道称AgNPs可以降低向日葵对Cs的吸收[24]。污泥的添加却对伴矿景天Cd、Zn吸收产生相反的影响,施加污泥后伴矿景天地上部Cd浓度较未添加污泥处理有所降低,然而Zn的情况正好与Cd相反。这可能与元素本身的性质等复杂因素有关,其作用机制尚需进一步验证和研究。经计算得知,由于盆栽的种植时间较短,每盆植物带走的Cd和Zn量分别在0.011 1~0.030 2 mg和2.14~6.85 mg之间,仅为供试土壤重金属全量的2.62%~7.14%(Cd)、2.39%~7.65%(Zn),即伴矿景天的短时间吸取修复并未对土壤Cd、Zn总量产生影响。污泥源或外源直接施入的AgNPs对超积累植物的Ag、Cd及Zn吸收的长期影响尚需深入研究。
4 结论(1)无论污泥添加与否,AgNPs均未对Cd、Zn超积累植物伴矿景天产生毒害作用,不同AgNPs浓度处理对伴矿景天的生物量无显著影响,但污泥施用却显著降低了伴矿景天生物量。
(2)伴矿景天地上部对AgNPs吸收性很小。与添加污泥的处理组相比,未添加污泥的处理伴矿景天根中Ag浓度更高;AgNPs处理显著增加了根系对Ag的吸收,且各处理间差异显著(P < 0.05);但AgNPs对伴矿景天对Cd和Zn吸收并无显著影响。
(3)无论污泥添加与否,AgNPs均未对Cd、Zn超积累植物伴矿景天的Cd、Zn吸取修复效率产生影响。
| [1] | 曲晨, 刘伟, 荣海钦, 等. 纳米Ag的生物学特性及其潜在毒性的研究进展[J]. 环境与健康杂志, 2010, 27(9) : 842–845. QU Chen, LIU Wei, RONG Hai-qin, et al. Research advance on biological features and toxicities of silver nanoparticles[J]. Journal of Environment and Health, 2010, 27(9) : 842–845. |
| [2] | Benn T M, Westerhoff P. Nanoparticles silver released into water from commercially available sock fabrics[J]. Environment Science & Technology, 2008, 42 : 4133–4139. |
| [3] | Blaser S A, Scheringer M, Macleod M, et al. Estimation of cumulative aquatic exposure and risk due to silver:Contribution of nano-functionalized plastics and textiles[J]. Science of the Total Environment, 2008, 390(Suppl 2/3) : 396–409. |
| [4] | 林道辉, 冀静, 田小利, 等. 纳米材料的环境行为与生物毒性[J]. 科学通报, 2009, 54(23) : 3590–3604. LIN Dao-hui, JI Jing, TIAN Xiao-li, et al. Environmental behavior and toxicity of engineered nanomaterials[J]. Chinese Science Bulletin, 2009, 54(23) : 3590–3604. DOI:10.1360/972009-2075 |
| [5] | Kaegi R, Voegelin A, Sinnet B, et al. Behavior of metallic silver nanoparticles in a pilot wastewater treatment plant[J]. Environmental Science & Technology, 2011, 45(9) : 3902–3908. |
| [6] | USEPA Targeted national sewage sludge survey statistical analysis[EB/OL]. http://water.epa.gov/scitech/wastetech/biosolids/upload/TNSSS_stat_appendix-A-Apr-2009.pdf (accessed 07/04/2015). |
| [7] | 周东美. 纳米Ag粒子在我国主要类型土壤中的迁移转化过程与环境效应[J]. 环境化学, 2015, 34(4) : 605–613. ZHOU Dong-mei. Transport and transformation of nano-Ag particle in soils and its environmental effects[J]. Environmental Chemistry, 2015, 34(4) : 605–613. |
| [8] | Ge Y, Schimel J P, Holden P A. Evidence for negative effects of TiO2 and ZnO nanoparticles on soil bacterial communities[J]. Environment Science & Technology, 2011, 45 : 1659–1664. |
| [9] | 金盛杨, 王玉军, 汪鹏, 等. 纳米与微米CuO及Cu2+对土壤脲酶的生态毒性比较研究[J]. 生态毒理学报, 2010, 5(6) : 835–841. JIN Sheng-yang, WANG Yu-jun, WANG Peng, et al. Comparative ecotoxicity of nanometer-, micrometer-Sized CuO and ionic copper to soil urease[J]. Asian Journal of Ecotoxicology, 2010, 5(6) : 835–841. |
| [10] | Jemec A, Drobne D, Remskar M, et al. Effects of increased nano-sized titanium dioxide on terrestrial isopods (Porcellio scaber)[J]. Environmental Toxicology and Chemistry, 2008, 27 : 1904–1914. DOI:10.1897/08-036.1 |
| [11] | 胡长伟, 崔益斌, 李丁生, 等. 纳米ZnO与TiO2对赤子爱胜蚓(Eisenia foetida) 的毒性效应[J]. 生态毒理学报, 2011, 6(2) : 200–206. HU Chang-wei, Cui Yi-bin, Li Ding-sheng, et al. Ecototoxicological effect of ZnO and TiO2 nanoparticles on Earthworm (Eisenia foetida)[J]. Asian Journal of Ecotoxicology, 2011, 6(2) : 200–206. |
| [12] | Lin D, Xing B. Root uptake and phyotoxicity of ZnO nanoparticles[J]. Environment Science & Technology, 2008, 42 : 5580–5585. |
| [13] | Stampoulis D, Sinha S K, White J C. Assay-dependent phytotoxicity of nanoparticles to plants[J]. Environment Science and Technology, 2009, 43 : 9473–9479. DOI:10.1021/es901695c |
| [14] | 吕继涛, 张淑贞. 人工纳米材料与植物的相互作用:植物毒性、吸收和传输[J]. 化学进展, 2013, 25(1) : 156–160. LÜ Ji-tao, ZHANG Shu-zhen. Interactions between manufactured nanomaterials a phytotoxicity, uptake and translocation[J]. Progress in Chemistry, 2013, 25(1) : 156–160. |
| [15] | Lee C W, Mahendra S, Zodrow K, et al. Developmental phytotoxicity of metal oxide nanoparticles to Arabidopsis thaliana[J]. Environmental Toxicology and Chemistry, 2010, 29(3) : 669–675. DOI:10.1002/etc.v29:3 |
| [16] | Oukarroum A, Barhoumi L, Pirastru L, et al. Silver nanoparticle toxicity effect on growth and cellular viability of the aquatic plant Lemna gibba[J]. Environmental Toxicology and Chemistry, 2013, 32(4) : 902–907. DOI:10.1002/etc.2131 |
| [17] | Dimkpa C O, McLean J E, Martineau N, et al. Silver nanoparticles disrupt wheat (Triticum aestivum L.) growth in a sand matrix[J]. Environmental Science & Technology, 2013, 47(2) : 1082–1090. |
| [18] | 王荣, 刘艳丽, 张民, 等. 纳米Ag对黑麦草生长特性的影响[J]. 农业环境科学学报, 2015, 34(4) : 639–645. WANG Rong, LIU Yan-li, ZHANG Min, et al. Effects of nano-silver on growth characteristics of perennial ryegrass[J]. Journal of Agro-Environment Science, 2015, 34(4) : 639–645. |
| [19] | Peng Wang, Neal W M, Paul G D, et al. Silver Nanoparticles entering soils via the wastewater sludge soil pathway pose low risk to plants but elevated Cl concentrations increase Ag bioavailability[J]. Environmental Science & Technology, 2016, 50 : 8274–8281. |
| [20] | Ae P D R, Castillo-Michel H A, Kaegi R, et al. Fate of Ag-NPs in sewage sludge after application on agricultural soils[J]. Environmental Science & Technology, 2016, 50 : 1759–1768. |
| [21] | Hinsinger, P. Bioavailability of trace elements as related to root induced chemical changes in the rhizosphere[J]. Trace Elements in the Rhizosphere, 2001 : 25–41. |
| [22] | 王卫中.丛枝菌根影响纳米氧化锌和纳米Ag对玉米的生物效应[D].河南科技大学, 2014. WANG Wei-zhong. Arbuscular mycorrhizal symbiosis influences the biological effects of nano-ZnO and nano-Ag on maize[D]. Hebei University of Science and Technology, 2014. |
| [23] | Yin L, Cheng Y, Espinasse B, et al. More than the Ions:The effects of silver nanoparticles on Lolium multiflorum[J]. Environmental Science & Technology, 2011, 45(6) : 2360–2370. |
| [24] | Elssner G, Korn D, Rühle M. The influence of interface impurities on fracture energy of UHV diffusion bonded metal-ceramic bicrystals[J]. Scripta Metallurgica Et Materialia, 1994, 31(8) : 1037–1042. DOI:10.1016/0956-716X(94)90523-1 |
 2017, Vol. 36
2017, Vol. 36