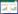文章信息
- 文嘉, 曾光明, 安赫, 贾民娟, 易元杰, 彭志龙
- WEN Jia, ZENG Guang-ming, AN He, JIA Min-juan, YI Yuan-jie, PENG Zhi-long
- 改性沸石改良底泥对土壤中微生物生物量碳及酶活性的影响
- Effects of zeolite-modified sediment on microbial biomass carbon and enzyme activity in soil
- 农业环境科学学报, 2017, 36(2): 302-307
- Journal of Agro-Environment Science, 2017, 36(2): 302-307
- http://dx.doi.org/10.11654/jaes.2016-1152
文章历史
- 收稿日期: 2016-09-07
2. 环境生物与控制教育部重点实验室(湖南大学), 长沙 410082
2. Key Laboratory of Environmental Biology and Pollution Control (Hunan University), Ministry of Education, Changsha 410082, China
重金属具毒性强、易积累、难降解等特性,在环境中备受关注。由于具有较大的比表面及含有大量活性官能团,底泥成为重金属污染物的主要载体[1]。底泥中的重金属毒性主要取决于重金属的形态。如果能消除底泥中的重金属对水体和底栖生物的作用,则能有效降低污染底泥的环境影响。当前国内外对河流污染物的修复主要有原位固定、原位处理、异位固定、异位处理4种方法[2]。国内成功修复底泥、水体的例子还不多见,效仿发达国家那样花大量资金通过疏浚来修复底泥还不现实,而化学修复又容易造成二次污染,不利于环境治理的可持续发展[3]。将底泥单纯堆放而不采取任何措施,不仅会占用大量土地,而且很容易会随着降雨降雪的冲刷作用产生二次污染。除此之外,底泥中的有益成分不能得到充分利用,也浪费了资源。
沸石是一类具有开旷格架的铝硅酸盐矿物,它的骨架最基本单元结构是硅氧四面体和铝氧四面体[4]。沸石对于尺寸小于其孔径的分子有较高的选择性,因此具有分子筛的作用。沸石在土壤养分状况改善、盐碱地改良、土壤物理性状改善和污染土壤修复等方面的应用受到广泛关注,国内外学者也对沸石处理重金属污染进行了相关研究[5-8]。若用沸石来改良底泥,不仅可以利用底泥丰富的有机质来作为土壤养分,也能实现底泥资源化,解决底泥出路。天然沸石对土壤中重金属有较好的吸附效果,但其本身孔隙大小局限,吸附量有限。通过化学方法对沸石的表面进行改性,可以使改性沸石对重金属的吸附性能高于天然沸石[9],其中NaCl改性可以疏通沸石孔道,除去表面杂质[9]。壳聚糖是甲壳素的脱乙酰基产物,内含羟基、氨基等活性官能团,具有较强的与金属离子配位的能力,可与重金属形成螯合物,也是一种常见的表面改性剂[10-12]。
本项目组前期研究表明,改性后的沸石能有效稳定底泥中的重金属,减少重金属的潜在毒性[9]。在利用沸石改良底泥的过程中,需要注意其对土壤性质和生态环境的影响。土壤的微生物环境对外源添加物十分敏感,是测试其生态毒性的主要参考。然而,国内外对沸石改良底泥对土壤微生物环境的研究还未见报道。本研究旨在解决底泥资源化问题,采用NaCl和壳聚糖两种改性剂对天然沸石进行了表面改性,并初步探究添加改性沸石的底泥对土壤微生物量及两种酶(脲酶和脱氢酶)活性的影响。
1 材料与方法 1.1 材料沸石来自河南巩义某矿山,粒度为0.5~1 mm,主要成分为斜发沸石。
供试底泥来自湖南岳阳东洞庭湖枯水期表层底泥(0~10 cm)。采集后迅速密封,遮光储存,冷藏备用。供试底泥的基本理化性质见表 1。
供试土壤来自城郊居民自留地的耕作土,主要土壤类型为红壤。采集0~20 cm表层土壤样品,室温风干,研磨过2 mm筛,备用。实验用土壤的基本理化性质见表 1。
1.2 底泥的地质累积指数地累积指数(Geo-accumulation Index,Igeo)是用于评价底泥重金属污染的地质化学标准[13]。通过比较现有和工业前地区重金属浓度来评价其污染程度,计算公式为:
Igeo=log2(Cn/1.5Bn)
式中:Cn是元素n的现有浓度,mg·kg-1;Bn是元素n的地质化学背景浓度,mg·kg-1;1.5是微量金属的岩性变异参数。
洞庭湖地区Cu、Pb、Zn、Cd的背景浓度分别为20.2、23.3、83.3、0.33 mg·kg-1[14]。Igeo的分级评价标准为: < 0,无污染;0~1,无污染至中度污染;1~2,中度污染;2~3,中度至重污染;>3,重污染。根据计算,供试底泥中Cu、Zn和Pb的Igeo分别为0.375、0.155和0.845(图 1),均处于无污染至中度污染范围;Cd的浓度严重超出历史背景浓度,其Igeo指数为3.36,达到重度污染水平。

|
| 图 1 供试底泥的地累积指数 Figure 1 Geo-accumulation index of the sediment |
分别取2份各25 g粒径0.5~1 mm的天然沸石放入锥形瓶中,加入250 mL浓度为1 mol·L-1的NaCl溶液,把锥形瓶放入振荡器中(100 r·min-1)振荡3 h,再置于恒温水槽中,控制水浴温度在90 ℃条件下反应4 h。用去离子水洗涤3遍后再重复一次上述实验。实验结束后取出沸石用去离子水洗涤5遍,于105 ℃烘干,并测试NaCl改性沸石在纯水中的pH(固液比1:2.5)。
1.3.2 壳聚糖改性沸石的制备[11-12]天然沸石清洗后用1 mol·L-1 HNO3振荡浸泡4 h,取出并冲洗。称取4.0 g壳聚糖和4.0 g上述经过前处理的沸石至烧杯中,加入320 mL 5%的乙酸溶液并在100 r·min-1下搅动3 h;用滴管将壳聚糖-沸石复合水凝胶逐滴加入至500 mL 0.5 mol·L-1 NaOH溶液中,于100 r·min-1下持续搅动3 h;将沉淀过滤出来,用蒸馏水洗脱,自然风干后备用,并测试壳聚糖改性沸石在纯水中的pH(固液比1:2.5)。
1.3.3 沸石性质表征采用X射线衍射仪(XRD)检验NaCl和壳聚糖改性后沸石的矿质成分,并用N2吸附法测试分析两种改性沸石的BET比表面积和孔径。改性沸石的表面特征采用扫描电镜(SEM)进行测定。
1.4 土壤培育将两种改性沸石和底泥混合,形成按比例1/9、3/7、6/4(干质量)的混合物,再将此混合物与土壤按1:3(干质量)的比例混匀,添加去离子水保持含水率为30%。将改良底泥-土壤混合物置于烧杯中于阴暗通风处培育1个月。
1.5 土壤可溶性重金属的测定土壤中可溶性重金属的测定方法参照Alvarenga等[15]的研究。将培育后分别添加了改良底泥(实验组)和未改良底泥(对照组)的土壤混合物风干,过2 mm筛,置于锥形瓶中按1:10的土水比添加去离子水,于往复振荡器上振荡24 h(100 r·min-1)。滤液经离心收集后过0.45 μm聚醚砜膜,用电感耦合等离子发射光谱仪(ICP-AES,PS-6,Baird)测定金属Cu、Pb、Zn、Cd的浓度,同时测定实验组和对照组混合物水溶液的pH。
1.6 微生物生物量碳、氮的测定实验组和对照组中微生物生物量按照氯仿熏蒸浸提法(FE)进行测定[16]。底泥-土壤混合物经氯仿熏蒸24 h后,被杀死的微生物生物量以一定比例被0.5 mol·L-1 K2SO4溶液提取。提取液中的有机碳用总有机碳测定仪(TOC-VCPH,日本岛津)测定。土壤微生物生物量碳以熏蒸和未熏蒸土壤提取液中有机碳的差值除以转换系数得到,土壤微生物生物量碳转换系数取0.38。同样采用熏蒸浸提法测土壤微生物生物量氮,浸提液中的氮采用消煮法测定,土壤微生物量氮转换系数取0.45。
1.7 生物酶活性的测定提取实验组和对照组土壤中脲酶和脱氢酶的成分,于紫外分光光度计上进行测定。其中,脲酶活性采用尿素残留法[16],脱氢酶活性采用氯化三苯基四氮唑(TTC)还原法[15]。
1.8 分析质量控制与数据处理各实验样品均进行三次平行测定,并设试剂空白实验。实验数据以Origin 9.0软件进行作图和显著性分析。对数据间的显著差异性以Fisher单因素方差分析进行检验(P < 0.05)。
2 结果与讨论 2.1 改性沸石表征天然沸石经NaCl和壳聚糖改性后,其纯水的pH值由原来的7.50分别上升至8.17和8.05。两种改性沸石的矿物成分见图 2。由于特征峰没有发生变化,沸石改性后的晶形结构没有改变。改性后斜发沸石成分吸收峰增强,其他杂质峰有消除和削减。NaCl改性沸石的比表面积、孔容和孔径较天然沸石有所增加(表 2),表明NaCl改性净化了沸石的孔道和表面。壳聚糖改性使沸石的比表面积增加至原来的1.6倍,而孔径减小至原来的80%。酸化后的沸石颗粒与壳聚糖反应的过程中,壳聚糖可以与沸石互相交联,并覆盖于沸石表面。Peng等[10]发现,使用更高浓度的壳聚糖对沸石进行改性,壳聚糖的孔径也相应减小了5%。通过扫描电镜对改性后的沸石进行扫描分析(图 3),发现NaCl改性沸石具有较天然沸石更大的孔径,表面更干净,而壳聚糖改性沸石可观察到在沸石表面附着的壳聚糖物质。

|
| 图 2 未改性与改性沸石的XRD Figure 2 XRD image of the unmodified and modified zeolite 1.斜发沸石;2.蒙脱石;3.石英;4.白榴石;5.铁辉石 1.Clinoptilolite; 2.Montmorillonite; 3.Quartz; 4.Leucite; 5.Ferrosilite |

|
| 图 3 天然沸石(左)、氯化钠改性沸石(中)和壳聚糖改性沸石(右)的扫描电镜图 Figure 3 Scanning electronic microscopy of natural zeolite (left), NaCl-modified zeolite (middle) and chitosan-modified zeolite (right) |
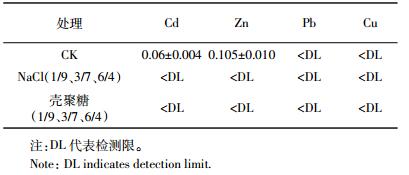
未改良底泥与土壤混合物中水溶态金属浓度分别为Cd(0.06±0.004)mg·kg-1、Zn(0.105±0.010)mg·kg-1,Pb和Cu的浓度在检测限以下(表 3)。经改良底泥处理后的滤出液金属浓度均在检测限以下,表明NaCl和壳聚糖改性沸石的添加都有效减少了混合物中水溶态重金属的含量。从滤出液的pH中可以观察到,施加了两种改性沸石的底泥虽然表观上提高了土壤pH 0.2~0.4个单位,但并无显著性差异(表 4)。两种改性沸石均呈碱性,故将改性沸石添加至底泥和土壤的混合物中,可以提高土壤pH。但因为与对照相比并无显著性差异,所以水溶态金属离子含量的减小并非直接由于土壤碱度增加而使金属离子钝化,可能是由于改性沸石的吸附性和离子交换性,使得这部分活性金属的含量减小,降低了其直接毒性[9]。
|

|
土壤微生物生物量(包括土壤微生物生物量碳和氮)是土壤有机质中最活跃和最易变化的部分,其变化可直接或间接地反映土壤耕作制度和土壤肥力的变化,也可反映土壤污染的程度[16]。从本实验土壤的微生物量碳的数据(表 4)来看,只有NaCl改性沸石投加量为3/7改良后的底泥中有明显增加的微生物生物量碳(P < 0.05),壳聚糖改性沸石处理的土壤-底泥混合物中的微生物生物量碳亦有一定增加的趋势(最高增幅为9%),而两种改性沸石处理后的底泥土壤混合物中的微生物量氮均呈减小趋势,表明土壤中氮的生物利用性降低。在NaCl改性沸石投加的混合物中,钠盐的存在可能会对微生物的生长有一定的抑制作用,体现在其能减缓土壤氮的硝化过程,促使氨氮的积累[17],而沸石对氨氮具有强烈的吸附作用[18],因此可能会造成微生物所利用氮素的减少。在壳聚糖改性沸石处理的混合物中出现的微生物量碳和氮增长趋势不一致的情况,其原因比较复杂。尽管壳聚糖的存在能为土壤提供氮源,促进微生物生物量碳和氮的增长[19],但彭桂香等[20]发现单纯添加沸石的土壤中微生物量碳呈增加而微生物量氮呈减小趋势。由于本实验中所用的是壳聚糖附加在沸石上生成的产物,产生这种微生物量碳、氮增长不一致的表现是受壳聚糖和沸石共同影响控制的结果。我们认为可能是沸石对土壤中氨氮的吸附影响大于壳聚糖作为氮源的影响,导致了微生物量氮的减少,但还需要进一步研究证实。两种改良底泥均有效增加了土壤中微生物量C/N比,最高的C/N比出现在壳聚糖改性沸石/底泥=6/4的处理组中。土壤的改良效果越好,则土壤微生物量C/N比越高[20]。
土壤的酶活性对重金属高度敏感,因此被作为一种标准的生化指数来评价土壤污染的状况[15]。脲酶是肽和氨基的水解酶,能水解含氮有机物、矿化氮素、催化尿素水解成二氧化碳和氨[21]。脲酶与土壤中的氮循环相关。与对照组相比,三种投加量梯度的NaCl改性沸石改良后的底泥并没有提高土壤中脲酶的活性,NaCl改性沸石投加量为3/7和6/4的土壤中脲酶活性甚至分别显著降低了13.5%和19.0%(P < 0.05)。NaCl改性沸石为混合物带来了更多的钠盐,且其含量与土壤中的脲酶活性呈显著负相关[22]。含壳聚糖改性沸石的底泥处理的土壤中,只有高沸石投加量(6/4)的处理,土壤中脲酶活性增加了11.0%(P < 0.05),其他处理组对脲酶活性影响均不明显。
脱氢酶是一种只存在于活性细胞中的氧化还原酶,因此脱氢酶活性代表着土壤中活性微生物的平均活度[23]。与其他土壤参数相比,脱氢酶对土壤中重金属的影响更为敏感[24-25]。Garau等[26]曾报道天然沸石的添加对重金属污染土壤中的脲酶活性影响不明显,但却大幅提高了脱氢酶的活性,而添加NaCl改性沸石的土壤中脱氢酶活性与对照组相比并不显著。壳聚糖改性沸石处理的底泥-土壤混合物中脱氢酶的活性更强(P < 0.05),其中壳聚糖6/4处理组的脱氢酶活性提高至对照组的1.6倍。两种改性沸石改良底泥相比,壳聚糖改性沸石处理组中的各项指标均优于NaCl改性沸石处理组。这可能是由于:其一,壳聚糖本身作为一种重金属螯合剂能络合底泥和土壤中的重金属,减小活性重金属的比例,从而降低重金属的毒性效应,促进了土壤中微生物生长[27];其二,壳聚糖可以作为一种碳源供给土壤中微生物,满足其生长需要,促进土壤微生物的快速繁殖,使得微生物量碳大幅增加,刺激了土壤酶的活性[18]。
3 结论通过将NaCl和壳聚糖改性沸石改良的底泥与土壤进行作用,获得一种资源化利用重金属污染底泥的方法。两种改良底泥均没有增加土壤中水溶态重金属Cu、Zn、Pb和Cd的含量。此外,两种改良底泥的施加对土壤中C/N比均有正效应,对土壤有一定程度的改良效果。壳聚糖改性沸石改良后的底泥对土壤微生物及酶活性的影响更为明显,土壤中微生物生物量碳和脲酶、脱氢酶活性随沸石投加量的增加呈递增趋势,因而对土壤的改良效果更优。后期实验将对土壤中其他种类酶活性、植物生长情况、金属长期淋溶情况进行研究,以期综合评价沸石分子筛改良底泥的生态效应及其回田利用的可行性。
| [1] | Chen F, Taylor W D, Anderson W B, et al. Application of fingerprint-based multivariate statistical analyses in source characterization and tracking of contaminated sediment migration in surface water[J]. Environmental Pollution, 2013, 179(2) : 224–231. |
| [2] | 李明明, 甘敏, 朱建裕, 等. 河流重金属污染底泥的修复技术研究进展[J]. 有色金属科学与工程, 2012, 3(1) : 67–71. LI Ming-ming, GAN Min, ZHU Jian-yu, et al. Remediation technology for river sediment polluted by heavy metals[J]. Nonferrous Metals Science and Engineering, 2012, 3(1) : 67–71. |
| [3] | 赵新华, 马伟芳, 孙井梅, 等. 植物修复重金属-有机物复合污染河道疏浚底泥的研究[J]. 天津大学学报, 2005, 38(11) : 1011–1016. ZHAO Xin-hua, MA Wei-fang, SUN Jing-mei, et al. Phytoremediation of heavy metal-organic complex in dredged sewage river sediment[J]. Journal of Tianjin University, 2005, 38(11) : 1011–1016. |
| [4] | Breck D W. Recent advances in zeolite science[M]//Flaginen E M, Sand L B. Molecular sieve zeolites. Washington D.C.:American Chemical Society, 1974:1-19. |
| [5] | Humidpour M, Afyuni M, Kalbasi M, et al. Mobility and plant-availability of Cd (Ⅱ) and Pb (Ⅱ) adsorbed on zeolite and bentonite[J]. Applied Clay Science, 2010, 48(3) : 342–348. DOI:10.1016/j.clay.2010.01.004 |
| [6] | Li J X, Wee C, Sohn B. Effect of ammonium-and potassium-loaded zeolite on kale (Brassica alboglabra) growth and soil property[J]. American Journal of Plant Sciences, 2013, 4(10) : 1976–1982. DOI:10.4236/ajps.2013.410245 |
| [7] | Shi W Y, Shao H B, Li H, et al. Progress in the remediation of hazardous heavy metal-pollute soils by natural zeolite[J]. Journal of Hazardous Materials, 2009, 170(1) : 1–6. DOI:10.1016/j.jhazmat.2009.04.097 |
| [8] | Ashmawy A M, Ibrahim H S, Moniem S M A, et al. Immobilization of some metals in contaminated sludge by zeolite prepared from local materials[J]. Toxicology and Environmental Chemistry, 2012, 94 : 1657–1669. DOI:10.1080/02772248.2012.727819 |
| [9] | Wen J, Yi Y J, Zeng G M. Effects of modified zeolite on the removal and stabilization of heavy metals in contaminated lake sediment using BCR sequential extraction[J]. Journal of Environmental Management, 2016, 178 : 63–69. DOI:10.1016/j.jenvman.2016.04.046 |
| [10] | Peng S, Zeng Q H, Guo Y C, et al. Defluoridation from aqueous solution by chitosan modified natural zeolite[J]. Journal of Chemical Technology & Biotechnology, 2013, 88(9) : 1707–1714. |
| [11] | Wan Ngah W S, Teong L C, Toh R H, et al. Comparative study on adsorption and desorption of Cu (Ⅱ) ions by three types of chitosan-zeolite composites[J]. Chemical Engineering Journal, 2013, 223(5) : 231–238. |
| [12] | 任刚, 余燕, 彭素芬, 等. 沸石和改性沸石对孔雀绿(MC) 和磺化若丹明(LR) 的吸附特性[J]. 环境化学, 2015, 34(2) : 367–376. REN Gang, YU Yan, PENG Su-fen, et al. Adsorption of malachite green (MG) and lissamine rhadamine (LR) on natural and modified zeolite[J]. Environmental Chemistry, 2015, 34(2) : 367–376. |
| [13] | Müller G. Index of geoaccumulation in sediments of the Rhine River[J]. Geochemical Journal, 1969(2) : 108–118. |
| [14] | Li J, Zeng B W, Chang L C, et al. Studies on environmental background levels in waters of Dongting Lake system[J]. Chinese Journal of Environmental Science, 1986(7) : 62–68. |
| [15] | Alvarenga P, Palma P, Gonçalves A P, et al. Organic residues as immobilizing agents in aided phytostabilization:(Ⅱ) Effects on soil biochemical and ecotoxicological characteristics[J]. Chemosphere, 2009, 74(10) : 1301–1308. DOI:10.1016/j.chemosphere.2008.11.006 |
| [16] | 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999. LU Ru-kun. Soil agrochemical analytical method[M]. Beijing: China Agricultural Science & Technology Press, 1999. |
| [17] | Azam F, Ifzal M. Microbial populations immobilizing NH4+-N and NO3-N differ in their sensitivity to sodium chloride salinity in soil[J]. Soil Biology and Biochemistry, 2006, 38(8) : 2491–2494. DOI:10.1016/j.soilbio.2006.01.028 |
| [18] | Jha V K, Hayashi S. Modification on natural clinoptilolite zeolite for its NH4+ retention capacity[J]. Journal of Hazardous Materials, 2009, 169(1/2/3) : 29–35. |
| [19] | 张文清, 吕伟娇, 陈强, 等. 不同分子量壳聚糖对土壤碳、氮及呼吸的影响[J]. 生态学报, 2006, 26(4) : 1280–1284. ZHANG Wen-qing, LÜ Wei-jiao, CHEN Qiang, et al. The effect of molecular weight of chitosan on soil's carbon, nitrogen and soil respiration[J]. Acta Ecologica Sinica, 2006, 26(4) : 1280–1284. |
| [20] | 彭桂香, 蔡婧, 林初夏. 超积累植物和化学改良剂联合修复锌镉污染土壤后的微生物特征[J]. 生态环境, 2005, 14(5) : 654–657. PENG Gui-xiang, CAI Jing, LIN Chu-xia. Microbial characteristics of a Zn and Cd contaminated soil chemically amended for growth of a heavy metal-hyperaccumulating plant[J]. Ecology and Environment, 2005, 14(5) : 654–657. |
| [21] | 王圣瑞. 湖泊沉积物-水界面过程:基本理论与常用测定方法[M]. 北京: 科学出版社, 2014: 149-150. WANG Sheng-rui. Sediment-water interface process of lakes:Theories and methods[M]. Beijing: Science Press, 2014: 149-150. |
| [22] | Garcia C, Hernandez T. Influence of salinity on the biological and biochemical activity of a calciorthird soil[J]. Plant and Soil, 1996, 178(2) : 255–263. DOI:10.1007/BF00011591 |
| [23] | Oliveira A, Pampulha M E. Effects of long-term heavy metal contamination on soil microbial characteristics[J]. Journal of Bioscience and Bioengineering, 2006, 102(3) : 157–161. DOI:10.1263/jbb.102.157 |
| [24] | Tabatabai M A. Soil enzymes[M]//Mickelson S H, Bigham J M. Methods of soil analysis. Part 2:Microbiological and biochemical properties. Wisconsin:Soil Science Society of America, 1994:775-833. |
| [25] | Lenhard G. Dehydrogenase activity as criterion for determination of toxic effects on biological purification system[J]. Hydrobiologia, 1965, 25(1) : 1–8. |
| [26] | Garau G, Castaldi P, Santona L, et al. Influence of red mud, zeolite and lime on heavy metal immobilization, culturable heterotrophic microbial populations and enzyme activities in a contaminated soil[J]. Geoderma, 2007, 142(1/2) : 47–57. |
| [27] | Zhang L, Zeng Y X, Cheng Z J. Removal of heavy metal ions using chitosan and modified chitosan:A review[J]. Journal of Molecular Liquids, 2016, 214 : 175–191. DOI:10.1016/j.molliq.2015.12.013 |
 2017, Vol. 36
2017, Vol. 36