文章信息
- 卢闯, 逄焕成, 张建丽, 燕守伟, 王婧, 李玉义
- LU Chuang, PANG Huan-cheng, ZHANG Jian-li, YAN Shou-wei, WANG Jing, LI Yu-yi
- 增施磷肥对重度盐碱地食葵生长及土壤微生物区系的影响
- Effect of phosphorus application rates on sunflower growth and soil microflora in severe saline land
- 农业环境科学学报, 2017, 36(2): 329-337
- Journal of Agro-Environment Science, 2017, 36(2): 329-337
- http://dx.doi.org/10.11654/jaes.2016-1024
文章历史
- 收稿日期: 2016-08-10
2. 北京理工大学生命学院, 北京 100081
2. School of Life Science, Beijing Institute of Technology, Beijing 100081, China
磷在土壤中主要以无机态存在,盐渍土以其碱性环境,使大量的磷素被土壤固定转化形成无效磷,因此土壤缺磷和盐碱化是比较常见且同时存在的胁迫因素。了解作物在这两种胁迫因素耦合作用下的生长状况及其对生理指标、养分离子吸收的影响,对提高作物磷利用效率和耐盐性调控具有重要意义[1]。但是,由于盐碱地复杂的理化性质,施磷条件下作物对不同程度和不同类型盐碱地的敏感性有所不同。例如,某些作物(如番茄和小麦)的耐盐性常随磷水平的提高而提高[2-3];还有些作物(如大豆)的耐盐性则随磷水平的提高而下降[1, 4]。即使是同一作物,在不同的条件下,其耐盐性对磷水平变化的反应也有所不同[5]。向日葵(Helianthus annuus)是一年生喜温耐旱、需磷量较多的植物,且具有较强的耐盐性(土壤含盐量在0.4%能出全苗)。邓力群等[6]研究表明,增施磷肥对滨海盐土上油葵产量有很大的影响,随着磷肥用量的增加,高盐土上油葵的产量逐步接近低盐土,但过多施磷将使油葵生长受阻,植株早熟,导致产量下降。迄今,对于食葵盐磷交互作用报道较少,特别是在重度盐胁迫下施磷对食葵叶片酶活性等耐盐生理指标及植株磷吸收积累的影响尚缺乏深入研究。
磷是土壤微生物生长必需的营养元素,国内外关于磷对土壤微生物影响的研究已有报道,但因地域、种植方式、试验持续时间等因素的差异,研究结论表现出较大变异,甚至出现不一致的结果[7-8]。Raiesi等[9]研究表明土壤微生物生长显著受外源磷素施用影响;牛世全等[10]研究发现甘肃河西地区盐碱地中有效磷与微生物数量、酶活性的关系较氮更密切;唐宏亮等[11]研究认为,短期高磷施用能够显著增加土壤微生物对碳源的利用,在一定程度上能够提高土壤微生物群落功能多样性。但针对干旱区重度盐碱地种植食葵增施磷肥后土壤微生物区系及优势菌群的变化尚不清楚。
内蒙古河套灌区自然地理条件特殊,水盐问题复杂,迄今该区仍有盐碱地34.53万hm2,盐荒地27.50万hm2,盐碱地面积大、盐渍程度重,成为影响当地农业经济、生态环境和社会发展的突出问题。但长期以来,农民对盐碱地食葵施磷缺乏认识,影响食葵产量和品质的进一步提升。本研究重点研究内蒙古河套灌区重度盐碱地增施磷肥对食葵叶片酶活性、干物质积累及植株磷吸收的影响,并探讨施磷肥后土壤微生物区系及优势菌群变化特征,为指导当地盐碱地改良和磷肥合理施用提供依据。
1 材料与方法 1.1 试验区概况试验于2011年5-10月在内蒙古五原县新公中镇永联村义长灌域管理局试验站进行(41.07°N,108.00°E,海拔1022 m)。该地区属于中温带季风气候,全年日照时数3263 h,年均温6.1 ℃,无霜期117~136 d,年蒸发量大,蒸降比较高,冬春季土壤盐分表聚现象严重。作物生长期地下水埋深变幅为1.10~1.70 m,2011年试验区总降水量为76.3 mm。试验区0~100 cm土壤质地为粉沙壤土,平均容重为1.45~1.50 g·cm-3。0~20 cm土壤含盐量为7.23 g·kg-1,pH 8.51,按盐土分类为氯化物-硫酸盐土,0~20 cm土层质地构成:砂粒35.86%、粉粒53.63%、粘粒10.51%,有机质9.21 g·kg-1,全氮0.55 g·kg-1,碱解氮31.89 mg·kg-1,全磷0.70 g·kg-1,速效磷6.93 mg·kg-1,全钾18.3 g·kg-1,速效钾113.76 mg·kg-1。根据当地划分标准,试验地属于重度盐碱且低磷土壤。
1.2 试验设计试验采用大田筒栽方法,试验实施前,将PVC管(壁厚5 mm、长120 cm、内径40 cm)下端插入土中100 cm,上端高出地表20 cm,便于浇水。管内0~20 cm和20~40 cm土壤均为试验地内相同层次的土壤,40~100 cm为原状土。为了使试验土壤基底值一致,将0~20 cm和20~40 cm的土壤分别挖出混匀后再依次回填、压实,但不必压实到原土层高度,可保持一定的疏松度,以利出苗及根系生长。12根筒口中心间距均为100 cm。
参考当地食葵施磷水平,试验设4个施磷(P2O5)用量处理,即不施磷(CK)、施磷60 kg·hm-2(P4)、120 kg·hm-2(P8)、180 kg·hm-2(P12),每处理3次重复。各处理氮肥和钾肥均按纯N 180 kg·hm-2,K2O 75 kg·hm-2施用。以上肥料均选用化学纯试剂,磷肥为磷酸二氢钾、钾肥为硫酸钾、氮肥为尿素。2011年5月11日进行春灌,参考当地春灌平均用量1850 m3·hm-2,每筒的灌溉量合0.023 3 m3,灌溉水源为黄河水(矿化度0.58 g·L-1)。灌后待土壤水分适宜后施肥,将施入的各种化学肥料与筒内0~20 cm土壤充分混合均匀,并保持一定的疏松度,以利出苗发根。然后整平表土,覆膜,播种,播后开孔口处盖细砂,供试作物为食用向日葵(Helianthus annuus),品种为LD 5009。破膜人工点播3穴,一穴一粒种子,后期根据苗期出苗情况间苗,每筒留一株。食葵生育期内不再追肥,苗期根据食葵生长需求进行等量补水,以保证后期作物生长发育的水分需求。其他管理措施与当地农户一致。
1.3 测定项目与方法叶片酶活性测定:在食葵盛花期进行叶片酶活性测定,采集的叶片迅速保存于液氮罐,以防止酶失活。叶片丙二醛(MDA)含量采用硫代巴比妥酸法[12]测定,超氧化物歧化酶(SOD)活性采用NBT还原法[13]测定,过氧化物酶(POD)活性采用愈创木酚法[14]测定,过氧化氢酶(CAT)活性采用Chance方法[15]测定。
土壤有效磷和植株磷测定:在食葵播种前、收获后采集0~30 cm土样,参照鲍士旦的方法[16],土壤有效磷用碳酸氢钠浸提-钼锑抗显色法测定,植株磷含量采用H2SO4-H2O2消煮,钒钼黄比色法测定,植株磷累积量(g)=干质量(g)×磷含量(mg·g-1)×1000。
土壤pH和电导率测定:在食葵播种前、收获后用土钻在各筒内取0~30 cm土样,带回实验室进行土壤pH、电导率等指标测定,土壤pH值用蒸馏水浸提(土水比1:5),pH计测定,土壤电导率用1:5土水比电导法测定。根据经验公式:土壤盐分含量(g·kg-1)=电导率×0.064×5×10÷1000。
土壤微生物区系及优势菌群:在食葵盛花期、收获期采集0~30 cm土样,将土样放入牛皮纸袋并迅速保存于4 ℃冷藏箱带回实验室。利用平板培养方法对可培养微生物进行区系分析,分别采用牛肉膏蛋白胨培养基、高氏一号培养基和马丁氏培养基对细菌、放线菌、真菌进行培养分析,选择稀释度为10-2、10-3、10-4、10-5四个梯度的土壤悬液,涂布在相应的培养基上,每种梯度做3次重复,数据处理根据平板中菌落密度,选取合适梯度进行总数计数。微生物区系分析中菌落总数为30~300个的平皿为有效数据,每组数据取重复的平均值。挑取平板中的所有菌落进行分离纯化,将纯化好的菌株进行小量DNA提取,以此为模板,细菌和放线菌利用通用引物27f和1492r进行16S rDNA扩增,并测序获得其16S rDNA全长序列(1500 bp)。将此序列在EzTaxon数据库和NCBI的Blast中进行比对,初步确定其最相似种和其所在属,出现频率高的菌株视为优势菌群。
1.4 数据处理用Office Excel 2007进行数据处理并作图,SPSS 13.0软件做差异性分析和方差分析。
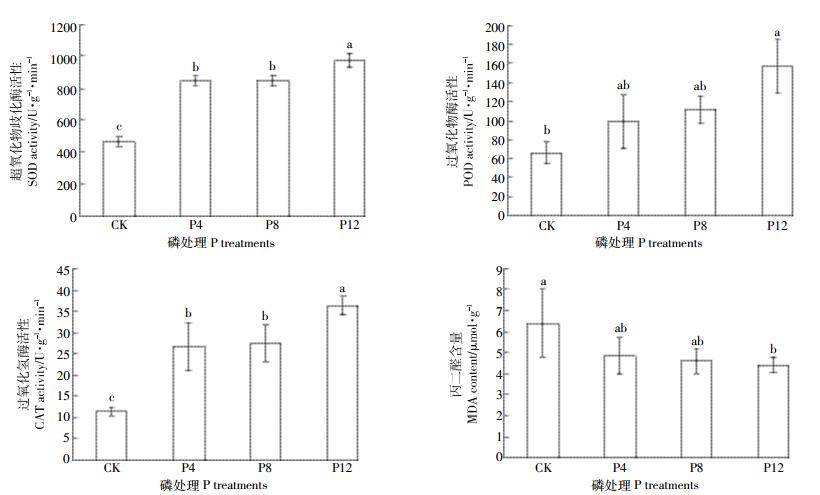
2 结果与讨论 2.1 施磷对食葵叶片保护酶活性及MDA含量的影响叶片SOD、POD和CAT等保护酶活性可以反映其衰老状况。在逆境条件下,植物细胞内活性氧自由基增加,使细胞膜脂过氧化生成MDA,而清除系统中的SOD、POD和CAT的活性就成为控制伤害的决定性因素[17]。不同施磷处理食葵盛花期叶片几种保护酶及MDA含量变化情况见图 1。
|
| 图 1 不同施磷量处理对食葵盛花期叶片保护酶及MDA含量的影响 Figure 1 Effect of different phosphorus application rates on sunflower leaf protective enzyme and MDA at flowering stage 不同小写字母表示处理间在0.05水平上差异显著 Different small letters mean significant difference at 0.05 level |
SOD是植物体内清除活性氧自由基的关键酶,其活性的强弱与植物抗氧化能力密切相关。SOD活性维持一个较高的水平更利于保证生物膜的能量交换、物质运输等过程的正常进行[18]。由图 1可以看出,P12处理食葵叶片SOD活性值均显著高于其他三个处理(P < 0.05),分别高出P8、P4和CK处理14.76%、14.83%和103.95%,另外,P8与P4处理叶片SOD活性值也显著高于CK,但P8与P4处理间差异不显著。这说明增加磷肥施用可显著提高食葵在重度盐胁迫条件下的忍耐力和适应性。
POD能够通过在氧化相应基质(如酚类化合物)时清除低浓度的H2O2,在氧化其他物质的同时,将H2O2还原为H2O,以消除细胞内的H2O2。由图 1可以看出,P8、P4处理的食葵叶片POD活性值与CK差异不显著,而且三个施磷处理间差异也不显著,但P12处理的叶片POD活性值显著高于CK,幅度达138.17%(P < 0.05)。这表明重度盐碱地通过增施磷能够显著提高食葵叶片POD保护酶的合成速度,从而提高其活性。CAT对细胞内的H2O2分解也同样有着重要的作用。图 1显示,不同处理CAT活性与SOD变化特点类似,P12处理的叶片CAT活性显著高于P8、P4和CK处理32.13%、35.69%和212.96%(P < 0.05),且P8与P4处理叶片CAT活性也显著高于CK,但P8与P4处理间差异不显著。
以上试验结果表明:磷素能够增强重度盐碱地食葵叶片活性氧清除系统的活性,食葵叶片SOD与CAT活性在施磷达到P4水平即显著提高,且施磷量达到P12又出现显著增加;而POD活性只有在施磷达到P12水平才出现显著增加。隆小华等[19]研究也发现,在海水处理下增加磷素浓度后,菊芋幼苗叶片SOD、CAT活性与POD表现出不同步性。施磷条件下三种保护酶这种不一致性表现可能是机体的一种补偿机制,用以清除活性氧对植物体造成的伤害[20]。
MDA是植物在逆境中遭受氧化胁迫发生膜脂过氧化的产物,其含量多少可代表膜损伤程度的大小。从本试验结果看(图 1),盛花期对照处理的MDA含量最高,平均值为6.40 μmol·g-1,而P12处理的MDA平均值为4.39 μmol·g-1,对照的MDA含量显著高于P12处理31.40%,但P8、P4与CK差异不显著,而且P8、P4与P12差异也不显著。据贾恢先等[21]报道,在高盐生境中,耐盐植物叶MDA、SOD含量明显较高,而且MDA与SOD二者之间保持相对稳定的比率。本研究结果也表现出同样现象,即施磷使得重度盐碱胁迫下食葵叶片SOD活性保持较高的水平,可以清除膜脂过氧化作用所产生的氧自由基,但叶片MDA含量在施磷量P4、P8水平并没有显著降低,直至达到P12水平才显著下降。
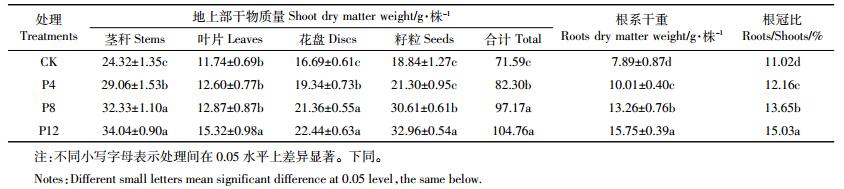
2.2 施磷对食葵干物质积累的影响在收获时测定食葵各器官的干物质重如表 1所示。P12、P8和P4处理的食葵茎干重与CK之间均达到差异显著水平,分别比CK高出12.36%、9.55%和1.69%,但P12、P8处理间差异不显著;P12处理的食葵叶片干重显著高出CK、P4和P8处理30.49%、21.59%和19.04%,但P8、P4和CK处理间没有显著差异;P12、P8和P4处理的食葵花盘干重分别显著高出CK处理34.45%、27.98%和15.88%,但P12、P8处理间差异不显著;P12处理的食葵籽粒干重分别比CK、P4和P8高出74.95%、62.47%和7.68%。以上结果说明重度盐碱地施用磷肥可以提高食葵的茎、叶片、花盘和籽粒干重,且在施磷量达到P8以上水平时,食葵叶片、籽粒干物质积累差异显著。有研究表明,磷素营养促进细胞分裂,叶片伸长,叶面积增大,从而提供更多的光合作用场所[22]。我们前期研究也表明,河套灌区重度盐碱地在施磷量达到120 kg·hm-2以上时,外源磷使食葵叶片光合作用增强,因而利于食葵的生长发育和生物量的积累[23]。
|
根系的生长状况与地上植株关系密切,它的生长好坏直接制约着地上部的生长和产量的高低,盐分胁迫显著地抑制了植物根系对大量元素的吸收,进而影响植株营养供给[24]。从表 1可以看出,增施磷肥可以显著提高食葵根干重及根冠比,P12处理的根干重分别比CK、P4和P8高99.62%、57.34%和18.78%,各处理食葵根冠比均达到差异显著水平,P12处理食葵的根冠比分别高于P8、P4和CK处理10.11%、23.60%和36.39%。根冠比是影响作物养分吸收效率的重要因子,有研究表明,在低磷胁迫条件下植物根冠比提高,光合产物分配到根部的比例较高,促使根系发达,扩大与外界环境的接触面,从而有可能使其获得的磷素增加[25]。但从本研究结果来看,在重度盐碱条件下磷肥的增施显著促进了食葵根系的生长发育,提高其根冠比,从而利于食葵对营养、水分的吸收利用,增加地上部干物质的积累。因此进一步证明,施磷对食葵在逆境中生长可提供一定的保护。
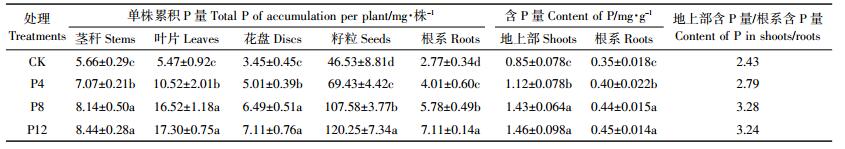
2.3 施磷对食葵植株磷积累的影响盐胁迫抑制磷在根细胞内的移动和在地上部不同部位的再分配过程,植物为了维持生长,必须积累更多的磷[26],以维持细胞膜等的稳定,进而维持离子平衡。不同施磷量对食葵收获后各器官磷积累量的影响如表 2所示,磷积累量从大到小依次为籽粒>叶片>茎秆>花盘>根。各处理籽粒磷积累量间差异显著(P < 0.05),P12分别较P8、P4和CK处理高出11.78%、73.20%和158.44%;叶片磷积累量P12与P8处理间差异不显著,但P12显著高出P4和CK处理64.45%、216.27%;茎秆磷积累量P12与P8处理间差异也不显著,P12显著高于P4、CK处理19.38%和49.12%;花盘磷积累量P12与P8处理差异也不显著,但同样显著高于P4、CK处理,P12分别比P4、CK高出41.92%和106.09%。另外,各处理根系磷积累量达到显著差异水平,P12分别比P8、P4和CK处理高23.01%、77.31%和156.68%。有研究表明,食葵对磷的吸收和富集存在很大的潜力,其地上部磷含量在更高的磷处理浓度下仍可能会增加[27]。本研究也发现,随着磷处理量增大,食葵收获期地上部各器官磷含量呈上升趋势,尤其是籽粒磷积累量差异极为显著,并且与根系磷积累量保持一致。
|
由表 2还可以看出,食葵地上部分含磷量因施磷水平提高而增加,且各施磷处理均显著高于CK,P12、P8、P4分别比CK增加71.76%、68.24%、31.76%,但P12与P8处理差异不显著。根系的含磷量也表现出同样趋势,P12、P8、P4分别高于CK处理28.57%、25.71%、14.29%,P12与P8处理无差异。因此,对于根系磷积累量,随着施磷量增加各处理出现显著差异原因可能主要与施磷后造成食葵根系生物量差异大有关,而根系磷含量变化可能不是主要因素。
地上部磷含量与地下部磷含量的比值,反映作物对土壤磷的转移能力。本研究中食葵地上部分含磷量与根系含磷量的比率在重度盐胁迫下随施磷量提高总体呈增加趋势,尽管在P12处理出现略微下降,但仍表现出较强的磷转运能力。这反映了在重度盐胁迫下,施磷有利于食葵吸收的磷素向上运输。
2.4 施磷对土壤微生物数量的影响微生物是土壤生态系统中最具活力的组成部分,土壤微生物对土壤环境质量的反映是通过其种类、数量和分布来表现的[28]。施肥通过增加根系生物量,改善土壤环境,有利于土壤微生物生长繁育[29]。各施磷处理土壤微生物种类数目如表 3所示。细菌在微生物数量中占有绝对优势,在食葵盛花期,P12处理土壤细菌数量最多,显著高于其他三个处理,分别比CK、P4和P8高出156.00%、48.84%、28.00%,但P4和P8处理间无显著差异;与盛花期相比,食葵收获后各施磷处理的细菌数量也明显增加,P12处理的细菌数同样显著高于其他处理,分别比CK、P4和P8高71.62%、45.98%、30.93%。
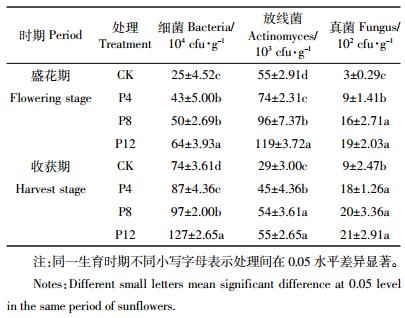
|
由表 3还可以看出,施磷也显著影响土壤放线菌和真菌数量。在食葵盛花期,P12处理土壤放线菌数量最高,为1.19×105 cfu·g-1土,分别比CK、P4和P8增加116.36%、60.81%、23.96%;与盛花期相比,收获后各处理放线菌数目均减少,P8和P12处理间没有显著差异,但显著高于P4和CK处理,其中P8比P4、CK分别增加20.00%、86.21%,P12比P4、CK分别增加22.22%、89.66%。与细菌和放线菌相比,真菌数目最少,在盛花期,施磷处理真菌数量均显著高于CK,P8和P12处理无差异,但显著高于P4和CK处理,到食葵收获后,三个施磷处理间真菌数量无显著差异,但均显著高于CK处理。
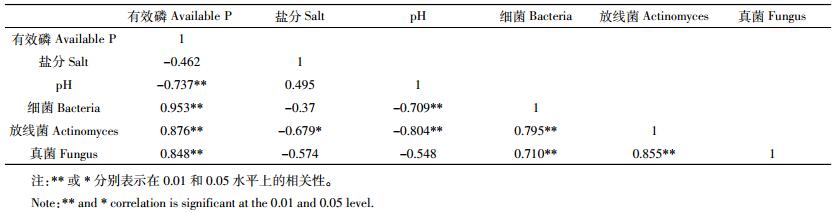
以上结果说明施磷显著增加了重度盐碱地土壤可培养微生物数量。其原因在于,增施磷显著调控了食葵根系生长,根系通过分泌小分子有机酸为微生物提供了重要食物来源[25],促进了微生物生长。除此之外,还与土壤的营养条件及微生物生存环境改变等因素有关。有研究表明,土壤微生物通常能够维持相对固定的碳磷比,在我国旱地土壤中,其值变化为16~75[30]。当基质中碳源供应充足时,磷元素成为微生物量的限制因子[31]。本试验地为重度盐碱地,且土壤长期处于低磷水平,外源加入无机磷后,微生物能够迅速吸收土壤中的磷并以多聚磷酸盐的形式富集在微生物细胞内,降低了碳磷比,提高了微生物数量。本研究通过相关性分析也表明(表 4),土壤有效磷与细菌、放线菌和真菌数目均呈极显著正相关关系(P < 0.01)。另外,施磷通过改变土壤pH进而也影响微生物分布。每种土壤微生物都有其最适宜的pH范围,细菌大多适宜在中性环境生长,放线菌较适应在微碱性、通气良好的土壤中生长,而真菌适宜在偏酸的环境中生长。本试验用盐碱土壤pH值在8.2~9.0之间,而施磷降低了土壤pH值,缓解了土壤的碱性,更有利于细菌和放线菌生长,表 4也显示pH值与细菌和放线菌菌落数之间呈极显著负相关关系(P < 0.01)。与盛花期相比,食葵收获后放线菌数量出现降低,由于盛花期至收获后pH值变化不大,土壤pH可能不是放线菌数量降低的主要原因。此外,施磷也会对土壤盐分产生一定影响,但本研究表明土壤含盐量仅与放线菌数量呈显著负相关(P < 0.05)。
|
通过对每个处理样品的可培养微生物的所有菌落进行分离纯化和大量测序,得到可培养优势菌群(表 5)。可以看出,不同施磷量处理的优势菌群多样性不同,优势菌多样性总体随磷肥施用量的增加而增加。在盛花期,各处理均广泛分布有芽胞杆菌属(Bacillus)和假单胞菌属(Pseudomonas),P8和P12处理优势菌群种类相同,较CK和P4更为丰富,有数量较多的节杆菌属(Arthrobacter),但P12处理优势菌数量高于P8。食葵收获后各处理优势菌群种类均多于盛花期,各处理都广泛分布有芽胞杆菌属(Bacillus)和短状杆菌属(Brachybacterium),P8和P12处理优势菌群种类另有考克氏菌属(Kocuria)、葡萄球菌属(Staphylococcus)和噬几丁质菌属(Chitinophaga),与盛花期相同,食葵收获后P12处理优势菌数量高于P8处理。种类丰富的优势菌群降解土壤有机物后所得的营养物质更为多样,也会分泌更多的有利于植株生长的活性成分,这些有益菌群的广泛分布,表明增施磷使土壤微生态系统得到了改善。

|
需要说明的是,本试验中可培养微生物群落分析所使用的土壤量较大,试验中针对细菌、放线菌、真菌所采用的培养基都是符合绝大多数微生物生长的牛肉膏蛋白胨培养基、高氏一号培养基以及马丁氏培养基,能够较全面地体现出盐碱土壤中可培养微生物的群落结构特征。使用高通量测序手段虽然可以对土壤中微生物群落结构信息有较全面的了解,但是提取微生物总DNA所需要的土壤量很小,很容易受根际或微环境的影响,进而导致高通量测序结果分析不能完全代表土壤中微生物群落结构信息。
3 结论(1) 重度盐碱地增施磷能够显著提高食葵叶片保护酶活性,SOD、CAT和POD活性均在施磷量达到P12出现显著增加;叶片MDA含量与SOD活性保持相对同步,在施磷量P12水平出现显著下降。
(2) 重度盐碱地在施磷量达P12水平时,食葵叶片、籽粒干物质积累差异显著,增施磷肥还显著提高了食葵根干重及根冠比。随着施磷量增加,食葵收获期地上部各器官磷含量呈上升趋势,尤其是籽粒磷积累量差异极为显著,并且与根系磷积累量保持一致。另外,在重度盐胁迫下施磷还有利于食葵吸收的磷素向上转移运输。
(3) 增施磷通过调控根系生长以及改善微环境增加了土壤细菌、放线菌、真菌等可培养微生物的数量和优势菌群,以P12处理最丰富。
综合来看,河套灌区重度盐碱地磷施用量达到180 kg·hm-2可以显著增加食葵叶片保护酶活性,促进食葵生长及磷吸收积累,提高食葵抗性,同时也有利于土壤微生物多样性增加。
| [1] | 廖红, 张秒高, 孔凡利, 等. 盐磷耦合胁迫下大豆的生长和钠、磷离子长距离运输[J]. 植物生理学通讯, 2006, 42(1) : 19–23. LIAO Hong, ZHANG Miao-gao, KONG Fan-li, et al. Soybean[Glycine max (L.) Merr.] growth and long-distance transport of sodium and phosphorus ions under salt and low phosphorus coupled stresses[J]. Plant Physiology Communications, 2006, 42(1) : 19–23. |
| [2] | Awad A S, Edwards D G, Campbell L C. Phosphorus enhancement of salt tolerance of tomato[J]. Crop Sci, 1990, 30(1) : 123–128. DOI:10.2135/cropsci1990.0011183X003000010028x |
| [3] | Gibson T S. Carbohydrate metabolism and phosphorus/salinity interactions in wheat (Triticum aestivum L.)[J]. Plant and Soil, 1988, 111(1) : 25–35. DOI:10.1007/BF02182033 |
| [4] | Grattan S R, Mass E V. Effect of salinity on phosphate accumulation and injury in soybean:I. Influence of CaCl2/NaCl rations[J]. Plant and Soil, 1988, 105(1) : 25–32. DOI:10.1007/BF02371139 |
| [5] | Kaya C, Kirnak H, Higgs D. Enhancement of growth and normal growth parameters by foliar application of potassium and phosphorus in tomato cultivars growth at high (NaCl) salinity[J]. J Plant Nutr, 2001, 24(2) : 357–367. DOI:10.1081/PLN-100001394 |
| [6] | 邓力群, 刘兆普, 程爱武, 等. 不同盐分滨海盐土上油葵(G1012B) 的氮磷肥效应研究[J]. 中国油料学报, 2002, 24(4) : 35–41. DENG Li-qun, LIU Zhao-pu, CHENG Ai-wu, et al. Influence of N and P fertilizers on sunflower grown in different saline soil on coast[J]. Chinese Journal of Oil Crop Science, 2002, 24(4) : 35–41. |
| [7] | 孔滨, 孙波, 郑宪清, 等. 水热条件和施肥对黑土中微生物群落代谢特征的影响[J]. 土壤学报, 2009, 46(1) : 100–106. KONG Bin, SUN Bo, ZHENG Xian-qing, et al. Effect of hydrothermal conditions and fertilization on metabolic characteristics of microbial community in a black soil[J]. Acta Pedologica Sinica, 2009, 46(1) : 100–106. |
| [8] | 赵晓琛, 刘红梅, 皇甫超河, 等. 贝加尔针茅草原土壤微生物功能多样性对养分添加的响应[J]. 农业环境科学学报, 2014, 33(10) : 1933–1939. ZHAO Xiao-chen, LIU Hong-mei, HUANGPU Chao-he, et al. Responses of functional diversity of soil microbial communities to nutrient additions in Stipa Baicalensis Steppe in Inner Mongolia, China[J]. Journal of Agro-Environment Science, 2014, 33(10) : 1933–1939. |
| [9] | Raiesi F, Ghollarataa M. Interactions between phosphorus availability and an AM fungus (Glomus intraradices) and their effects on soil microbial respiration, biomass and enzyme activities in a calcareous soil[J]. Pedobiologia, 2006, 50(5) : 413–425. DOI:10.1016/j.pedobi.2006.08.001 |
| [10] | 牛世全, 杨建文, 胡磊, 等. 河西走廊春季不同盐碱土壤中微生物数量、酶活性与理化因子的关系[J]. 微生物学通报, 2012, 39(3) : 416–427. NIU Shi-quan, YANG Jian-wen, HU Lei, et al. Relationship with soil microbial quantity, soil enzyme activity and physicochemical factor between different saline-alkali soil in Hexi Corridor in spring[J]. Microbiology China, 2012, 39(3) : 416–427. |
| [11] | 唐宏亮, 郭秋换, 张春潮, 等. 磷供应对玉米根际微生物碳源利用和功能多样性的影响[J]. 中国生态农业学报, 2015, 23(10) : 1312–1319. TANG Hong-liang, GUO Qiu-huan, ZHANG Chun-chao, et al. Effects of phosphorus supply on microbial carbon source utilization and functional diversity of maize rhizosphere[J]. Chinese Journal of Eco-Agriculture, 2015, 23(10) : 1312–1319. |
| [12] | 赵世杰, 刘华山, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科技出版社, 1998. ZHAO Shi-jie, LIU Hua-shan, DONG Xin-chun. Plant physiology experiment[M]. Beijing: China Agriculture Sci & Tec Press, 1998. |
| [13] | Giamopolitis C N, Ries S K. Superoxide dismutases:Ⅱ. Purification and quantitative relationship with water-soluble protein in seedlings[J]. Plant Physiology, 1977, 59(2) : 315–318. DOI:10.1104/pp.59.2.315 |
| [14] | Omran R G. Peroxide levels and the activities of catalase, peroxidase and indoleacetic acid oxidase during and after chilling cucumber seedlings[J]. Plant Physiology, 1980, 65(2) : 407–408. DOI:10.1104/pp.65.2.407 |
| [15] | Chance B, maehly A C. Assay of catalases and peroxidase[J]. Methods Enzymol, 1995, 2 : 764–775. |
| [16] | 鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2002. BAO Shi-dan. Soil agricultural-chemical analysis[M]. 3 rd Ed. Beijing: China Agricultural Press, 2002. |
| [17] | Tanaka Y, Hibino T, Hayashi Y. Salt tolerance of transgenic rice overexpressing yeast mitochondrial Mn-SOD in chloroplasts[J]. Plant Science, 1999, 148(2) : 131–138. DOI:10.1016/S0168-9452(99)00133-8 |
| [18] | Chen B D, Li X L, Tao H Q, et al. The role of arbuscularmycorrhiza in zinc uptake by red clover growing in a calcareous soil spiked with various quantities of zinc[J]. Chemospere, 2003, 50(6) : 839–846. DOI:10.1016/S0045-6535(02)00228-X |
| [19] | 隆小华, 刘兆普, 徐文君. 海水处理下菊芋幼苗生理生化特性及磷效应的研究[J]. 植物生态学报, 2006, 30(2) : 307–313. LONG Xiao-hua, LIU Zhao-pu, XU Wen-jun. Effects of seawater treatments on the physiolgical and biochemical characteristics of helianthus seedlings and response to phosphorus supply[J]. Journal of Plant Ecology, 2006, 30(2) : 307–313. DOI:10.17521/cjpe.2006.0041 |
| [20] | 娄成后, 王学臣. 作物产量形成的生理学基础[M]. 北京: 中国农业出版社, 2001. LOU Cheng-hou, WANG Xue-chen. Physiological basis of crop yield formation[M]. Beijing: China Agricultural Press, 2001. |
| [21] | 贾恢先, 赵曼容, 马莹. 典型盐地植物细胞脂质过氧化伤害与质膜超微结构变化的研究[J]. 西北植物学报, 1994, 14(6) : 1–5. JIA Hui-xian, ZHAO Man-rong, MA Ying. The study on cell lipid over-oxidation injuries and changes of plasmalemma ultrastructure in typical saline plants[J]. Acta Botanica Boreali-Occidentalia Sinica, 1994, 14(6) : 1–5. |
| [22] | Rodriguez D, santa G E, Pomar M C. Effects of phosphorus and drought stresses on dry matter and phosphorus allocation in wheat[J]. Plant Nutrition, 1995, 8(11) : 2501–2517. |
| [23] | 胡小龙, 逄焕成, 赵永敢, 等. 河套灌区盐碱地施用磷肥对向日葵生长及光合特性的影响[J]. 中国土壤与肥料, 2013, 6 : 52–56. HU Xiao-long, PANG Huan-cheng, ZHAO Yong-gan, et al. Effect of increased phosphate fertilizer on sunflower growth and photosynthesis characteristic in saline land in Hetao irrigation district[J]. Soil and Fertilizer Sciences in China, 2013, 6 : 52–56. |
| [24] | Attia H, Karray N, Rabhi M, et al. Salt-imposed restrictions on the uptake of macroelements by roots of Arabidopsis thaliana[J]. Acta Physiologiae Plantarum, 2008, 30(5) : 723–727. DOI:10.1007/s11738-008-0172-4 |
| [25] | 沈宏, 施卫明, 王校常, 等. 不同作物对低磷胁迫的适应机理研究[J]. 植物营养与肥料学报, 2001, 7(2) : 172–177. SHEN Hong, SHI Wei-ming, WANG Xiao-chang, et al. Study on adaptation mechanisms of different crops to low phosphorus stress[J]. Plant Nutrition and Fertilizer Science, 2001, 7(2) : 172–177. |
| [26] | 冯固, 杨茂秋, 白灯莎. 盐胁迫下VA菌根对无芒雀麦体内矿质元素含量及组成的影响[J]. 草业学报, 1998, 7(3) : 21–28. FENG Gu, YANG Mao-qiu, BAI Deng-sha. Influence of VAM fungion mineral elements concentration and compositon in Bromus inermis under salinity stress[J]. Acta Prataculturae Sinica, 1998, 7(3) : 21–28. |
| [27] | 吴浩, 卢志军, 黄汉东, 等. 三种植物对土壤磷吸收和富集能力的比较[J]. 植物生态学报, 2015, 39(1) : 63–71. WU Hao, LU Zhi-jun, HUANG Han-dong, et al. Comparison of phosphorus uptake and accumulation capacity among three plant species[J]. Chinese Journal of Plant Ecology, 2015, 39(1) : 63–71. DOI:10.17521/cjpe.2015.0007 |
| [28] | Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterization of microbial communities in soil:A review[J]. Biology and Fertility of Soils, 1999, 29(2) : 111–129. DOI:10.1007/s003740050533 |
| [29] | Hu J L, Lin X G, Wang J H, et al. Microbial functional diversity, metabolic quotient, and invertase activity of a sandy loam soil as affected by long-term application of organic amendment and mineral fertilizer[J]. Journal of Soils and Sediments, 2011, 11(2) : 271–280. DOI:10.1007/s11368-010-0308-1 |
| [30] | 吴金水, 肖和艾, 陈桂秋, 等. 旱地土壤微生物磷测定方法研究[J]. 土壤学报, 2003, 40(1) : 70–78. WU Jin-shui, XIAO He-ai, CHEN Gui-qiu, et al. Measurement of microbial biomass-P in upland soils in China[J]. Acta Pedologica Sinica, 2003, 40(1) : 70–78. |
| [31] | 来璐, 赵小蓉, 李贵桐, 等. 土壤微生物量磷及碳磷比对加入无机磷的响应[J]. 中国农业科学, 2006, 39(10) : 2036–2041. LAI Lu, ZHAO Xiao-rong, LI Gui-tong, et al. The changes of soil microbial biomass P and C/P with adding different quantities of inorganic P[J]. Scientia Agricultura Sinica, 2006, 39(10) : 2036–2041. |
 2017, Vol. 36
2017, Vol. 36