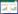文章信息
- 张翠萍, 王蓓, 李淑英, 卢国理, 朱春蓉, 周元清
- ZHANG Cui-ping, WANG Bei, LI Shu-ying, LU Guo-li, ZHU Chun-rong, ZHOU Yuan-qing
- 六氯苯胁迫对干湿交替运行人工湿地典型植物根系分泌物的影响
- Effects on root exudates of typical macrophytes operating in dry-wet alternation constructed wetlands under hexachlorobenzene stress
- 农业环境科学学报, 2017, 36(2): 362-368
- Journal of Agro-Environment Science, 2017, 36(2): 362-368
- http://dx.doi.org/10.11654/jaes.2016-1090
文章历史
- 收稿日期: 2016-08-23
2. 云南大学生态学与地植物学研究所, 昆明 650091
2. Institute of Ecology and Geobotany, Yunnan University, Kunming 650091, China
氯苯类化合物六氯苯(Hexachlorobenzene,HCB)作为《斯德哥尔摩公约》首批需要采取国际行动的12种持久性有机污染物(Persistent Organic Pollutants,POPs)之一,是化学性质极稳定的高毒性难降解化合物,随烟气、废渣等排放进入环境,易被吸附在土壤及沉积层[1],并通过食物链的传递和富积作用进入其他生物体内,对生态系统和人体健康构成严重威胁[2]。
人工湿地作为一种污水生态净化技术,已被广泛应用于污水及农药面源污染处理[3]。植物是人工湿地系统的重要组成部分[4],通过根系输氧和根系分泌有机酸、糖类、氨基酸等有机物,改变土壤理化性质[5],影响根际微生物的种群数量和结构,进而影响污染物的生物降解[6-8]。采用人工湿地系统去除和降解HCB已成为国内外关注的重点[9],湿地植物的根际效应对HCB降解的影响是解决HCB污染的主要切入点[10]。根际是植物-土壤-微生物共同作用的土壤微域,是养分、水分、有益和有害物质及生物进入根系参与食物链物质循环的门户[11]。根系分泌物的组成及含量变化是植物响应环境胁迫最直接和最明显的反映[12],是植物对其生存环境不断适应的结果[13]。植物根系分泌物是湿地内部的重要碳源[14],能促进根际生物降解,提高人工湿地的净化能力。目前,国内外学者在不同植物根系分泌物的收集、检测方法及分泌机制等方面的研究不断深入[15],基于根系分泌物对环境污染物生物降解的影响研究已开展了很多[16],但关于环境污染胁迫对人工湿地植物根系分泌物的动态响应报道较少。水文周期是影响湿地植物生长的重要环境因子[17],全球气候变化背景下,湿地干湿交替频繁发生,淹水程度改变湿地土壤氧化还原电位,影响植物生长发育和生理特性[18]。因此,HCB胁迫下干湿交替对人工湿地芦苇和香蒲根系分泌物动态变化的影响亟待研究。
本文以全球分布最广、运用最多的芦苇和香蒲为人工湿地典型植物[19-22],构建湿地微宇宙系统,通过控制淹水与排水来模拟干(Water draining,WD)湿(Water flooding,WF)交替条件,探讨HCB胁迫下干湿交替对人工湿地芦苇和香蒲根系分泌物动态变化的影响,旨在为湿地去除氯苯类化合物提供理论依据与基础数据。
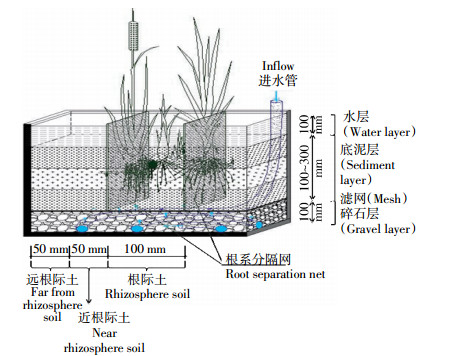
1 材料与方法 1.1 试验装置本研究选择芦苇和香蒲为人工湿地典型植物,构建人工湿地微宇宙根箱[10](图 1)。根箱大小为40 cm×30 cm×50 cm(长×宽×高),自上而下依次是水层10 cm(用自来水补充其蒸发量,保持在10±1 cm),土壤层30 cm,砾石层10 cm。300目尼龙网将系统分成3部分:湿地植物根际生长区及近根际和远根际区,植物根系被限制于中室内生长。
|
| 图 1 湿地微宇宙系统 Figure 1 Constructed wetland mesocosms vegetated with cattail or reed |
芦苇、香蒲及底泥均从抚仙湖流域内的牛摩湿地获得。芦苇和香蒲选择20~40 cm高的植株均一苗。将2000 mg HCB(分析纯,纯度99.50%)溶于4000 mL正己烷,添加到1500 g石英砂中,充分混匀至溶剂完全挥发,将石英砂加入到1000 kg底泥中,每个箱子装入65 kg底泥(理化指标见表 1),获得2.0 mg·kg-1的HCB污染底泥[10, 23],充分混合后高压蒸汽灭菌,将污染底泥转移到湿地微宇宙系统中。试验在HCB初始浓度为1.21 mg·kg-1胁迫下,设置未灭菌芦苇、灭菌芦苇、未灭菌香蒲、灭菌香蒲和无植物种植的对照(CK)5个处理,每个处理组设3个平行。灭菌植株用表面消毒的方法获取:70%酒精清洗1 min后,5%NaClO消毒5 min,再用无菌水清洗3次。第1~4周试验处理组均经历7 d淹水(WF)和7 d排水(WD)的交替培养、第5~12周淹水(WF)、第13周排水(WD)。所有处理组整个生长期均放置于室外遮雨棚下。
HCB胁迫下湿地植物缓培4 d后,于第1(WF)、2(WD)、3(WF)、4(WD)、5~12(WF)、13(WD)周的第2 d和第6 d进行底泥采样。采用Zhou等[10]的自制底泥采样器,对湿地微宇宙系统中的根际土、近根际土和远根际土分别进行多点梅花采样,获得至少150 g混合土样装入密封袋中待测。采用气相色谱仪测定HCB含量[24],HCB降解率计算公式:
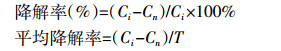
式中Ci为HCB初始检测平均值;Cn为HCB第n d的含量;T=n-i,代表降解时间。
参照张志良等[25]的方法,采用蒽酮比色法测定底泥中总糖含量,考马斯亮蓝比色法测定蛋白质含量,茚三酮显色法测定氨基酸含量。
1.4 统计分析Excel 2013软件对试验数据进行统计,不同处理结果用平均数±标准误(mean±SE)表示。所有数据均采用SPSS 16.0软件(SPSS Inc.)进行相关性分析和显著性检验,Origin 8.0软件作图。采用单因素方差分析(One-Way ANOVA)进行多重比较,检验各指标的差异显著性(P < 0.05)。
2 结果与分析 2.1 干湿交替下六氯苯的变化特征香蒲和芦苇组的根际土壤中HCB含量显著低于非根际(P < 0.05),表明芦苇和香蒲根际效应明显。整个试验期,香蒲组土壤中HCB的平均降解率高于芦苇组,但差异不显著(P>0.05),说明香蒲对HCB的耐受性比芦苇强。干湿交替下芦苇和香蒲组根际与非根际土壤(近根际与远根际的均值)中HCB降解幅度是持续淹水处理的近2倍,说明干湿交替比持续淹水更能促进HCB降解。第1~13周芦苇和香蒲组根际土与非根际土壤中HCB降解率均为:未灭菌>灭菌(图 2),说明微生物参与了HCB的降解。芦苇和香蒲组土壤中HCB含量与根系分泌的蛋白质、氨基酸、总糖呈负相关,相关系数在-0.046~-0.065之间,表明土壤蛋白质、氨基酸、总糖促进了土壤中HCB的降解。
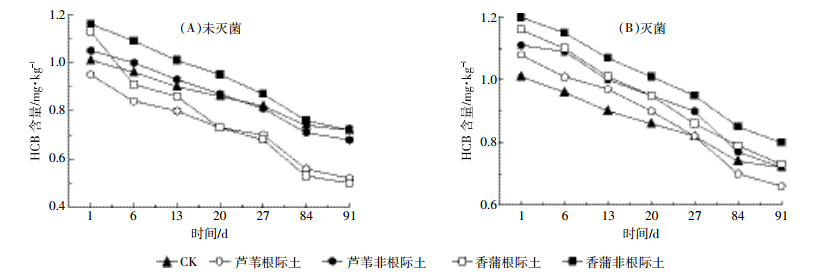
|
| 图 2 干湿交替下芦苇和香蒲根际与非根际土壤中HCB含量变化 Figure 2 Variations of the HCB contents in WF and WD alternation mesocosms of rhizosphere soil and nonrhizosphere |
缓培4 d后,芦苇与香蒲湿地土壤(根际土、近根际土和远根际土的平均值)中的氨基酸含量较HCB胁迫处理前显著增加约2.8倍(P < 0.05),且芦苇和香蒲组土壤中氨基酸含量明显高于CK组(图 3),说明HCB胁迫促进了芦苇和香蒲根系中氨基酸含量的增加。香蒲组湿地土壤氨基酸含量显著高于芦苇(P < 0.05),说明氨基酸含量与植物种类有关。淹水条件下,随淹水时间的增加,氨基酸含量明显下降(P < 0.05),排水处理下基本呈上升趋势,说明排水比淹水条件更易促进芦苇和香蒲根系土壤中氨基酸的增加。

|
| 图 3 淹水与排水交替下芦苇和香蒲氨基酸含量变化 Figure 3 Variations of the amino acid contents in WF and WD alternation mesocosms |
经4 d缓培后,芦苇和香蒲组湿地土壤中蛋白质平均含量较HCB胁迫处理前分别显著增加了2.6、2.9倍(P < 0.05)。芦苇和香蒲组蛋白质平均含量均高于CK,香蒲组高于芦苇,但差异不显著(P>0.05)。淹水处理下芦苇和香蒲组土壤中蛋白质含量呈下降趋势,排水处理下基本呈上升趋势(图 4)。HCB胁迫下芦苇和香蒲组土壤中蛋白质含量最高值均出现在干湿交替后(第4周),最低值均出现在持续淹水后(第12周),表明芦苇和香蒲能对外界环境变化做出反应,且干湿交替更有利于促进芦苇和香蒲根系土壤中蛋白质含量的增加。

|
| 图 4 淹水与排水交替下芦苇和香蒲蛋白质含量变化 Figure 4 Changes of the protein contents in WF and WD alternation mesocosms |
缓培4 d后,芦苇和香蒲组湿地土壤中总糖含量较HCB胁迫处理前分别增加5.2、4.1倍(P < 0.05),说明HCB胁迫促进了其根系土壤中总糖含量的上升。与CK相比,芦苇和香蒲组湿地土壤中总糖含量增加,而且香蒲更能适应外界环境变化(图 5)。第1~13周总体呈先升高后下降的趋势,淹水处理下总糖含量呈下降趋势(图 5),表明干湿交替比持续淹水更能促进香蒲和芦苇根系土壤中总糖含量的增加。
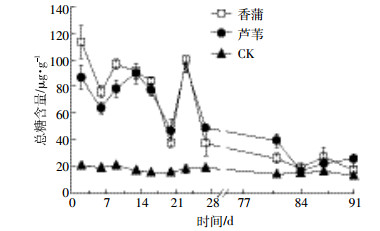
|
| 图 5 淹水与排水交替下芦苇和香蒲总糖含量变化 Figure 5 Changes of the total sugar contents in WF and WD alternation mesocosms |
芦苇和香蒲根系土壤分泌物中,氨基酸、蛋白质、总糖平均含量的比值为2.9:3.9:3.3,且含量变幅为根际土>近根际土>远根际土(表 2),即R/S>1,根际效应明显,表明植物根系作用是适应HCB胁迫的重要因素。WD条件下芦苇和香蒲组土壤的氨基酸、蛋白质、总糖含量明显高于WF处理(P < 0.05),说明WD比WF更能促进芦苇和香蒲根系分泌物的产生。实验结果中芦苇和香蒲根际土壤中3种分泌物含量均表现为未灭菌植物显著高于灭菌植物(P < 0.05),说明根系分泌物的含量变化可能与微生物有关。
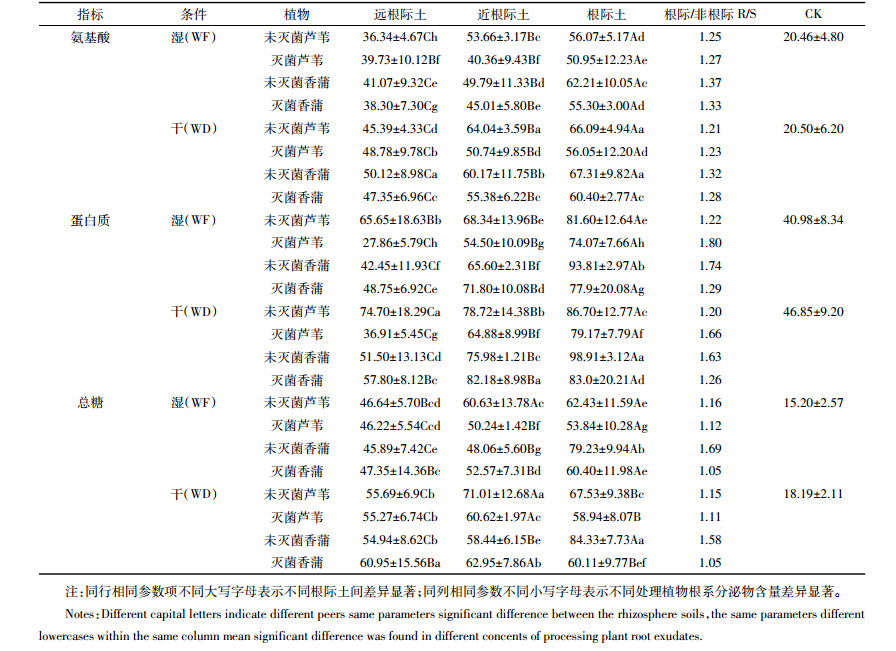 |
根分泌物的产生,使根系周围几毫米内形成称为“根际”的特殊微域[26],由于其植物根系、微生物、基质和污染物之间的相互作用而诱导发生的物化和生物过程,根际比非根际要活跃得多[27],根系分泌最旺盛的部位是根尖,离根尖越远,分泌作用越弱[28]。本研究中,香蒲和芦苇组根际土壤中HCB含量显著低于非根际(P < 0.05),根系分泌物含量为根际土>非根际土,表现出显著的根际效应(R/S>1),与邱权等[29]研究结果相似。根系分泌物是根际效应的存在前提,植物根系分泌物的种类和数量取决于植物的种类、年龄、生态型和基因型以及外部环境因素[30]。试验期间,香蒲组根际土壤中HCB降解率和根系分泌物含量均高于芦苇组。此结果与Ma等[31]报道的香蒲根系通常比芦苇根系更发达密集,根系环境稳定,根际效应明显一致。微生物是调节根部代谢活动的关键因素。根系分泌物间接影响根际微生物种群结构的同时,根际微生物可刺激根系分泌物的增加[32],改变植物碳水化合物、氨基酸、蛋白质、核酸等物质的代谢,进而影响污染物的生物降解。本试验中,湿地土壤HCB含量与3种根系分泌物呈负相关,且灭菌与未灭菌芦苇和香蒲根系分泌物表现为:未灭菌植物显著高于灭菌植物(P < 0.05),表明根际效应能有效促进HCB降解[31]。
植物根系的分泌作用也是适应胁迫环境的重要方式,其含量变化反映了植物个体新陈代谢和生长发育状况。本研究表明,HCB胁迫下芦苇和香蒲根系分泌物含量显著高于CK(P < 0.01),而芦苇和香蒲组土壤中HCB含量显著低于CK,表明植物根系的作用会降低土壤中HCB的活性及生物有效性,从而降低其对环境和人类健康的污染风险。由于植株对胁迫环境也有一定的承受能力,可以通过“生物反馈调节”机制改变根际分泌特征来适应胁迫。因此,适当的HCB胁迫可能会促进根系分泌物的含量,表现出较好的根际效应。Kiwi等[33]研究也发现,一定浓度的污染胁迫下根系分泌物随胁迫浓度增加而增加。
3.2 干湿交替对六氯苯降解和根系分泌物的影响水分是湿地植物生长发育和土壤微生物生理代谢的关键因素,淹水时间和淹水频率严格控制植物的空间分布[34]。彭玉兰等[35]发现一定程度的淹水能够促进芦苇和香蒲生长发育,本研究中,干湿交替条件下HCB的降解率明显高于持续淹水,表明干湿交替利于HCB降解,主要是干湿交替使植物根系处于好氧-厌氧交替环境,有利于根系生长,促进根系分泌有机物,进而影响HCB的降解。本试验干湿交替下,氨基酸、蛋白质和总糖平均含量均比唐利等[36]检测表流型湿地中芦苇和香蒲根系分泌物的平均含量高,表明干湿交替增加了植物根系分泌作用。Reilley等[37]发现,水分胁迫下植物会分泌更多有机碳,其中氨基酸是对照的4倍。第1~4周内芦苇组和香蒲组排水条件(WD)下3种根系分泌物含量均呈上升趋势,可能是由于排水改变了土壤的氧化还原电位,增加了湿地植物根部的输氧作用,促进植物生长和生理代谢所导致的。持续淹水期间芦苇和香蒲组根际土壤中HCB的降解速率比干湿交替下低,主要是持续淹水造成植株缺氧而进行无氧呼吸[35],部分代谢物破坏细胞蛋白质结构[38],导致植物细胞受到严重伤害。Schluter等[39]研究表明,长期淹水条件下,虽然香蒲和芦苇地上部分和根系中的糖酵解速率会降低,但其发达的通气组织和不定根仍能够忍受长期淹水,并储存和分泌较高的糖和氨基酸等。第13周排水后芦苇和香蒲组土壤中HCB的降解速率和分泌物小幅上升,则是因为持续淹水胁迫后对植株的影响还没有完全消除。此外,HCB污染胁迫程度与其在土壤中的老化过程密切相关[40],与新鲜污染土相比,污染物在其平衡一段时间后的老化土壤中,抗性更强,生物有效性更低[41],从而影响其根际作用。
4 结论(1)不同植物的根系分泌物数量存在显著差异,在人工湿地中,香蒲根系分泌物--氨基酸、蛋白质、总糖含量均比芦苇高。
(2)HCB胁迫下,芦苇和香蒲表现出明显的根际效应(R/S>1),根系分泌物中的氨基酸、蛋白质、总糖含量为:根际土>近根际土>远根际土。
(3)干湿交替比持续性淹水更能促进芦苇和香蒲根系分泌物的增加和HCB的降解。
(4)排水条件比淹水更能促进芦苇和香蒲根系分泌物的增加。因此在芦苇和香蒲湿地管理中,要合理调控水分条件,促进芦苇和香蒲根系分泌物的形成,以利于提高根际效应对持久性有机污染物HCB的去除与降解。
| [1] | Guo W, Zhang H Y, Huo S L. Organochlorine pesticides in aquatic hydrophyte tissues and surrounding sediments in Baiyangdian wetland, China[J]. Ecological Engineering, 2014, 67 : 150–155. DOI:10.1016/j.ecoleng.2014.03.047 |
| [2] | Perelló G, Gómez-Catalán J, Castell V, et al. Estimation of the daily intake of hexachlorobenzene from food consumption by the population of Catalonia, Spain:Health risks[J]. Food Control, 2012, 23(1) : 198–202. DOI:10.1016/j.foodcont.2011.07.010 |
| [3] | Upadhyay A K, Bankoti N S, Rai U N. Studies on sustainability of simulated constructed wetland system for treatment of urban waste:Design and operation[J]. Journal of Environmental Management, 2016, 169 : 285–292. DOI:10.1016/j.jenvman.2016.01.004 |
| [4] | Carballeira T, Ruiz I, Soto M. Effect of plants and surface loading rate on the treatment efficiency of shallow subsurface constructed wetlands[J]. Ecological Engineering, 2016, 90 : 203–214. DOI:10.1016/j.ecoleng.2016.01.038 |
| [5] | 苗欣宇, 周启星. 污染土壤植物修复效率影响因素研究进展[J]. 生态学杂志, 2015, 34(3) : 870–877. MIAO Xin-yu, ZHOU Qi-xing. Some research progresses in influencing factors for the efficiency of contaminated soil phytoremediation[J]. Chinese Journal of Ecology, 2015, 34(3) : 870–877. |
| [6] | 魏树和, 周启星, 张凯松, 等. 根际圈在污染土壤修复中的作用与机理分析[J]. 应用生态学报, 2003, 14(1) : 16–21. WEI Shu-he, ZHOU Qi-xing, ZHANG Kai-song, et al. Roles of rhizosphere in remediation of contaminated soils and its mechanism[J]. Chinese Journal of Applied Ecology, 2003, 14(1) : 16–21. |
| [7] | 宋蕾. 微生物降解氯苯类化合物机理与应用[M]. 北京: 化学工业出版社, 2015. SONG Lei. The mechanism of microbial degradation of chlorobenzene compounds and application[M]. Beijing: Chemical Industry Press, 2015. |
| [8] | Yan D Z, Mao L Q, Li C Z, et al. Biodegradation of hexachlorobenzene by a constructed microbial consortium[J]. World Journal of Microbiology and Biotechnology, 2015, 31(2) : 371–377. DOI:10.1007/s11274-014-1789-7 |
| [9] | Vymazal J, Brezinova T. The use of constructed wetlands for removal of pesticides from agricultural runoff and drainage:A review[J]. Environment International, 2015, 75 : 11–20. DOI:10.1016/j.envint.2014.10.026 |
| [10] | Zhou Y Q, Tigane T, Li X Z, et al. Hexachlorobenzene dechlorination in constructed wetland mesocosms[J]. Water Research, 2013, 47(1) : 102–110. DOI:10.1016/j.watres.2012.09.030 |
| [11] | Bais H P, Weir T L, Perry L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review of Plant Biology, 2006, 57 : 233–266. DOI:10.1146/annurev.arplant.57.032905.105159 |
| [12] | Baetz U, Martinoia E. Root exudates:The hidden part of plant defense[J]. Trends in Plant Science, 2014, 19(2) : 90–98. DOI:10.1016/j.tplants.2013.11.006 |
| [13] | Toyama T, Furukawa T, Maeda N, et al. Accelerated biodegradation of pyrene and benzo[J]. Water Research, 2011, 45(4) : 1629–1638. DOI:10.1016/j.watres.2010.11.044 |
| [14] | 陆松柳, 张辰, 徐俊伟. 植物根系分泌物分析及对湿地微生物群落的影响研究[J]. 生态环境学报, 2011, 20(4) : 676–680. LU Song-liu, ZHANG Chen, XU Jun-wei. Root exudates of wetland plants and the influence on the microbial community in constructed wetlands[J]. Ecology and Environmental Sciences, 2011, 20(4) : 676–680. |
| [15] | 张文明, 邱慧珍, 张春红, 等. 连作马铃薯不同生育期根系分泌物的成分检测及其自毒效应[J]. 中国生态农业学报, 2015, 23(2) : 215–224. ZHANG Wen-ming, QIU Hui-zhen, ZHANG Chun-hong, et al. Identification and autotoxicity of root exudates of continuous cropping potato at different growth stages[J]. Chinese Journal of Eco-Agriculture, 2015, 23(2) : 215–224. |
| [16] | Salazar M J, Rodriguez J H, Cid C V, et al. Auxin effects on Pb phytoextraction from polluted soils by Tegetes minuta L. and Bidens pilosa L.:Extractive power of their root exudates[J]. Journal of Hazardous Materials, 2016, 311 : 63–69. DOI:10.1016/j.jhazmat.2016.02.053 |
| [17] | Jing X, Sanders N J, Shi Y, et al. The links between ecosystem multifunctionality and above-and belowground biodiversity are mediated by climate[J]. Nature Communications, 2015, 9 : 1–8. |
| [18] | 康云艳, 郭世荣, 段九菊. 根际低氧胁迫对黄瓜幼苗根系呼吸代谢的影响[J]. 应用生态学报, 2008, 19(3) : 583–587. KANG Yun-yan, GUO Shi-rong, DUAN Jiu-ju. Effects of root zone hypoxia on respiratory metabolism of cucumber seedlings roots[J]. Chinese Journal of Applied Ecology, 2008, 19(3) : 583–587. |
| [19] | Stuckey, R L, Salamon, D P. Typha angustifolia in North America:Masquerading as a native[J]. Am J Bot, 1987, 74 : 757. |
| [20] | Selbo S M, Snow A A. The potential for hybridization between Typha angustifolia and Typha latifolia in a constructed wetland[J]. Aquatic Botany, 2004, 78(4) : 361–369. DOI:10.1016/j.aquabot.2004.01.003 |
| [21] | 李睿华, 管运涛, 何苗, 等. 河岸芦苇、茭白和香蒲植物带处理受污染河水中试研究[J]. 环境科学, 2006, 27(3) : 494–497. LI Rui-hua, GUAN Yun-tao, HE Miao, et al. Pilot-scale study on riparian Phragmites communis, Zizania latifolia and Typha angustifolia L. Zones treating polluted river water[J]. Environmental Science, 2006, 27(3) : 494–497. |
| [22] | 陈友媛, 孙萍, 陈广琳, 等. 滨海区芦苇和香蒲耐盐碱性及除氮磷效果对比研究[J]. 环境科学, 2015, 36(4) : 1489–1496. CHEN You-yuan, SUN Ping, CHEN Guang-lin, et al. A contrastive study on salt-alkaline resistance and removal efficiency of nitrogen and phosphorus by Phragmites australis and Typha angustifolia in coastal estuary area[J]. Environmental Sciences, 2015, 36(4) : 1489–1496. |
| [23] | Liu C Y, Jiang X, Wang F, et al. Hexachlorobenzene dechlorination as affected by nitrogen application in acidic paddy soil[J]. Journal of Hazardous Materials, 2010, 179(1) : 709–714. |
| [24] | 郭强, 田慧, 吴有方, 等. 甘肃省及其周边地区土壤六氯苯污染特征[J]. 中国环境科学, 2013, 33(3) : 455–460. GUO Qiang, TIAN Hui, WU You-fang, et al. Hexachlorobenzene soil pollution characteristics in Gansu Province and its surrounding areas[J]. China Environmental Science, 2013, 33(3) : 455–460. |
| [25] | 张志良, 瞿伟菁, 李小方. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2009. ZHANG Zhi-liang, QU Wei-jing, LI Xiao-fang. Plant physiology experiment instruction[M]. Beijing: Higher Education Press, 2009. |
| [26] | 詹媛媛, 薛梓瑜, 任伟, 等. 干旱荒漠区不同灌木根际与非根际土壤氮素的含量特征[J]. 生态学报, 2009, 29(1) : 59–65. ZHAN Yuan-yuan, XIE Zi-yu, REN Wei, et al. Arid desert shrub different rhizosphere and non rhizosphere soil nitrogen content sign[J]. Acta Ecologica Sinica, 2009, 29(1) : 59–65. |
| [27] | Nielsen S. Sludge reed bed facilities:Operation and problems[J]. Water Science and Technology, 2005, 51(9) : 99–107. |
| [28] | 王茹华, 张启发, 周宝利, 等. 浅析植物根分泌物与根际微生物的相互作用关系[J]. 土壤通报, 2007, 38(1) : 167–172. WANG Ru-hua, ZHANG Qi-fa, ZHOU Bao-li, et al. Analysis on the interaction between root exudates and rhizosphere microbes[J]. Chinese Journal of Soil Science, 2007, 38(1) : 167–172. |
| [29] | 邱权, 李吉跃, 王军辉, 等. 西宁南山4种灌木根际和非根际土壤微生物、酶活性和养分特征[J]. 生态学报, 2014, 34(24) : 7411–7418. QIU Quan, LI Ji-yue, WANG Jun-hui, et al. Microbes, enzyme activities and nutrient characteristics of rhizosphere and non-rhizosphere soils under four shrubs in Xining Nanshan, Prefecture, China[J]. Acta Ecologica Sinica, 2014, 34(24) : 7411–7418. |
| [30] | Hook D D. Waterlogging tolerance of lowland tree species of the South[J]. Southern Journal of Applied Forestry, 1984, 8(3) : 136–149. |
| [31] | Ma X, Havelka M M. Phytotoxicity of chlorinated benzenes to Typha angustifolia and Phragmites communis[J]. Environmental Toxicology, 2009, 24(1) : 43–48. DOI:10.1002/tox.v24:1 |
| [32] | Jeremy A R, Pedro J A, Jerald L S. Repression of Pseudomonas putida phenanthrene-degrading activity by plant root extracts and exudates[J]. Environment Microbiology, 2004, 6(6) : 574–583. DOI:10.1111/emi.2004.6.issue-6 |
| [33] | Kiwi J, Lopez A, Nadtochenko V. Mechanism and kinetics of the OH-radical intervention during Fenton oxidation in the presence of a significant amount of radical scavenger (Cl-)[J]. Environmental Science & Technology, 2000, 34(11) : 2162–2168. |
| [34] | 吴春笃, 孟宪民, 储金宇, 等. 北固山水文情势与湿地植被的关系[J]. 江苏大学学报(自然版), 2005, 26(4) : 321–325. WU Chun-du, MENG Xian-min, CHU Jin-yu, et al. Correlation between hydrological situation and vegetation in Mount Beigu wetland[J]. Journal of Jiangsu University (Natural Science Edition), 2005, 26(4) : 321–325. |
| [35] | 彭玉兰, 涂卫国, 包维凯, 等. 九寨沟自然保护区4种水深梯度下芦苇分株地上生物量的分配与生长[J]. 应用与环境生物学报, 2008, 14(2) : 153–157. PENG Yu-lan, TU Wei-guo, BAO Wei-kai, et al. Jiuzhaigou nature reserve, four kinds of water depth gradient plant growth and distribution of above ground biomass in the reed points[J]. Application and Environmental Science, 2008, 14(2) : 153–157. |
| [36] | 唐利, 杨奇, 邱江平, 等. 芦苇、香蒲根系分泌物及其根际效应比较分析[J]. 哈尔滨商业大学学报(自然科学版), 2010, 26(4) : 425–429. TANG Li, YANG Qi, QIU Jiang-ping, et al. Influence of root exudates from Phragmites australis & Typha orientalis presl[J]. Journal of Harbin University of Commerce-Natural Sciences Edition, 2010, 26(4) : 425–429. |
| [37] | Reilley K A, Banks M K, Schwab A P. Dissipation of polycyclic aromatic hydrocarbons in the rhizosphere[J]. Journal of Environmental Quality, 1996, 25(2) : 212–219. |
| [38] | Bellaloui N, Hu Y B, Mengistu A, et al. Effects of foliar boron application on seed composition, cell wall boron, and seed δ15N and δ13C isotopes in water-stressed soybean plants[J]. Frontiers in Plant Science, 2013, 4 : 270. |
| [39] | Schluter U, Crawford R M M. Long-term anoxia tolerance in leaves of Acorus calamus L. and Iris pseudacorus L.[J]. Journal of Experimental Botany, 2001, 52(364) : 2213–2225. DOI:10.1093/jexbot/52.364.2213 |
| [40] | Li Z, Lu G Y, Zhang X K. Improving drought tolerance of germinating seeds by exogenous application of gibberellic acid (GA3) in rapeseed (Brassica napus L.)[J]. Seed Science and Technology, 2010, 38(2) : 432–440. DOI:10.15258/sst |
| [41] | Binet P, Portal J M, Leyval C. Dissipation of 3-6-ring polycyclic aromatic hydrocarbons in the rhizosphere of ryegrass[J]. Soil Biology & Biochemistry, 2000, 32(14) : 2011–2017. |
 2017, Vol. 36
2017, Vol. 36