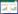文章信息
- 江群, 杨帆, 朱墨染, 赵璐璐, 闫立龙, 张颖
- JIANG Qun, YANG Fan, ZHU Mo-ran, ZHAO Lu-lu, YAN Li-long, ZHANG Ying
- 玉米秸秆生物炭固定化Acinetobacter lwoffii DNS32性能研究
- The degradation properties of immobilized bacteria using corn stover-derived biochars as carriers
- 农业环境科学学报, 2017, 36(2): 382-386
- Journal of Agro-Environment Science, 2017, 36(2): 382-386
- http://dx.doi.org/10.11654/jaes.2016-1018
文章历史
- 收稿日期: 2016-08-09
阿特拉津是一种三氮苯类农药,其化学结构非常稳定,属于长残留有机污染物,目前在北方玉米田除草中仍广泛应用。资料表明,每年松花江水体和周边土壤中均有阿特拉津被检出[1]。阿特拉津对土壤、水体的污染及其对生态环境的危害已引起广泛重视[2]。微生物修复技术是目前环境中有机污染物最有效的修复方法之一。固定化微生物技术因其可以克服游离菌易受环境因素影响、降解效率低、不易回收等缺点而备受关注。但传统固定化载体,如海藻酸钠、沸石等存在寿命短或吸附能力小等劣势。
生物炭是生物质在限氧条件下高温热解产生的,主要由芳香烃和单质碳或具有类石墨结构的碳组成,一般含有60%以上的C元素[3]。丰富的芳香化结构和脂肪族链状结构[4]使其具有极强的吸附能力和抗氧化能力[5-7]。Yu等[8]认为生物炭分散在其他营养物中可以减缓释放肥料,因此提高了肥料的利用效率。而且,生物炭可以降低污染物的流动性。例如,小麦秸秆生物炭以1%(W/W)比例添加到土壤中,对敌草隆的吸附比未修复的土壤增加了80%~86%[9]。
针对传统固定化载体寿命短、吸附能力小和成本高等不足,以及生物炭具有多孔结构的特点,本研究拟使用生物炭为载体,固定化Acinetobacter lwoffiiDNS32,以期实现吸附-降解一体化修复阿特拉津的效果。本研究选用农业废弃物玉米秸秆作为制备生物炭的原料,不仅可以降低成本,还可以达到废弃物资源化利用的附加目的。研究秸秆生物炭固定化Acinetobacter lwoffii DNS32的性能,其目的在于验证以上设想的可行性及探究生物炭固定化微生物的降解效果。
1 材料与方法 1.1 试验材料 1.1.1 阿特拉津降解菌所用菌株DNS32[10]是实验室从阿特拉津污染土壤中筛选的一株降解菌,属于Acinetobacter lwoffii,能以阿特拉津为唯一氮源生长。其最适温度范围比常规菌株低5~10 ℃,在寒冷地区具有较高的应用价值。
无机盐培养基:KH2PO4 0.4 g,K2HPO4 1.6 g,MgSO4 0.2 g,NaCl 0.1 g,葡萄糖3.0 g,溶解于1000 mL蒸馏水中制得[13]。使用时加入阿特拉津使其浓度为100 mg·L-1。
LB培养液:胰蛋白胨10.0 g,酵母粉5.0 g,NaCl 10.0 g,溶解于1000 mL蒸馏水中,121 ℃灭菌30 min,备用。
1.1.2 玉米秸秆制备生物炭的原料是玉米秸秆,收集于东北农业大学园艺站。将风干的玉米秸秆剪成0.5~1.0 cm的小块,再放到烘箱中烘24 h,备用。
1.2 实验方法 1.2.1 生物炭的制备与表征将准备好的玉米秸秆置于真空管式炉中,通入氩气限氧,以10 ℃·min-1的速率升温到750 ℃,并恒温持续2 h炭化。降温后取出,磨粉,即得到生物炭。
生物炭的结构形态在扫描电镜(SEM,ZEISS SUPRA 40,德国)下观察。
称取100 mg生物炭用去离子水定容到100 mL,超声2 h后备用。使用之前再超声处理30 min。
1.2.2 固定化降解菌的制备取15 mL生物炭母液于50 mL锥形瓶中,加入15 mL OD600值为1.0的菌悬液中,在30 ℃、125 r·min-1条件下振荡2 h,使微生物吸附挂膜。
1.2.3 生物炭固定化降解菌的生长及其对阿特拉津的降解将制备好的固定化菌剂投入到阿特拉津含量为100 mg·L-1的无机盐培养液中,每隔8 h取样一次,测菌的生长量(OD600)及其对阿特拉津的降解率。为排除吸附作用的影响,在取样前先将溶液摇匀,取5 mL混合菌液,涡旋5 s后萃取。设等量的游离菌为空白对照。每个实验设3组平行。
1.2.4 固定化降解菌的生长条件根据唯一差别原则,设置pH分别为5、6、7、8、9、10,研究酸碱性对固定化降解菌的影响;其他培养条件不变,设置温度分别为10、20、25、30、35、40 ℃,研究温度对固定化降解菌的影响。设等量的游离菌为空白对照。每个实验设3组平行。
1.2.5 固定化降解菌在模拟污染水中的修复效果将生物炭固定化降解菌按质量比投入到阿特拉津含量为100 mg·L-1的1 L模拟污水中,每天按时取5 mL样液,测定阿特拉津的残留量。当阿特拉津快降解完时,再加入100 mg·L-1的阿特拉津和适量的葡萄糖,再次定容到1 L并每天取样。如此反复直到第30 d为止。设等量游离态的菌株作为对照。
1.3 阿特拉津残留量测定将含有阿特拉津的5 mL样液倒入分液漏斗中,加入等体积的CHCl3萃取(浓度低于检出限,用旋转蒸发仪浓缩后,再用CHCl3定容至1 mL)。然后用GC-14C型气相色谱仪(岛津)对样品进行检测。FID检测器和N2000色谱工作站:色谱柱为内涂14% OV-1701大口径毛细管柱(30 m×0.53 mm);温度条件:进样口250 ℃,柱温200 ℃,检测器250 ℃,非程序升温;气体流量:氮气50 kPa、氢气50 kPa、空气50 kPa、尾吹100 kPa;不分流进样,进样量1 μL,利用峰高计算阿特拉津浓度。
2 结果与讨论 2.1 材料表征所制备的生物炭扫描电镜如图 1所示。可以看出,生物质炭化过程完好地保留了原生物质的细微孔隙结构,使其具有丰富的孔隙结构,从而增大了比表面积。这使得生物炭具有很强的吸附能力,使其可以作为固定化载体制备出具有吸附-降解一体化的固定化降解菌剂。

|
| 图 1 生物炭的扫描电镜图 Figure 1 SEM of biochars |
图 2表明,游离态DNS32在16 h之前为生长延滞期,16~40 h为对数生长期,40~72 h为稳定期。固定化降解菌的生长趋势与游离态菌株具有类似的生长行为,证明生物炭具有较好的生物相容性。同时可以观察到24 h之后,固定化降解菌比游离态菌株生长得更快。这可能是由于生物炭多孔结构给微生物提供了更好的生长环境,可降低菌体与阿特拉津的接触,从而缓解阿特拉津及菌代谢过程中产生的有害物质对菌株的毒害作用[11-12]。Pietikäinen等[13]认为,个体较小且生长速度较快的微生物生长更适合在生物炭的孔隙结构中生长,当生物炭的孔径大于微生物时,微生物便有可能进入生物炭孔隙并利用其中的养分。Samonin等[14]更明确指出,不动杆菌能够进入孔径大小为2~4 μm的孔隙中生长代谢。
|
| 图 2 固定化降解菌株生长曲线 Figure 2 Effects of biochar on the growth curve of DNS32 |
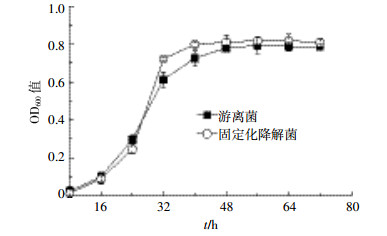
如图 3所示,第8 h,游离菌降解率为12%,固定化降解菌的降解率仅7.5%。这可能是由于开始阶段,固定化降解菌与阿特拉津的接触面积比游离菌小。但第32 h时,固定化降解菌的降解率为68%,比游离菌的降解率高20%,且之后均高于游离态降解率,如第40 h时,固定化菌剂阿特拉津降解率达94%,游离菌仅70%,说明后期固定化菌剂比游离菌更高效。这与固定化菌和游离态菌的生长曲线(图 2)保持一致。Chen等[15]也有类似报道,他们认为生物炭固定菌剂可以提高土壤中多环芳烃的生物降解效率。然而,也有很多研究发现,生物炭吸附有机污染物会降低污染物的生物可利用性,降低降解菌的降解效率[16-18]。产生不同结果的原因可能与菌株的种类以及生物炭与污染物的相互作用有关。
|
| 图 3 固定化菌剂和游离菌的降解率 Figure 3 Degradation rate of immobilized bacteria and free bacteria |
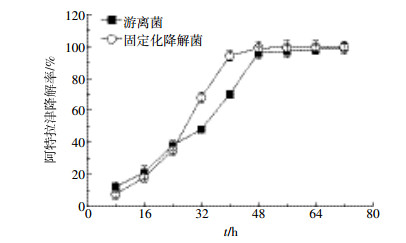
图 4是pH对固定化降解菌降解率的影响(游离菌作对照),可以看出,生物炭固定化降解菌比游离菌能更好地抵抗pH的变化。固定化微生物和游离菌的最适pH均为7~8,但在最适pH的条件下,生物炭固定化降解菌的降解率比游离菌高。pH=5时固定化降解菌和游离菌的降解率分别为34%和42%,pH=10时固定化降解菌和游离菌的降解率分别为23%和35%,即强酸强碱条件下,固定化降解菌的降解率均高于游离菌,表明固定化菌更能适应自然环境。阿特拉津本身是弱碱性,DNS32将阿特拉津降解成无毒的氢氰酸[2],随着阿特拉津降解,培养液自身的pH会下降。所以偏碱条件利于偏酸条件。
|
| 图 4 pH对固定化降解菌降解率的影响 Figure 4 Effects of pH on atrazine degradation rate |
图 5为温度对固定化和游离态降解菌降解率的影响。可以看出,固定化微生物对温度的敏感性比游离菌小,其最适温度均为25~30 ℃。在最适温度下,固定化降解菌的降解率与游离菌几乎相等。温度为10 ℃和20 ℃时,固定化降解菌的降解率分别比游离菌高出14%和17%,说明固定化降解菌更耐低温;温度为40 ℃时,两种菌剂降解率仅相差7%,说明高温条件下,固定化菌剂的耐性没有低温高,可能与酶的活性有关。
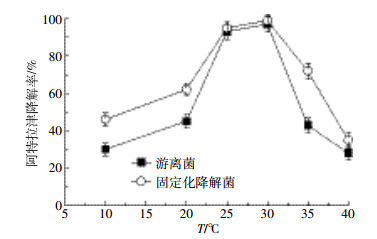
|
| 图 5 温度对固定化降解菌降解率的影响 Figure 5 Effects of temperature on atrazine degradation rate |
在为期30 d修复模拟阿特拉津污染水的试验中,生物炭固定化降解菌表现出高效且持久的修复效果(图 6)。在第7 d第一次将阿特拉津降解到1%时,立刻加入100 mg·L-1的阿特拉津;到第15 d第二次将阿特拉津降解到仅剩3%,再加入100 mg·L-1的阿特拉津。虽然在15 d之后的降解率小于15 d之前,但第30 d时固定化降解菌仍然具有活性。这说明固定化微生物不仅可以高效降解阿特拉津,还可以持久发挥作用。
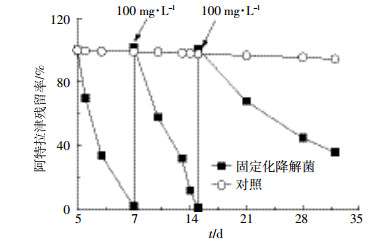
|
| 图 6 生物炭固定化降解菌处理的阿特拉津残留率 Figure 6 Removal rate of atrazine by immobilized bacteria |
(1)玉米秸秆生物炭固定化DNS32具有较高的降解阿特拉津的能力。该固定化菌剂可在40 h内将无机盐培养液中浓度为100 mg·L-1的阿特拉津降解掉98%,比游离菌高28%;对pH和温度的敏感性比游离菌小。这表明该固定化菌剂比游离菌更适用于阿特拉津污染环境的治理。
(2)生物炭固定化降解菌具有高效且持久的阿特拉津降解效果。在第30 d时固定化降解菌仍然具有活性,表明生物炭是良好的固定化载体,其固定化降解菌可能在实际应用中发挥很好的作用。
| [1] | Zhang Y, Wang P J, Wang L, et al. The influence of facility agriculture production on phthalate esters distribution in black soils of Northeast China[J]. Science of the Total Environment, 2015, 506 : 118–125. |
| [2] | 郭火生, 等. 阿特拉津降解菌株DNS32的降解特性及分类鉴定与降解途径研究[J]. 微生物学通报, 2012, 39(9) : 1234–1241. GUO Huo-sheng, et al. Degradation characteristics and identification and the degradation pathway of the atrazine-degrading strain DNS32[J]. Microbiology China, 2012, 39(9) : 1234–1241. |
| [3] | Braida W J, Pignatello J J, Lu Y F. Sorption hystersis of benzene in charcoal particles[J]. Environmental Science & Technology, 2003, 37(2) : 409–417. |
| [4] | Kramer R W, Kujawinski E B, Hatcher P G. Identification of black carbon derived structures in a volcanic ash soil humic acid by Fourier transform ion cyclotron resonance mass spectrometry[J]. Environmental Science & Technology, 2004, 38(12) : 3387–3395. |
| [5] | Oguntunde P G, Abiodun B J, Ajayi A E, et al. Effects of charcoal production on soil physical properties in Ghana[J]. Journal of Plant Nutrition and Soil Science, 2008, 171(4) : 591–596. DOI:10.1002/(ISSN)1522-2624 |
| [6] | Asai H, Samson B K, Stephan H M, et al. Biochar amendment techniques for upland rice production in northern Laos:1.Soil physical properties, leaf SPAD and grain yield[J]. Field Crops Research, 2009, 111(S1/2) : 81–84. |
| [7] | Piccolo A, Mbagwu J S C. Effects of different organic waste amendments on soil microaggregates stability and molecular sizes of humic substances[J]. Plant and Soil, 1990, 123(1) : 27–37. |
| [8] | Yu X Y, Ying G G, Kookana R S. Reduced plant uptake of pesticides with biochar additions to soil[J]. Chemosphere, 2009, 76 : 665–671. DOI:10.1016/j.chemosphere.2009.04.001 |
| [9] | Liang B, Lehmann J, Solomon D, et al. Black carbon increases cation exchange capacity in soils[J]. Soil Science Society of America Journal, 2006, 70(5) : 1719–1730. DOI:10.2136/sssaj2005.0383 |
| [10] | 王志刚, 张颖, 郭火生, 等. 阿特拉津降解菌Acinetobacter sp. DNS32对无机氮源的响应[J]. 微生物学通报, 2014, 41(8) : 1541–1546. WANG Zhi-Gang, ZHANG Ying, GUO Huo-sheng, et al. Response of an atrazine-degrading bacterium strain Acinetobacter sp. DNS32 to inorganic nitrogen source[J]. Microbiology China, 2014, 41(8) : 1541–1546. |
| [11] | Atkinson C J, Fitzgerald J D, Hipps N A. Potential mechanisms for achieving agricultural benefits from biochar application to temperate soils:A review[J]. Plant and Soil, 2010, 337(1/2) : 1–18. |
| [12] | Hamer U, Marschner B, Brodowski S, et al. Interactive priming of black carbon and glucose mineralisation[J]. Organic Geochemistry, 2004, 35(7) : 823–830. DOI:10.1016/j.orggeochem.2004.03.003 |
| [13] | Pietikäinen J, KiikkiläO, Fritze H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 2000, 89(2) : 231–242. DOI:10.1034/j.1600-0706.2000.890203.x |
| [14] | Samonin V V, Elikova E E. A study of the adsorption of bacterial cells on porous materials[J]. Microbiology, 2004, 73(6) : 696–701. DOI:10.1007/s11021-005-0011-1 |
| [15] | Chen B L, Yuan M X, Qian L B. Enhanced bioremediation of PAH-contaminated soil by immobilized bacteria with plant residue and biochar as carriers[J]. Journal of Soils and Sediments, 2012, 12(9) : 1350–1359. DOI:10.1007/s11368-012-0554-5 |
| [16] | Xia X H, Li Y R, Zhou Z, et al. Bioavailability of adsorbed phenanthrene by black carbon and multi-walled carbon nanotubes to Agrobacterium[J]. Chemosphere, 2010, 78 : 1329–1336. DOI:10.1016/j.chemosphere.2010.01.007 |
| [17] | Jones D L, Edwards G, Murphy D V. Biochar mediated alterations in herbicide breakdown and leaching in soil[J]. Soil Biology and Biochemistry, 2011, 43(4) : 804–813. DOI:10.1016/j.soilbio.2010.12.015 |
| [18] | Wang Y, Wang Y J, Wang L, et al. Reducing the bioavailability of PCBs in soil to plant by biochars assessed with triolein-embedded cellulose acetate membrane technique[J]. Environmental Pollution, 2013, 174(5) : 250–256. |
 2017, Vol. 36
2017, Vol. 36