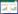文章信息
- 林丽娜, 黄青, 廉菲, 刘仲齐, 宋正国
- LIN Li-na, HUANG Qing, LIAN Fei, LIU Zhong-qi, SONG Zheng-guo
- 腐植酸及pH对生物炭-铁锰氧化物复合材料吸附As (Ⅲ) 的影响机理
- Effect of humic acid and pH on the adsorption of arsenic (Ⅲ) on biochar-ferro manganese oxide composite material
- 农业环境科学学报, 2017, 36(2): 387-393
- Journal of Agro-Environment Science, 2017, 36(2): 387-393
- http://dx.doi.org/10.11654/jaes.2016-1188
文章历史
- 收稿日期: 2016-09-13
2. 沈阳农业大学土地与环境学院, 沈阳 110000
2. School of Land and Environmental Sciences, Shenyang Agriculture University, Shenyang 110000, China
腐殖质是地表环境中天然有机质的重要组成部分,占土壤天然有机质的80%左右和水体中溶解性有机碳的60%左右[1]。腐植酸(HA)作为一种重要的腐殖质,广泛存在于土壤、水体以及沉积物,主要由C、H、O、N和少量S、P等元素组成,其含有丰富的官能团,如羟基、酚羟基、羧基、羰基、氨基等,具有较强的络合、螯合、吸附和氧化还原能力。天然环境中,特别是水体中HA能与金属离子、氧化物、矿化物、有毒活性污染物等发生复杂的交互作用,且能影响营养盐和污染物的迁移转化[2]。
砷(As)是自然界分布较广的有毒元素,在环境中通常以As(Ⅲ)和As(Ⅴ)两种形态存在,且在一定条件下可以相互转化,但中性及弱酸条件对As(Ⅲ)和As(Ⅴ)的转化影响不大[3]。As(Ⅲ)的生物毒性比As(Ⅴ)高很多,其对生态环境和人体健康造成更大的威胁。As进入人体后,除了少量As能够被排出,大多数会在体内累积,会损害细胞的氧化还原能力,影响细胞的正常代谢,甚至会导致死亡[4]。我国有1960万人口生活在高浓度含As饮用水的环境中[5],解决水体As污染问题已经迫在眉睫。在众多的As污染处理方法中,吸附法因其工艺简单、价格低廉等优点被广泛应用于去除水体As污染[6-8]。pH以及HA是影响吸附材料去除重金属的主要因素,何忠明等[9]研究发现,随着溶液pH值的增大,水中六价Cr和As的去除率不断下降。Wang等[10]考察了腐植酸对Pb(Ⅱ)、Cd(Ⅱ)和Cr(Ⅲ)在钛纳米管上的竞争吸附。张彩凤等[11]研究发现HA与As易形成HA-As络合物。Weng等[12]研究了HA对羟基氧化铁吸附As的影响,得出位点和静电力竞争是主要的影响机制。Ko等[13]考察了在HA存在时,As(Ⅲ)、As(Ⅴ)在赤铁矿上的吸附顺序,指出HA可以导致As吸附量的减少。因此,开展不同条件添加HA以及不同pH条件对As环境行为差异的研究意义重大。
生物炭是生物有机材料在无氧或低氧环境中高温裂解产生的固相物质[14],环境稳定性好、孔隙结构发达、表面含有大量的活性基团[15-16],对As有一定的吸附能力,但吸附能力较弱。为提高生物炭对As的吸附性能,将金属氧化物改性生物炭制备成复合材料吸附As已成为研究热点[17-18]。研究[19-20]表明,HA对铁锰氧化物、生物炭吸附重金属(如As)有较大影响,而其对生物炭-铁锰氧化物复合材料对As吸附性能的影响鲜见报道。因此,本研究拟通过添加不同浓度的HA,以及调节不同pH来探讨其对F1M4BC25吸附As(Ⅲ)的影响,以期为生物炭-铁锰氧化物复合材料修复水体中As污染提供依据。
1 材料与方法 1.1 材料生物炭-铁锰氧化物(F1M4BC25)的制备:将自然风干的玉米秸秆,磨碎后置于刚玉坩埚内,以氮气(600 cm3·min-1)作为保护气,马弗炉内(600 ℃)限氧热解2 h制备生物炭。称取12.432 g生物炭放入刚玉坩埚内,分别加入浓度为0.24 mol·L-1的高锰酸钾20 mL和浓度为0.06 mol·L-1硝酸铁20 mL,铁、锰和炭的理论质量比为1:4:25;混合均匀后,放入数字超声仪中超声分散2 h,继续搅拌均匀后,放入水浴锅内恒温(95 ℃)水浴蒸干;然后放入马弗炉内,以氮气(600 cm3·min-1)作为保护气,在600 ℃条件下限氧热解0.5 h,冷却后储存备用。用元素分析仪(Elementar Vario Macro EL,德国)测定材料中主要组成元素C、H、N、O的质量百分含量,结果见表 1。
采用比表面积分析仪(Quantachrome,美国)测定材料的比表面积及孔径[17],采用电位滴定法[21]测定零电荷点,采用Boehm滴定法[21]测定表面酸碱官能团。理化性质见表 2。
As储备液:将17.33 g NaAsO2溶于100 mL NaOH(0.1 mg·L-1)溶液中,浓度为10 g·L-1,储存备用。
HA储备液(1000 mg·L-1):HA购自Alfa公司。称取1 g HA,用超纯水50 ℃水浴溶解12 h,定容到1 L,用0.45 μm滤膜过滤,避光储存[22]。
1.2 方法EDS表征:采用LEO 1530VP型扫描电镜,将待测试样放入烘箱中于50 ℃下烘干后表面镀金膜,用真空泵抽真空1 h,进行EDS表征分析,观察其显微结构以及元素成分含量。
不同用量HA的吸附实验:称取0.1 g F1M4BC25置于50 mL棕色玻璃瓶中,分别加入10、20、30、40、50 mg·L-1含As(Ⅲ)溶液。添加一定量HA,使得体系HA浓度为5、10、50 mg·L-1,溶液总体积为20 mL,调节pH=6后180 r·min-1恒温摇床振荡12 h,过滤后测定As含量,用Whatman No.42滤纸过滤,用原子荧光光谱仪(AFS-9760)测定滤液中As的含量。用总有机碳分析仪(Multi NC 3100,德国)测定吸附平衡后滤液的溶解性有机碳(DOC)浓度。
不同添加顺序HA的吸附实验:HA和As(Ⅲ)溶液的添加采取以下3种顺序:同时添加HA和As(Ⅲ)、先添加HA后添加As(Ⅲ)、先添加As(Ⅲ)后添加HA。后添加HA的步骤是:F1M4BC25吸附As(Ⅲ)溶液6 h平衡后,添加HA使得体系的HA浓度为50 mg·L-1,恒温振荡6 h,测定方法同上。后添加As(Ⅲ)的方法与后添加HA的步骤一致,每个处理重复3次。
不同pH条件下的吸附实验:称取0.1 g F1M4BC25置于50 mL棕色玻璃瓶中,分别加入10、20、30、40、50 mg·L-1含As(Ⅲ)溶液(以0.01 mol·L-1 NaNO3为电解质)20 mL,调节pH为3和6后,180 r·min-1恒温摇床振荡12 h,测定方法同上。
1.3 数据与分析吸附数据分别用Freundlich方程与Langmuir模型来描述。
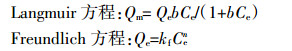
式中:Qe表示平衡时吸附量,mg·g-1;Ce表示平衡后溶液中吸附质的质量浓度,mg·L-1;Qm表示Langmuir吸附等温线的最大吸附容量,mg·g-1;kf,b,n分别为相应模型中的常数,其中b为Langmuir吸附特征常数,L·g-1,是表征吸附剂与吸附质之间亲和力的一个参数,b值越大,吸附亲和力越大[23]。
数据采用SPSS 17.0进行方差分析和差异显著性检验(P < 0.05),采用Origin 8.6绘图。
2 结果与分析 2.1 EDS表征分析每个样品均含有C、O、Si、Mn和Fe元素,其中主要成分是碳和氧,其他元素含量较小,Fe、Mn元素在材料中分布较为均匀,其物质的量之比约为1:4,与制备过程溶液中Fe、Mn投量比例基本一致。由于材料表面凹凸不平,存在块状结构以及粗糙不一的表面,F1M4BC25具有较大的比表面积,可为重金属离子的吸附提供较多的附着位点。F1M4BC25材料吸附As后,将出现较强的As吸收峰,质量浓度1.70%,显示As已被F1M4BC25吸附到表面(图 1)。

|
| 图 1 不同吸附条件下复合材料的EDS图 Figure 1 The photos of EDS of composite materials under different adsorption condition a为生物炭-铁锰氧化物的EDS图;b为生物炭-铁锰氧化物吸附HA后EDS图;c为生物炭-铁锰氧化物同时吸附As与HA的EDS图 a, the photos of F1M4BC25; b, the photos of F1M4BC25 adsorbed HA; c, the photos of F1M4BC25 adsorbed HA and As (Ⅲ) |
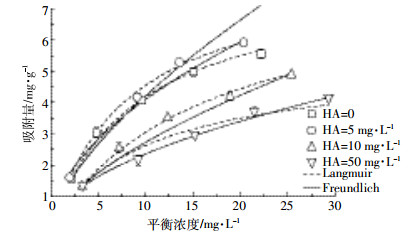
不同浓度的HA对F1M4BC25吸附As(Ⅲ)容量的影响存在明显差异(图 2)。HA浓度为5 mg·L-1可以促进F1M4BC25对As(Ⅲ)吸附,当HA浓度为10 mg·L-1和50 mg·L-1时会抑制F1M4BC25对As(Ⅲ)的吸附。
|
| 图 2 添加不同浓度HA后F1M4BC25吸附As(Ⅲ)的等温线 Figure 2 Adsorption isotherms of As (Ⅲ) by F1M4BC25 in different HA concentration |
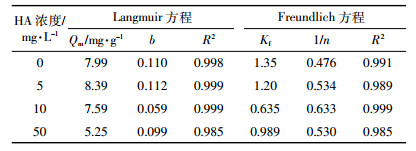
Langmuir和Freundlich吸附等温方程对吸附数据的拟合效果均较好(表 3),比较而言,Langmuir吸附等温方程拟合效果更好。加入5、10、50 mg·L-1的HA时,Qm分别为8.39、7.59、5.25 mg·g-1。相比未添加HA处理,添加5 mg·L-1的HA时Qm增加了5.00%,添加10 mg·L-1的HA时Qm降低了5.00%,添加50 mg·L-1的HA时Qm降低了34.3%。这说明添加不同浓度的HA对F1M4BC25吸附As(Ⅲ)有不同的影响,当HA浓度低时会增大材料对As(Ⅲ)的吸附,当浓度过大时就会抑制其吸附。
 |
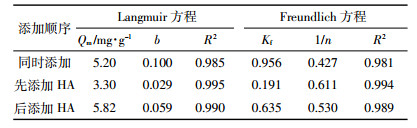
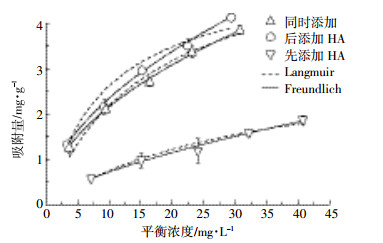
不同HA添加顺序对F1M4BC25吸附As(Ⅲ)的影响存在明显差异(图 3),As(Ⅲ)的吸附量大小顺序为后添加HA>同时添加>先添加HA,先添加HA对F1M4BC25吸附As(Ⅲ)的影响较大。
|
| 图 3 HA不同添加顺序的等温线 Figure 3 Effect of the order of added HA on the adsorption of As |
Langmuir和Freundlich吸附等温方程对吸附数据的拟合效果均较好(表 4),比较而言,Langmuir吸附等温方程拟合效果更好。后添加HA、同时添加、先添加HA时的吸附量分别为5.82、5.20、3.30 mg·g-1,相比未添加HA处理,后添加HA、同时添加、先添加HA时的吸附容量降低了27.2%、34.9%、58.7%,进一步说明高浓度HA会抑制材料对As(Ⅲ)的吸附,且HA与As(Ⅲ)的添加顺序影响了其吸附效果。
由图 4可知,吸附平衡后溶液的pH均增大,但在初始pH=3时增幅大于初始pH=6时。pH=3条件下pH从3.13增大到7.5~8.0,pH=6条件下pH从6.2增大到8.0~8.5,说明HA浓度以及添加顺序对溶液pH影响不大。
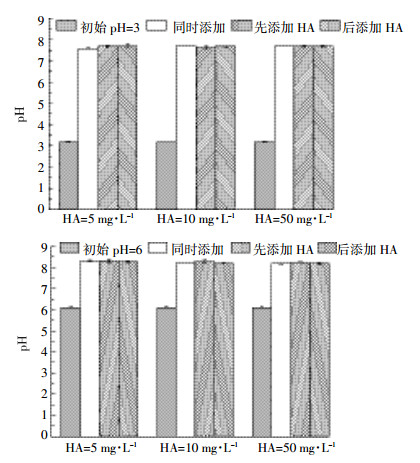
|
| 图 4 吸附平衡后溶液的pH Figure 4 pH of equilibrium concentrations in different order of added HA |
吸附平衡后上清液DOC浓度如图 5所示。在初始pH=3和pH=6两种条件下,DOC浓度大小顺序均为:后添加HA>同时添加>先添加HA,即F1M4BC25对HA吸附量大小顺序为先添加HA>同时添加>后添加HA,且HA添加的初始浓度对F1M4BC25吸附HA无明显影响,pH=3条件下DOC浓度明显大于pH=6时,平均浓度比pH=6时高16.1 mg·L-1。

|
| 图 5 吸附平衡后溶液的DOC含量 Figure 5 DOC of equilibrium concentrations in different order of added HA |
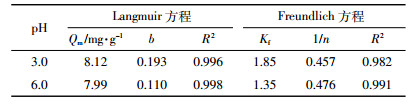
pH条件对F1M4BC25吸附As(Ⅲ)有一定的影响(图 6)。在pH=3时材料对As(Ⅲ)的吸附性能强于pH=6时,在pH=3时Qm为8.12 mg·L-1,而在pH=6时Qm为7.99 mg·L-1,说明一定的酸性条件有利于F1M4BC25对As(Ⅲ)的吸附。
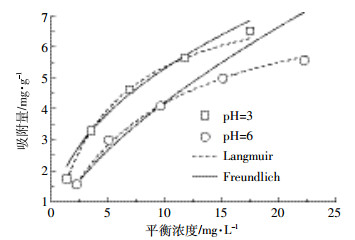
|
| 图 6 两种pH条件下F1M4BC25吸附As(Ⅲ)的等温线 Figure 6 Adsorption isotherms of As (Ⅲ) by F1M4BC25 in different pH |
采用Langmuir和Freundlich吸附等温方程对其进行拟合,结果如表 5所示。根据R2可知,Langmuir较Freundlich方程拟合度更高。材料F1M4BC25去除As无论是静电吸引,还是离子交换或配位络合,都是在As以阴离子形式存在而吸附剂带正电时最为有利,因而偏酸的溶液环境比较有利于F1M4BC25吸附As(Ⅲ)。
本实验发现添加HA对F1M4BC25吸附As(Ⅲ)有很大影响。有研究[24-25]表明随着有机酸含量的增加,As的毒性呈增强趋势。本研究发现,添加HA浓度为5 mg·L-1时可以促进F1M4BC25对As(Ⅲ)的吸附,当HA浓度为10 mg·L-1和50 mg·L-1时会抑制F1M4BC25对As(Ⅲ)的吸附,高浓度HA组对F1M4BC25吸附As(Ⅲ)的抑制作用强于低浓度组。原因可能是当HA浓度低时,由于F1M4BC25可以提供较多的吸附点位,HA与As并未形成竞争吸附,并且HA的添加可能会影响溶液的pH,进而增大吸附量;当HA增大到一定浓度时会与As产生竞争吸附,进而影响材料对As(Ⅲ)的吸附性能。F1M4BC25对As(Ⅲ)的吸附可以较好地用Langmuir方程拟合,拟合度(R2)均在0.98以上,说明F1M4BC25对As(Ⅲ)的吸附过程是单分子层吸附,呈现化学吸附特性,与谢亚巍[26]的研究结果一致。随着平衡浓度的增加,吸附量增速越来越缓慢并趋于稳定,主要是因为As(Ⅲ)浓度较低时可以很快进入吸附剂表面,此时以物理吸附为主;当As(Ⅲ)浓度较高时,As(Ⅲ)离子进入亲和力较高的吸附位点,此时以化学吸附为主,吸附速率降低。还有研究[11]表明HA的存在能够导致As的解吸,从而使溶液中As的含量增加,故HA的添加能够明显影响材料对As(Ⅲ)的吸附。这表明,添加不同浓度的HA对材料吸附As(Ⅲ)的影响不同。添加浓度为50 mg·L-1的HA时,As(Ⅲ)的吸附量大小顺序为:后添加HA>同时添加>先添加HA。宋康等[27]对HA影响针铁矿吸附磷也有相似的结论。在HA存在时As(Ⅲ)在F1M4BC25上的吸附强弱顺序为:As(Ⅲ)-F1M4BC25>As(Ⅲ)-F1M4BC25-HA>HA-F1M4BC25,说明F1M4BC25对As(Ⅲ)的亲和力大于HA。F1M4BC25对As(Ⅲ)吸附饱和后,加入HA后有很少的As(Ⅲ)被取代下来;而F1M4BC25对HA吸附饱和后,加入As(Ⅲ)溶液后能取代HA的吸附位点。Kong等[19]报道了腐植酸对负载铁锰氧化物沸石(NIMZ)吸附As的竞争影响,结果显示,As的吸附竞争性远强于HA。由实验测定吸附后上清液的DOC含量可知,体系对HA的吸附与As(Ⅲ)的添加顺序有很大关系。As(Ⅲ)与HA在F1M4BC25上产生竞争吸附,F1M4BC25对HA的吸附规律与对As(Ⅲ)的吸附规律相反。这在一定程度上反映了HA与As(Ⅲ)在F1M4BC25表面的竞争吸附机制,两种吸附质共同竞争F1M4BC25表面的吸附点位。
F1M4BC25在pH=3时对As(Ⅲ)的吸附量大于pH=6时,与范荣桂等[28]研究相似,说明F1M4BC25对As(Ⅲ)的吸附受pH影响显著。这与吸附剂表面的官能团种类和吸附质的离子状态有关,F1M4BC25表面碱性官能团含量较高,当pH=2~6.5时,As的形态以带一个单位的负电荷H2AsO4-为主;随着pH增大,溶液中OH-的亲和力大于H2AsO4-,吸附剂表面的活性位点被OH-夺取,对As(Ⅲ)的吸附能力下降。所以在一定pH范围内,增大环境的pH不利于材料对As(Ⅲ)的吸附。吸附平衡后,溶液的pH较初始pH有所增大,pH=3时的增幅大于pH=6时,HA浓度以及添加顺序对溶液pH影响不大,原因是F1M4BC25自身的pH影响了溶液的pH。另外,HA具有弱酸特性,对酸碱度有一定的缓冲作用。
4 结论(1)添加低浓度HA可以促进F1M4BC25对As(Ⅲ)的吸附,与未添加HA相比,添加5 mg·L-1的HA时最大吸附量增加了5.00%;添加高浓度HA会抑制F1M4BC25对As(Ⅲ)的吸附,与未添加HA相比,添加10 mg·L-1的HA时最大吸附量降低了5.00%,添加50 mg·L-1的HA时降低了34.3%。
(2)HA与As(Ⅲ)不同添加顺序下,F1M4BC25对As(Ⅲ)的吸附量大小顺序为:后添加HA>同时添加>先添加HA。上清液的DOC含量大小顺序为后添加HA>同时添加>先添加HA,由此可知,HA与As(Ⅲ)在F1M4BC25吸附表面形成竞争吸附,F1M4BC25对As(Ⅲ)的亲和力大于HA。
(3)F1M4BC25吸附As(Ⅲ)的吸附容量在初始pH=3时明显高于pH=6时,说明一定的酸性条件有利于材料对As的吸附;两种pH条件下吸附平衡后溶液的pH值均增大到8左右,说明F1M4BC25自身的pH以及HA的缓冲作用对实验条件影响较大。
| [1] | 蒋展鹏, 廖孟钧. 腐殖质及其在环境污染控制中的作用[J]. 环境污染与防治, 1990, 12(3) : 24–28. JIANG Zhan-peng, LIAO Meng-jun. Humic acid and its role in environment pollution control[J]. Environment Pollution and Control, 1990, 12(3) : 24–28. |
| [2] | Rao P, Mak M S H, Liu T, et al. Effects of humic acid on arsenic (Ⅴ) removal by zero-valent iron from groundwater with special references to corrosion products analyses[J]. Chemosphere, 2009, 75(2) : 156–162. DOI:10.1016/j.chemosphere.2008.12.019 |
| [3] | 黄永炳, 王丽丽, 李晓娟, 等. 砷形态转化及其环境效应研究[J]. 环境污染与防治, 2013, 35(1) : 16–19. HUANG Yong-bing, WANG Li-li, LI Xiao-juan, et al. Transformation of arsenic species and its environmental effect[J]. Environment Pollution and Control, 2013, 35(1) : 16–19. |
| [4] | Rodriguez-Lado L, Sun G, Berg M, et al. Groundwater arsenic contamination throughout China[J]. Science, 2013, 341(6148) : 866–868. DOI:10.1126/science.1237484 |
| [5] | Rahman M M, Ng J C, Naidu R. Chronic exposure of arsenic via drinking water and its adverse health impacts on humans[J]. Environment Geochemistry and Health, 2009, 31(Suppl 1) : 189–200. |
| [6] | Huang L H, Kong J J, Wang W L, et al. Study on Fe (Ⅲ) and Mn (Ⅱ) modied activated carbons derived from Zizania latifoliato removal basic fuchsin[J]. Desalination, 2012, 286 : 268–276. DOI:10.1016/j.desal.2011.11.034 |
| [7] | Huang Y H, Shih Y J, Cheng F J. Novel KMnO4-modified iron oxide for effective arsenite removal[J]. Journal of Hazardous Materials, 2011, 198(2) : 1–6. |
| [8] | Inyang M, Gao B, Yao Y, et al. Removal of heavy metals from aqueous solution by biochars derived from anaerobically digested biomass[J]. Bioresource Technology, 2012, 110(2) : 50–56. |
| [9] | 何忠明, 王琼, 付宏渊, 等. 柚子皮吸附去除水中的六价铬和砷[J]. 环境工程, 2016, 34(S1) : 299–302. HE Zhong-ming, WANG Qiong, FU Hong-yuan, et al. Adsorption removal of Cr (Ⅵ)/As in aqueous solution by pomelo peel[J]. Environmental Engineering, 2016, 34(S1) : 299–302. |
| [10] | Wang T, Liu W, Xiong L, et al. Influence of pH, ionic strength and humic acid on competitive adsorption of Pb (Ⅱ), Cd (Ⅱ) and Cr (Ⅲ) onto titanate nanotubes[J]. Chemical Engineering Journal, 2013, 215/216 : 366–374. DOI:10.1016/j.cej.2012.11.029 |
| [11] | 张彩凤, 李丽荣, 张树青, 等. 腐殖酸对砷的吸附作用研究[J]. 燃料化学学报, 2010, 38(6) : 733–738. ZHANG Cai-feng, LI Li-rong, ZHANG Shu-qing, et al. Adsorption of arsenic by humic acid[J]. Journal of Fuel Chemistry and Technology, 2010, 38(6) : 733–738. |
| [12] | Weng L P, Riemsdijk W H V, Hiemstra T. Effects of fulvic and humic acids on arsenate adsorption to goethite:Experiments and modeling[J]. Environmental Science & Technology, 2009, 43(19) : 7198–7204. |
| [13] | Ko I, Davis A P, Kim J Y, et al. Effect of contact order on the adsorption of inorganic arsenic species onto hematite in the presence of humic acid[J]. Journal of Hazardous Materials, 2007, 141(1) : 53–60. DOI:10.1016/j.jhazmat.2006.06.084 |
| [14] | Woolf D, AmonetteJ E, Street-perrott F A, et al. Sustainable biochar to mitigate global climate change[J]. Nature Communications, 2010(1) : 1–9. |
| [15] | 何绪生, 张树清, 佘雕, 等. 生物炭对土壤肥料的作用及未来研究[J]. 中国农学通报, 2011, 27(15) : 16–25. HE Xu-sheng, ZHANG Shu-qing, SHE Diao, et al. Effects of biochar onsoil and fertilizer and future research[J]. Chinese Agricultural Science Bulletin, 2011, 27(15) : 16–25. |
| [16] | Beesley L, Moreno E, Gomez J L, et al. A review of biochars' potential role in the remediation, revegetation and restoration of contaminated soils[J]. Environmental Pollution, 2011, 159(12) : 3269–3282. DOI:10.1016/j.envpol.2011.07.023 |
| [17] | 于志红, 黄一帆, 廉菲, 等. 生物炭-锰氧化物复合材料吸附砷(Ⅲ) 的性能研究[J]. 农业环境科学学报[J], 2015, 34(1) : 155–161. YU Zhi-hong, HUANG Yi-fan, LIAN Fei, et al. Adsorption of arsenic (Ⅲ) on biochar manganese oxide composites[J]. Journal of Agro-Environment Science, 2015, 34(1) : 155–161. |
| [18] | 朱瑾, 楼子墨, 王卓行, 等. 铁锰氧化物/碳基复合材料的制备及其对水中砷的去除[J]. 化学进展, 2014, 26(9) : 1551–1561. ZHU Jin, LOU Zi-mo, WANG Zhuo-hang, et al. Preparation of iron and manganese oxides/carbon composite materials for arsenic removal from aqueous solution[J]. Progress in Chemistry, 2014, 26(9) : 1551–1561. |
| [19] | Kong S Q, Wang Y X, Zhan H B, et al. Competitive adsorption of humic acid and arsenate on nanoscale iron-manganese binary oxide-loaded zeolite in groundwater[J]. Journal of Geochemical Exploration, 2014, 144 : 220–225. DOI:10.1016/j.gexplo.2014.02.005 |
| [20] | Liu G, Fernandez A, Cai Y. Complexation of arsenite with humic acid in the presence of ferriciron[J]. Environmental Science & Technology, 2011, 45(8) : 3210–3216. |
| [21] | 刘振中, 邓慧萍. 负载铁锰氧化物的活性炭除砷酸盐的性能研究[J]. 哈尔滨工业大学学报, 2010, 42(8) : 1317–1322. LIU Zhen-zhong, DENG Hui-ping. Arsenate removal performance on GAC impregnated with Fe-Mn oxide[J]. Journal of Harbin Institute of Technology, 2010, 42(8) : 1317–1322. |
| [22] | 梁咏梅, 刘伟, 马军. pH和腐植酸对高铁酸盐去除水中铅镉的影响[J]. 哈尔滨工业大学学报, 2003, 35(5) : 545–538. LIANG Yong-mei, LIU Wei, MA Jun. Effect of pH and humic acid on removal of lead and cadmium by combined ferrate pretreatment and alum coagulation[J]. Journal of Harbin Institute of Technology, 2003, 35(5) : 545–538. |
| [23] | Dong X L, Ma L Q, Li Y C. Characteristics and mechanisms of hexavalent chromium removal by biochar from sugar beet tailing[J]. Journal of Hazardous Materials, 2011, 190(1/2/3) : 909–915. |
| [24] | Jain A, Raven K P, Loeppert R H. Response to comment on "arsenite and arsenate adsorption on ferrihydrite:Surface charge reduction and net OH-release stoichiometry"[J]. Environmental Science & Technology, 1999, 33(20) : 3695. |
| [25] | Burton E D, Bush R T, Johnston S G, et al. Sorptionof arsenic (Ⅴ) and arsenic (Ⅲ) to schwertmannite[J]. Environmental Science & Technology, 2009, 43(24) : 9202–9207. |
| [26] | 谢亚巍.铁氧化物及其腐植酸复合物对砷的吸持特性研究[D].重庆:西南大学, 2012. XIE Ya-wei. Adsorption and desorption characteristics of arsenate on/from iron oxides and their complex with humic acid[D]. Chongqing:Southwest University, 2012. |
| [27] | 宋康, 符志友, 赵晓丽, 等. 腐植酸对针铁矿吸附磷的影响机理[J]. 环境科学研究, 2012, 25(8) : 904–910. SONG Kang, FU Zhi-you, ZHAO Xiao-li, et al. Mechanism of humic acid influence on the adsorption of phosphate on goethite[J]. Research of Environmental Sciences, 2012, 25(8) : 904–910. |
| [28] | 范荣桂, 姜清凤, 张世强, 等. 改性玉米秸秆对水中砷的吸附[J]. 环境工程学报, 2015, 9(11) : 5493–5498. FAN Rong-gui, JIANG Qing-feng, ZHANG Shi-qiang, et al. Adsorption of arsenic in water by modified corn straw[J]. Chinese Journal of Environmental Engineering, 2015, 9(11) : 5493–5498. |
 2017, Vol. 36
2017, Vol. 36