文章信息
- 张亚经, 马成仓, 郭军康, 韩磊, 冯人伟, 冯雪敏, 曹雲清, 王瑞刚
- ZHANG Ya-jing, MA Cheng-cang, GUO Jun-kang, HAN Lei, FENG Ren-wei, FENG Xue-min, CAO Yun-qing, WANG Rui-gang
- 接种伯克氏菌D54对东南景天吸收富集Cd的影响
- The effect of inoculating Burkholderia sp. D54 on cadmium uptake and accumulation in Sedum alfredii Hance
- 农业环境科学学报, 2017, 36(3): 449-457
- Journal of Agro-Environment Science, 2017, 36(3): 449-457
- http://dx.doi.org/10.11654/jaes.2016-1280
文章历史
- 收稿日期: 2016-10-08
2. 陕西科技大学环境科学与工程学院, 西安 710021;
3. 农业部环境保护科研监测所, 天津 300191;
4. 天津农学院农学与资源环境学院, 天津 300384
2. School of Environmental Science and Engineering, Shaanxi University of Science & Technology, Xi'an 710021, China;
3. Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China;
4. College of Agronomy & Resources and Environment, Tianjin Agricultural University, Tianjin 300384, China
Cd污染在世界范围内广泛存在并日益严重,我国受Cd污染的土地面积已超过1.3万hm2[1]。2011年4月国务院批复了“重金属污染综合防治十二五规划”,Cd被列为第一类规划对象,明确提出,要开展农产品产地重金属污染治理与修复。
植物修复技术具有经济、环保等优点而备受关注。超积累生态型东南景天(HE)是自然进化的Cd和Zn超富集植物,属景天科,虽然在植物修复领域具有很大的应用前景[2],但因其生物量小,以及土壤中重金属生物有效性低而严重限制了植物修复效率的提高,成为植物修复的瓶颈[3]。近年来,利用添加植物促生菌(如伯克氏菌)来强化植物修复,因其不仅可以促进植物生长,增加植物对重金属的绝对吸收量,大幅提高植物修复效率,而且施用成本低、环境友好,越来越受到关注[4-9]。
伯克氏菌是一种植物促生菌,可定植于植物根部和根际,与豆科和非豆科植物宿主共生结瘤,在植物微生物联合修复领域被广泛关注与应用[10]。但因伯克氏菌的种类、试验条件以及宿主植物的不同,接种伯克氏菌对植物吸收、转运和富集Cd的影响也不相同[4, 6, 11-13]。我们前期研究发现,土培盆栽条件下伯克氏菌D54(Burkholderia sp. D54)能显著增加HE根部和地上部的Cd含量[6],但在水培条件下伯克氏菌D54却显著降低了番茄茎部Cd含量[11]。同时,陆仲烟[12]研究也发现,在水培条件下伯克氏菌D54降低了水稻地上部Cd含量和根部向地上部的转移系数。另外,Dourado等[13]也得出耐Cd的伯克氏菌SCMS54不仅促进了番茄生长,而且能降低根部对Cd的吸收,提高其耐性。但Li等[4]研究却发现水培条件下,伯克氏菌(Burkholderia cepacia)能降低HE根部的Cd含量、增加地上部的Cd含量,提高根部向地上部转移Cd的能力。目前,关于伯克氏菌D54在水培条件下对HE和非超积累生态型东南景天(NHE)吸收和富集Cd的研究还未见报道。
在前期研究中,我们利用非损伤微测技术研究发现,10 μmol·L-1 CdCl2处理2 h后,HE的Cd2+内流速率显著高于NHE,并进一步证实HE根、茎、叶对Cd的超富集能力可能源于HE根对Cd的强吸收能力[14]。非损伤微测技术是一种选择性微电极技术,在不损伤活体样品的情况下,能真实反映植物根系吸收Cd2+的动态变化[15],而关于伯克氏菌D54处理对两种东南景天根系动态吸收Cd2+的影响还未见报道。
Cd是植物生长的非必需元素,可以通过Zn2+、Mg2+、Fe2+、Mn2+等离子通道或者离子载体进入植物体内,同时Cd也影响这些矿质元素的吸收,并且因植物种类和Cd处理浓度、时间的不同,表现出复杂的效应[16]。Zhou等[17]研究发现,Cd处理能显著增加HE根、茎、叶中Fe的含量,以及茎、叶中Zn的含量,但对各器官中Mg的含量没有显著影响。万雪琴等[18]发现,Cd胁迫增加了3种杨树叶片中Mg的含量。许多研究发现Cd胁迫导致了Mn含量的降低[18-20],也有研究发现植物中Mn的含量因Cd处理浓度的高低而有不同的响应[22-23]。但关于Cd胁迫对HE和NHE中Mn含量的影响,以及接种伯克氏菌D54后Cd胁迫对HE和NHE中Fe、Mn、Mg、Zn含量的影响尚未见报道。
为此,本论文利用水培盆栽试验,研究了伯克氏菌D54对HE和NHE不同组织富集Cd的影响,并通过非损伤微测技术从根系吸收Cd2+的动态变化以及Cd处理对Fe、Mn、Mg、Zn等二价阳离子的影响等方面探讨伯克氏菌D54对HE和NHE吸收和富集Cd的机制,以期为将来利用伯克氏菌提高植物修复效率,突破植物修复的瓶颈提供数据支持。
1 材料与方法 1.1 试验材料 1.1.1 东南景天的培养超积累生态型东南景天(HE)和非超积累生态型东南景天(NHE)均由浙江大学提供。选取健康和长势相似的HE和NHE茎段,从顶端往下8 cm处剪断,去掉下部4 cm左右的叶片,在紧靠叶片处用2 cm过滤棉裹紧,插入自来水中培养两周,待根长至1 cm左右,换置1/4东南景天营养液培养一周,继续发根,之后换置1/2东南景天营养液培养,待根长至5 cm左右时进行Cd和伯克氏菌D54处理。整个试验在人工气候室中进行,温度为26 ℃、湿度为80 %,光照为16 h,24 h通气。
东南景天完全营养液的配方[24]:2.00 mmol·L-1 Ca(NO3)·4H2O、0.10 mmol·L-1 KH2PO4、0.50 mmol·L-1 MgSO4·7H2O、0.10 mmol·L-1 KCl、0.70 mmol·L-1 K2SO4、10.00 μmol·L-1 H3BO3、0.50 μmol·L-1 MnSO4·H2O、5.00 μmol·L-1 ZnSO4·7H2O、0.20 μmol·L-1 CuSO4·5H2O、0.01 μmol·L-1(NH4)6Mo7O24、100 μmol·L-1 Fe-EDTA,用0.1 mol·L-1 NaOH或HCl溶液调pH值为5.5~5.8。
1.1.2 伯克氏菌液的制备参考Guo等[6]伯克氏菌D54(Burkholderia sp. D54)的培养方法,简单描述如下:在无菌操作台上按照1:100的比例接种伯克氏菌原液(由农业部环境保护科研监测所提供)到灭菌后的6号液体培养基中(6号培养基组成:甘露醇10 g、(NH4)2SO4 2 g、蛋白胨2 g、K2HPO4 0.5 g、MgSO4·7H2O 0.05 g、MnSO4·H2O 0.1 g、FeSO4·7H2O 0.05 g、酵母粉0.1 g、超纯水1 L),然后在28 ℃、180 r·min-1摇床里培养3 d,在25 ℃条件下离心10 min(10 000 r·min-1)。去掉上清液,再用灭菌水重新悬浮菌体,重复2次,最后按原体积加入灭菌水,得到新培养的伯克氏菌原液,然后再按照1%(V:V)的比例加到培养液中,即为1%伯克氏菌处理液(1%菌),菌体密度约为1×106 CFU·mL-1,菌液中活菌数量满足接种实验要求。
1.2 试验处理及样品采集选取生长良好和长势相似的HE和NHE移入1 L的1/2东南景天营养液中,并进行相应的Cd和伯克氏菌D54处理,设置5个处理,分别为:CK,10 μmol·L-1 Cd,10 μmol·L-1 Cd+1%菌,100 μmol·L-1 Cd,100 μmol·L-1 Cd+1%菌,每个处理设置8个重复。由于NHE不耐Cd,在100 μmol·L-1 Cd处理下会死亡,NHE缺少100 μmol·L-1 Cd和100 μmol·L-1 Cd+1%菌两个处理。每周换2次培养液,连续培养3周,其中前2周均进行接种处理。在处理2周后进行Cd2+流速测定。处理3周后,将HE和NHE分为根、茎、叶三部分,根部先用20 mmol·L-1 Na2-EDTA交换20 min,再分别用自来水和超纯水冲洗,茎和叶直接用自来水和超纯水冲洗,105 ℃杀青30 min,70 ℃烘干至恒重,粉碎后用于Cd和其他矿质元素的测定。
1.3 Cd2+流速测定首先将根系放在与培养液Cd浓度相同的测试液中(10 μmol·L-1或100 μmol·L-1 CdCl2,50 mmol·L-1 CaCl2,pH 5.5)浸泡10 min,然后利用非损伤微测系统(BIO001A;Younger USA,LLC,MA,USA)对根系的Cd2+流速进行实时监测。具体测量参考Sun等[14]方法,分别测定与根尖距离为0、200、300、500 μm的Cd2+流速(图 1),每个处理测定8个重复的根系,负值代表Cd2+内流,正值则代表Cd2+外流。

|
| 图 1 根尖Cd2+流速的测定部位 Figure 1 Measuring position of Cd2+ flux in root tip |
分别称取根、茎、叶烘干样品0.100 0 g,放入消煮管中,用绿茶成分分析标准物质设置标准品(GBW10052(GSB-30),地球物理地球化学勘查研究所,2010),并设置空白,加入微电子级浓硝酸10 mL,在智能电热消解仪消煮(ED54,LabTech,中国),具体流程为:80 ℃煮1.5 h,120 ℃煮1.5 h,150 ℃煮2 h,175 ℃赶酸至消煮液体积小于1 mL,用1%硝酸溶液转移定容至50 mL容量瓶中,定量滤纸过滤后用电感耦合等离子体质谱仪(ICP-MS)测定Cd、Fe、Mg、Mn、Zn等元素含量。
1.5 数据分析所有数据均用SPSS 17.0进行分析,多重比较采用Duncan法,并利用Origin 8.5软件作图。
2 结果与分析 2.1 HE和NHE根、茎、叶中Cd的含量如图 2所示,Cd处理后HE和NHE的东南景天根、茎、叶中Cd含量显著增加。HE茎、叶中的Cd含量均显著高于NHE,HE叶片的Cd含量显著高于根和茎,而NHE正好相反,叶的Cd含量显著低于根和茎。伯克氏菌D54处理显著降低了HE和NHE茎、叶中Cd的含量,以及NHE根中Cd的含量。对于HE,100 μmol·L-1 Cd处理下,各器官Cd含量均显著高于10 μmol·L-1 Cd处理。
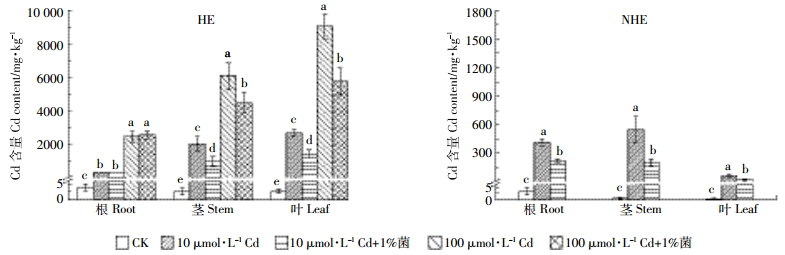
|
| 图 2 HE和NHE根、茎、叶Cd含量 Figure 2 The Cd content of root, stem and leaf in HE and NHE 不同的字母表示同一部位不同处理间存在显著差异(P < 0.05,n=8) Different letters mean significant difference among the treatments in the same organ (P < 0.05, n=8) |
如图 3所示,在10 μmol·L-1 Cd处理下,在距根尖0、200、300、500 μm处HE的Cd2+内流速率均高于NHE。伯克氏菌处理显著降低了HE和NHE在距根尖0、200、300 μm处的Cd2+内流速率。对于HE,100 μmol·L-1 Cd处理下根部的Cd2+内流速率均显著大于10 μmol·L-1 Cd处理。另外,HE和NHE均在距根尖200 μm处内流速率最大。

|
| 图 3 HE和NHE根尖Cd2+流速 Figure 3 The Cd2+ flux of root tip in HE and NHE 不同的字母表示根尖相同部位不同处理间存在显著差异(P < 0.05,n=8) Different letters mean significant difference between the treatments in the same position of root tip (P < 0.05, n=8) |
如图 4所示,在所有处理中,HE茎/根、叶/根Cd的转移系数均显著大于NHE。HE叶/根Cd的转移系数显著高于茎/根,NHE则相反,叶/根Cd的转移系数显著低于茎/根。与10 μmol·L-1 Cd处理相比,100 μmol·L-1 Cd处理后HE茎/根、叶/根Cd的转移系数显著降低。在两个Cd处理浓度下,伯克氏菌处理降低了HE和NHE茎/根、叶/根Cd的转移系数,除100 μmol·L-1 Cd处理下茎/根Cd的转移系数外,HE茎/根、叶/根Cd的转移系数均达到显著水平。
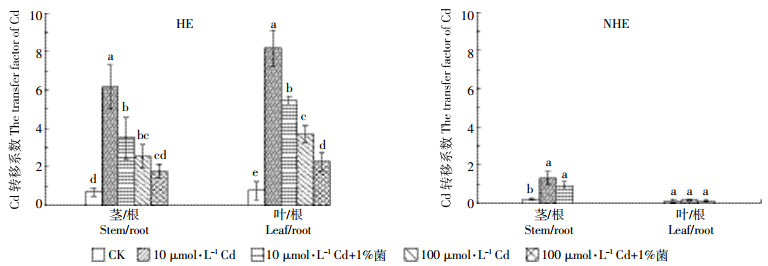
|
| 图 4 HE和NHE的Cd转移系数 Figure 4 The transfer factor of Cd in HE and NHE 不同的字母表示茎/根、叶/根Cd的转移系数在不同处理间存在显著差异(P < 0.05,n=8) Different letters mean significant difference among the treatments in the transfer factor of Cd in stem/root or leaf/root (P < 0.05, n=8) |
如图 5所示,在所有处理条件下,HE和NHE根中的Fe、Mn含量显著高于茎和叶,茎中Mg的含量显著高于根和叶(除NHE在对照条件下外)。不同的是,HE茎叶中Zn含量显著高于NHE,且HE茎的Zn含量最高,而NHE根的Zn含量最高。
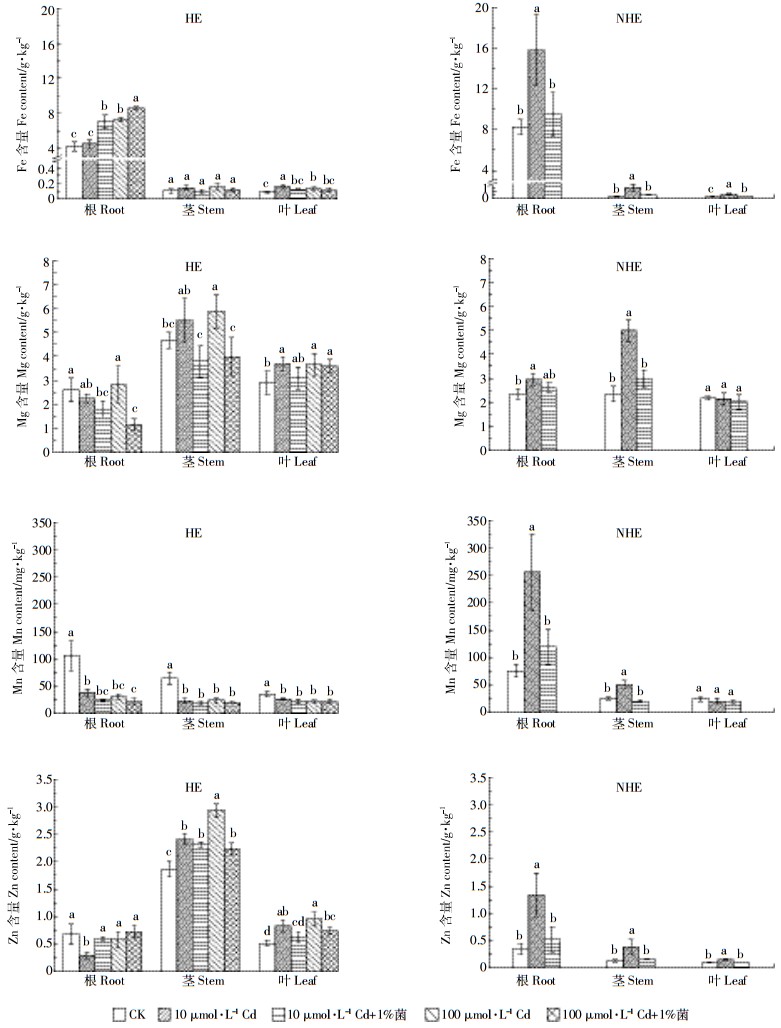
|
| 图 5 HE和NHE根、茎、叶中Fe、Mg、Mn、Zn的含量 Figure 5 The Fe, Mg, Mn and Zn content of root, stem and leaf in HE and NHE 不同的字母表示同一部位不同处理间存在显著差异(P < 0.05,n=8) Different letters mean significant difference among the treatments in the same organ (P < 0.05, n=8) |
Cd处理不同程度地增加了HE和NHE根、茎、叶中Fe和Zn(除HE的根外)的含量以及茎中Mg的含量,Cd处理还显著增加了HE叶和NHE根中Mg的含量。不同的是,Cd处理显著降低了HE根、茎、叶中Mn的含量,却显著增加了NHE根和茎中Mn的含量,对NHE叶中Mn含量无显著影响。
除不同程度增加了HE根中Fe、Zn含量外,伯克氏菌D54均不同程度地降低了HE和NHE根、茎、叶中Fe、Mg、Mn和Zn的含量。
3 讨论 3.1 接种伯克氏菌D54对HE和NHE吸收、转运和富集Cd的影响许多研究表明,在相同Cd浓度处理下,HE茎、叶中Cd含量显著高于NHE,且HE叶/根和茎/根Cd的转移系数显著高于NHE[2, 25-26]。本研究也发现相同的结果,10 μmol·L-1 Cd处理下,HE茎、叶中Cd含量显著高于NHE,且HE茎/根、叶/根Cd的转移系数均显著大于NHE(图 2和图 4)。这说明HE对Cd的富集能力要显著高于NHE,且HE从根转运Cd到茎和叶的能力要显著高于NHE。另外,本研究还发现,HE叶/根Cd的转移系数显著高于茎/根,而NHE叶/根Cd的转移系数要显著低于茎/根,说明HE从茎转运Cd到叶的能力显著高于NHE。与10 μmol·L-1 Cd处理相比,100 μmol·L-1 Cd处理下HE叶/根和茎/根Cd的转移系数显著降低,说明随着Cd处理浓度的增加,HE将Cd从根转运至地上部的比例降低[27]。
HE茎、叶对Cd的超富集能力可能源于HE根对Cd的强吸收能力。Sun等[14]发现,经10 μmol·L-1 CdCl2处理2 h后,HE的Cd2+内流速率显著高于NHE。本研究也发现,10 μmol·L-1 Cd处理后HE根尖不同部位Cd2+内流速率显著高于NHE(图 3)。这进一步表明,HE各器官对Cd的超富集能力与根部对Cd的强吸收能力密切相关。另外,本研究还发现100 μmol·L-1 Cd处理下HE根尖各部位Cd2+内流速率均显著大于10 μmol·L-1 Cd处理(图 3)。这说明随着Cd处理浓度的增加,根系对Cd2+的吸收速率也增加,进而导致HE各器官中Cd富集量显著增加(图 2)。
伯克氏菌D54是本研究团队从广东大宝山Cd污染土壤中分离获得的,它能产生生长素、ACC脱氨酶、铁载体及溶解无机磷,并通过与植物的相互作用提高植物对重金属的耐性[6]。同时,本研究团队发现土培盆栽条件下,伯克氏菌D54能显著增加HE根部和地上部的Cd含量[6],但在水培条件下却显著降低了番茄茎部Cd含量[11]。陆仲烟[12]利用水培方法在水稻上也得出相似的结果,伯克氏菌D54降低了水稻地上部Cd含量和根部向地上部的转移系数。本研究的结果发现,伯克氏菌D54处理显著降低了HE和NHE茎、叶中Cd的含量,以及茎/根、叶/根Cd的转移系数。这表明伯克氏菌D54在水培条件下能降低HE和NHE地上部对Cd的富集,同时降低了Cd从根部转移至地上部的比例。Dourado等[13]也得出相同的结论,耐Cd伯克氏菌SCMS54不仅促进了番茄生长,而且能降低根部对Cd的吸收,提高其耐性。但Li等[4]研究却发现水培条件下,从东南景天根部分离的伯克氏菌(Burkholderia cepacia)能够降低根部Cd含量、增加地上部的Cd含量,提高根部向地上部转移Cd的能力。这说明由于培养条件以及伯克氏菌种类的差别,伯克氏菌对不同植物吸收、转移和富集Cd的影响也不相同。本研究还发现,伯克氏菌D54处理显著降低了HE和NHE在距根尖0、200、300 μm处的Cd2+内流速率。这进一步表明,伯克氏菌D54能减小HE和NHE根系对Cd2+的吸收速率,从而减少HE和NHE地上部对Cd的富集。
3.2 接种伯克氏菌D54和Cd处理对HE和NHE植株Zn、Mg、Fe、Mn含量的影响Cd是植物生长的非必需元素,可以通过Zn2+、Mg2+、Fe2+、Mn2+等离子通道或者离子载体进入植物体内,同时Cd也影响这些矿质元素的吸收,并且因植物种类和Cd处理浓度时间的不同,表现出复杂的效应[16]。本研究结果发现,Cd处理增加了HE和NHE根、茎、叶中Fe和Zn的含量(除HE的根外)。前人研究也发现,Cd处理能显著增加HE根、茎、叶中Fe的含量[17],同时也能增加茎、叶中Zn的含量[17, 27]。Zhou等[17]发现,Cd胁迫下HE叶片中Fe含量的增加有助于叶绿素含量的增加,而Zn含量的增加则表明Cd和Zn在东南景天植物中具有协同吸收和转运的作用。这一结论在本研究中得到了进一步证实。
本研究还发现,Cd处理增加了HE和NHE茎中Mg的含量以及HE叶中Mg的含量,但对NHE叶中Mg的含量没有显著影响(图 5)。Mg是叶绿素合成的重要金属元素,这说明Cd处理能促进Mg在HE茎中富集,并能将Mg转运至叶片中促进叶绿素更多的合成,从而促进HE光合作用的进行;而Cd仅促进了Mg在NHE茎中的富集,并不能促进更多的Mg转移至叶片。Zhou等[17]发现Cd的增加没有对HE各器官中Mg的含量有显著影响,但万雪琴等[18]发现Cd胁迫增加了三种杨树叶片中Mg的含量。这说明Cd胁迫对植物Mg含量的影响可能与植物品种以及Cd处理浓度等因素有关,其机理还有待进一步研究[28]。
两种东南景天不同部位Mn含量表现出明显的不同,Cd处理显著降低了HE根、茎、叶中Mn的含量,却显著增加了NHE根和茎中Mn的含量,对叶中Mn的含量则无显著影响(图 5)。这可能与Cd和Mn的竞争吸收有关,HE因对Cd的强吸收和富集作用,导致Mn在植株中的积累降低。相似的结果也在杨树[18]、籽粒苋[19]、柳树[20]、大白菜[21]等植物上得到了验证。而NHE在Cd处理后根和茎中Mn含量显著增加,一方面可能与NHE吸收和富集Cd的能力较弱有关,另一方面可能与植物品种及Cd处理浓度有关。郭智等[22]发现低浓度Cd促进了龙葵茎和叶Mn含量增加,而高浓度Cd处理下茎叶Mn含量又下降;李君等[23]则发现低浓度Cd抑制蓖麻根、茎、叶中Mn含量的增加,而高浓度Cd处理促进了蓖麻对Mn的吸收和富集。
HE茎叶中Zn含量显著高于NHE,且HE茎中Zn含量最高,而NHE根中Zn含量最高(图 5)。这说明HE在超富集Cd的同时,对Zn的吸收和富集能力也强于NHE,同时HE从根转运Zn至地上部的能力也强于NHE。这可能与HE是Cd/Zn的超富集植物,同时Cd和Zn是同族元素,具有相似的化学性质有关。HE在Cd和Zn的分配上有差异,Cd在叶片中富集最高,而Zn在茎中最高,揭示Cd与Zn在HE中积累和运输机制不同。卢玲丽[29]也得出相同的结论。
前人的研究显示,Cd与Zn2+、Mg2+、Fe2+、Mn2+等离子具有相同的转运通道或载体[16]。前面的讨论也证实Cd处理下随着两种东南景天组织中Cd含量的增加,Fe、Mg、Zn和Mn(除HE)的含量也显著增加。本研究的结果显示,接种伯克氏菌D54不仅显著降低HE和NHE茎、叶中Cd的含量以及根尖对Cd2+的吸收速率,而且也不同程度地降低了Fe、Mg、Mn和Zn的含量(图 5)。由此我们推测,接种伯克氏菌D54可能抑制了Cd、Fe、Mg、Zn和Mn相同的转运通道或者载体,进而在减少Cd吸收和富集的同时,也减少了对Fe、Mg、Zn和Mn的富集。
4 结论HE对Cd的转运和富集能力显著高于NHE,且HE对Cd超富集能力与根部对Cd的强吸收能力密切相关。Cd处理促进了HE和NHE对Fe、Zn和Mg的富集,抑制了HE对Mn的富集和促进了NHE对Mn的富集。接种伯克氏菌D54在减少HE和NHE对Cd吸收和富集的同时,也导致了Fe、Mg、Mn和Zn富集的减少。该研究不仅丰富了接种伯克氏菌影响东南景天吸收和富集Cd的机制,而且证实试验条件的不同会改变伯克氏菌对东南景天的作用效果。
| [1] | 徐良将, 张明礼, 杨浩. 土壤重金属镉污染的生物修复技术研究进展[J]. 南京师大学报 (自然科学版), 2011, 34(1): 102–106. XU Liang-jiang, ZHANG Ming-li, YANG Hao. Reaearch progress of bioremediation technology of cadmium polluted soil[J]. Journal of Nan-jing Normal University (Natural Sciences Edition), 2011, 34(1): 102–106. |
| [2] | 熊愈辉.东南景天对镉的耐性生理机制及其对土壤镉的提取与修复作用的研究[D].杭州:浙江大学, 2005. XIONG Yu-hui. Physiological mechanisms of cadmium tolerance and phytoextraction in Sedum alfredii Hance[D]. Hangzhou:Zhejiang University, 2005. |
| [3] | 韦朝阳, 陈同斌. 重金属污染植物修复技术的研究与应用现状[J]. 地球科学进展, 2002, 17(6): 833–839. WEI Chao-yang, CHEN Tong-bin. An prerview on the status of research and application of heavy metal phytormediation[J]. Advance in Earth Sciences, 2002, 17(6): 833–839. |
| [4] | Li W C, Ye Z H, Wong M H. Effects of bacteria on enhanced metal uptake of the Cd/Zn-hyperaccumulating plant, Sedum alfredii[J]. Journal of Experimental Botany, 2007, 58(15/16): 4173–4182. |
| [5] | Jiang C Y, Sheng X F, Qian M, et al. Isolation and characterization of a heavy metal-resistant Burkholderia sp. from heavy metal-contaminated paddy field soil and its potential in promoting plant growth and heavy metal accumulation in metal-polluted soil[J]. Chemosphere, 2008, 72(2): 157–164. DOI:10.1016/j.chemosphere.2008.02.006 |
| [6] | Guo J K, Tang S R, Ju X H, et al. Effects of inoculation of a plant growth promoting rhizobacterium Burkholderia sp. D54 on plant growth and metal uptake by a hyperaccumulator Sedum alfredii Hance grown on multiple metal contaminated soil[J]. World Journal of Microbiology and Biotechnology, 2011, 27(12): 2835–2844. DOI:10.1007/s11274-011-0762-y |
| [7] | Tang S R, Liao S Q, Guo J K, et al. Growth and cesium uptake responses of Phytolacca americana Linn. and Amaranthus cruentus L. grown on cesium contaminated soil to elevated CO2 or inoculation with a plant growth promoting rhizobacterium Burkholderia sp. D54, or in combination[J]. Journal of Hazardous Materials, 2011, 198: 188–197. DOI:10.1016/j.jhazmat.2011.10.029 |
| [8] | Song N N, Zhang X M, Wang F L, et al. Elevated CO2 increases Cs uptake and alters microbial communities and biomass in the rhizosphere of Phytolacca americana Linn (pokeweed) and Amaranthus cruentus L. (purple amaranth) grown on soils spiked with various levels of Cs[J]. Journal of Environmental Radioactivity, 2012, 112: 29–37. DOI:10.1016/j.jenvrad.2012.03.002 |
| [9] | Song N N, Wang F L, Zhang C B, et al. Fungal inoculation and elevated CO2 mediate growth of Lolium mutiforum and Phytolacca americana, metal uptake, and metal bioavailability in metal-contaminated soil:Evidence from DGT measurement[J]. International Journal of Phytoremediation, 2013, 15(3): 268–282. DOI:10.1080/15226514.2012.694500 |
| [10] | Moulin L, Munive A, Dreyfus B, et al. Nodulation of legumes by members of the β-subclass of Proteobacteria[J]. Nature, 2001, 411(6840): 948–950. DOI:10.1038/35082070 |
| [11] | 郭军康.耐Cd植物促生菌对番茄幼苗生长及Cd吸收转运的影响机制[D].天津:天津大学, 2013. GUO Jun-kang. Effects of Cd-tolerant plant growth promoting rhizobacteria on mechanisms of tomato seedlings growth Cd uptake and transport[D]. Tianjin:Tianjin University, 2013. |
| [12] | 陆仲烟.伯克氏菌和基因型对水稻及大麦镉积累特性的影响[D].北京:中国农业科学院, 2014. LU Zhong-yan. Effects of Burkholderia bacteria and genotype on cadmium accumulation of rice and barley[D]. Beijing:Chinese Academy of Agricultural Sciences, 2014. |
| [13] | Dourado M N, Martins P F, Quecine M C, et al. Burkholderia sp. SCMS54 reduces cadmium toxicity and promotes growth in tomato[J]. Annals of Applied Biology, 2013, 163(3): 494–507. |
| [14] | Sun J, Wang W G, Liu Z Q, et al. Non-invasive microelectrode cadmium flux measurements reveal the spatial characteristics and real-time kinetics of cadmium transport in hyperaccumulator and nonhyperaccumulator ecotypes of Sedum alfredii[J]. Journal of Plant Physiology, 2013, 170(3): 355–359. DOI:10.1016/j.jplph.2012.10.014 |
| [15] | 李静, 韩庆庆, 段丽婕, 等. 非损伤微测技术在植物生理学研究中的应用及进展[J]. 植物生理学报, 2014, 50(10): 1445–1452. LI Jing, HAN Qing-qing, DUAN Li-jie, et al. Applications and advances of non-invasive micro-test technique in plant physiology researches[J]. Plant Physiology Journal, 2014, 50(10): 1445–1452. |
| [16] | Zhang X F, Gao B, Xia H P. Effect of cadmium on growth, photosynthesis, mineral nutrition and metal accumulation of bana grass and vetiver grass[J]. Ecotoxicology and Environmental Safety, 2014, 106: 102–108. DOI:10.1016/j.ecoenv.2014.04.025 |
| [17] | Zhou W B, Qiu B S. Effects of cadmium hyperaccumulation on physiological characteristics of Sedum alfredii Hance (Crassulaceae)[J]. Plant Science, 2005, 169(4): 737–745. DOI:10.1016/j.plantsci.2005.05.030 |
| [18] | 万雪琴, 张帆, 夏新莉, 等. 镉胁迫对杨树矿质营养吸收和分配的影响[J]. 林业科学, 2009, 45(7): 45–51. WAN Xue-qin, ZHANG Fan, XIA Xin-li, et al. Effects of cadmium stress on absorption and distribution of mineral nurtients in poplar plants[J]. Scientia Silvae Sinicae, 2009, 45(7): 45–51. |
| [19] | 李虹颖, 苏彦华. 镉对籽粒苋耐性生理及营养元素吸收积累的影响[J]. 生态环境学报, 2012, 21(2): 308–313. LI Hong-ying, SU Yan-hua. Effect of cadmium on tolerance physiology and nutrient accumulation in Amaranthus hypochondriacus L.[J]. Ecology and Environmental, 2012, 21(2): 308–313. |
| [20] | 杨卫东, 陈益泰, 王树凤. 镉胁迫对旱柳矿质营养吸收的影响[J]. 林业科学研究, 2009, 22(3): 618–622. YANG Wei-dong, CHEN Yi-tai, WANG Shu-feng. Effects of cadmium stress on mineral nutrient uptake of Salix matsudana[J]. Forest Research, 2009, 22(3): 618–622. |
| [21] | 刘志华, 伊晓云, 曾其龙, 等. 低浓度镉对大白菜苗期生长及营养元素吸收积累的影响研究[J]. 土壤, 2008, 40(4): 630–634. LIU Zhi-hua, YI Xiao-yun, ZENG Qi-long, et al. Study on growth and accumulation of nutrient elements in Chinese Cabbage at seedling stage under low Cd stress[J]. Soils, 2008, 40(4): 630–634. |
| [22] | 郭智, 原海燕, 奥岩松. 镉胁迫对龙葵幼苗光合特性和营养元素吸收的影响[J]. 生态环境学报, 2009, 18(3): 824–829. GUO Zhi, YUAN Hai-yan, AO Yan-song. Effect of cadmium on photosynthesis and nutrient elements uptake of Solanum nigrum L. seedlings[J]. Ecology and Environmental, 2009, 18(3): 824–829. |
| [23] | 李君, 葛跃, 王明新, 等. 镉对蓖麻耐性生理及营养元素吸收转运的影响[J]. 环境科学学报, 2016, 36(8): 3081–3087. LI Jun, GE Yue, WANG Ming-xin, et al. Effect of Cd on tolerance physiology, nutrients uptake and translocation in Ricinus communis L.[J]. Acta Scientiae Circumstantiae, 2016, 36(8): 3081–3087. |
| [24] | 杨肖娥, 龙新宪, 倪吾钟, 等. 古老铅锌矿山生态型东南景天对锌耐性及超积累特性的研究[J]. 植物生态学报, 2001, 25(6): 665–672. YANG Xiao-e, LONG Xin-xian, NI Wu-zhong, et al. Zinc tolerance and hyperaccumulation in a new ecotype of Sedum alfredii Hance[J]. Acta Phytoecologica Sinica, 2001, 25(6): 665–672. |
| [25] | 朱艳霞.东南景天 (Sedum alfredii Hance) 对镉的超积累与有机酸含量变化的关系[D].杭州:浙江大学, 2006. ZHU Yan-xia. The relation of organie acids and Cd accumulation in Sedum alfredii Hance[D]. Hangzhou:Zhejiang University, 2006. |
| [26] | 倪天华.东南景天 (Sedum alfredii Hance) 对镉特异吸收和积累特性的研究[D].杭州:浙江大学, 2003. NI Tian-hua. Mechanisms of cadmium uptake and accumulation in Sedum alfredii Hance[D]. Hangzhou:Zhejiang University, 2003. |
| [27] | 叶海波, 杨肖娥, 何冰, 等. 东南景天对锌镉复合污染的反应及其对锌镉吸收和积累特性的研究[J]. 农业环境科学学报, 2003, 22(5): 513–518. YE Hai-bo, YANG Xiao-e, HE Bing, et al. Response of Sedum alfredii Hance towards Cd/Zn complex-pollution and accumulation of the heavy metals[J]. Journal of Agro-Enviroment Science, 2003, 22(5): 513–518. |
| [28] | 张金彪, 黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报, 2000, 20(3): 514–523. ZHANG Jin-biao, HUANG Wei-nan. Advances on physiological and ecological effects of cadmium on plants[J]. Acta Ecologica Sinica, 2000, 20(3): 514–523. |
| [29] | 卢玲丽.超积累植物东南景天 (Sedum alfredii Hance) 对镉的吸收及转运机制研究[D].杭州:浙江大学, 2009. LU Ling-li. Cadmium uptake and translation in the hyperaccumulator Sedum alfredii Hance[D]. Hangzhou:Zhejiang University, 2009. |
 2017, Vol. 36
2017, Vol. 36




