文章信息
- 陈柯罕, 张科, 李取生, 胡妮, 徐智敏, 魏佳
- CHEN Ke-han, ZHANG Ke, LI Qu-sheng, HU Ni, XU Zhi-min, WEI Jia
- 四种盐生植物对Cd Pb复合污染提取修复效果比较研究
- Remediation effects of four halophytes on Cd and Pb compound pollution
- 农业环境科学学报, 2017, 36(3): 458-465
- Journal of Agro-Environment Science, 2017, 36(3): 458-465
- http://dx.doi.org/10.11654/jaes.2016-1252
文章历史
- 收稿日期: 2016-09-27
2. 广东省环境污染控制与修复材料中心, 广州 510632;
3. 中国科学院新疆生态与地理研究所, 乌鲁木齐 830011
2. Guangdong Provincial Research Center of Environmental Pollution Control and Remediation Material, Guangzhou 510632, China;
3. Xinjiang Institute of Ecology and Geography, Chinese Academy of Sciences, Urumqi 830011, China
随着农业灌溉、不合理耕作、施肥等人为活动的影响,土壤盐渍化已经成为土地退化的重要因素之一。据联合国粮农组织和联合国环境规划署估计,目前全球约有400万km2土地和20%的农田受到土壤盐渍化影响[1-2]。由于多种原因许多盐渍化土壤同时又受到了重金属污染[3-4],如在长期高强度施肥的作用下,设施土壤盐分和重金属逐渐累积[5],许多沿海滩涂围垦农田土壤也存在盐分和重金属双重影响[6]。在我国的重金属污染土壤中,Cd污染占很大比例,且多数以Cd、Pb复合污染存在,在盐分作用下,土壤中重金属具有更大的生物有效性,盐分提高了重金属的潜在风险[7]。因此,对重金属污染盐渍土的修复受到广泛关注。
植物修复技术以其环境友好、成本低廉等众多优点被广泛用于修复实践中[8]。然而,现已报道的400多种重金属超累积植物大多为甜土植物,并不适用于盐渍环境下重金属污染的修复,而关于重金属超累积的盐生植物也鲜见报道[9-10]。与甜土植物相比,盐生植物不仅具有应对渗透胁迫和营养不平衡的特有机制,一定情况下还具有应对重金属离子胁迫带来毒害作用的特性[11]。此外,适量盐分不但可以促进盐生植物的生长,还被认为是影响盐生植物吸收和转运Cd等重金属的重要因素,这使得挖掘盐生植物在修复重金属污染方面的潜力有了更多期待。
草木樨(Melilotus suaveolens Ledeb.)、盐地碱蓬(Suaeda salsa)、大叶补血草(Limonium gmelinii)、野榆钱菠菜(Atripex aucheri Moq.)是四种具有代表性的盐生植物。其中,盐地碱蓬是一种典型的盐碱地指示植物,可以耐受高盐分生长于海水中,也可以适应荒漠贫瘠土壤[12]。有研究发现,盐地碱蓬、野榆钱菠菜等几种盐生植物均具有生物量大、吸盐能力强的特点,而且对土壤中的重金属不但具有一定耐受性,还可能具有一定的富集能力[13-15]。这些特征在修复重金属污染的盐土中有重要的实际意义。
本研究采用温室砂培盆栽试验比较了四种盐生植物的生物量大小和吸收转运能力,初步探讨了几种盐生植物在盐分条件下对重金属Cd、Pb的提取修复能力,分析了Cd、Pb在四种盐生植物体内的分布、吸收和转运差异,为盐生植物作为修复材料应用于土壤修复实践中提供了科学依据。
1 材料和方法 1.1 试验材料盆栽试验于2016年4月20日到7月1日(平均温度18.0~28.7 ℃)在广州市暨南大学环境学院玻璃温室内进行。选取草木樨、盐地碱蓬、大叶补血草、野榆钱菠菜四种盐生植物为试验材料,植物种子全部来源于中国科学院新疆生态与地理研究所。选取白色石英砂作为植物培养载体,以砂培方式进行,盆栽试验过程中所有外加处理均为生物有效态。
1.2 试验方法供试白色石英砂用20%盐酸浸泡24 h,再用清水清洗数次,最后用蒸馏水冲洗,直至pH值接近中性为止。此后,将其置于高温高压灭菌锅中,120 ℃条件下严格灭菌30 min,最后在实验室烘箱内70 ℃条件下烘干至恒重。准确称量2.5 kg烘干后的白色石英砂于无孔塑料花盆(22 cm × 14 cm),将培育好的大叶补血草、盐地碱蓬、草木樨、野榆钱菠菜幼苗依据个体植株大小相近的原则分别移植8株到花盆中,并加入霍格兰营养液进行培育,营养液的加入量及之后培育期间的含水量严格控制在最大田间持水量的70%左右,培育60 d后收获。
试验中的盐分与重金属以NaCl、Cd(NO3)2和Pb(NO3)2的形式加入,剂量如表 1所示,各处理添加剂量参照课题组前期对广州重金属污染区域的采样调查结果。根据三种外源物的高低浓度差别,设置三因素三水平试验,每个处理下均设3个平行。待移栽缓苗正常后,各处理同霍格兰营养液在灌溉时一同加入花盆,培育60 d后对全部植株进行取样,用不锈钢小铲将整株植物连根铲起,去离子水清洗数次后沥去水分,用不锈钢剪刀将植株剪开,分别称取根部和地上部(茎叶)的鲜重,之后在70 ℃下烘干至恒重。剪开植株的同时取5 g根系鲜样,用CaCl2溶液充分超声淋洗,以提取根细胞质外体金属。同样在70 ℃下烘干至恒重后分别称取根部和地上部的干质量,磨碎备用。
分别称取0.2 g磨碎后的植物根部和地上部干样与10 mL浓HNO3充分混合后浸泡24 h,用微波消解仪(CEM corporation,MARS5)消解,消解液定容至25 mL后经低速滤纸过滤备用。本试验采用日本岛津公司AA-7000原子吸收分光光度计火焰法分析测定植物根部和地上部的Pb含量,采用石墨炉法分析测定植物根部和地上部的Cd含量。采用植物标准样品(GSV-1国家标准参比物质)进行质控。
1.4 数据处理本研究采用富集系数、转运系数、提取系数、提取净化时间等作为植物修复Cd、Pb污染的分析指标,采用Microsoft Excel 2014和IBM SPSS statistics 19.0进行数据处理和统计分析,采用Origin 8绘图。具体计算公式如下:
富集系数(AF)=地上部重金属含量/土壤中相应元素含量
转运系数(TF)=地上部重金属含量/根部相应元素含量
提取系数(EC)=地上部重金属含量×地上部干质量/土壤中相应元素含量×100%
提取净化时间=培养载体中可溶态重金属含量/(地上部重金属含量×地上部干质量×年种植次数)
根净吸收能力=(地上部重金属含量×地上部干质量+根部重金属含量×根部干质量)/根部干质量
根净转运能力=根净吸收能力-根部重金属含量
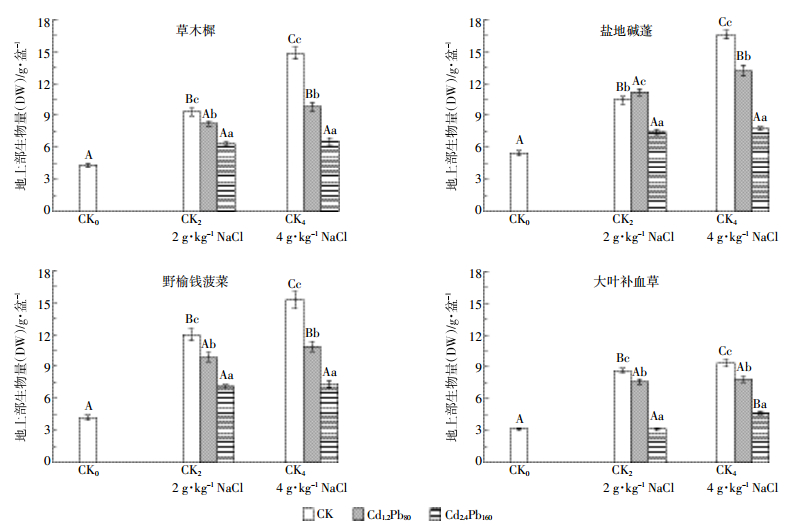
2 结果与分析 2.1 四种盐生植物地上部生物量比较如图 1所示,在2 g·kg-1和4 g·kg-1盐分处理下,四种盐生植物生物量较CK0均有显著增加,且生物量随盐分的增加而增大;在4 g·kg-1盐分条件下,草木樨、盐地碱蓬、大叶补血草、野榆钱菠菜的生物量分别为CK0的3.4、3.0、3.9、3.6倍。同一盐度梯度下,盐生植物在Cd1.2Pb80和Cd2.4Pb160处理下生物量较对照组均显著下降,但盐地碱蓬在2 g·kg-1盐分处理时,Cd1.2Pb80处理下的生物量较CK2显著增加,而Cd2.4Pb160处理下生物量较CK2却显著下降。
|
| 图 1 不同处理下几种盐生植物地上部生物量 Figure 1 Aboveground biomass of four halophytes under different treatments 不同大写字母代表相同重金属处理不同盐分梯度间差异显著,不同小写字母代表相同盐分梯度下不同重金属处理间差异显著(P < 0.05) Different capital letters represent the same heavy metal treatment between different salinity gradients significant differences, different lower case letters represent the same salinity gradient between different heavy treatments was significant (P < 0.05) |
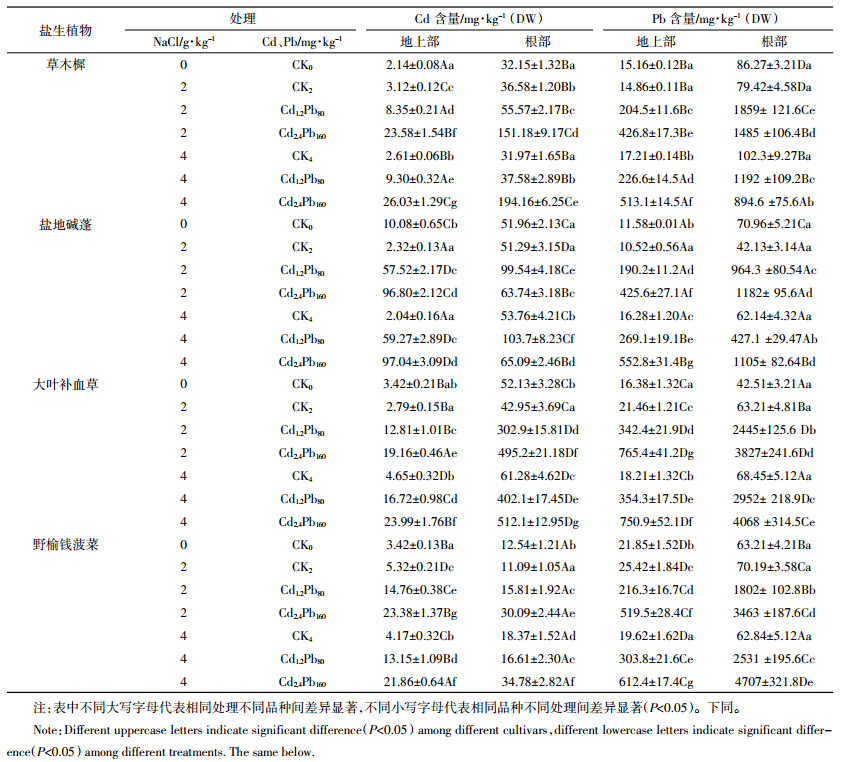
如表 2所示,外源添加的Cd、Pb进入植株后部分被转移到地上部,大部分则滞留在根部,Cd、Pb在草木樨、大叶补血草、野榆钱菠菜根部含量显著大于其地上部,其中大叶补血草根部Cd含量最大为其地上部含量的25.84倍,而草木樨根部Pb含量最大为其地上部含量的9.10倍。盐地碱蓬在Cd2.4Pb160处理下,地上部Cd含量显著大于其根部含量,地上部含量最高可达97.04 mg·kg-1,非常接近100 mg·kg-1的Cd超累积植物界定标准。四种盐生植物对Pb的地上部富集量在204~705 mg·kg-1范围内,小于1000 mg·kg-1的Pb超累积植物界定标准。
|
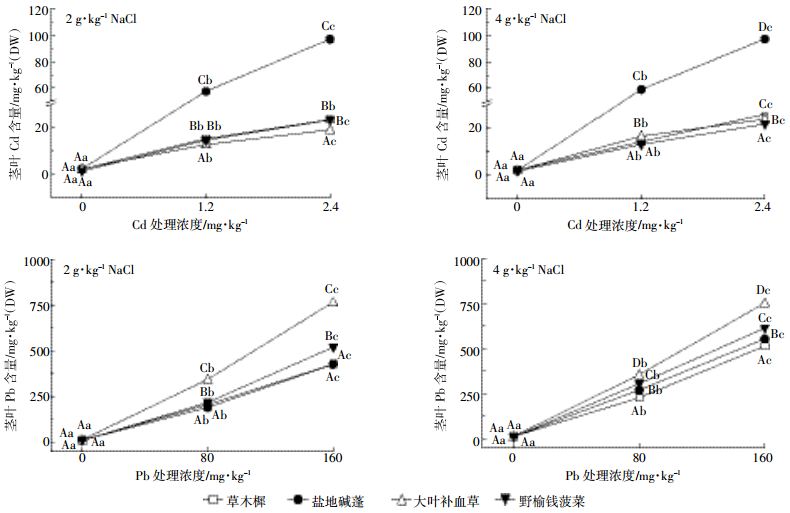
如图 2所示,随着环境中有效态Cd、Pb浓度的增加,几种盐生植物地上部Cd、Pb含量总体呈上升趋势,但增加幅度各不相同:地上部Cd含量在外源添加高浓度有效态Cd后增幅减缓,而地上部Pb含量则在外源添加高浓度有效态Pb后增幅变大,最大增量为108.8 mg·kg-1,是较低浓度下的1.34倍。这说明地上部Cd、Pb含量表现出相反的变化规律。
|
| 图 2 2 g·kg-1和4 g·kg-1盐度下地上部Cd、Pb含量与Cd、Pb处理浓度的关系 Figure 2 The relation between shoot content of Cd, Pb and added content of Cd, Pb under 2 g·kg-1 and 4 g·kg-1 salinity 图中不同大写字母代表相同处理不同品种间差异显著,不同小写字母代表相同品种不同处理间差异显著(P < 0.05) Different uppercase letters indicate significant difference (P < 0.05) among different cultivars, different lowercase letters indicate significant difference (P < 0.05) among different treatments |
经计算,四种盐生植物对Cd的富集系数均大于1,其中盐地碱蓬最大富集系数可达49.39,表现出很强的Cd富集能力;Pb平均富集系数仅为Cd富集系数的12%;外源添加Cd1.2Pb80处理后,植物的富集系数小于较高浓度下的植物富集系数。盐地碱蓬最大转运系数可达1.52,而其他三种盐生植物Cd、Pb转运系数均小于1。如表 3所示,盐地碱蓬对Cd、Pb的根净吸收能力和根净转运能力也显著高于其他三种盐生植物。盐地碱蓬、大叶补血草、野榆钱菠菜在4 g·kg-1盐分条件下Cd、Pb根净吸收能力显著高于2 g·kg-1盐分条件。
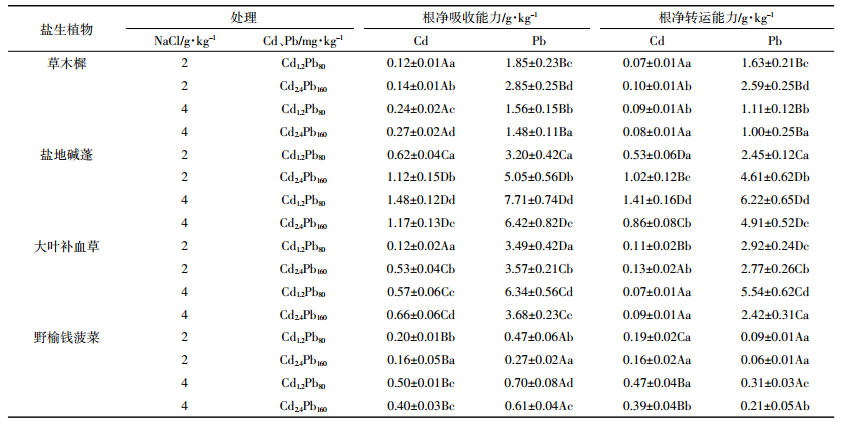
|
由图 3可知,同一盐分条件下,四种盐生植物对于Pb的提取率显著低于Cd,不同盐分条件下四种植物Pb的提取率全部低于1%。2 g·kg-1盐分条件下盐地碱蓬Cd最大提取率为31.80%,提取Cd量可达到938.20 μg·盆-1;草木樨平均提取Cd量为46.42 μg·盆-1,大叶补血草平均提取Cd量为57.81 μg·盆-1,野榆钱菠菜平均提取Cd量为32.47 μg·盆-1。经计算四种植物Cd、Pb提取净化时间有很大差别,Pb提取净化时间较长;不同盐分条件下Cd提取净化时间最短的为盐地碱蓬3.14年,其他分别为草木樨85.30年,大叶补血草59.21年,野榆钱菠菜77.84年。

|
| 图 3 四种盐生植物对Cd、Pb的提取率比较 Figure 3 The extraction rate of four halophytes 不同大写字母代表不同品种间差异显著(P<.05) Different capital letters represent significant differences among different species(P<.05) |
一定浓度的盐分处理可促进盐生植物的生长[16-17]。本研究中,在2 g·kg-1盐度处理下四种盐生植物生物量较对照组(CK0)均显著增加,平均增加1.5倍,4 g·kg-1盐度处理下生物量平均增加2.5倍。盐度的升高促进了盐生植物的生长,很可能因为Na是盐生植物的必需元素[18],也可能由于盐生植物本身应对盐分胁迫具有一种自适应能力,可通过快速生长来增加个体重量,从而降低盐分在植物体内的浓度[19-20]。四种盐生植物中盐地碱蓬的生物量最大,其干质量可达13.17 g·盆-1,在野外高盐度培育条件下地上生物量干质量可达18 978 kg·hm-2 [21]。这一生物量是重金属Cd超累积植物龙葵[22]的1.8倍,是宝山堇菜[23]的6.3倍,较大的生物量在植物修复重金属污染土壤实践中极具潜力。以Cd为主的重金属会通过抑制植物的光合作用和蒸腾作用来减缓植物的生长,也会干扰植物营养物质的正常吸收和体内再分配,从而降低植物的生物量。本研究中,在Cd2.4Pb160处理下,四种盐生植物的生长均受到不同程度的抑制,但培育过程中未观察到植物衰败或枯萎等严重中毒现象,表明四种盐生植物对重金属Cd、Pb有一定耐性。4 g·kg-1 NaCl处理下四种盐生植物根部Cd、Pb含量显著高于2 g·kg-1处理下的含量,Cd、Pb的根净吸收能力也表现出相同规律。这表明适当盐分胁迫不但促进盐生植物的生长,也促进其根部对重金属的吸收。在Cd1.2Pb80处理下,盐地碱蓬生物量较空白上升7.8%,表明低浓度的Cd、Pb可能会促进其根部对营养物质的吸收,也可能刺激茎叶部有机酸的生成,从而促进生长[24]。重金属胁迫下盐地碱蓬较大的生物量表明其有较强的Cd、Pb耐性,植物对重金属的耐性强弱可作为植物能否被用于修复遭受重金属污染土壤的基本依据[25-26],特别是重度污染的土壤。本研究结果说明盐地碱蓬对于重金属污染土壤的修复具有较强的应用潜力和价值。
富集量、富集系数一般用来表征土壤或其他培养体系与植物体之间元素迁移的难易程度,富集量、富集系数越大说明元素越容易通过植物根部迁移到植物体内。转运系数大于1意味着植物地上部重金属的含量大于根部的含量,表明植物体对这种元素有很好的转运能力。这是重金属高累积植物区别于普通植物的重要特征。本研究中,四种盐生植物对Cd富集能力显著大于Pb。这是因为复合污染下,Cd具有的较强毒性,很大程度上抑制了植物根部对Pb的吸收[27],当Cd、Pb复合污染条件下,Cd更易与盐生植物生长环境中的Cl-发生络合反应,更易移动从而增加Cd的生物有效性,增加其进入植物体的可能性,而Pb则更易与环境中CO32-、PO43-、SO42-形成不易溶解的物质[28],从而降低其移动性,不易被富集进入植物体内。
本研究中,草木樨、大叶补血草和野榆钱菠菜的Cd、Pb转运系数均小于1,说明Cd、Pb进入植物根部后,难以被转移到地上部。原因是Cd、Pb为植物的非必需元素,植物体内没有专门负责其迁移的转运蛋白和相应通道,植物对Cd、Pb的吸收多为被动吸收,故大部分Cd、Pb离子滞留在植物根部。低浓度Cd、Pb处理下,四种盐生植物的Cd、Pb富集系数高于高浓度处理,且地上部Cd、Pb含量均随处理浓度的增大而增加,但高浓度处理使得植物对Cd吸收速率下降,同时Pb表现出与Cd富集转运相反的规律。这表明盐生植物根部对Cd、Pb的累积能力有限,在正常的富集能力范围内富集系数随Cd、Pb处理浓度的增加而降低,低浓度处理时富集系数更高,高浓度处理时富集系数较低。盐地碱蓬Cd富集系数达49.40,地上部Cd富集量达97.04 mg·kg-1,转运系数达1.52,根净吸收与根净转运能力显著大于其他盐生植物。主要原因是其根部有较强的吸收与转运能力,应用于土壤修复实践时可直接通过收割植物的地上部后焚烧处理,一方面可提高经济效益,另一方面便于集中处理含大量Cd的灰渣。
植物提取率与提取净化时间指标在修复重金属污染土壤实践工作中更具实际意义。植物提取率可表征某种植物对污染土壤的净化效率,提取净化时间则表征有效态Cd、Pb被植物完全吸收净化所需时间。由于Pb进入植物体后大多沉淀富集在植物根部的细胞壁和液泡中,难以迁移到地上部分,而Cd的移动性远大于Pb的移动性,故几种植物对于Cd的提取率明显高于对Pb的提取率,Cd提取净化时间也显著少于提取净化Pb所需的时间。本研究中,几种盐生植物依据上述评价指标综合看来,盐地碱蓬具有根部吸收转运Cd能力强、提取效率高、提取净化时间短的优势,且有较强吸盐能力,表现出对重金属和盐分均有较好的去除效果,故在重金属Cd污染的盐土修复实践中具有很大的潜力和应用价值。
4 结论(1)经过对比四种盐生植物对重金属的提取修复能力,发现盐地碱蓬地上部生物量为13.17 g·盆-1,地上部Cd含量可达97.04 mg·kg-1,Cd最大提取率为31.80%;提取Cd量可达938.20 μg·盆-1,提取净化时间仅为3.14年;又因其有很强的吸盐能力,故盐地碱蓬在受重金属Cd污染的盐土修复实践中有较大潜力与价值。
(2)4 g·kg-1 NaCl处理下四种盐生植物的地上部生物量及根部Cd、Pb含量显著高于2 g·kg-1处理,表明适当浓度盐分不但促进盐生植物的生长,也促进了盐生植物根部对土壤中重金属的吸收。
(3)盐地碱蓬对Cd、Pb的根吸收能力与根转运能力显著高于其他三种盐生植物,表明盐地碱蓬地上部高富集重金属是由其根部较强的吸收能力和较强的转运能力共同决定的。
(4)四种盐生植物对Cd、Pb吸收和转运存在较大差异,较高重金属浓度下Pb的吸收速率明显高于Cd。
| [1] | Rozema J, Flowers T. Crops for a salinized world[J]. Science, 2008, 322(5907): 1478–1480. DOI:10.1126/science.1168572 |
| [2] | Ravindran K, Venkatesan K, Balakrishnan V, et al. Restoration of saline land by halophytes for Indian soils[J]. Soil Biology and Biochemistry, 2007, 39(10): 2661–2664. DOI:10.1016/j.soilbio.2007.02.005 |
| [3] | Gabrijel O, Davor R, Zed R, et al. Cadmium accumulation by muskmelon under salt stress in contaminated organic soil[J]. Science of the Total Environment, 2009, 407(7): 2175–2182. DOI:10.1016/j.scitotenv.2008.12.032 |
| [4] | Duarte B, Caetano M, Almeida P R, et al. Accumulation and biological cycling of heavy metal in four salt marsh species, from Tagus estuary (Portugal)[J]. Environmental Pollution, 2010, 158(5): 1661–1668. DOI:10.1016/j.envpol.2009.12.004 |
| [5] | 余海英, 李廷轩, 周健民. 典型设施栽培土壤盐分变化规律及潜在的环境效应研究[J]. 土壤学报, 2006, 43(4): 571–576. YU Hai-ying, LI Ting-xuan, ZHOU Jian-min. Salt in typical greenhouse soil profiles and its potential environment effect[J]. Acta Pedologica Sinica, 2006, 43(4): 571–576. |
| [6] | Li Q S, Chen Y, Fu H, et al. Health risk of heavy metals in food crops grown on reclaimed tidal flat soil in the Pearl River Estuary, China[J]. Journal of Hazardous Materials, 2012, 227: 148–154. |
| [7] | Du Laing G, Rinklebe J, Vandecasteele B, et al. Trace metal behaviour in estuarine and riverine floodplain soils and sediments:A review[J]. Science of the Total Environment, 2009, 407(13): 3972–3985. DOI:10.1016/j.scitotenv.2008.07.025 |
| [8] | Mahar A, Wang P, Ali A, et al. Challenges and opportunities in the phytoremediation of heavy metals contaminated soils:A review, China[J]. Ecotoxicology and Environmental Safety, 2016, 126: 111–121. DOI:10.1016/j.ecoenv.2015.12.023 |
| [9] | Manousaki E, Kalogerakis N. Phytoextraction of Pb and Cd by the mediterranean saltbush (Atriplex halimus L.):Metal uptake in relation to salinity[J]. Environmental Science and Pollution Research, 2009, 16(7): 844–854. DOI:10.1007/s11356-009-0224-3 |
| [10] | Wang H L, Tian C Y, Jiang L, et al. Remediation of heavy metals contaminated saline soils:A halophyte choice?[J]. Environmental Science and Technology, 2013, 48(1): 21–22. |
| [11] | 卞阿娜, 林鸣, 王文卿, 等. 根系盐胁迫对盐生植物和甜土植物的幼苗生长及矿质元素分布的影响[J]. 热带亚热带植物学报, 2015, 23(4): 405–412. BIAN A-na, LIN Ming, WANG Wen-qing, et al. Effects of root salt stress on growth and allocation of mineral elements in halophyte and glycophyte seedlings[J]. Journal of Tropical and Subtropical Botany, 2015, 23(4): 405–412. |
| [12] | 赵可夫, 李法曾, 樊守金, 等. 中国的盐生植物[J]. 植物学通报, 1999, 16(3): 201–207. ZHAO Ke-fu, LI Fa-zeng, FAN Shou-jin, et al. Halophytes in China[J]. Chinese Bulletin of Botany, 1999, 16(3): 201–207. |
| [13] | Han R M, Lefèvre I, Ruan C J, et al. Effects of salinity on the response of the wetland halophyte Kosteletzkya virginica (L.) presl:To copper toxicity[J]. Water, Air, & Soil Pollution, 2012, 223(3): 1137–1150. |
| [14] | Bankaji I, Sleimi N, López-Climent M, et al. Effects of combined abiotic stresses on growth, trace element accumulation, and phytohormone regulation in two halophytic species[J]. Journal of Plant Growth Regulation, 2014, 33(3): 632–643. DOI:10.1007/s00344-014-9413-5 |
| [15] | Chai M W, Shi F C, Li R L, et al. Effect of NaCl on growth and Cd accumulation of halophyte spartina alterniflora under CdCl2 stress[J]. South African Journal of Botany, 2013, 85(2): 63–69. |
| [16] | Clough B F. Growth and salt balance of the mangroves Avicennia marina (Forsk.) Vierh. and Rhizophora stylosa Griff. in relation to salinity[J]. Plant Physiology, 1984, 11(5): 419–430. |
| [17] | Khan M A, Ungar I A, Showalter A M. The effect of salinity on the growth, water status, and ion content of a leaf succulent perennial halophyte, Suaeda fruticosa (L.) Forssk[J]. Journal of Arid Environments, 2000, 45(1): 73–84. DOI:10.1006/jare.1999.0617 |
| [18] | Brownell P. E. Sodium as an essential micronutrient for a higher plant (Atriplex vesicaria)[J]. Plant Physiology, 1965, 40(3): 460–468. DOI:10.1104/pp.40.3.460 |
| [19] | Brownell P E, Crossland C J. The requirement for sodium as a micronutrient by species having C4 dicarboxylic photosynthetic pathway[J]. Plant Physiology, 1972, 49(5): 794–797. DOI:10.1104/pp.49.5.794 |
| [20] | Mandak B, Pysek P. Effects of plant density and nutrient levels on fruit polymorphism in Artiplex sagittata[J]. Oecologia, 1999, 119(1): 63–72. DOI:10.1007/s004420050761 |
| [21] | 郭洋, 陈波浪, 盛建东, 等. 几种一年生盐生植物的吸盐能力[J]. 植物营养与肥料学报, 2015, 21(1): 269–276. GUO Yang, CHEN Bo-lang, SHENG Jian-dong, et al. Salt absorption capacities of several annul halophytes[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(1): 269–276. |
| [22] | 魏树和, 周启星, 王新. 超积累植物龙葵及其对镉的富集特征[J]. 环境科学, 2005, 26(3): 167–171. WEI Shu-he, ZHOU Qi-Xing, WANG-Xin. Cadmium-hyperaccumulator Solanum nigrum L. and its accumulating characteristics[J]. Environmental Science, 2005, 26(3): 167–171. |
| [23] | 刘威, 束文圣, 蓝崇钰. 宝 (山堇) 菜 (Viola baoshanensis):一种新的Cd超富集植物[J]. 科学通报, 2003, 48(19): 2046–2049. LIU Wei, SHU Wen-sheng, LAN Chong-yu. A new cadmium-hyperaccumulate plant:Viola baoshanensis[J]. Chinese Science Bulletin, 2003, 48(19): 2046–2049. |
| [24] | 郭平, 刘畅, 张海博, 等. 向日葵幼苗对Pb、Cu富集能力与耐受性研究[J]. 水土保持学报, 2007, 21(6): 92–95. GUO Ping, LIU Chang, ZHANG Hai-bo, et al. Studies on enrichment and tolerance ability to Pb, Cu of sunflower seedlings[J]. Journal of Soil and Water Conservation, 2007, 21(6): 92–95. |
| [25] | McGrath S P, Shen Z G, Zhao F J. Heavy metal uptake and chemical changes in the rhizosphere of Thlaspi caerulescens and Thlaspi ochroleucum grown in contaminated soils[J]. Plant and Soil, 1997, 188: 153–159. DOI:10.1023/A:1004248123948 |
| [26] | Lefevre I, Correal E, Lutts S. Cadmium tolerance and accumulation in the noxious weed Zygophyllum fabago[J]. Canadian Journal of Botany, 2005, 83(12): 1655–1662. DOI:10.1139/b05-130 |
| [27] | 牛之欣, 孙丽娜, 孙铁珩. 水培条件下四种植物对Cd、Pb富集特征[J]. 生态学杂志, 2010, 29(2): 261–268. NIU Zhi-xin, SUN Li-na, SUN Tie-heng. Enrichment characteristics of Cd and Pb by four kinds of plant under hydroponic culture[J]. Chinese Journal of Ecology, 2010, 29(2): 261–268. |
| [28] | 王新, 梁仁禄, 周启星. Cd-Pb复合污染在土壤-水稻系统中生态效应的研究[J]. 农村生态环境, 2001, 17(2): 41–44. WANG Xin, LIANG Ren-lu, ZHOU Qi-xing. Ecological effect of Cd-Pb combined pollution on soil-rice system[J]. Rural Eco-Environment, 2001, 17(2): 41–44. |
 2017, Vol. 36
2017, Vol. 36