文章信息
- 姜锦林, 单正军, 周军英, 卜元卿, 田丰
- JIANG Jin-lin, SHAN Zheng-jun, ZHOU Jun-ying, BU Yuan-qing, TIAN Feng
- 常用农药对赤子爱胜蚓急性毒性和抗氧化酶系的影响
- Influence of commonly used pesticides on acute toxicity to earthworm Eisenia fetida and alteration of antioxidant enzyme activities
- 农业环境科学学报, 2017, 36(3): 466-473
- Journal of Agro-Environment Science, 2017, 36(3): 466-473
- http://dx.doi.org/10.11654/jaes.2016-1095
文章历史
- 收稿日期: 2016-08-23
2. 南京信息工程大学江苏省大气环境与装备技术协同创新中心, 南京 210044
2. Jiangsu Collaborative Innovation Center of Atmospheric Environment and Equipment Technology (CICAEET), Nanjing University of Information Science & Technology, Nanjing 210044, China
我国是农药生产与使用大国,农药的长期大量使用对我国生态环境产生的负面影响已经显现。近年来,我国农药管理部门开始重视农药的环境安全管理,但目前国内大部分研究基本着眼于农药使用对鸟类、陆生和水生生物的负面影响,有关农药对土壤生物及土壤环境质量的影响还未引起足够重视[1-3]。蚯蚓是土壤大型无脊椎动物的代表,在评价土壤生态系统的污染方面发挥了重要作用[1-2, 4]。近几十年来,赤子爱胜蚓(Eisenia fetida)已经被视为陆地生态毒理研究的模式生物物种,国内外学者对其污染物胁迫下的生态毒理学特性进行了大量的研究。蚯蚓急性毒性试验简单、快速,能对农药毒性进行初步的评估和筛选,为深入研究农药的慢性毒性和复合毒性提供基本依据[2-3, 5-7]。需要注意的是,不同农药的化学结构、毒性机制,以及其对蚯蚓的主要侵入方式、在蚯蚓体内的吸收、分布、代谢速度和在土壤环境中的分解难易程度等均有所不同,都会影响对蚯蚓的急性毒性。另外,从大多数生态毒理试验结果来看,在很多情况下相对其他土壤非靶标动物而言,蚯蚓死亡率变化对农用化学品暴露并不敏感[1-2, 8],单纯应用其数据进行生态风险评估可能并不能很好地体现农药对土壤生物的影响,况且目前标准土壤无脊椎动物测试物种赤子爱胜蚓的选择更多是出于其适合于标准化室内测试的目的,而不是其对农药的敏感性,即能保护大多数(95%)土壤生物物种和土壤生态功能[2, 9]。目前农药对土壤生物的生态毒理数据相当匮乏,Frampton等[8]调研了1950个农药土壤数据,其中包括250种农药和67个土壤无脊椎生物类群,但大多数(96%)的农药数据来源少于5个土壤生物物种。调研结果显示,基于急性死亡率数据的赤子爱胜蚓对农药是最不敏感的,远远不如弹尾目白符跳(Folsomia candida)。在研究农药对蚯蚓致死效应的同时,还需关注其他毒理效应,如农药还能影响蚯蚓的繁殖率和呼吸强度,损伤蚯蚓体(如体表和肠道)超微结构,影响体内的一些重要物质(如蛋白质、氨基酸和葡萄糖等)含量和酶(乙酰胆碱酯酶、纤维素酶、转氨酶和常见抗氧化系统酶等)活性,影响蚯蚓溶酶体膜稳定性,以及造成蚯蚓DNA损伤等[3]。
本研究选择多种典型品种农药原药或标准品,以及常见的农药制剂为受试物,应用人工土壤法测定受试物对蚯蚓的7 d和14 d死亡率(LC50)。同时,考虑到农药毒性大小和使用的广泛性,选择抗生素类杀虫剂阿维菌素以及新烟碱类杀虫剂吡虫啉和噻虫啉等作为受试农药,研究其暴露对蚯蚓体内各种酶活性的影响,阐明农药对赤子爱胜蚓的急性毒性效应特点。
1 材料和方法 1.1 受试生物选用环境保护部南京环境科学研究所生态毒理实验室自行保种繁殖的同一批次赤子爱胜蚓为受试生物,供试蚯蚓环带明显,大小、体重一致。抽样结果显示平均每条供试蚯蚓体重为0.382 g。试验开始前,将新获得的蚯蚓在试验条件下于未受污染的土壤中预养7 d,供试验用。
1.2 受试农药受试农药原药或标准品选用8种杀虫剂(吡虫啉、噻虫啉、阿维菌素、高效氯氰菊酯、吡蚜酮、噻嗪酮、毒死蜱、克百威)和3种除草剂(草甘膦、阿特拉津和百草枯),除百草枯标准品购自Sigma公司外,其余农药原药购自国内农药生产厂家;农药制剂品种有600 g·L-1吡虫啉悬浮种衣剂、65%吡虫啉水剂、5%阿维菌素乳油、5%阿维菌素可湿性粉剂、50%吡蚜酮水分散粒剂、37%噻嗪酮悬浮剂、30%毒死蜱水乳剂、41%草甘膦水剂和88.8%草甘膦铵盐可溶粒剂等9种,均来自国内农药生产厂家。参比物质选用2-氯乙酰胺(99.8%),购自国内化学试剂厂家。
1.3 试验方法根据《化学农药环境安全评价试验准则》[10]和OECD 207试验准则[11],采用人工土壤法评价受试物对蚯蚓的急性毒性效应。测试农药原药或标准品时,将受试药剂用丙酮溶解后拌于10 g石英砂中(当部分原药在丙酮中溶解度较低时,加入1.0%Triton X-100助剂),待丙酮完全挥发后与490 g人工土壤混匀,加入去离子水使土壤含水量约为30%。在每个标本瓶中放500 g人工土,再向其中放入10条蚯蚓。用塑料薄膜扎孔后封住瓶口,然后将标本瓶置于(20 ℃±2 ℃、湿度80%~85%)恒温箱中连续培养。根据预试验结果,每种农药按一定级差设置5~7个浓度组,每个浓度设3个重复,同时设不含药剂的空白对照组和溶剂对照组,浓度以有效成分(Active ingredient)计,单位mg a.i.·kg-1干土。测试农药制剂时,用制剂配成一定浓度的农药溶液,加入500 g人工土壤并充分拌匀,其余处理同农药原药或标准品毒性测定试验。分别于第7 d和第14 d记录死亡数及中毒症状,如蚯蚓在土壤表面出现扭动挣扎、体态松弛、环带肿大、反应迟钝、部分身体出现局部膨起肿大等。
1.4 蚯蚓酶液提取及生理生化指标测定用于蚯蚓生理生化指标测定试验的受试农药均为农药原药。
蚯蚓匀浆缓冲液包括50 mmol·L-1 Tris-HCl,1 mmol·L-1 DTT,1 mmol·L-1 EDTA,250 mmol·L-1蔗糖,调节pH至7.6。将蚯蚓匀浆缓冲液置于4 ℃冰箱保存,备用。取清肠后的蚯蚓1~2条,称重并剪碎,取适量按照1:10(W/V)加入蚯蚓匀浆缓冲液,迅速匀浆,制成10%的组织匀浆。将匀浆液转入10 mL离心管,12 000 r·min-1离心20 min,取上清液。蚯蚓粗酶液于-80 ℃冻存,每个处理组都分成四份用来测定抗氧化系统酶活性。以上操作均在4 ℃下进行。
T-SOD活性测定采用邻苯三酚自氧化法[12],酶活性单位定义为每毫升反应液中,每分钟抑制邻苯三酚自氧化速率达50%的酶量;CAT活性测定采用徐镜波等[13]的方法,一个单位的CAT活性定义为25 ℃下,100 s内使过氧化氢分解1/2时的酶蛋白量;GST活性测定采用Habig法[14],一个GST活力单位(U·mg-1蛋白)定义为每毫克蛋白质,扣除非酶反应,每分钟使GSH浓度下降1 μmol·L-1。
脂质过氧化水平的测定参照Miller等[15]的方法,根据膜脂过氧化产物丙二醛(MDA)与硫代巴比妥酸(TBA)的定量反应来测定MDA的含量。反应体系包含8.1% SDS 0.2 mL、20%醋酸缓冲液1.5 mL、1% TBA 1.5 mL、蒸馏水1 mL,pH为3.5。沸水浴1 h,冷却后3000 r·min-1离心15 min,取上清液532 nm测吸光度,MDA以nmol TBARS·mg-1蛋白表示,毫摩尔消光系数155 mmol-1·cm-1。
1.5 数据处理应用SPSS 16.0的Probit回归方法计算农药对蚯蚓的半数致死浓度值(LC50)及其95%置信限(CI)。采用《化学农药环境安全评价试验准则》[10]中的标准对农药对蚯蚓的毒性进行分级。
蚯蚓的生理生化指标数据,在满足正态分布(Shapiro-Wilk test)和方差齐性(Levene′s test)的前提条件下,采用方差分析(ANOVA)和S-N-K检验分析处理之间的差异显著性,否则采用非参数检验(Kruskal-Wallis test)来检验处理之间差异的显著性。星号(*)代表处理组的数据与空白对照组相比有显著性差异。所有统计均采用SPSS 16.0软件完成。
2 结果与分析 2.1 常见农药原药(或标准品)对蚯蚓的急性毒性评价如表 1所示,在研究农药品种中,除了吡虫啉、噻虫啉和克百威对赤子爱胜蚓是中毒外,其余农药对赤子爱胜蚓皆是低毒,溶剂对照组显示所用最高剂量对蚯蚓存活无影响。应用参比物质2-氯乙酰胺对方法进行了验证,14 d-LC50数据在正常范围(20~80 mg a.i.·kg-1)内。
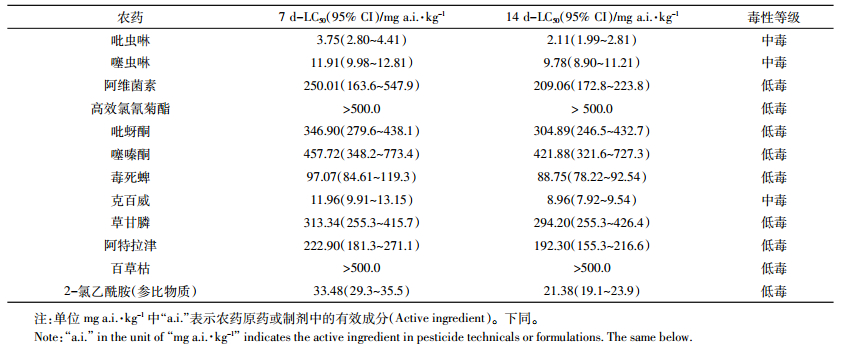
|
表 2是9种农药制剂对赤子爱胜蚓的急性毒性测试结果。对比表 1,可以看出,部分农药制剂(65%吡虫啉水剂、5%阿维菌素乳油、5%阿维菌素可湿性粉剂、50%吡蚜酮水分散粒剂、37%噻嗪酮悬浮剂和30%毒死蜱水乳剂)增强了制剂活性成分对赤子爱胜蚓的毒性。
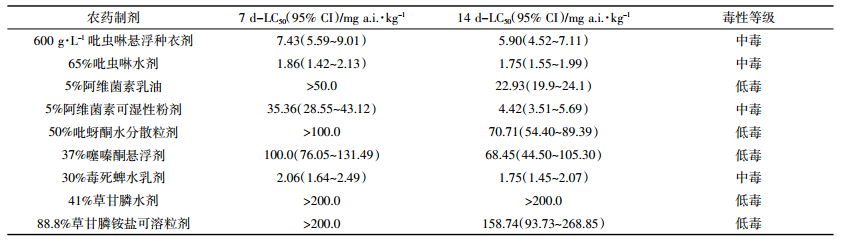
|
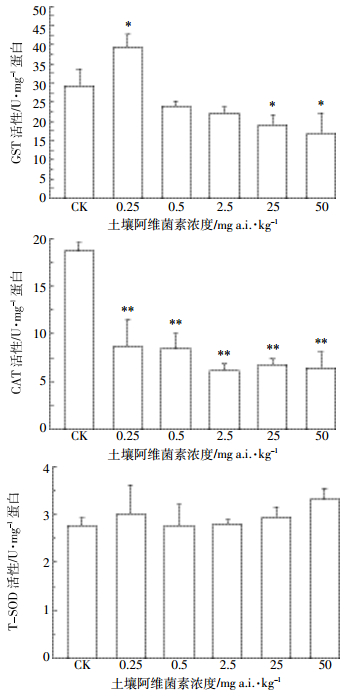
由图 1可以看出,赤子爱胜蚓在不同浓度阿维菌素的土壤中暴露14 d之后,体内的GST活性出现了明显的变化,浓度为0.25 mg a.i.·kg-1的土壤中出现了显著性诱导(P < 0.05),其他浓度组中活性有所下降,并在25、50 mg a.i.·kg-1浓度组出现了显著性抑制(P < 0.05);而CAT活性在所有阿维菌素处理组均出现了极显著抑制;赤子爱胜蚓的T-SOD活性在所有处理组并没有出现显著性的变化。
|
| 图 1 阿维菌素对赤子爱胜蚓GST、CAT和T-SOD活性的影响 Figure 1 Effects of abamectin on the activities of GST, CAT and T-SOD in E. fetida |
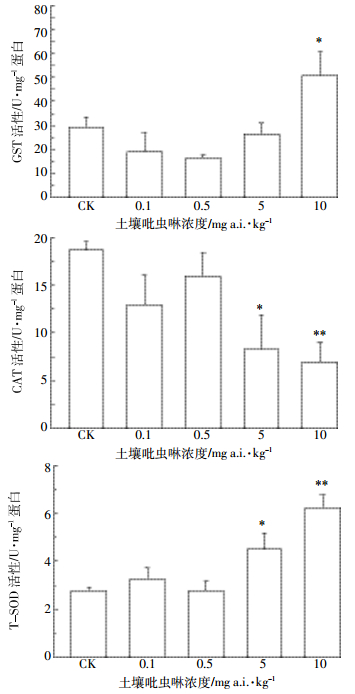
如图 2所示,赤子爱胜蚓在含0.1~5 mg a.i.·kg-1吡虫啉的土壤中暴露14 d,其体内GST活性相比对照组无显著性变化,但在吡虫啉浓度为10 mg a.i.·kg-1时出现显著性诱导(P < 0.05);赤子爱胜蚓的CAT活性在不同浓度的吡虫啉作用下相比对照空白样出现了下降,在5~10 mg a.i.·kg-1处理组出现了显著性抑制作用(P < 0.05);与此相应,T-SOD活性在5~10 mg a.i.·kg-1处理组出现了显著性诱导(P < 0.05)。
|
| 图 2 吡虫啉对赤子爱胜蚓GST、CAT和T-SOD活性的影响 Figure 2 Effects of imidacloprid on the activities of GST, CAT and T-SOD in E. fetida |
如图 3所示,赤子爱胜蚓体内GST活性在50 mg a.i.·kg-1的浓度组出现了极显性抑制(P < 0.01);而CAT活性在所有噻虫啉浓度组中均出现了极显著的抑制作用(P < 0.01),且抑制程度随着浓度上升而加重;T-SOD活性变化表明,0.1~5 mg a.i.·kg-1的浓度范围内,噻虫啉对赤子爱胜蚓的T-SOD活性有显著性诱导作用(P < 0.05,P < 0.01)。
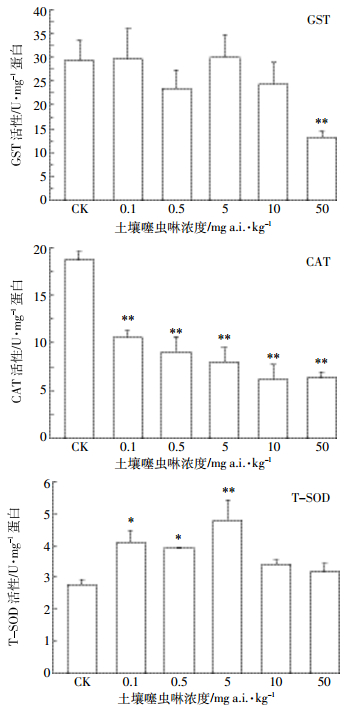
|
| 图 3 噻虫啉对赤子爱胜蚓GST、CAT和T-SOD活性的影响 Figure 3 Effects of thiaclopridon the activities of GST, CAT and T-SOD in E. fetida |
从图 4可以看出,赤子爱胜蚓的MDA含量在阿维菌素浓度为0.5 mg a.i.·kg-1时显著性上升(P < 0.05),表明0.5 mg a.i.·kg-1的阿维菌素对蚯蚓造成了氧化损伤;但在更高浓度组中MDA含量下降,并在50 mg a.i.·kg-1时出现了显著性下降(P < 0.05)。最低的吡虫啉暴露浓度(0.1 mg a.i.·kg-1)即可使赤子爱胜蚓的MDA的含量受到极显著抑制(P < 0.01),且总体上随着浓度升高抑制作用加大。土壤噻虫啉在0.5~50 mg a.i.·kg-1的浓度范围内均能极显著抑制赤子爱胜蚓MDA含量(P < 0.01)。
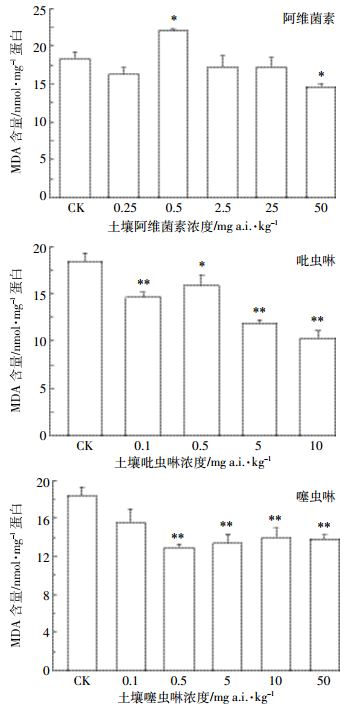
|
| 图 4 阿维菌素、吡虫啉和噻虫啉对赤子爱胜蚓MDA含量的影响 Figure 4 Effects of abamectin, imidacloprid and thiacloprid on the MDA contents in E. fetida |
蚯蚓急性毒性测试可快速地对农药生态毒性予以初步的判断,探明农药与蚯蚓短时间接触引起的损伤作用,明确农药毒性作用途径和剂量-效应关系,并可为农药慢性毒性试验(如繁殖毒性测试)和田间试验的浓度设计提供依据。因此,急性毒性试验在蚯蚓的生态毒理学研究中具有重要的作用[2-3, 5-7]。在我国农药登记与环境安全性评价中,一般采用人工土壤法作为农药对蚯蚓的急性毒性试验方法,蚯蚓死亡率(14 d-LD50/LC50)是最常用的评价农药对蚯蚓毒性的指标[5, 16-17]。
从本研究选择的20种农药对蚯蚓的急性毒性来看,吡虫啉、噻虫啉和克百威等几种杀虫剂对赤子爱胜蚓毒性较大,在向土壤施用时需注意其对土壤生物可能具有的不利影响。阿维菌素和高效氯氰菊酯等虽然对水生生物毒性高,但是在土壤中降解相对较快,对蚯蚓的急性毒性低,因此对土壤生物长期影响可能较小。另外,相对活性成分来说,部分农药制剂(65%吡虫啉水剂、5%阿维菌素乳油、5%阿维菌素可湿性粉剂、50%吡蚜酮水分散粒剂、37%噻嗪酮悬浮剂和30%毒死蜱水乳剂)增强了活性物质对赤子爱胜蚓的毒性,说明助剂使用有可能造成农药对土壤生物毒性的增强。有关助剂对环境生物的风险,曾有学者对2010—2011年间拟申请登记的368个农药制剂的剂型、助剂品种、作用、含量等基本数据进行调查,发现只有190个农药制剂提供了助剂信息,助剂类型以乳化剂、溶剂、分散剂等为主,每种农药制剂中含有3~4种助剂成分,平均含量介于1%~99%,助剂使用量远远大于农药活性成分;乳油、水乳剂、悬浮剂等农药剂型中含有甲苯、二甲苯、环己酮和烷基酚聚氧乙烯醚等高毒性成分,其助剂本身或其代谢产物具有三致效应、内分泌干扰作用、繁殖损失和神经毒性等健康风险[18]。因此,我国管理部门需要重视助剂的规范使用,提出切实有效的管理和评价方法。另外,600 g·L-1吡虫啉悬浮种衣剂对蚯蚓的急性毒性相对原药有所降低,可能是因为种衣剂里的成膜剂会在一定时间内成膜而使药液缓慢释放,造成农药活性成分的生物有效性有所降低,表现为这种剂型对蚯蚓急性毒性降低。
需要注意的是,虽然人工土壤法测定的多数农药品种对蚯蚓毒性等级较低,根据急性毒性数据结果,在常规施用剂量的条件下,大多数农药暴露并不会引起蚯蚓的快速死亡效应,但蚯蚓在土壤中长期接触农药所产生的慢性毒性仍然是不可忽视的,有可能引起除致死效应之外的其他不利效应,最典型就是对蚯蚓的生长和繁殖具有抑制效应。有机磷杀虫剂暴露对蚯蚓具有较显著的生长毒性影响,研究发现5 mg a.i.·kg-1的毒死蜱暴露8周后对蚯蚓生长有不利影响[19],而蚯蚓体重下降也是氯氰菊酯、草甘膦和百草枯中毒的典型症状之一[1-2]。许多农药在低浓度下还能显著抑制蚯蚓的繁殖[1]。此外,虽然除草剂品种很少对蚯蚓产生直接毒性,但蚯蚓以摄食土壤中的有机质为生,而杂草是有机质的重要来源之一,因此除草剂可能通过影响杂草的生长而对蚯蚓产生间接作用[7]。随着我国农药登记管理制度的日益完善,应逐步引入类似于美国、欧盟和OECD现行的以多层次农药生态风险评价为理念的农药登记管理制度[1]。
多数情况下仅研究蚯蚓死亡率对农药暴露的响应是不够的,在研究农药对蚯蚓致死效应的同时,还需关注其他毒理效应[1, 3]。农药在蚯蚓体内诱导产生活性氧(ROS),过量ROS存在则诱导蚯蚓体内的抗氧化机制和酶保护机制的产生,如诱导SOD和CAT等酶活性发生改变[20]。阿维菌素由链霉菌中灰色链霉菌Streptomyces avermitilis发酵产生,为高效、广谱的抗生素类杀虫剂,由一组十六元大环内酯化合物组成,对螨类和昆虫具有胃毒和触杀作用,其作用机制是干扰神经生理活动,刺激释放γ-氨基丁酸,而氨基丁酸对节肢动物的神经传导有抑制作用;吡虫啉和噻虫啉为典型的新烟碱类杀虫剂,具有独特的作用机制,其作用靶标为乙酰胆碱受体(nAChRs)。鉴于目前针对这几种杀虫剂对土壤生物的毒理研究相对较少,本研究选择抗氧化系统的几个常见生理生化指标对暴露于含受试农药的土壤环境中的赤子爱胜蚓进行研究,结果表明除吡虫啉之外,蚯蚓体内的GST、CAT和T-SOD对阿维菌素和噻虫啉暴露均十分敏感,发生显著性变化的浓度值远远低于LC50值。吡虫啉暴露下抗氧化酶之所以不敏感,可能是因为抗氧化酶常被用作污染物对生物影响的早期预警指标,在过高的暴露浓度下这些指标反而变化不敏感。有趣的是,Zhang等[21]发现蚯蚓暴露在2 mg a.i.·kg-1吡虫啉的人工土壤中1、6、14 d后,体内SOD和CAT活性显著提高,而本研究中含5 mg a.i.·kg-1吡虫啉的人工土壤则对蚯蚓CAT活性产生显著性抑制作用。从各个酶学指标对农药暴露的响应规律来看,蚯蚓组织的T-SOD活性在一定浓度的两种新烟碱类杀虫剂暴露下均出现显著性诱导,有助于蚯蚓对体内超氧阴离子的去除,但较高浓度的不同农药暴露下,蚯蚓CAT活性均出现抑制。CAT是生物体内催化过氧化氢分解成氧和水的酶,其活性的抑制将导致过氧化氢自由基的累积,有可能对蚯蚓造成过氧化损伤。抗氧化系统在污染物胁迫下的变化是一个较为复杂的变化,在农药胁迫下,抗氧化系统关键酶如SOD、CAT、POD和GST的变化指示了蚯蚓体内正在进行的解毒反应过程。污染物胁迫下,酶活性在蚯蚓体内受到非常复杂的调控,它的变化与作用剂量和作用时间的关系非常密切[22]。正因为如此,虽然敏感的酶活性变化在污染物早期预警研究中很早就受到关注,但一直较难应用到实践当中,对其研究可以为污染物毒性作用特点提供必要的基础数据。
相当多的研究证据表明,污染物对生物毒性的一个重要体现就是指示过氧化损伤的脂质过氧化(LPO)水平的上升[23]。本研究中,蚯蚓组织LPO水平通过测定MDA含量来体现。在不同农药14 d暴露后,仅在0.5 mg a.i.·kg-1阿维菌素暴露组观察到MDA含量的显著性上升,表征蚯蚓受到了氧化损伤,但是在高浓度组(50 mg a.i.·kg-1),MDA含量出现了显著性下降。该现象在新烟碱类杀虫剂吡虫啉和噻虫啉暴露组里尤为显著,可能与高浓度农药胁迫下,蚯蚓组织细胞内膜结构的损伤以及自由基水平的变化密切相关[24-25]。农药对蚯蚓的毒性可以表现在多个方面,近年来的研究发现包括农药在内的多种化学物质会对蚯蚓表皮和中肠造成损害。有学者发现蚯蚓受到吡虫啉伤害后,表皮分泌细胞开始增多,胶原纤维开始扩张并在角质层内形成空泡,上角质层增厚,同时也会对蚯蚓的中肠造成伤害,使蚯蚓中肠细胞变形,高浓度时甚至出现裂解。因此,氧化应激和抗氧化损伤仅仅是蚯蚓对农药的毒性响应之一,对于对土壤生物具有潜在高风险的农药,未来需要开展更多的致毒机制方面的研究[26]。
4 结论受试的11种农药原药(或标准品)对蚯蚓的急性毒性等级从高到低依次为吡虫啉>噻虫啉>克百威>毒死蜱>阿特拉津>阿维菌素>草甘膦>吡蚜酮>噻嗪酮>高效氯氰菊酯和百草枯,其中吡虫啉、噻虫啉和克百威对蚯蚓的毒性分级为中毒,其余均为低毒。部分农药制剂(65%吡虫啉水剂、5%阿维菌素乳油、5%阿维菌素可湿性粉剂、50%吡蚜酮水分散粒剂、37%噻嗪酮悬浮剂和30%毒死蜱水乳剂)增加了农药对赤子爱胜蚓的毒性。赤子爱胜蚓的GST(显著性诱导)和CAT(显著性抑制)活性对阿维菌素暴露较为敏感(0.25 mg a.i.·kg-1);CAT(抑制)和T-SOD(诱导)在5 mg a.i.·kg-1吡虫啉暴露下出现显著性变化;0.1 mg a.i.·kg-1噻虫啉暴露下,蚯蚓CAT(抑制)和T-SOD(诱导)活性即产生显著性变化。另外,阿维菌素、吡虫啉和噻虫啉分别在0.5、0.1、0.5 mg a.i.·kg-1的暴露水平,可以诱导蚯蚓体内MDA含量出现显著性变化。
| [1] | 姜锦林, 程燕, 卜元卿, 等. 农药对蚯蚓的生长和繁殖毒性及其在生态风险评价中的应用[J]. 农药科学与管理, 2014, 35(9): 23–32. JIANG Jin-lin, CHENG Yan, BU Yuan-qing, et al. Effects of pesticides on the growth and reproduction of earthworm and its application in ecological risk assessment[J]. Pesticide Science and Administration, 2014, 35(9): 23–32. |
| [2] | Shahla Y, D'souza S. Effects of pesticides on the growth and reproduction of earthworm:A review[J]. Applied and Environmental Soil Science, 2010(3): 1–9. |
| [3] | 左海根, 林玉锁, 龚瑞忠. 农药污染对蚯蚓毒性毒理研究进展[J]. 农村生态环境, 2004, 20(4): 68–72. ZUO Hai-gen, LIN Yu-suo, GONG Rui-zhong. Toxicology of pesticide pollution to earthworms[J]. Rural Eco-Environment, 2004, 20(4): 68–72. |
| [4] | Beeby A. What do sentinels stand for?[J]. Environmental Pollution, 2001, 112(2): 285–298. DOI:10.1016/S0269-7491(00)00038-5 |
| [5] | 蔡道基, 张壬午, 李治祥, 等. 农药对蚯蚓的毒性与危害性评估[J]. 农村生态环境, 1986, 2(2): 14–18. CAI Dao-ji, ZHANG Ren-wu, LI Zhi-xiang, et al. Toxicity and hazard assessment of pesticides on earthworm[J]. Rural Eco-Environment, 1986, 2(2): 14–18. |
| [6] | 龚鹏博, 李健雄, 郭明昉, 等. 蚯蚓生态毒理试验现状与发展趋势[J]. 生态学杂志, 2007, 26(8): 1297–1302. GONG Peng-bo, LI Jian-xiong, GUO Ming-fang, et al. Present status and development trend of earthworm eco-toxicological test[J]. Chinese Journal of Ecology, 2007, 26(8): 1297–1302. |
| [7] | 王彦华, 俞卫华, 杨立之, 等. 22种常用除草剂对蚯蚓 (Eisenia fetida) 的急性毒性[J]. 生态毒理学报, 2012, 7(3): 317–325. WANG Yan-hua, YU Wei-hua, YANG Li-zhi, et al. Acute toxicity of twenty-two commonly used herbicides to earthworm (Eisenia fetida)[J]. Asian Journal of Ecotoxicology, 2012, 7(3): 317–325. |
| [8] | Frampton G K, Jansch S, Scott-Fordsmand J J. Effects of pesticides on soil invertebrates in laboratory studies:A review and analysis using species sensitivity distributions[J]. Environmental Toxicology and Chemistry, 2006, 25(9): 2480–2489. DOI:10.1897/05-438R.1 |
| [9] | Jänsch S, Amorim M J, Römbke J. Identification of the ecological requirements of important terrestrial ecotoxicological test species[J]. Environmental Reviews, 2005, 13(2): 51–83. DOI:10.1139/a05-007 |
| [10] | 国家质量监督检验检疫总局, 国家标准化管理委员会. GB/T 31270.15-2014化学农药环境安全评价试验准则第15部分:蚯蚓急性毒性试验[S].北京:中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of PRC, Standardization Administration of PRC. GB/T 31270.15-2014 Test guidelines on environmental safety assessment for chemical pesticides. Part 15:Earthworm acute toxicity test[S]. Beijing:China Standards Press, 2014. |
| [11] | Organization for Economic Co-operation and Development (OECD). Guideline for testing of chemicals. No. 207, Earthworm acute toxicity test[S]. Paris:OECD, 1984. |
| [12] | Marklund S, Marklund G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase[J]. European Journal of Biochemistry, 1974, 47(3): 169–174. |
| [13] | 徐镜波, 袁晓凡. 过氧化氢酶活性及活性抑制的紫外分光光度测定[J]. 环境化学, 1997, 16(1): 73–76. XU Jing-bo, YUAN Xiao-fan. The determination of enzymic activity and its inhibition on catalase by ultraviolet spectrophotometry[J]. Environmetnal Chemistry, 1997, 16(1): 73–76. |
| [14] | Habig W H, Pabst M J, Jakoby W B. Glutathione stransferases:The first enzymatic step in mercapturic acid formation[J]. Journal of Biological Chemistry, 1974, 249(22): 7130–7139. |
| [15] | Miller D M, Aust S D. Studies of ascorbate-dependent, iron catalyzed lipid peroxidation[J]. Archives of Biochemistry and Biophysics, 1989, 271(1): 113–119. DOI:10.1016/0003-9861(89)90261-0 |
| [16] | van Gestel C A M, van Dis W A. The influence of soil characteristics on the toxicity of four chemicals to the earthworm Eisenia fetida andrei (Oligochaeta)[J]. Biology and Fertility of Soils, 1988, 6(3): 262–265. DOI:10.1007/BF00260822 |
| [17] | van Gestel C A M, van Dis W A, van Breemen E M, et al. Development of a standardized reproduction toxicity test with the earthworm species Eisenia fetida andrei using copper, pentachlorophenol, and 2, 4-dichloroaniline[J]. Ecotoxicology and Environmental Safety, 1989, 18(3): 305–312. DOI:10.1016/0147-6513(89)90024-9 |
| [18] | 卜元卿, 王暂畅, 智勇, 等. 农药制剂中助剂使用状况调研及风险分析[J]. 农药, 2014, 53(12): 932–936. BU Yuan-qing, WANG Zan-chang, ZHI Yong, et al. Investigation and risk analysis of pesticide inert ingredients in pesticide products[J]. Agrochemicals, 2014, 53(12): 932–936. |
| [19] | Zhou S P, Duan C Q, Fu H. Toxicity assessment for chlorpyrifos-contaminated soil with three different earthworm test methods[J]. Journal of Environmental Sciences, 2007, 19(7): 854–858. DOI:10.1016/S1001-0742(07)60142-9 |
| [20] | Banerjee B D, Seth V, Ahmed R S. Pesticide-induced oxidative stress:Perspective and trends[J]. Reviews on Environmental Health, 2001, 16(1): 1–40. DOI:10.1515/REVEH.2001.16.1.1 |
| [21] | Zhang Q M, Zhang B H, Wang C X. Ecotoxicological effects on the earthworm Eisenia fetida following exposure to soil contaminated with imidacloprid[J]. Environmental Science and Pollution Research International, 2014, 21: 12345–12353. DOI:10.1007/s11356-014-3178-z |
| [22] | 王晓蓉, 罗义, 施华宏, 等. 分子生物标志物在污染环境早期诊断和生态风险评价中的应用[J]. 环境化学, 2006, 25(3): 320–325. WANG Xiao-rong, LUO Yi, SHI Hua-hong, et al. Application of molecular biomarkers in early diagnosis and ecological risk assessment for water and soil[J]. Environmental Chemistry, 2006, 25(3): 320–325. |
| [23] | Leflaive J, Ten-Hage L. Algal and cyanobacterial secondary metabolites in freshwaters:A comparison of allelopathic compounds and toxins[J]. Freshwater Biology, 2007, 52(2): 199–214. DOI:10.1111/fwb.2007.52.issue-2 |
| [24] | Yin Y, Wang X R, Sun Y Y, et al. Bioaccumulation and oxidative stress in submerged macrophyte Ceratophyllum demersum L. upon exposure to pyrene[J]. Environmental Toxicology, 2007, 23(3): 328–336. DOI:10.1016/j.etap.2006.12.004 |
| [25] | Wang C R, Wang X R, Tian Y, et al. Oxidative stress, defense response, and early biomarkers for lead-contaminated soil in Vicia faba seedlings[J]. Environmental Toxicology and Chemistry, 2008, 27(4): 970–977. DOI:10.1897/07-344.1 |
| [26] | Dittbrenner N, Schmitt H, Capowiez Y, et al. Sensitivity of Eisenia fetida in comparison to Aporrectodea caliginosa and Lumbricus terrestris after imidacloprid exposure:Body mass change and histopathology[J]. Journal of Soils and Sediments, 2011, 11(6): 1000–1010. DOI:10.1007/s11368-011-0397-5 |
 2017, Vol. 36
2017, Vol. 36




