文章信息
- 刘慧, 蒋安祺, 王为木
- LIU Hui, JIANG An-qi, WANG Wei-mu
- 低浓度微纳米氧化锌对中华圆田螺的生态毒性
- Ecotoxicity of low concentration micro/nano ZnO exposure on Cipangopaludina Cahayensis
- 农业环境科学学报, 2017, 36(3): 474-480
- Journal of Agro-Environment Science, 2017, 36(3): 474-480
- http://dx.doi.org/10.11654/jaes.2016-1334
文章历史
- 收稿日期: 2016-10-19
2. 河海大学南方地区高效灌排与农业水土环境教育部重点实验室, 南京 210098
2. Key Laboratory of High-Efficient Irrigation and Drainage and Agricultural Water and Soil Environment in Southern China, Ministry Education, Nanjing 210098, China
氧化锌是一种宽带隙半导体材料,在光电子领域有重要作用,也是无机抗菌剂研究的热点之一。纳米氧化锌作为常见的纳米材料还被广泛应用于陶瓷、油漆等行业,甚至在化妆品领域也有广阔的应用前景[1-2]。目前,相关实验发现微米氧化锌在高剂量时可诱导小鼠细胞DNA损伤[3],但对水生生物毒性的研究还较少,而纳米氧化锌在此方面的研究主要针对细菌、藻类和鱼类。研究显示,低浓度纳米氧化锌对斜生栅藻生长起促进作用,达到一定浓度后表现为抑制作用[4];纳米氧化锌虽然在鱼类体内不具有生物蓄积性,但无法完全清除,高浓度下会有大量Zn积累在鱼鳃、肠等部位并出现氧化应激反应,甚至还会导致鱼类器官损伤,渗透调节能力变弱以及免疫系统紊乱[5-6]。
采用电子顺磁共振(EPR)技术与自旋捕集技术相结合来捕捉寿命短、稳态浓度低的瞬态自由基是细胞生物学及生物化学研究中常用的方法,具有灵敏度高、特异选择性强和分析结果可靠等优点[7]。在所有需氧生物体内,都存在一系列抗氧化酶和抗氧化剂,它们的总称就是抗氧化防御系统,其作用是清除体内过剩的活性氧簇(ROS),保护机体免受过量ROS带来的伤害[8]。中华圆田螺(Cipangopaludina cahayensis)是国内常见的杂食性大型淡水底栖动物,处于食物链低营养级别,且在水中的移动性很小,生活环境相对固定,可以真实地反映周围底泥或水体的实际污染状况[9],然而目前关于纳米颗粒对底栖动物低浓度暴露的生态毒理学效应的研究还较为少见。
本研究以中华圆田螺为受试生物进行室内试验,以自由基强度、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、谷胱甘肽S-转移酶(GST)以及肝脏中Zn的富集量为测试指标,研究低浓度下微、纳米氧化锌悬浮液对中华圆田螺的生态毒理学效应,以期为今后纳米氧化锌的生态安全性评价提供数据支撑和科学依据。
1 材料与方法 1.1 供试生物试验所用中华圆田螺购自南京市水产市场,其平均体长为(5.41±0.65)cm,平均体宽为(3.85±0.75)cm,平均体重为(43.57±0.45)g。驯养采用曝气除氯自来水,试验前驯养14 d,死亡率小于5%。随机选取个体差异不大的田螺用于暴露试验。
1.2 仪器与试剂仪器:EMX 10/12型EPR谱仪(德国Bruker公司);UV-8000S双光束紫外/可见分光光度计;HC-3018R高速冷冻离心机;PE-AA800火焰原子吸收光谱仪(铂金埃尔默仪器有限公司,上海)等。
试剂:纳米氧化锌(纯度99.7%,粒径50±10 nm)和微米氧化锌(AR,纯度≥99.0%,粒径≤1 μm)购自阿拉丁(Aladdin)公司,二甲基亚砜(DMSO),α-苯基-N-叔丁基甲亚胺-N-氧化物(PBN),其余试剂均为国产分析纯。
1.3 试验设计微、纳米ZnO悬浮液制备:分别将微米氧化锌和纳米氧化锌(浓度为0.1、0.2、0.5、1.0、2.0 mg·L-1)溶于30 L除氯自来水中,超声60 min(仪器设置:功率250,频率40 kHz,温度24 ℃)后待用[10-11]。
暴露试验:将已制备好的悬浮液分别加入体积为40 L的玻璃水缸中,并投放20只田螺,同时设置空白对照。暴露时间为14 d,光照周期为12 h(白昼)/12 h(黑暗),维持水温(24±2)℃,每2 d投放人工饵料一次。采用静态置换法每2 d更换一次溶液,并检查一次水质。试验期间,田螺状况良好无死亡。试验结束后,将实验螺取出洗净,夹破螺壳后分离出肝脏,一部分直接保存于-20 ℃冰箱中用于测定Zn富集量,另一部分加磷酸缓冲液研磨后经高速冷冻离心机离心30 min,取上清液存放于-20 ℃冰箱中保存待测。
1.4 指标测定 1.4.1 自由基的捕获与测定自由基的捕获与测定采用Davies等改良方法[12],即在N2环境下,用PBN和DMSO制取肝脏匀浆液,而后抽取上清液注入一端封口的毛细管中,迅速放入液氮中保存,待电子顺磁共振(EPR)测定。其中EPR谱仪操作参数:测试温度130 K,微波功率20 mW,微波频率9.751 GHz,调制频率100 kHz,调制幅度0.5 G,中心磁场3470 G,扫场时间84 s,时间常数41 ms,扫场宽度200 G,信号为5次叠加[13]。
1.4.2 生化指标测定采用考马斯亮蓝G250与蛋白质结合的方法测定蛋白质含量[14];改进的邻苯三酚自氧化法测定SOD[15];徐镜波等[16]的方法测定CAT;Habig[17]改进法测定GST;硫代巴比妥酸(TBA)比色法测定MDA[18]。
1.4.3 Zn生物积累测定将中华圆田螺洗净解剖后取出肝脏,在60 ℃下烘48 h至样品恒重。称取0.5 g左右预处理后的肝脏置于锥形瓶内,加入10 mL优级纯混酸溶液(浓HNO3:浓HClO4为5:1),在电热板上消煮至白色后用稀HNO3定容至25 mL。利用原子吸收光谱仪测定Zn的含量[19]。
1.5 数据处理与分析数据采用Origin 7.5进行自由基图谱绘制和分析、SPSS 17.0进行统计分析。运用单因素方差分析方法,采用Duncan法进行多重比较。差异显著性水平为0.05,结果以标记字母法表示。
2 结果与分析 2.1 中华圆田螺肝脏自由基种类鉴定与变化情况图 1是中华圆田螺暴露于0.2 mg·L-1微、纳米氧化锌悬浮液14 d时肝脏自由基图谱。经计算,图 1A暴露于微米ZnO中华圆田螺肝脏捕获的自由基超精细分裂常数PBN/CH3为aN=15.2 Gauss、aH=3.1 Gauss、g=2.005 8,PBN/OCH3为aN=15.6 Gauss、aH=3.5 Gauss、g=2.005 8;图 1B暴露于纳米ZnO中华圆田螺肝脏捕获的自由基超精细分裂常数PBN/CH3为aN=15.2 Gauss、aH=3.1 Gauss、g=2.005 8,PBN/OCH3为aN=15.4 Gauss、aH=3.3 Gauss、g=2.005 8。两者均与文献报道的PBN捕获甲基和甲氧基的特征参数基本一致[20-21]。根据羟基(·OH)自由基生成甲基和甲氧基的具体反应式:·OH+DMSO→·CH3+PBN→PBN/·CH3+O2→PBN/·OCH3,且产生三组双重峰分类谱线为典型的PBN捕获自由基形成PBN/·OH的EPR图谱,可以判断在氮气环境下微、纳米氧化锌均可诱导中华圆田螺肝脏产生羟基(·OH)自由基。两个自由基图谱均具有超精细分裂峰的三组峰,以第二组峰的第一个小峰的峰高与峰谷之间信号强度差值的绝对值作为自由基的相对浓度值[20]。该浓度下两处理组自由基信号强度分别为3 549.8和5 282.2。
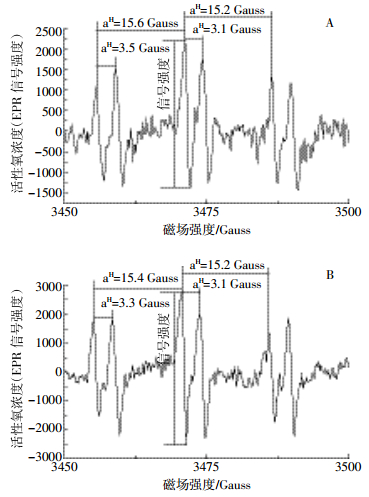
|
| 图 1 微米氧化锌(A)与纳米氧化锌(B)暴露中华圆田螺肝脏自由基图谱 Figure 1 EPR spectrum of free radical in liver of Cipangopaludina cahayensis exposed to micro ZnO (A) and nano ZnO (B) |
微、纳米氧化锌暴露14 d中华圆田螺肝脏自由基强度的变化如图 2所示。从图可以看出,微、纳米氧化锌诱导·OH自由基信号强度均高于对照组,其中0.2~1 mg·L-1微米氧化锌和0.1~1 mg·L-1纳米氧化锌暴露信号强度显著高于对照组。两者随浓度增加均表现为先升高后降低的变化趋势,最大信号值均出现在0.5 mg·L-1暴露水平下,但纳米氧化锌诱导产生自由基强度为微米氧化锌的3.09倍、对照组的7.37倍。
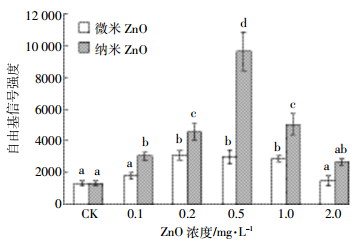
|
| 图 2 自由基信号强度变化情况(n=5) Figure 2 Changes of free radical signal intensity (n=5) |
微、纳米氧化锌暴露14 d中华圆田螺肝脏Zn的富集量情况如表 1所示。从表中可以明显看出,Zn的富集量随暴露浓度的增加逐渐升高,除0.1 mg·L-1微米氧化锌处理外,其他处理组富集量均与对照组差异显著。两处理组暴露浓度与富集量之间均存在显著的线性相关,分别为:y=0.094 3x+0.109 3,R2=0.933 5;y=0.108 3x+0.090 9,R2=0.940 4。但纳米氧化锌暴露Zn含量均高于同浓度微米氧化锌暴露。

|
微、纳米氧化锌暴露14 d中华圆田螺肝脏SOD活性的变化如图 3所示。由图可知,0.1~0.5 mg·L-1微米氧化锌暴露SOD活性呈显著抑制状态,1~2 mg·L-1暴露组与对照组无显著差异。纳米氧化锌暴露SOD活性随浓度升高呈先增加后降低的变化趋势,0.1~0.2 mg·L-1暴露与对照无显著差异,1 mg·L-1时SOD活性达到最大值,为对照组的2.99倍。
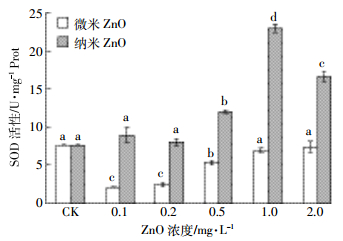
|
| 图 3 SOD活性变化情况(n=5) Figure 3 Changes of SOD activities (n=5) |
微、纳米氧化锌暴露14 d中华圆田螺肝脏CAT活性的变化如图 4所示。微、纳米氧化锌暴露下CAT活性均处于显著诱导状态,且纳米氧化锌对CAT活性的诱导程度大于微米氧化锌。两者暴露下CAT活性均随ZnO浓度增加逐渐增加,在2 mg·L-1达到最大值。其中,0.1~0.2 mg·L-1微、纳米氧化锌暴露与0.5~1 mg·L-1纳米氧化锌暴露CAT活性均无显著差异。
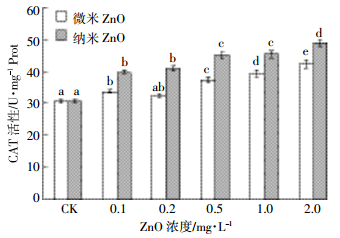
|
| 图 4 CAT活性变化情况(n=5) Figure 4 Changes of CAT activities (n=5) |
微、纳米氧化锌暴露14 d中华圆田螺肝脏MDA含量的变化如图 5所示。由图可以看出,0.1~0.5 mg·L-1微米氧化锌暴露MDA含量未发生显著变化,浓度达到1~2 mg·L-1时MDA含量出现显著诱导,分别为对照组的28.67倍和33.45倍;纳米氧化锌暴露MDA含量显著增加,且随浓度增大呈先增加后降低的变化趋势,1 mg·L-1时出现最大值,为对照组的91.71倍。
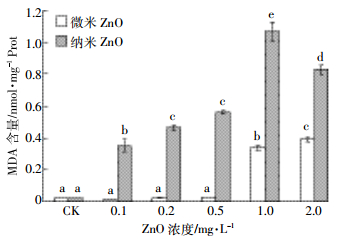
|
| 图 5 MDA含量变化情况(n=5) Figure 5 Changes of MDA contents (n=5) |
微、纳米氧化锌暴露14 d中华圆田螺肝脏GST活性的变化如图 6所示。由图可知,两者暴露GST活性均处于显著抑制状态,在0.5 mg·L-1暴露水平下抑制程度最弱,但两者之间差异不显著。
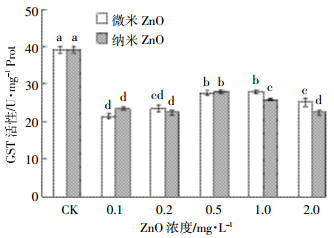
|
| 图 6 GST活性变化情况(n=5) Figure 6 Changes of GST activities (n=5) |
有研究指出颗粒尺寸大小会影响其对生物的生态毒性效应。Pradhan等[22]的研究表明,无脊椎碎食者的摄食速率会随纳米颗粒尺寸的下降而抑制效果增强。有学者同样发现尺寸较小( < 10 nm)的纳米TiO2颗粒在低浓度暴露下对藻类的生长抑制程度高于尺寸较大的颗粒[23]。但也有实验结果发现微、纳米ZnO对线虫的24 h半致死剂量没有显著差异[24]。
活性氧的产生是生物体对外源性污染物胁迫响应的路径之一,污染物可以通过活性氧进一步诱导生物体发生氧化应激和氧化损伤。在本实验中,微、纳米氧化锌均诱导田螺产生·OH自由基,且纳米氧化锌诱导产生自由基信号强度高于微米氧化锌,与在鲫鱼腹腔注射微、纳米氧化锌后肝脏中测得羟基自由基显著诱导的结论相同[25]。金霏霏等[26]选用体外暴露的方式同样在鲫鱼肝脏中发现了纳米氧化锌显著诱导产生ROS,Zhao等[27]用斑马鱼作为受试生物在20、50、100 mg·L-1纳米氧化锌暴露下得出ROS诱导程度分别为对照组的179%、194%和244%的结论。这表明诱导产生ROS是ZnO对水生生物致毒的重要原因,且随ZnO浓度增加表现出一定的剂量-效应关系,同时纳米氧化锌暴露下生物受到的氧化胁迫大于微米氧化锌,也表明颗粒粒径大小会影响其对生物的毒性。
SOD、CAT和GST作为抗氧化防御系统的一部分,在清除活性氧以及机体的保护性防御中发挥着巨大的作用。在本实验中华圆田螺暴露于两种尺寸的ZnO悬浮液中,机体受到一定程度的污染物胁迫,表现出大量·OH自由基的产生,三种抗氧化酶也表现出不同的变化情况。实验结果显示,在微米氧化锌暴露下SOD活性处于抑制状态,可能如Ntasham Frankin所述析出的锌离子以及光催化会对其产生较大影响,从而引起细胞功能下降[28-29]。熊道文等[30]在7 d的急性暴露实验中也发现常规ZnO会造成斑马鱼SOD活性显著降低,仅为对照组的48.7%,田文静等[31]的实验结果则表明释放锌的处理组斑马鱼胚胎SOD活性表现出逐渐降低趋势。而纳米氧化锌暴露则显著诱导SOD活性,与Zhao等[27]和刘林等[32]研究斑马鱼胚胎和肝脏中SOD活性显著增加且存在一定剂量依赖性的变化情况相似。胡正雪等[25]则发现微米ZnO对鲫鱼肝脏和脑部SOD活性均无明显影响,而1 mg·L-1和12.5 mg·L-1纳米氧化锌暴露显著抑制鲫鱼肝脏和脑部SOD活性。两种尺寸氧化锌暴露下CAT活性均呈诱导状态,且两者均随浓度增大活性逐渐增加,与熊道文等[30]在斑马鱼腮部、消化道中得到的CAT活性诱导程度为对照组153.6%、253.0%的结果相似。在0.2~1 mg·L-1微米氧化锌暴露下活性氧浓度才出现显著升高,此时SOD活性处于抑制状态、CAT表现出显著诱导情况,这表明在ZnO低毒性影响下CAT起防御作用略大。而在0.1~0.5 mg·L-1纳米氧化锌胁迫下SOD和CAT活性均表现出与自由基强度相同的变化规律,表明此条件下需SOD和CAT联合作用,共同消除活性氧对田螺造成的胁迫作用。而当浓度达到1 mg·L-1时,活性氧浓度大幅下降至对照组相似水平,SOD和CAT仍处于诱导状态,可能是由于两种酶的大量产生使得ROS得到了消除,机体开始向稳定状态恢复。以上结果表明,生物物种的差别以及器官的不同均会影响抗氧化酶对ZnO的反应,但ZnO颗粒尺寸的大小确实会对其产生毒性的高低造成影响。在本实验中,GST活性表现出显著抑制状态,且GST活性在微、纳米氧化锌暴露之间的差异不显著,与斑马鱼暴露96 h后肠组织中GST活性的变化情况有相似之处[33]。这表明GST作为第二阶段解毒酶未发挥明显作用,其抑制情况可能因为受到脂质过氧化的伤害,但关于GST活性具体表现为抑制状态的原因还不明确,有待进一步研究。
·OH自由基的生成与MDA含量虽不完全同步,但变化有一定正相关性,且SOD的最大诱导为对照组的299%,远低于活性氧生成量,显著超出抗氧化防御能力,因此田螺机体出现氧化应激,表现出严重的脂质过氧化损伤。在微米氧化锌暴露时MDA含量仅在1~2 mg·L-1时发生大幅度增加,但纳米氧化锌暴露中华圆田螺肝脏MDA含量显著增加,与其他学者关于鲫鱼、斑马鱼和白亚口鱼等水生动物的结果相似[10, 34-35],这说明微米氧化锌与纳米氧化锌均可因活性氧的生成造成中华圆田螺细胞膜发生脂质过氧化,影响细胞功能正常发挥[36],且纳米氧化锌造成的损伤程度大于微米氧化锌,与ROS产生量保持一定的正相关。
本实验的结果还显示,随着ZnO浓度的增加中华圆田螺肝脏中Zn富集量表现出显著的线性相关,且两种尺寸暴露下Zn富集量存在显著差异,这表明纳米ZnO更容易造成Zn在田螺肝脏中的积累。但有实验结果显示,纳米氧化锌在水中析出Zn2+的浓度较低,释放率不超过5%[37],而环境中Zn2+浓度通常大于10 mg·L-1,远高于纳米氧化锌溶解极限[28],但Zn2+释放程度大小对田螺具体影响程度以及Zn的富集是以Zn的何种形态、通过哪种途径进入到肝脏中还需通过进一步实验得出。
4 结论氧化锌颗粒粒径的大小会影响其对生物的生态毒性,在本实验中表现为纳米氧化锌对中华圆田螺的生态毒性高于微米氧化锌;不同浓度下微、纳米氧化锌对中华圆田螺的毒性有一定差异,0.5~1 mg·L-1为生态毒性发生改变的阈值范围,且较高浓度微米氧化锌表现出与低浓度(0.1~0.2 mg·L-1)纳米氧化锌暴露相似的影响;微、纳米氧化锌对中华圆田螺肝脏自由基强度、SOD、CAT活性、MDA含量以及Zn富集量均有一定影响,因此可以考虑采用该指标体系评价氧化锌对底栖生物的生态毒性。
| [1] | Sirelkhatim A, Mahmud S, Seeni A, et al. Review on zinc oxide nanoparticles:Antibacterial activity and toxicity mechanism[J]. Nano-Micro Letters, 2015, 7(3): 219–242. DOI:10.1007/s40820-015-0040-x |
| [2] | Nandi I, Mitra P, Banerjee P, et al. Ecotoxicological impact of sunlight assisted photoreduction of hexavalent chromium present in wastewater with zinc oxide nanoparticles on common Anabaena flos-aquae[J]. Ecotoxicology and Environmental Safety, 2012, 86: 7–12. DOI:10.1016/j.ecoenv.2012.08.020 |
| [3] | 梁春柳, 朱江波, 朱玉平, 等. 纳米与微米尺度氧化锌体外遗传毒作用特征的比较研究[J]. 生态毒理学报, 2012, 7(3): 299–304. LIANG Chun-liu, ZHU Jiang-bo, ZHU Yu-ping, et al. Comparative study on genotoxicity in vitro caused by nano-and micro-scale ZnO[J]. Asian Journal of Ecotoxicology, 2012, 7(3): 299–304. |
| [4] | 李雅洁, 王静, 崔益斌, 等. 纳米氧化锌和二氧化钛对斜生栅藻的毒性效应[J]. 农业环境科学学报, 2013, 32(6): 1122–1127. LI Ya-jie, WANG Jing, CUI Yi-bin, et al. Ecotoxicological effects of ZnO and TiO2 nanoparticles on microalgae Scenedesmus oblignus[J]. Journal of Agro-Environment Science, 2013, 32(6): 1122–1127. |
| [5] | Kaya H, Aydın F, Gürkan M, et al. Effects of zinc oxide nanoparticles on bioaccumulation and oxidative stress in different organs of tilapia (Oreochromis niloticus)[J]. Environmental Toxicology and Pharmacology, 2015, 40(3): 936–947. DOI:10.1016/j.etap.2015.10.001 |
| [6] | Kaya H, Aydın F, Gürkan M, et al. A comparative toxicity study between small and large size zinc oxide nanoparticles in tilapia (Oreochromis niloticus):Organ pathologies, osmoregulatory responses and immunological parameters[J]. Chemosphere, 2016, 144: 571–582. DOI:10.1016/j.chemosphere.2015.09.024 |
| [7] | 王翠平, 叶柳, 谢安建, 等. 电子顺磁共振技术应用及进展[J]. 实验室研究与探索, 2013, 32(5): 5–7, 25. WANG Cui-ping, YE Liu, XIE An-jian, et al. Progress and applications of electron paramagnetic resonance spectroscopy[J]. Research and Exploration in Laboratory, 2013, 32(5): 5–7, 25. |
| [8] | 陈家长, 宋超, 胡庚东, 等. 微囊藻毒素-LR对罗非鱼肝脏活性氧自由基含量及相关抗氧化酶活性的影响[J]. 农业环境科学学报, 2011, 30(8): 1521–1525. CHEN Jia-zhang, SONG Chao, HU Geng-dong, et al. Effects of microcystin-LR on antioxidant enzymes and reactive oxygen species in tilapia fish[J]. Journal of Agro-Environment Science, 2011, 30(8): 1521–1525. |
| [9] | Völker C, Gräf T, Schneider I, et al. Combined effects of silver nanoparticles and 17α-ethinylestradiol on the freshwater mudsnail Potamopyrgus antipodarum[J]. Environmental Science and Pollution Research, 2014, 21(18): 10661–10670. DOI:10.1007/s11356-014-3067-5 |
| [10] | 刘慧, 朱方伟, 尹颖, 等. 纳米ZnO对鲫鱼肝脏的毒性[J]. 生态毒理学报, 2010, 5(5): 698–703. LIU Hui, ZHU Fang-wei, YIN Ying, et al. Toxicity of nano-ZnO on liver of goldfish (Carassius auratus)[J]. Asian Journal of Ecotoxicology, 2010, 5(5): 698–703. |
| [11] | 陈铮, 罗专溪, 颜昌宙, 等. SHMP分散配制用于环境风险模拟研究的纳米ZnO颗粒溶胶[J]. 环境科学研究, 2012, 25(8): 927–932. CHEN Zheng, LUO Zhuan-xi, YAN Chang-zhou, et al. Using SHMP for preparation of the disperion of ZnO nanoparticles for environmental risk study[J]. Research of Environmental Science, 2012, 25(8): 927–932. |
| [12] | Davies M J, Havkins C L. EPR spin trapping of protein radicals[J]. Free Radical Biology and Medicine, 2004, 36(9): 1072–1086. DOI:10.1016/j.freeradbiomed.2003.12.013 |
| [13] | 刘慧, 王群, 王为木, 等. 两种有机酸存在下铜对中华圆田螺肝脏的氧化应激效应[J]. 生态毒理学报, 2015, 10(2): 306–312. LIU Hui, WANG Qun, WANG Wei-mu, et al. The oxidative stress of copper on liver of river snail Cipangopaludina cahayensis in the presence of two kinds of organic acids[J]. Asian Journal of Ecotoxicology, 2015, 10(2): 306–312. |
| [14] | Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248–254. |
| [15] | 邹国林, 桂兴芬, 钟晓凌, 等. 一种SOD的测活方法:邻苯三酚自氧化法的改进[J]. 生物化学与生物物理学进展, 1986, 4: 71–73. ZOU Guo-lin, GUI Xing-fen, ZHONG Xiao-ling, et al. A method to determination of SOD activity:To improve the pyrogallol autoxidation method[J]. Progress in Biochemistry and Biophysics, 1986, 4: 71–73. |
| [16] | 徐镜波, 袁小凡, 郎佩贞. 过氧化氢酶活性及活性抑制的紫外分光光度法测定[J]. 环境化学, 1997, 16(1): 73–76. XU Jing-bo, YUAN Xiao-fan, LANG Pei-zhen. The determination of enzymic activity and its inhibition of catalase[J]. Environmental Chemistry, 1997, 16(1): 73–76. |
| [17] | Habig W H, Pabst M J, Jskoby W B. Glutathione-S-transferases the first enzymatic step in mercapturic acid formation[J]. Journal of Biological Chemistry, 1974, 249(22): 7130–7139. |
| [18] | 罗义, 施华宏, 王晓蓉, 等. 2, 4-二氯苯酚诱导鲫鱼肝脏自由基的产生和脂质过氧化[J]. 环境科学, 2005, 26(3): 29–32. LUO Yi, SHI Hua-hong, WANG Xiao-rong, et al. Free radical generation and lipid peroxidation induced by 2, 4-Dichlorophenol in liver of Carassius auratus[J]. Environmental Science, 2005, 26(3): 29–32. |
| [19] | 马陶武, 朱程, 王桂岩, 等. 铜锈环棱螺对沉积物中重金属的生物积累及其与重金属赋存形态的关系[J]. 应用生态学报, 2010, 21(3): 409–411. MA Tao-wu, ZHU Cheng, WANG Gui-yan, et al. Bioaccumulation of sediment heavy metals in Bellamya aeruginosa and its relations with the metals geochem ical fractions[J]. Chinese Journal of Applied Ecology, 2010, 21(3): 409–411. |
| [20] | 王晓蓉, 等. 污染物微观致毒机制和环境生态风险早期诊断[M]. 北京: 科学出版社, 2013. WANG Xiao-rong, et al. Toxic mechanism of pollutants and early diagnosis of ecological risk[M]. Beijing: Science Press, 2013. |
| [21] | 王为木, 王群, 刘慧, 等. 利用电子顺磁共振技术捕获中华圆田螺肝脏活性氧[J]. 分析试验室, 2015, 34(4): 409–411. WANG Wei-mu, WANG Qun, LIU Hui, et al. Using electron paramagnetic resonance technique capture reactive oxygen species in liver of river snail Cipangopaludina cathayensis[J]. Chinese Journal of Analysis Laboratory, 2015, 34(4): 409–411. |
| [22] | Pradhan A, Geraldes P, Seena S, et al. Natural organic matter alters size-dependent effects of nano CuO on the feeding behaviour of freshwater invertebrate shredders[J]. Science of the Total Environment, 2015(535): 94–101. |
| [23] | Hartmann N B, Von der Kammer F, Hofmann T, et al. Algal testing of titanium dioxide nanoparticles:Testing considerations, inhibitory effects and modification of cadmium bioavailability[J]. Toxicology, 2010, 269(2): 190–197. |
| [24] | Wang H H, Wick R L, Xing B S. Toxicity of nanoparticulate and bulk ZnO, Al2O3 and TiO2 to the nematode Caenorhabditis elegans[J]. Environmental Pollution, 2009, 157(4): 1171–1177. DOI:10.1016/j.envpol.2008.11.004 |
| [25] | 胡正雪, 刘林, 郭红岩, 等. 纳米和微米ZnO对鲫鱼的毒性效应研究[J]. 南京大学学报 (自然科学), 2014, 50(4): 425–430. HU Zheng-xue, LIU Lin, GUO Hong-yan, et al. Toxicity of nano and micro ZnO on Carassius auratus[J]. Journal of Nanjing University (Natural Sciences), 2014, 50(4): 425–430. |
| [26] | 金霏霏, 尹颖, 黄娟, 等. 腐植酸 (HA) 作用下纳米氧化锌对鲫鱼的毒性效应[J]. 应用与环境生物学报, 2011, 17(6): 829–832. JIN Fei-fei, YIN Ying, HUANG Juan, et al. Effect of HA on ecotoxicity of nano ZnO in Carassius auratus[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(6): 829–832. |
| [27] | Zhao X S, Wang S T, Wu Y, et al. Acute ZnO nanoparticles exposure induces developmental toxicity, oxidative stress and DNA damage in embryo-larval zebrafish[J]. Aquatic Toxicology, 2013, 136-137: 49–59. DOI:10.1016/j.aquatox.2013.03.019 |
| [28] | Frankin N, Rogers N, Apte S, et al. Comparative toxicity of nanoparticulate ZnO, bulk ZnO, and ZnCl2 to a freshwater microalga (Pseudokirchneriella subcapitata):The importance of particle solubility[J]. Environmental Science & Technology, 2007, 41(24): 8484–8490. |
| [29] | Ma H B, Williams P L, Diamond S A. Ecotoxicity of manufactured ZnO nanoparticles:A review[J]. Environmental Pollution, 2013, 172: 76–85. DOI:10.1016/j.envpol.2012.08.011 |
| [30] | 熊道文, 方涛, 陈旭东, 等. 纳米材料对斑马鱼的氧化损伤及应激效应研究[J]. 环境科学, 2010, 31(5): 1320–1327. XIONG Dao-wen, FANG Tao, CHEN Xu-dong, et al. Oxidative stress effects and damage of nanoscale TiO2 and ZnO on zebrafish[J]. Environmental Science, 2010, 31(5): 1320–1327. |
| [31] | 田文静, 白伟, 赵春禄, 等. 纳米ZnO对斑马鱼胚胎抗氧化酶系统的影响[J]. 中国环境科学, 2010, 30(5): 705–709. TIAN Wen-jing, BAI Wei, ZHAO Chun-lu, et al. Effects of ZnO nanoparticles on antioxidant enzyme system of zebrafish embryos[J]. China Environmental Science, 2010, 30(5): 705–709. |
| [32] | 刘林, 赵群芬, 金凯星, 等. 纳米氧化锌对斑马鱼肝脏的毒性效应[J]. 环境科学, 2015, 36(10): 3884–3891. LIU Lin, ZHAO Qun-fen, JIN Kai-xing, et al. Toxic effect of nano-ZnO in liver of zebrafish[J]. Environmental Science, 2015, 36(10): 3884–3891. |
| [33] | 刘林, 赵群芬, 朱帅旗, 等. 纳米氧化锌对斑马鱼肠组织的氧化损伤[J]. 水产学报, 2015, 39(11): 1702–1711. LIU Lin, ZHAO Qun-fen, ZHU Shuai-qi, et al. Oxidative damage of zinc oxide nanoparticles to zebrafish intestine[J]. Journal of Fisheries of China, 2015, 39(11): 1702–1711. |
| [34] | 杜佳, 王树涛, 刘征, 等. 全氟辛烷磺酸钾 (PFOS) 和纳米氧化锌 (Nano-ZnO) 单独与联合暴露对斑马鱼胚胎的氧化损伤和细胞凋亡的影响[J]. 生态毒理学报, 2015, 10(3): 238–247. DU Jia, WANG Shu-tao, LIU Zheng, et al. PFOS and ZnO nanoparticles induced oxidative stress and apoptosis in zebrafish (Danio rerio)[J]. Asian Journal of Ecotoxicology, 2015, 10(3): 238–247. |
| [35] | Bessemer R A, Butler K M A, Tunnah L, et al. Cardiorespiratory toxicity of environmentally relevant zinc oxide nanoparticles in the freshwater fish Catostomus commersonii[J]. Nanotoxicology, 2015, 9(7): 861–870. DOI:10.3109/17435390.2014.982737 |
| [36] | 林秀秀, 叶元土, 蔡春芳, 等. 丙二醛引起草鱼肠道、肝胰脏谷胱甘肽/谷胱甘肽转移酶通路抗氧化应激[J]. 动物营养学报, 2015, 27(11): 3604–3612. LIN Xiu-xiu, YE Yuan-tu, CAI Chun-fang, et al. Malondialdehyde causes glutathione/glutathione transferase pathway oxidative stress in intestine and hepatopancreas of grass carp (Ctenopharyngodon idellus)[J]. Chinese Journal of Animal Nutrition, 2015, 27(11): 3604–3612. |
| [37] | 朱方伟.纳米氧化锌对典型水生生物的安全评价[D].南京:河海大学, 2010. ZHU Fang-wei. Research on safety of nano zinc oxide to modle aquatic[D]. Nanjing:Hohai University, 2010. |
 2017, Vol. 36
2017, Vol. 36



