文章信息
- 刘迎, 姜蕾, 潘波, 林勇
- LIU Ying, JIANG Lei, PAN Bo, LIN Yong
- 斑马鱼胚胎经丙草胺暴露后对其仔鱼致畸效应的研究
- Teratogenic effects of embryonic exposure to pretilachlor on the larvae of zebrafish
- 农业环境科学学报, 2017, 36(3): 481-486
- Journal of Agro-Environment Science, 2017, 36(3): 481-486
- http://dx.doi.org/10.11654/jaes.2016-1418
文章历史
- 收稿日期: 2016-11-08
酰胺类除草剂是20世纪60年代开发的一类高效、高选择性的除草剂,在全球农药品种市场中列第9位,在各类除草剂中列第4位,仅排在氨基酸类、磺酰脲类和其他结构类之后[1]。随着酰胺类除草剂的大量使用而引起的环境问题日益受到关注:甲草胺被美国环境保护局归为B-2类致癌物[2],同时也是一种环境内分泌干扰物[3];乙草胺[4]和丙草胺[5]暴露可引起斑马鱼胚胎内分泌紊乱、细胞凋亡、氧化应激和免疫毒性;丁草胺可影响斑马鱼繁殖、扰乱甲状腺激素、性激素等内分泌物质代谢[6],同时丁草胺暴露引起斑马鱼胚胎内分泌紊乱和免疫毒性[7];异丙甲草胺暴露可影响斑马鱼胚胎孵化,对胚胎产生致畸效应[8-9]。由于丙草胺为我国水稻田常用除草剂,研究其对斑马鱼胚胎毒性具有重要意义。
在斑马鱼胚胎发育过程中,关键基因的变化会导致心脏、骨骼等器官的发育异常。鞠黎等[10]研究推断多氯联苯诱导斑马鱼幼鱼脊柱弯曲可能与通过抑制骨形态蛋白家族相关基因(BMP-2和BMP-4)的表达而影响骨骼细胞的正常分化有关,岳东等[11]研究发现久效磷通过干扰心脏发育相关基因(Tbx2)和肌肉发育相关基因(Mef2)的表达引起胚胎心率下降和幼鱼出现包囊肿率和脊柱弯曲等畸形,Winata等[12]发现敲除对鱼鳔组织分化与形成有决定作用的shha和ihha基因后,能够引起鱼鳔发育缺陷。实验室前期研究发现斑马鱼胚胎暴露于丙草胺可降低斑马鱼胚胎孵化率,诱导斑马鱼仔鱼出现心包囊肿、游囊关闭、躯干弯曲等畸形表型[9]。本实验在此基础上研究丙草胺不同浓度暴露下各畸形表型的百分比,同时通过产生畸形的相关器官——心脏、脊椎和游囊发育相关基因的表达变化来研究丙草胺在分子水平上对斑马鱼胚胎(仔鱼)相关器官发育的影响,探讨致畸机理。
1 材料与方法 1.1 供试药剂和实验仪器94%丙草胺原药(山东滨农科技有限公司)、丙酮(广州化学试剂厂)、吐温-80(国药集团化学试剂有限公司)。SMZ1000体视显微镜(日本Nikon公司)、PYX-250Q-C人工培养箱(广东韶关科技试验仪器有限公司)、斑马鱼水循环养殖系统(Z-A-S4,上海海圣工贸有限公司)、AUY220万分之一电子天平(日本岛津公司)。
1.2 斑马鱼胚胎采集实验所用斑马鱼购于海口市水仙池水族馆,体长为2~3 cm,在实验室斑马鱼水循环养殖系统中驯养2周后,将雌雄鱼分开驯养2周用于胚胎采集。成鱼每日喂食2次人工饲料,光照/黑暗周期为14 h:10 h。试验前一天晚上关灯前将雌雄鱼按1:2配对放入产卵缸中,第二天早上8:00开灯,半个小时后收集胚胎,经2次清洗、去掉粪便和凝结的卵后转移至试验用水中(曝气自来水,硬度82 mg·L-1,pH 7.52),于(26±1)℃人工培养箱中培养待用。
1.3 斑马鱼胚胎染毒0.5 g(折百后)丙草胺原药加1.0 mL丙酮充分溶解后加0.8 mL吐温-80助溶,用去离子水定容至100 mL容量瓶配制成5000 mg·L-1母液,置于4 ℃冰箱中备用。根据前期研究[9]斑马鱼胚胎半数致畸质量浓度(120 h)EC50=1.36 mg·L-1,将母液依次稀释成含丙草胺0.50、1.00、1.50 mg·L-1进行染毒,所有染毒液中丙酮的浓度≤0.01%。将30 mL染毒液转移到直径为10 cm的培养皿中,每皿中移入受精后6 h的受精卵50颗,每处理重复3次,设置溶剂对照和空白对照(CK),将培养皿转移到培养箱(26±1℃)培养,光/暗周期为14 h:10 h。整个染毒周期为6~120 hpf(Hour post fertilization)。上述操作重复2组,一组用来调查畸形表型和比例,另一组用作基因表达分析。
1.4 鱼胚胎染毒观察指标120 hpf染毒结束后,在体式显微镜下观察斑马鱼仔鱼的畸形表型及采集图像,计算各种畸形表型的比例。
1.5 基因表达分析随机取不同组斑马鱼胚胎(48、72 hpf)或幼鱼(120 hpf)各30枚(条),用AxyPrep总RNA小量制备试剂盒(AXYGEN)进行总RNA抽提,提取所得总RNA用NanoDrop ND-2000C紫外分光光度计(美国Thermo Fisher)测定RNA质量和浓度。等量的总RNA(2 μg)通过PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit(TaKaRa)反转录为cDNA,所有操作均严格按照试剂盒说明进行。按照SYBR Premix Ex TaqTM Ⅱ(Tli RNaseH Plus,TaKaRa)试剂盒说明书进行目的基因的荧光检测,目的基因和内参基因引物序列参考见表 1。使用实时荧光定量PCR仪(ABI-7500)进行实时定量PCR实验,采用两步法进行real-time PCR反应,其程序设置为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。QPCR的数据分析采用2-ΔΔCT方法。每次实验设置3次RNA提取重复和3次QPCR平行管重复。
将所有的数据求出平均值和标准差(Mean±SE),使用SPSS 19.0软件对实验数据进行统计分析,采用单因素方差分析(One-way ANOVO)中的LSD(Least significant difference)对处理组和对照之间差异显著性进行比较。使用Origin 8.0软件作图。
2 结果与分析 2.1 胚胎期丙草胺暴露对斑马鱼仔鱼的致畸效应丙草胺暴露后诱导斑马鱼仔鱼(120 hpf)产生的畸形表型见图 1。斑马鱼仔鱼出现心包囊肿、游囊关闭、躯干弯曲等现象,且同一条仔鱼可出现2~3种症状。试验中溶剂对照组斑马鱼仔鱼没有出现致畸现象。
|
| 图 1 丙草胺暴露120 h斑马鱼仔鱼的畸形表型q Figure 1 The malformation phenotype of zebrafish larvae after exposure to pretilachlor for 120 h A.对照组:脊椎、游囊(SB);B、C.丙草胺暴露组:心包囊肿(PC)、游囊关闭(USB)、脊椎弯曲(SC) A.Control groups:Spine, swim bladder (SB); B, C.Exposed groups:Pericardial cyst (PC), Uninflated swim bladder (USB), Spinal curvature (SC) |
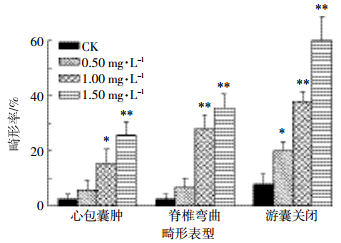
图 2显示丙草胺暴露斑马鱼胚胎至120 hpf,不同浓度暴露组仔鱼产生畸形表型的百分比。随着暴露浓度的增加,心包囊肿、脊柱弯曲、游囊关闭症状的严重程度增加。其中,0.50、1.00、1.50 mg·L-1暴露组仔鱼心包囊肿率分别为5.56%、15.56%和25.56%,与对照组相比,1.00 mg·L-1暴露组显著升高(P < 0.05),1.50 mg·L-1暴露组极显著升高(P < 0.01);0.50、1.00、1.50 mg·L-1暴露组仔鱼脊柱弯曲率分别为6.67%、27.78%和35.56%,与对照组相比,1.00、1.50 mg·L-1暴露组均极显著升高;0.50、1.00、1.50 mg·L-1暴露组仔鱼游囊关闭率分别为20.00%、37.78%和60.00%,与对照组相比,0.50 mg·L-1暴露组显著升高,1.00、1.50 mg·L-1暴露组均极显著升高。

|
| 图 2 丙草胺暴露120 h斑马鱼仔鱼的畸形率 Figure 2 The malformation rate of larvae after zebrafish embryos exposed to pretilachlor for 120 h 与对照组相比,*P < 0.05,**P < 0.01。下同 *P < 0.05, **P < 0.01, compared with the control group. The same blow |
胚胎期丙草胺暴露后斑马鱼仔鱼产生心包囊肿、脊柱弯曲、游囊关闭症状,因此选取了心脏、脊椎和游囊发育相关基因来研究丙草胺在分子水平上对斑马鱼胚胎(仔鱼)相关器官发育的影响(图 3)。结果表明,丙草胺暴露斑马鱼胚胎至48 hpf,1.00 mg·L-1暴露组Tbx2基因的表达水平极显著降低(P < 0.01),1.50 mg·L-1暴露组表达水平显著降低(P < 0.05);丙草胺暴露斑马鱼胚胎至仔鱼(120 hpf),1.50 mg·L-1暴露组BMP-2基因的表达水平显著降低,1.00、1.50 mg·L-1暴露组BMP-4基因的表达水平极显著降低;丙草胺暴露斑马鱼胚胎至72 hpf,1.50 mg·L-1暴露组shha基因的表达水平显著降低,1.00、1.50 mg·L-1暴露组ihha基因的表达水平显著降低。

|
| 图 3 丙草胺暴露后斑马鱼心脏、骨骼和游囊相关基因的表达情况 Figure 3 The expression changes of heart, skeleton, swimbladder-related genes after zebrafish embryos exposed to pretilachlor 心脏相关基因Tbx2(48 hpf,胚胎);骨骼相关基因BMP-2、BMP-4(120 hpf,仔鱼);游囊相关基因shha、ihha(72 hpf,胚胎) heart-related genes Tbx2(48 hpf, embryo); skeleton-related genes BMP-2, BMP-4(120 hpf, larvae), swimbladder-related genes shha, ihha(72 hpf, embryo) |
研究发现丙草胺暴露斑马鱼胚胎至120 hpf,斑马鱼仔鱼出现心包囊肿、脊柱弯曲、游囊关闭等症状,且随着暴露浓度的增加,畸形表型的严重程度增加,呈现剂量-效应关系。心包囊肿、脊柱弯曲、游囊关闭等症状是许多环境化学物质诱导斑马鱼胚胎/仔鱼产生的畸形表型[11, 13-14],心包囊肿具有不可逆性,一旦形成就难以自然消失[15],将造成仔鱼心脏的结构异常和功能缺失,甚至威胁到斑马鱼的生存[11]。本试验中出现心包囊肿的仔鱼2 d内便会死亡。脊椎弯曲会导致仔鱼游动能力减弱,停留在培养皿底部,最终因缺氧和影响取食而死。斑马鱼游囊由前后两个组成,后游囊在受精后4.5 d开始充气,游囊通过充气和放气来调节鱼体的比重,以控制鱼体内外的水压平衡和身体沉浮,对于仔鱼的呼吸和取食具有重要意义[16]。研究发现[17]游囊可以作为化学物质暴露的特定靶标器官,试验中发现游囊关闭是丙草胺诱导斑马鱼仔鱼出现的最敏感指标,畸形比率高于其他两种畸形表型,游囊关闭的仔鱼游动能力减弱而停留在培养皿底部,最终因缺氧和影响取食而死亡。
T-box基因家族在脊椎动物心脏发育中起重要作用,主要作用于脊椎动物的早期心脏谱系决定、心室特化、房室分隔和胚胎传导系统分化等[18]。其中,Tbx2基因在房室特异性分化和房室管形成方面发挥了重要的作用[19]。本研究中丙草胺暴露斑马鱼胚胎至48 hpf,1.00 mg·L-1暴露组Tbx2基因的表达水平极显著降低,1.50 mg·L-1暴露组表达水平显著降低,表明丙草胺可能通过抑制心脏发育相关基因Tbx2的表达来影响心脏的发育,导致斑马鱼仔鱼出现心包囊肿现象。有关化学物质导致斑马鱼心脏发育毒性的机理研究很多,心脏发育过程中Nkx2.5在心脏传导系统、心房形成等方面起着重要作用[20],章强等[14]报道低浓度铜通过下调Nkx2.5的上游基因Gata5来调控Nkx2.5的表达,从而影响斑马鱼胚胎的心脏发育。Tbx5转录因子在早期心脏发育,尤其是心房和左心室的发育中起着关键的作用,Hong等[21]研究发现软骨藻酸(DA)暴露后斑马鱼心脏发育异常,推断DA是通过调控Tbx5影响钙循环相关基因的表达而引起心脏发育毒性。丙草胺是否通过上述机理来诱导斑马鱼心包囊肿尚需进一步验证。
骨形态发生蛋白(Bone morphogenetic proteins,BMPs)是唯一能够单独诱导骨组织形成的局部生长因子,是骨组织形成过程中最关键的调节因子。在骨形成早期,BMP-2不仅可使未分化间质细胞向骨形成中心募集,并分化为骨系细胞,而且可使成纤维细胞、成肌细胞及骨髓的基细胞逆转分化为骨系细胞[22];BMP-4可促进软骨细胞的分化和发育[23]。本研究发现丙草胺暴露斑马鱼胚胎至仔鱼(120 hpf),1.50 mg·L-1暴露组BMP-2基因的表达水平显著降低,1.00、1.50 mg·L-1暴露组BMP-4基因的表达水平极显著降低。这表明丙草胺可能通过抑制BMP-2和BMP-4的表达而影响骨骼细胞的正常分化,造成斑马鱼仔鱼脊椎弯曲。研究发现Mef2在骨骼肌、心肌和平滑肌发育过程中的介导细胞分化中起主要作用,最突出的作用是控制肌细胞分化过程中的基因转录[24],岳东等[11]研究发现,久效磷暴露斑马鱼胚胎可能通过促进Mef2基因的表达而导致斑马鱼仔鱼脊柱弯曲。研究表明MyoD、Myf5可调节骨骼肌的规范和分化[25],丙草胺是否通过影响上述基因表达来诱导斑马鱼仔鱼脊椎弯曲需进一步通过试验验证。shha和ihha基因对鱼鳔上皮层、中胚层和外层组织的分化和形成具有决定作用[12]。本研究发现丙草胺暴露斑马鱼胚胎至72 hpf,1.50 mg·L-1暴露组shha基因的表达水平显著降低,1.00、1.50 mg·L-1暴露组ihha基因的表达水平显著降低,表明丙草胺可能通过抑制shha和ihha基因的表达而影响游囊的正常分化和发育,造成斑马鱼仔鱼游囊发育畸形。
4 结论丙草胺暴露斑马鱼胚胎后干扰了心脏、骨骼和游囊相关基因的表达,引起斑马鱼仔鱼相关器官的发育异常,进而导致斑马鱼仔鱼出现心包囊肿、游囊关闭、躯干弯曲等畸形现象。
| [1] | 张一宾. 酰胺类除草剂的全球市场、品种及发展趋向[J]. 现代农药, 2011, 11(1): 41–44. ZHANG Yi-bin. Market and products and development trend of amide herbicides[J]. Modern Agrochemicals, 2011, 11(1): 41–44. |
| [2] | Potter T L, Carpenter T L. Occurrence of alachlor environmental degradation products in groundwater[J]. Environ Sci Technol, 1995, 29(6): 1557–1563. DOI:10.1021/es00006a018 |
| [3] | Wilson A G E, Thake D C, Heydens W E, et al. Mode of action of thyroid tumor formation in the male Long-Evans rat administered high doses of alachlor[J]. Toxicol Sci, 1996, 33(1): 16–23. DOI:10.1093/toxsci/33.1.16 |
| [4] | Jiang J, Wu S, Liu X, et al. Effect of acetochlor on transcription of genes associated with oxidative stress, apoptosis, immunotoxicity and endocrine disruption in the early life stage of zebrafish[J]. Environmental Toxicology and Pharmacology, 2015, 40(2): 516–523. DOI:10.1016/j.etap.2015.08.005 |
| [5] | Jiang J, Chen Y, Yu R, et al. Pretilachlor has the potential to induce endocrine disruption, oxidative stress, apoptosis and immunotoxicity during zebrafish embryo development[J]. Environmental Toxicology and Pharmacology, 2016, 42: 125–134. DOI:10.1016/j.etap.2016.01.006 |
| [6] | Chang J, Liu S, Zhou S, et al. Effects of butachlor on reproduction and hormone levels in adult zebrafish (Danio rerio)[J]. Experimental and Toxicologic Pathology, 2013, 65(1): 205–209. |
| [7] | Tu W, Niu L, Liu W, et al. Embryonic exposure to butachlor in zebrafish (Danio rerio):Endocrine disruption, developmental toxicity and immunotoxicity[J]. Ecotoxicology and Environmental Safety, 2013, 89: 189–195. DOI:10.1016/j.ecoenv.2012.11.031 |
| [8] | 周炳, 赵美蓉, 黄海凤. 4种农药对斑马鱼胚胎的毒理研究[J]. 浙江工业大学学报, 2008, 36(2): 136–140. ZHOU Bing, ZHAO Mei-rong, HUANG Hai-feng. Study on zebrafish embryo-toxicity of four pesticides[J]. Journal of Zhejiang University of Technology, 2008, 36(2): 136–140. |
| [9] | 刘迎, 胡燕, 姜蕾, 等. 5种酰胺类除草剂对斑马鱼胚胎发育的毒性效应[J]. 农药, 2014, 53(11): 806–808. LIU Ying, HU Yan, JIANG Lei, et al. The toxicity effects of five amide herbicides on embryo development of zebrafish[J]. Agrochemicals, 2014, 53(11): 806–808. |
| [10] | 鞠黎, 楼跃, 王艳萍, 等. 多氯联苯暴露对斑马鱼脊柱形态及BMP-2, BMP-4基因表达的影响[J]. 南京医科大学学报:自然科学版, 2011, 31(9): 1277–1281. JU Li, LOU Yue, WANG Yan-ping, et al. Effects of embryonic exposure to polychlorinated biphenyls on zebrafish spinal morphology and the expression of BMP-2 and BMP-4 gene[J]. Acta Universitatis Medicinalis Nanjing (Natural Science), 2011, 31(9): 1277–1281. |
| [11] | 岳东, 张晓雪, 赵飞, 等. 久效磷对斑马鱼胚胎期心脏和骨骼发育的毒性效应研究[J]. 中国海洋大学学报, 2016, 46(8): 72–78. YUE Dong, ZHANG Xiao-xue, ZHAO Fei, et al. Study of the toxixity of monocrotophos on the cardiac and skeletal developement of Danio rerio embryos[J]. Periodical of Ocean University of China, 2016, 46(8): 72–78. |
| [12] | Winata C L, Korzh S, Kondrychyn I, et al. Development of zebrafish swimbladder:The requirement of Hedgehog signaling in specification and organization of the three tissue layers[J]. Developmental biology, 2009, 331(2): 222–236. DOI:10.1016/j.ydbio.2009.04.035 |
| [13] | 杨洋, 陈亚文, 唐天乐, 等. 双酚AF暴露对胚胎期和幼鱼期斑马鱼的毒性效应[J]. 环境科学研究, 2015, 28(8): 1219–1226. YANG Yang, CHEN Ya-wen, TANG Tian-le, et al. Toxic effects of bisphenol AF on zebrafish embryos and larvae[J]. Research of Environmental Sciences, 2015, 28(8): 1219–1226. |
| [14] | 章强, 辛琦, 强丽媛, 等. 铜及其与四环素的联合暴露对斑马鱼胚胎的毒性效应研究[J]. 生态毒理学报, 2015, 10(5): 35–46. ZHANG Qiang, XIN Qi, QIANG Li-yuan, et al. Developmental toxicity of Cu and tetracycline on zebrafish embryos (Danio rerio)[J]. Asian Journal of Ecotoxicology, 2015, 10(5): 35–46. |
| [15] | Sun J, Liu J, Tu W, et al. Separation and aquatic toxicity of enantiomers of the organophosphorus insecticide O-ethyl O-4-nitrophenyl phenylphosphonothioate (EPN)[J]. Chemosphere, 2010, 81(10): 1308–1313. DOI:10.1016/j.chemosphere.2010.08.036 |
| [16] | Goolish E M, Okutake K. Lack of gas bladder inflation by the larvae of zebrafish in the absence of an air-water interface[J]. Journal of Fish Biology, 1999, 55(5): 1054–1063. |
| [17] | Li J, Liang Y, Zhang X, et al. Impaired gas bladder inflation in zebrafish exposed to a novel heterocyclic brominated flame retardant tris (2, 3-dibromopropyl) isocyanurate[J]. Environmental Science & Technology, 2011, 45(22): 9750–9757. |
| [18] | 辛娜, 邱广蓉, 孙开来. T-box基因与脊椎动物心脏发育[J]. 国际遗传学杂志, 2007, 30(4): 295–297. XIN Na, QIU Guang-rong, SUN Kai-lai. T-box gene and vertebrate heart development[J]. International Journal of Genetics, 2007, 30(4): 295–297. |
| [19] | 崇梅, 桂永浩, 成璐, 等. 斑马鱼Tbx2基因阻抑先天性心脏病模型的建立与研究[J]. 中华医学杂志, 2007, 87(14): 991–994. CHONG Mei, GUI Yong-hao, CHENG Lu, et al. Establish of model of congenital heart disease with Tbx2 gene knockdown:Experiment with zebrafish[J]. National Medical Journal of China, 2007, 87(14): 991–994. |
| [20] | Zhang Y, Wang C, Huang L, et al. Low-level pyrene exposure causes cardiac toxicity in zebrafish (Danio rerio) embryos[J]. Aquatic Toxicology, 2012, 114: 119–124. |
| [21] | Hong Z, Zhang Y, Zuo Z, et al. Influences of domoic acid exposure on cardiac development and the expression of cardiovascular relative genes in zebrafish (Danio rerio) embryos[J]. Journal of Biochemical and Molecular Toxicology, 2015, 29(6): 254–260. DOI:10.1002/jbt.2015.29.issue-6 |
| [22] | 郁卫东. 骨形态发生蛋白-2在骨形成过程中的作用机制[J]. 中国临床解剖学杂志, 2000, 18(1): 82–83. YU Wei-dong. Mechanism of BMP-2 in the process of bone formation[J]. Chinese Journal of Clinical Anatomy, 2000, 18(1): 82–83. |
| [23] | 张虎林, 陈玉琴, 俞诗源. 骨形态发生蛋白-4的研究进展[J]. 解剖学杂志, 2007, 13(4): 810–813. ZHANG Hu-lin, CHEN Yu-qin, YU Shi-yuan. The research progress of BMP-4[J]. Chinese Journal of Anatomy, 2007, 13(4): 810–813. |
| [24] | 程波, 李利, 王林杰, 等. MEF2基因家族的研究进展[J]. 中国畜牧杂志, 2012, 15: 70–74. CHENG Bo, LI Li, WANG Lin-jie, et al. The research progress of MEF2 gene family[J]. Chinese Journal of Animal Science, 2012, 15: 70–74. |
| [25] | Conerly M L, Yao Z, Zhong J W, et al. Distinct activities of Myf5 and MyoD indicate separate roles in skeletal muscle lineage specification and differentiation[J]. Developmental Cell, 2016, 36(4): 375–385. DOI:10.1016/j.devcel.2016.01.021 |
 2017, Vol. 36
2017, Vol. 36





