文章信息
- 蔺中, 杨杰文, 蔡彬, 钟来元, 张倩, 李进, 李隆凡, 陈小丽, 甄珍
- LIN Zhong, YANG Jie-wen, CAI Bin, ZHONG Lai-yuan, ZHANG Qian, LI Jin, LI Long-fan, CHEN Xiao-li, ZHEN Zhen
- 根际效应对狼尾草降解土壤中阿特拉津的强化作用
- Enhancement of atrazine degradation in soils caused by rhizosphere effects of Pennisetum
- 农业环境科学学报, 2017, 36(3): 531-538
- Journal of Agro-Environment Science, 2017, 36(3): 531-538
- http://dx.doi.org/10.11654/jaes.2016-1313
文章历史
- 收稿日期: 2016-10-14
2. 湛江出入境检验检疫局, 广东 湛江 524088
2. Zhanjiang Entry-Exit Inspection and Quarantine Bureau, Zhanjiang 524088, China
阿特拉津(Atrazine)作为三嗪类除草剂,在世界范围内被广泛应用,是典型含氯原子的“致畸、致癌、致突变的“三致”污染物[1]。阿特拉津结构稳定、不易降解,具有广谱毒性和生物累积性[2]。我国于20世纪80年代初开始使用阿特拉津,主要作为旱区作物玉米、高粱、林地、果茶园等地的除草剂,且每年用量以约20%的速度递增[3]。阿特拉津污染已直接影响世界粮食生产安全和农业生态健康,进而影响人类健康[4]。
植物修复技术具有费用低、环境破坏极小、可大面积应用等独特优势,被认为是最具潜力的土壤有机污染治理措施。植物修复技术主要利用植物及其共存土壤环境体系(即土壤-植物-微生物组成的复合体系),以植物积累、代谢、转化为基础,加速降解、转移或固定土壤中的有机污染物,进而恢复土壤的正常生态系统功能。与重金属等无机污染物的植物超积累修复机制不同,有机污染物的植物修复作用通常发生在根际而非植物体内。根系生长改善了土壤理化性状,增加了微生物种群数量及多样性[5],或者选择性地富集污染物降解特异菌群,形成一个不同于周围土体的特殊微域环境。根系分泌碳水化合物、氨基酸和有机酸等物质可以为根际周围的细菌和真菌提供营养,降低土壤有机污染物的毒性[6]。研究表明,根际周围的微生物通常是非根际的几十到几千倍,很多有机物高效降解菌株是由植物根际分离[7]。植物根际重要性已被学界认识,有机污染物的根际修复研究成为国际上的研究热点。
狼尾草根系发达,环境适应性强,对阿特拉津污染具有一定的耐受能力[8],具有潜在修复阿特拉津污染的能力[9]。目前狼尾草根际土壤阿特拉津降解研究多集中在根际分泌物的影响机制、根际降解菌株的筛选和功能基因研究等方面[10-12],狼尾草根际土壤阿特拉津的生物降解过程,以及相伴的土壤微生物学指标演变情况鲜见报道。本文选择阿特拉津作为研究对象,动态研究狼尾草对土壤阿特拉津的去除能力及其相伴的系列土壤微生物学指标,为丰富和发展土壤有机污染修复技术提供理论依据和技术支撑。
1 材料与方法 1.1 供试土壤和植物供试土壤采自湛江南亚热带园(21°10′6.49″N,110°17′2.28″E)表层土(0~20 cm),土壤类型为砖红壤。土壤基本理化性质:土壤pH为5.11,有机质含量为30.12 g·kg-1,全氮含量为1.72 g·kg-1、全磷含量为1.49 g·kg-1,全钾含量为9.77 g·kg-1。供试土壤未检测到阿特拉津,土壤风干后过2 mm筛备用。
供试植物为狼尾草(P.alopecuroides(L.)Spreng),由嘉祥县宝丰养殖专业合作社购买。挑选籽粒饱满的狼尾草种子用蒸馏水浸泡3 h,用20% H2O2消毒20 min后,蒸馏水冲洗多次,放入25 ℃恒温培养箱催芽2 d,移植到花盆生长至株高20~25 cm备用。
1.2 研究方法 1.2.1 实验设计实验共计3类4个处理:(1)灭菌土壤(C0)处理;(2)未灭菌土壤(CK)处理;(3)未灭菌土壤种植狼尾草处理,用根际袋培养法培养,取根际土和非根际土测定,分别作为狼尾草根际土壤(SR)处理和狼尾草非根际土壤(SN)处理。每个处理重复3次。土壤阿特拉津污染浓度为20 mg·kg-1,狼尾草每盆5株。每盆土壤重2 kg,将其中0.5 kg装在300目的尼龙网袋中放在花盆中央,袋周围及底部添加剩余1.5 kg土。盆栽实验期间,C0处理在超净工作台培养,定期开紫外灯灭菌。CK处理在25 ℃恒温培养箱培养。所有处理光照时间为16 h(7500 lx),黑暗时间为8 h,土壤水分维持在田间持水量的60%。从狼尾草移植到花盆时(0 d)开始计算培养时间,在0、7、14、21、28 d时分别取样,狼尾草的根系在尼龙网袋中相当密,故将袋内土壤作为根际土壤,袋周围及底部为非根际土壤。部分土壤样品保存于-20 ℃低温冰箱,待测阿特拉津浓度,部分土壤样品存放在4 ℃冰箱,待测土壤微生物指标。
染毒过程:将0.6 g阿特拉津溶解于5 mL丙酮,与2 kg的供试土壤混匀后,静置于通风橱内12 h,待丙酮挥发完毕,加入剩余28 kg土壤搅拌均匀。
灭菌土壤制备:风干土样装入广口塑料瓶密封后用γ射线辐照灭菌(60Co源,辐照剂量为30 kGy)[13]。
1.2.2 土壤理化性质的测定土壤pH值用pH计电位法测定,土壤全氮采用浓硫酸消煮,定氮仪测定,土壤全磷用NaOH熔融-钼锑抗比色法测定,土壤全钾用NaOH熔融-火焰光度法测定,土壤有机质用重铬酸钾容量法-外加热法测定。土壤微生物呼吸采用氢氧化钠吸收法测定,微生物生物量碳、氮参考氯仿熏蒸-硫酸钾浸提法测定[14-15]。
1.2.3 阿特拉津含量测定样品冷冻干燥后过2 mm筛,称取1 g土样于血清瓶中,加入20 mL甲醇。静置10 min,超声提取15 min后,25 ℃、4000 r·min-1离心10 min,重复三次。合并上清液共60 mL,旋转蒸发至2 mL,转移至固相萃取柱(预先用4.5 mL甲醇活化)。用3 mL的5%氨水甲醇溶液洗脱净化三次,氮吹合并后洗脱液至近干,用甲醇定容至2 mL安捷伦液谱小瓶中,上液相色谱自动进样测试[16]。采用Agilent 1260 LC液相色谱仪,HC-C18(4.6×150 mm,5 μm)色谱柱,VWD检测器,自动进样仪,流动相为甲醇:水=80:20,水相为10 mmol·L-1磷酸盐缓冲液,流速1 mL·min-1,VWD检测波长220 nm,温度25 ℃,进样量10 μL。
1.2.4 细菌、真菌和放线菌培养采用系列稀释平板培养法(Colony Forming Unit,CFU)对土壤微生物进行活菌数量测定。细菌、真菌、放线菌分别用牛肉膏蛋白胨(NA)培养基、马丁氏(Martin)培养基和改良高氏1号(Gause 1)培养基选择性培养,稀释平板法计数。同一土壤样品接种三个连续的稀释度,各重复3次,计数结果以每克干土中的菌落数(CFU·g-1)表示。
1.2.5 土壤细菌群落结构DGGE分析利用Mobio Power Soil DNA Isolation Kit(MO BIO Laboratories,Inc.,Carlsbad,CA)试剂盒提取土壤样品DNA。细菌通用引物F338-GC(5′-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GGG AGG CAG CAG-3′)和R518(5′-ATT ACC GCG GCT GCT GG-3′),扩增16S rDNA基因V3区片段,扩增产物片段长约230 bp。
PCR反应体系:反应体系总体积为50 μL,上下游引物(10 μmol·μL-1)各1.5 μL,Premix Taq(含DNA polymerase、buffer、dNTP Mixture)25 μL,模板DNA 2.0 μL,去离子水补足50 μL[17]。PCR反应条件为:94 ℃预变性5 min;94 ℃变性40 s,55 ℃退火30 s,72 ℃延伸30 min,40个循环;72 ℃延伸10 min;4 ℃∞循环。PCR产物上样量为20.0 μL,聚丙烯凝胶溶液灌胶,电泳缓冲液为1×TAE,变性梯度为30%-60%,电泳结束后,YBR green染色,凝胶成像系统下观察拍照。
1.3 数据处理实验数据采用Origin 8.1作图,SPSS 18.0软件统计分析(Duncan检验)。Image Lab软件判读DGGE图谱,Quantity One软件计算条带强度、样品的多样性指数,并绘制系统树。
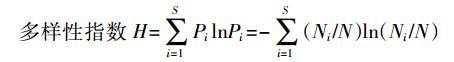
式中:Pi为某条带强度在总强度中所占比率;S为条带数目总和;Ni为条带强度总和;N为某一条带强度。
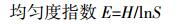
式中:H为多样性指数;S为条带数目总和[10]。
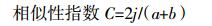
式中:a、b为比较条带的总数量;j为相同条带数量。
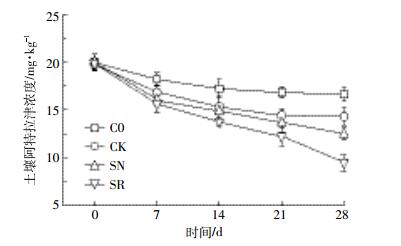
2 结果分析 2.1 狼尾草对土壤阿特拉津降解的影响各处理土壤阿特拉津残留浓度的动态变化如图 1所示。C0和CK处理中阿特拉津浓度在0~7 d下降较为迅速,随后7~28 d趋于平缓。SR和SN处理中阿特拉津的残留浓度变化趋势基本一致,土壤阿特拉津的含量在0~21 d下降较为迅速,直到21~28 d才渐趋平缓。整个培养阶段,SR处理中阿特拉津的降解率在各处理中均为最高。实验结束时(28 d),C0处理阿特拉津浓度为16.62 mg·kg-1,降解率为16.90%,CK处理阿特拉津浓度为14.28 mg·kg-1,降解率为28.60%。阿特拉津降解率在CK处理中比C0处理高11.70%。SR处理阿特拉津的浓度为9.46 mg·kg-1,降解率达到52.70%,SN处理的浓度为12.48 mg·kg-1,降解率为37.60%,阿特拉津降解率在SR处理中比SN处理高15.10%。Duncan检验显示,SR处理中阿特拉津降解率显著高于SN处理,二者阿特拉津降解率均显著高于CK处理,CK处理显著高于C0处理(P < 0.05)。这表明狼尾草可显著提高土壤阿特拉津的降解,根际土壤阿特拉津降解率显著高于非根际土壤。土壤自身蕴含的土著微生物对阿特拉津降解有促进作用,在没有狼尾草作用下,本研究的湛江砖红壤中阿特拉津降解以非生物降解为主。
|
| 图 1 各处理中土壤阿特拉津残留浓度动态变化 Figure 1 Soil atrazine residue concentrations with time dependence in different treatments |
如图 2A所示,各处理中土壤微生物碳呈先上升后降低趋势,种植狼尾草处理(SR和SN)中土壤微生物碳在14 d达到最大值,而CK处理中土壤微生物碳最大值出现于21 d。实验结束时,SR处理中土壤微生物碳含量为241.54 mg·kg-1,显著高于SN处理(187.64 mg·kg-1),且两者均显著高于CK处理(133.45 mg·kg-1)。各处理中土壤微生物氮含量在14 d达到最大值,SR处理中微生物氮含量始终最高。Duncan检验显示,培养28 d后SR处理中土壤微生物氮含量(66.52 mg·kg-1)显著高于SN(45.13 mg·kg-1)和CK处理(42.13 mg·kg-1),SN和CK处理间未到达显著性差异(图 2B)。与土壤微生物碳和氮趋势一致,土壤微生物呼吸亦呈先上升后降低趋势,各处理在14 d达到最大值。实验结束时,SR处理中土壤微生物呼吸量为230.54 mg·kg-1,显著高于SN处理(156.45 mg·kg-1)。种植狼尾草处理(SR和SN)中土壤微生物呼吸(图 2C)均显著高于CK处理(107.54 mg·kg-1)。

|
| 图 2 各处理中土壤微生物碳(A)、微生物氮(B)和微生物呼吸(C)的变化 Figure 2 Soil respiration (A), microbial biomass carbon (B) and nitrogen (C) in different treatments 不同小写字母表示同一时间不同处理差异显著(Duncan法,P < 0.05)。下同 Different small letters indicate significant difference (Duncan′s test, P < 0.05) among treatments at same incubation time. The same below |
狼尾草,尤其是狼尾草的根际作用可显著提高土壤中总微生物数量和活性。
2.3 狼尾草对土壤可培养细菌、真菌和放线菌的影响不同阶段各处理中土壤可培养细菌数量变化情况如图 3A所示。与CK处理相比,种植狼尾草处理(SR和SN)中土壤可培养细菌数量在各个阶段均有明显增加(P < 0.05)。SR处理中可培养细菌数量最多,在21 d达到最大值(46.57 ×105 CFU·g-1)。实验结束时,SR处理可培养细菌数量为40.36 ×105 CFU·g-1,显著高于SN处理(23.54×105 CFU·g-1),二者均显著高于CK处理(16.08×105 CFU·g-1)。SR和SN处理中可培养真菌数量一直呈上升趋势,CK处理中可培养真菌数量在21 d达到最大值,其后缓慢降低。Duncan检验显示,实验结束时SR处理土壤中可培养真菌数量(2.81×104 CFU·g-1)显著高于SN处理(2.17×104 CFU·g-1),SN处理土壤可培养真菌数量显著高于CK处理(1.68×104 CFU·g-1)(图 3B)。土壤可培养放线菌变化趋势与土壤可培养真菌趋势一致,SR和SN处理中土壤可培养放线菌数量均显著提高,尤其是SR处理(P < 0.05)。培养28 d后,SR处理中土壤可培养放线菌数量最高,为1.01×105 CFU·g-1,SN处理中土壤可培养放线菌数量为0.84×105 CFU·g-1,CK处理中土壤可培养放线菌数量为0.64×105 CFU·g-1(图 3C)。种植狼尾草可显著提高土壤可培养细菌、真菌和放线菌的数量,尤其是土壤可培养细菌数量。
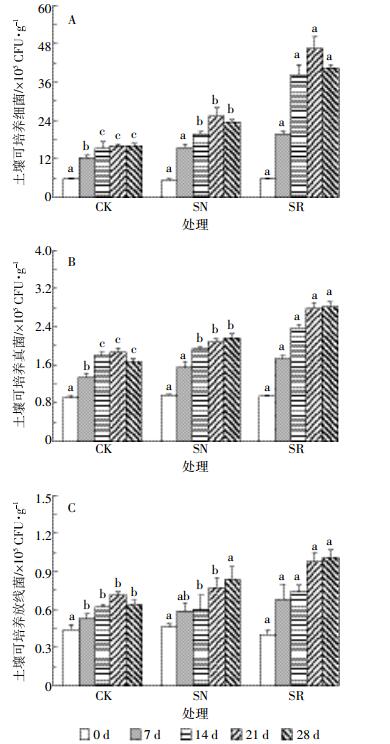
|
| 图 3 各处理中土壤细菌(A)、真菌(B)和放线菌(C)数量的变化 Figure 3 Colony forming units of cultivable bacteria (A), fungi (B) and actinomyces (C) in different treatments |
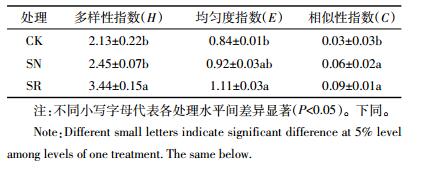
实验结束时,对各处理土壤中可培养细菌的群落结构进行研究,DGGE结果见图 4。不同处理的DGGE条带数量差异较大,CK处理条带数量最少,仅有19条,SN和SR处理条带分别为27条和35条。处理中条带数目越多,代表微生物种类越丰富,条带明暗程度,代表该类微生物相对数量的多寡。狼尾草作用下,土壤微生物的丰富度明显升高,尤其是狼尾草根际区。通过未加权算术平均对群法(UPGMA),对相似性矩阵数据聚类分析,CK和SN处理相似度较高,达到71%。SR处理中微生物群落结构明显异于其他处理,单独聚为一类,与CK和SN处理聚为一类的发育树相似度仅为59%。应用Quantity One软件对图谱进行优化处理,计算样品的多样性指数,结果见表 1。SR处理中细菌多样性指数为3.44,显著高于SN(2.45)和CK处理(2.13)。SR处理中细菌均匀度指数为1.11,显著高于CK处理(0.84)。SN处理均匀度指数为0.92,与上述两处理未达到显著性差异。种植狼尾草处理(SR和SN)中细菌相似性指数分别为0.09和0.06,显著高于CK(0.03)处理。种植狼尾草土壤,尤其是狼尾草根际土壤的细菌多样性和均匀度均得到显著提升。
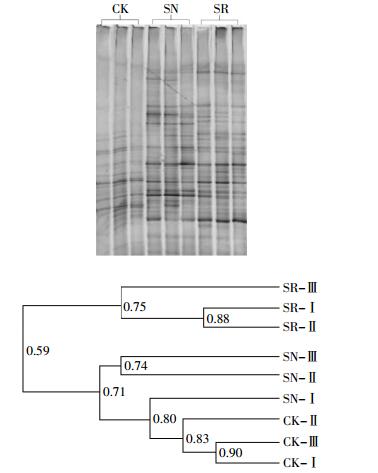
|
| 图 4 培养28 d时土壤细菌16S rRNA基因的DGGE图谱 Figure 4 Microbial community structure (16S rRNA DGGE) for different treatments after 28 days of incubation |
|
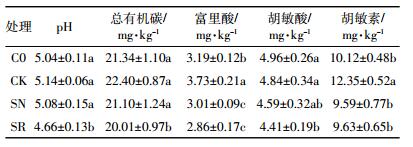
实验结束时,相关土壤理化性质指标见表 2。Duncan检验显示,SR处理的土壤pH值显著低于SN、CK和C0处理(P < 0.05),其他处理间未达到显著性差异。SR处理中土壤总有机碳显著低于SN、CK和C0处理,其他处理间未达到显著性差异。种植狼尾草处理(SN和SR)中富里酸含量显著低于CK和C0处理,C0处理中富里酸含量显著低于CK。SR处理中胡敏酸含量显著低于CK和C0处理,其他处理间未达到显著性差异。CK处理中胡敏素含量显著高于C0、SN和SR处理。狼尾草的根际作用可显著降低土壤pH和腐殖质(富里酸、胡敏酸和胡敏素)含量。
|
实验结束时,各处理中阿特拉津残留量、土壤微生物学指标(微生物碳、氮和微生物呼吸)、土壤理化性质(pH值、总有机碳、富里酸、胡敏酸和胡敏素)指标的相关性分析(图 5A)表明,第一主成分(PC1)和第二主成分(PC2)的累计方差贡献率达到87.63%,其中:第一主成分的方差贡献率为74.51%,主要贡献来源于微生物碳、微生物呼吸和微生物氮;第二主成分方差贡献率为13.12%,主要贡献来源于胡敏素和胡敏酸。主成分得分图(图 5B)显示,各处理之间的差异达到极显著水平(P < 0.05)。CK处理与种植狼尾草处理(SN和SR)的土壤综合特征差异主要体现在第一主成分上。主成分载荷图中,代表各土壤变量的箭头间余弦角度显示了各变量的相互关系(图 5A),角度越小相关性越高。相关分析结果表明,阿特拉津残留量和土壤微生物学指标(微生物碳、氮和微生物呼吸)以及pH值间存在显著的负相关关系,但与土壤富里酸、胡敏酸和胡敏素有显著的正相关关系(P < 0.05)。
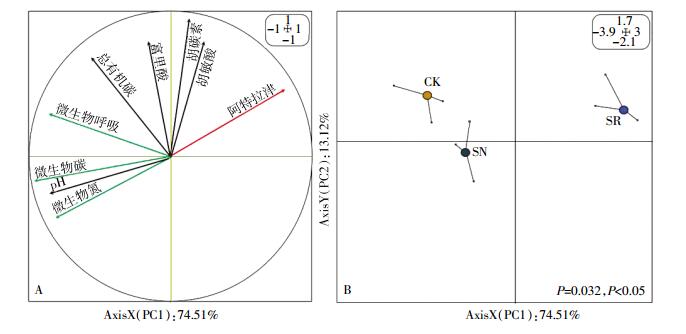
|
| 图 5 土壤微生物学指标和理化性质指标与阿特拉津间的主成分分析 Figure 5 Principal component analysis among soil microbiology, physicochemical indexes and atrazine residual |
自然土壤中阿特拉津降解主要源于生物降解和非生物降解[18]。辐照灭菌后,土壤阿特拉津降解主要依靠氧化还原降解和水解等非生物降解。实验结果显示,无狼尾草处理的自然土壤中阿特拉津降解率要比灭菌土壤高11.70%,说明土壤自身蕴含的土著微生物可以加速阿特拉津降解,但效果弱于非生物降解(16.90%)。研究表明,pH值对阿特拉津降解过程有强烈影响,土壤pH值不同其降解途径亦不同,碱性土壤中阿特拉津降解以微生物降解为主,而酸性土壤中阿特拉津降解则主要通过化学水解,由微生物和化学水解共同作用[19]。本实验土壤为酸性较强的赤红壤,pH值为5.11。因此,无狼尾草处理的湛江砖红壤中阿特拉津的降解主要以非生物降解为主,土壤蕴含的土著微生物对阿特拉津降解有一定强化作用,但效果弱于非生物降解。
狼尾草可加速土壤阿特拉津的降解,降解速率在实验最后阶段最为迅速,但土壤微生物量碳、氮和微生物呼吸却在实验中期(14 d)达到最大值,呈先上升后降低趋势。实验初期阿特拉津浓度较高,对土壤微生物数量和活性的抑制作用较大。随着阿特拉津浓度降低,微生物数量和活性持续增长,尤其是在狼尾草根际土壤中。14 d后伴随土壤中营养成分或代谢碳源的消耗,土壤微生物数量相应有所下降。除28 d种植狼尾草处理(SN和SR),微生物碳、氮和微生物呼吸变化趋势与土壤阿特拉津浓度变化趋势呈正相关关系。种植狼尾草处理(SN和SR)中,28 d微生物总数量和活性减少,但土壤阿特拉津降解速率却最快。据此推断,土壤微生物总量和活性虽因土壤中营养减少而有所降低,但阿特拉津的降解菌可以持续利用阿特拉津作为代谢碳源,保持较高的数量和活性。因此,狼尾草根际土壤中阿特拉津降解速率在实验最后阶段最快。
实验结束时,根际土壤阿特拉津降解率(52.70%)显著优于非根际土壤(37.60%),狼尾草根际土壤中总微生物数量和活性也显著高于非根际土壤。植物根际是在物理、化学和生物学特性上不同于周围土体的一个微域环境,植物修复有机污染物通常发生在此区域。植物根系分泌的营养物质,如糖类、醇、蛋白质等,可为根际微生物生长提供有机碳源,提高微生物的数量和活性[20]。狼尾草可显著提高土壤可培养细菌、真菌和放线菌的数量,尤其是土壤可培养细菌数量。细菌在土壤阿特拉津降解过程中起重要作用,已发现可深度矿化降解阿特拉津的降解菌(假单胞菌、不动杆菌属和红球菌)多数为细菌[21]。DGGE结果显示,狼尾草根际土壤中细菌群落结构对比未灭菌对照土壤发生较大变化,根际土壤的细菌多样性和均匀度均得到显著提升。主成分分析结果表明,狼尾草根际土壤与对照的差异主要来源于第一主成分微生物学指标(微生物碳、氮和微生物呼吸)的贡献(74.51%),微生物数量和活性越高,土壤中阿特拉津残留量越少。与此研究结果相似,Arthur等[22]研究表明阿特拉津在植物根际区土壤中的半衰期较无植物对照土壤缩短约75%,且根际区土壤中阿特拉津的降解菌数量比对照中的相应数量多9倍。Singh等[11]研究阿特拉津和西玛津在C4植物狼尾草根际降解特征时发现,生长80 d的C4植物狼尾草根际中微生物的数量增大7个数量级,阿特拉津和西玛津的降解率分别达45%和52%,而非根际中仅降解22%和20%,狼尾草的吸收是微量的,只占原始药量的0.13%~1.08%,土壤污染物消失的主要贡献源于微生物降解。狼尾草对阿特拉津污染土壤有较好的根际强化降解效果,强化作用主要源于根际土壤微生物的间接作用,但对降解过程中起具体作用的微生物种类,尤其是不可培养的降解微生物种类和功能基因有待进一步研究。稳定同位素标记和高通量测序等技术的发展为未来开展此方面研究提供了良好契机[23]。
4 结论(1)狼尾草具有强化修复阿特拉津污染土壤的作用。狼尾草根际土壤的阿特拉津降解率显著高于非根际土壤,根际降解效果更为明显。
(2)土壤自身具有修复阿特拉津的潜能,无狼尾草处理的湛江砖红壤中阿特拉津降解以非生物降解为主。土著微生物对阿特拉津降解有一定强化作用,但效果弱于非生物降解。
(3)狼尾草通过根际效应显著提高了土壤总微生物数量和活性,增加了土壤可培养细菌、真菌和放线菌的数量,尤其是土壤可培养细菌数量,提升了土壤细菌群落结构的丰富度和均匀度,进而间接强化了土壤阿特拉津的生物降解。
| [1] | Cao X, Ma L, Liang Y, et al. Simultaneous immobilization of lead and atrazine in contaminated soils using dairy-manure biochar[J]. Environmental Science & Technology, 2011, 45(11): 4884–4889. |
| [2] | Kabra A N, Ji M, Choi J, et al. Toxicity of atrazine and its bioaccumulation and biodegradation in a green microalga:Chlamydomonas mexicana[J]. Environmental Science and Pollution Research, 2014, 21(21): 12270–12278. DOI:10.1007/s11356-014-3157-4 |
| [3] | 邵佳. 环境中阿特拉津的处理技术研究进展[J]. 中国环境管理干部学院学报, 2016(3): 90–93. SHAO Jia. Research progress of treatment technology for atrazine in environment[J]. Journal of EMCC, 2016(3): 90–93. |
| [4] | Delwiche K B, Lehmann J, Walter M T. Atrazine leaching from biochar-amended soils[J]. Chemosphere, 2014, 95: 346–352. DOI:10.1016/j.chemosphere.2013.09.043 |
| [5] | Xiao C P, Yang L M, Zhang L X, et al. Effects of cultivation ages and modes on microbial diversity in the rhizosphere soil of Panax ginseng[J]. Journal of Ginseng Research, 2015, 40(1): 303–307. |
| [6] | Afzal M, Khan Q M, Sessitsch A. Endophytic bacteria:Prospects and applications for the phytoremediation of organic pollutants[J]. Chemosphere, 2014, 117: 232–242. DOI:10.1016/j.chemosphere.2014.06.078 |
| [7] | Toyama T, Furukawa T, Maeda N, et al. Accelerated biodegradation of pyrene and benzo[a]pyrene in the Phragmites australis rhizosphere by bacteria-root exudate interactions[J]. Water Research, 2011, 45(4): 1629–1638. DOI:10.1016/j.watres.2010.11.044 |
| [8] | 马兵兵, 姜昭, 叶思源, 等. 狼尾草典型生理生化特征对阿特拉津胁迫的响应[J]. 农业环境科学学报, 2015, 34(11): 2083–2088. MA Bing-bing, JIANG Zhao, YE Si-yuan, et al. Typical physiological and biochemical characteristics of Pennisetum americanum L.(cv. K. Schum) under atrazine stresses[J]. Journal of Agro-Environment Science, 2015, 34(11): 2083–2088. |
| [9] | Lin C H, Lerch R N, Kremer R J, et al. Stimulated rhizodegradation of atrazine by selected plant species[J]. Journal of Environmental Quality, 2011, 40(4): 1113–1121. DOI:10.2134/jeq2010.0440 |
| [10] | Zhang Y, Ge S J, Jiang M Y, et al. Combined bioremediation of atrazine-contaminated soil by Pennisetum and Arthrobacter sp. strain DNS10.[J]. Environmental Science and Pollution Research, 2014, 21(9): 6234–6238. DOI:10.1007/s11356-013-2410-6 |
| [11] | Singh N, Megharaj M, Kookana R S, et al. Atrazine and simazine degradation in Pennisetum rhizosphere[J]. Chemosphere, 2004, 56(3): 257–263. DOI:10.1016/j.chemosphere.2004.03.010 |
| [12] | Erinle K O, Jiang Z, Li M Y, et al. Oxidative stress response induced in an atrazine phytoremediating plant:Physiological responses of Pennisetum glaucum to high atrazine concentrations[J]. International Journal of Phytoremediation, 2016, 18(12): 1187–1194. DOI:10.1080/15226514.2016.1193464 |
| [13] | Vibber L L, Pressler M J, Colores G M. Isolation and characterization of novel atrazine-degrading microorganisms from an agricultural soil[J]. Applied Microbiology and Biotechnology, 2007, 75(4): 921–928. DOI:10.1007/s00253-007-0871-6 |
| [14] | 鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2000: 138-141. BAO Shi-dan. Soil agricultural chemistry analysis[M]. 3rd Edition. Beijing: China Agricultural Press, 2000: 138-141. |
| [15] | 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 167-169. LU Ru-kun. Soil agricultural chemical analysis method[M]. Beijing: China Agricultural Press, 1999: 167-169. |
| [16] | Kuklenyik Z, Panuwet P, Jayatilaka N K, et al. Two-dimensional high performance liquid chromatography separation and tandem mass spectrometry detection of atrazine and its metabolic and hydrolysis products in urine[J]. Journal of Chromatography B, 2012, 901: 1–8. DOI:10.1016/j.jchromb.2012.05.028 |
| [17] | Lalande J, Villemur R, Deschênes L. A new framework to accurately quantify soil bacterial community diversity from DGGE[J]. Microbial Ecology, 2013, 66(3): 647–658. DOI:10.1007/s00248-013-0230-3 |
| [18] | Wang Q F, Xie S G. Isolation and characterization of a high-efficiency soil atrazine-degrading Arthrobacter sp. strain[J]. International Biodeterioration & Biodegradation, 2012, 71: 61–66. |
| [19] | Thomasc M, Lawrencee S, Mark R. Effect of soil pH and previous atrazine use history on atrazine degradation in a Tennessee field soil[J]. Weed Science, 2010, 58(4): 478–483. DOI:10.1614/WS-D-09-00041.1 |
| [20] | Urrutia C, Rubilar O, Tortella G, et al. Influence of the rhizosphere in a biopurification system on the dissipation of a pesticide mixture[J]. Journal of Soil Science & Plant Nutrition, 2015, 15(4): 914–927. |
| [21] | Udikouić-Kolić N, Hršak D, Devers M, et al. Taxonomic and functional diversity of atrazine-degrading bacterial communities enriched from agrochemical factory soil[J]. Journal of Applied Microbiology, 2010, 109(1): 355–367. |
| [22] | Arthur E L, Perkovich B S, Anderson T A, et al. Degradation of an atrazine and metolachlor herbicide mixture in pesticide-contaminated soils from two agrochemical dealerships in Iowa[J]. Water, Air, & Soil Pollution, 2000, 119(1/2/3/4): 75–90. |
| [23] | Song M K, Luo C L, Jiang L F, et al. Identification of benzo[a]pyrene-metabolizing bacteria in forest soils by using DNA-based stable-isotope probing[J]. Applied & Environmental Microbiology, 2015, 81(21): 7368–7376. |
 2017, Vol. 36
2017, Vol. 36




