文章信息
- 汪艳如, 侯杰发, 郭建华, 黄兵, 罗专溪, 陈樑
- WANG Yan-ru, HOU Jie-fa, GUO Jian-hua, HUANG Bing, LUO Zhuan-xi, CHEN Liang
- 冻融循环对牦牛粪生物炭吸附氨氮的影响
- Effects of freeze-thaw cycles on ammonium-nitrogen adsorption of yak dung biochar
- 农业环境科学学报, 2017, 36(3): 566-573
- Journal of Agro-Environment Science, 2017, 36(3): 566-573
- http://dx.doi.org/10.11654/jaes.2016-0994
文章历史
- 收稿日期: 2016-08-01
2. 中国科学院城市环境研究所 城市环境与健康重点实验室, 福建 厦门 361021
2. Key Laboratory of Urban Environment and Health, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China
氮是植物生长的重要养分之一, 但过量的氮输出会导致生态环境的恶化。氨氮是最常见的氮污染物之一[1]。氨氮排入河流、湖泊等水体中会导致水体富营养化, 引起水体中溶解氧浓度急剧减少, 对水生生物及环境造成严重破坏[2]。减少氨氮输出, 去除水体中的氨氮, 对于保障水环境质量至关重要。
生物炭 (Biochar) 是指在完全或部分缺氧的条件下, 由农作物秸秆、木质材料、禽畜粪便等有机材料经热解 (一般温度低于700 ℃) 炭化所产生的一类高度芳香化的难溶性固态物质[3]。生物炭是一种新型吸附剂, 对氨氮有较好的吸附作用[4-6]。但生物炭在应用过程中会出现老化, 老化可能使生物炭颗粒表面形成负电荷, 使阳离子交换量增加, 表面酸性增强[7-9], 影响生物炭的使用效果。有研究表明生物炭应用于修复酸性土壤时, 新鲜炭能够有效降低土壤的酸性, 但随着生物炭老化, 其酸性增强, 修复效果降低[10]。不同生物炭的老化对其理化性质的影响不同[11]。生物炭吸附氨氮的应用中, 生物炭老化后自身性质的变化如何影响其对氨氮的吸附还不甚清晰, 不利于生物炭的长期应用。因此, 研究老化作用对生物炭吸附氨氮的影响有着重要的实际意义。
高原地区的牦牛粪长期在草原上大量堆积, 对环境造成污染的同时, 亦造成资源的浪费, 牦牛粪资源化利用的问题亟待解决[12]。另外, 近年来农业上化肥的过量使用也加重了土壤中氮的流失, 生活用水的随意排放等, 均可能引起高原湖泊的富营养化。本文选取牦牛粪为原料制备生物炭, 采用冻融循环这一简单易行、绿色环保的物理老化方式, 通过氨氮的吸附试验, 建立等温吸附模型和动力学吸附模型, 研究冻融循环对生物炭吸附氨氮的影响, 并分析生物炭老化前后表面形态特征、官能团及理化性质的变化, 探讨老化的生物炭吸附氨氮的潜在作用机理, 旨在为生物炭去除土壤/水体氨氮的长期应用提供科学依据。
1 材料与方法 1.1 生物炭的制备及其冻融循环本实验以牦牛粪为生物炭的制备原料, 牦牛粪采自云南省迪庆藏族自治州香格里拉县角茸大草原。制备方法:牦牛粪经风干, 破碎至2~3 cm, 装入不锈钢铁盒, 放入可编程气氛保护箱式炉 (SXQF-12-10, 杭州蓝天仪器有限公司), 在通入氮气保护的情况下, 以5 ℃·min-1的速率升温, 热解温度分别为300、450、600 ℃, 慢速热解3 h, 所得生物炭分别记为BC300、BC450、BC600。随炉自然冷却至室温后取出, 研钵研磨, 过100目筛, 贮存。
称取BC300、BC450、BC600生物炭各50 g, 加入超纯水 (Milli-Q A10, Milli-pore公司) 200 mL (W: V=1: 4) 和1%的20 g·L-1的叠氮化钠灭菌, 混匀。温度范围: 35 ℃(16 h), -20 ℃(8 h), 循环冷冻-解冻30次, 在此期间保持样品的水分含量恒定。老化后的生物炭分别记为PBC300、PBC450、PBC600。
1.2 生物炭对氨氮的吸附等温吸附实验:准确称取0.200 0 g (电子分析天平, AUY220, 日本) 生物炭样品于50 mL离心管中, 加入不同浓度的NH4Cl溶液 (5.0、10.0、20.0、50.0、80.0、100.0、150.0、200.0、300.0 mg·L-1)20 mL, 混合均匀, 置于恒温振荡摇床 (ZHWY-221B, ZHCHENG), 温度25 ℃, 转速150 r·min-1振荡24 h。取出后静置30 min, 过0.45 μm滤膜, 测定溶液中NH4+的浓度。
吸附动力学实验:准确称取生物炭0.200 0 g于50 mL离心管中, 取20 mL浓度为20 mg·L-1的NH4Cl溶液加入离心管中, 混合均匀, 置于恒温振荡摇床, 温度25 ℃, 转速150 r·min-1振荡, 于1、2、8、15、20、40、80、150、240、720 min取样, 过0.45 μm滤膜, 测定溶液中NH4+的浓度。溶液中NH4+浓度测定采用连续流动注射分析仪 (LACHAT QC8500)。
所有实验均设置3个平行。
1.3 生物炭的表征生物炭中C、H、N、O的含量采用元素分析仪 (VARIO MAX, 德国) 测定。用场发射扫描电子显微镜 (S-4800, 日本) 及全自动快速比表面积及中孔/微孔分析仪 (ASAP2020, 德国) 表征生物炭表面形态特征。用傅里叶变换红外光谱仪 (is10, 美国) 测定生物炭的红外谱图。pH值采用pH计 (FIVE Easy, METTLER TOLEDO) 测定, 生物炭:水为1: 20(W: V)[13]。Zeta电位采用Zeta电位及纳米/微米粒度分析仪 (ZetaPALS, 英国) 测定。
1.4 阳离子交换量 (CEC) 的测定称取生物炭1.00 g于50 mL离心管中, 加入1 mol·L-1 NaOAc溶液8.25 mL。振荡 (200 r·min-1, 25 ℃) 5 min, 离心 (3500 r·min-1, 25 ℃) 10 min, 弃去上清液。重复NaOAc提取4次, 保证阳离子完全被Na+取代。然后以同样的方法用乙醇洗涤样品3次, 最后一次尽量除尽洗涤液。向上述样品中加入1 mol·L-1 NH4OAc (pH 7) 8.25 mL, 振荡5 min, 离心, 取上清液过0.45 μm滤膜, 然后倒入25 mL容量瓶。以同样的方法用1 mol·L-1 NH4OAc交换洗涤2次。收集的上清液最后用NH4OAc溶液稀释到刻度, 用电感耦合等离子体发射光谱仪 (ICP-OES, Optima 7000DV) 测定溶液中Na+浓度, 计算生物炭的CEC[14]。
1.5 数据分析 1.5.1 生物炭对氨氮的吸附量及吸附效率生物炭对氨氮的吸附容量及去除效率计算方法如下:
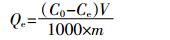 (1)
(1) 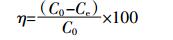 (2)
(2) 式中: Qe为生物炭对氨氮的吸附量, mg·g-1; V为溶液的体积, mL; m为生物炭的质量, g; C0和Ce分别为溶液中氨氮的初始浓度和平衡浓度, mg·L-1; η为生物炭的去除效率, %。
1.5.2 吸附等温线模型分别用Langmuir和Freundlich模型对吸附试验数据进行拟合, 拟合方程为 (3) 和 (4)。
 (3)
(3) 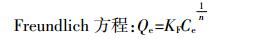 (4)
(4) 式中: Qm为理论最大吸附量, mg·g-1; KL为Langmuir等温方程常数, L·mg-1; KF和n均为Freundlich等温方程常数, L·mg-1。
分离因子RL(也称平衡参数) 可以判断吸附材料是否能有效吸附污染物, 0 < RL < 1为有利吸附; RL>1为不利吸附; RL=1为线性吸附; RL=0为不可逆吸附[15]。采用下式计算:
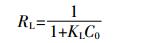 (5)
(5) 分别用准一级和准二级动力学模型对动力学数据进行拟合, 拟合方程为 (6) 和 (7)。
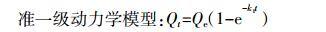 (6)
(6)  (7)
(7) 式中: Qt为t时刻氨氮的吸附量, mg·g-1; t为吸附时间, min; k1、k2分别为准一级、准二级动力学模型的速度常数。
1.5.4 生物炭CEC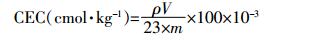 (8)
(8) 式中: ρ为标准曲线上待测液中的钠离子的质量浓度, μg·mL-1; V为测定时定容的体积, mL; 23为钠的摩尔质量, g·mol-1。
1.6 数据处理与统计实验数据采用Origin 8.5拟合作图, SPSS 17.0进行统计分析, 并应用Duncan多重比较进行差异显著性分析, 显著性水平为0.05。
2 结果与讨论 2.1 生物炭对氨氮的吸附等温曲线Langmuir和Freundlich模型拟合结果如图 1、表 1所示。拟合度R2(Freundlich)>R2(Langmuir)>0.959, 可见, 牦牛粪生物炭老化前后对氨氮的吸附以多分子层不均匀吸附模式为主, 同时也存在着单分子层吸附。根据方程 (5) 计算生物炭吸附氨氮的平衡参数RL均小于1(0.406~0.985), 说明生物炭对氨氮的吸附为有利吸附, 而且随着初始浓度的增加平衡参数减小, 说明提高初始浓度有利于生物炭对氨氮的吸附[16]。

|
| 图 1 不同生物炭对氨氮的吸附等温线 Figure 1 Adsorption isotherms for NH+4 onto biochars |
统计分析发现, 不同氨氮初始浓度下, BC300和PBC300对氨氮的吸附量不存在显著差异 (P>0.05)。氨氮初始浓度为5 mg·L-1时, PBC450和PBC600的吸附量比老化前分别显著提高了13.1%、12.4%(P < 0.05), 去除效率分别为62.6%、55%;氨氮初始浓度为10 mg·L-1时, PBC600的吸附量比老化前显著提高9.8%, 去除效率为53.3%;氨氮初始浓度为20 mg·L-1时, 三种生物炭老化前后对氨氮的吸附量没有显著性差异。可见, 随着氨氮初始浓度的增加 (C0 < 20 mg·L-1), 常规炭和老化炭对氨氮的吸附量显著性差异减小, 且热解温度越低的生物炭显著性差异越小; 当氨氮初始浓度大于20 mg·L-1时, 老化炭对氨氮的吸附量显著低于常规炭。
2.2 生物炭对氨氮的吸附动力学牦牛粪生物炭对氨氮的吸附在短时间内就能达到平衡, 达到平衡后吸附量有微小的变动, 具有"迅速吸附, 缓慢稳定"的特征 (图 2)。经过准一级动力学和准二级动力学模型拟合, 生物炭对氨氮的吸附更符合准二级动力学模型 (表 2), 拟合度在0.984~0.997之间, 且根据准二级动力学公式计算的生物炭平衡吸附量与实验所得最大平衡吸附量相近 (Qe=0.696~0.876 mg·g-1)。这表明生物炭对氨氮的吸附行为以化学吸附为主。

|
| 图 2 不同生物炭对氨氮的吸附动力学曲线 Figure 2 Adsorption kinetics and modeling for NH+4 onto biochars |
吸附动力学表明不同热解温度的生物炭对氨氮的吸附作用有显著性差异 (P < 0.05), 热解温度升高, 生物炭对氨氮的吸附作用先增强后减弱, 即BC300对氨氮的吸附量显著高于BC600, 显著低于BC450。有研究认为随着热解温度的升高, 生物炭对NH4+的吸附作用减弱, 与生物炭的CEC减小有关[17]; 也有研究认为热解温度对生物炭吸附NH4+没有影响, 而与热解材料有关[18]。PBC300和PBC450对氨氮的吸附没有显著性差异 (P>0.05), 但PBC450显著高于PBC600(P < 0.05)。PBC300、PBC450、PBC600的平衡吸附量比老化前分别增加2.04%、8.04%、8.58%, 说明随着生物炭热解温度升高, 冻融循环对生物炭吸附氨氮的影响越显著。
2.3 冻融循环对生物炭吸附氨氮的潜在影响机制 2.3.1 表面形态特征如图 3a、图 3b、图 3c所示, 随着热解温度的升高, 生物炭的粗糙、分层程度越明显, 且孔隙结构增加, 这是由于生物质在热解过程中, 随着有机质分解、消耗, 在结构上留下了很多孔, 使得生物炭整体疏松多孔。生物质各组分的热解所需温度不同, 导致生物炭表面孔隙结构各异且排列不规则, 热解温度越高, 损失的组分越多, 表面就越粗糙[19]。由SEM图可见, 老化后生物炭表面孔隙结构变化不明显。比表面积分析结果 (表 3) 显示, 随着热解温度的升高, 生物炭的微孔体积和微孔比表面积增加显著, 比表面积也迅速增加, 牦牛粪生物炭孔径属于中孔范围 (2.0~50 nm)。BC300表面孔隙较少, 冻融循环对其表面形态特征影响不显著。PBC450和PBC600的比表面积、微孔体积、微孔比表面积均比老化前显著增加, 因而能为NH4+提供更多的接触位点。

|
| 图 3 不同生物炭的扫面电镜图 Figure 3 SEM of different biochars |
图 4为各生物炭的红外谱图, 据该图分析: 3200~3550 cm-1附近的吸收峰表示存在酚羟基或者醇羟基, 其中酚羟基属于酸性官能团; 2940 cm-1和2 860.7 cm-1处出现烷烃的C-H伸缩振动; 2347 cm-1处的吸收峰, 推测存在P-H、C=C、C=N的伸缩振动; 1610~1550 cm-1(强峰) 和1420~1300 cm-1(中强峰) 代表COO-, 生物炭的羧基官能团是影响其吸附氨氮的关键性因素[20]; 1085 cm-1处均存在一个明显的吸收峰, 代表生物炭的芳香性结构; 794.8 cm-1和680.8 cm-1附近存在连续波峰, 推测为芳香族化合物C-H键面外弯曲振动产生。

|
| 图 4 不同生物炭的红外光谱图 Figure 4 The FTIR spectra of different biochars |
由图 4可知, 热解温度对生物炭官能团的种类和数量有较大的影响。生物炭老化前后红外图谱峰的位置基本一致, 但部分峰强度发生了变化。BC300和BC450的表面官能团种类和数量差别较小, 热解温度升高, BC450的芳香性增强。当热解温度为600 ℃时, 生物炭的羟基官能团减少, 烷烃的C-H伸缩振动也减弱, 羧基官能团也减少, 不利于生物炭对氨氮的吸附。冻融循环使得PBC300的羧基官能团增加, 酸性官能团的增加有利于生物炭对氨氮的吸附, 而PBC450和PBC600的官能团变化情况在FTIR图上显示不明显, 说明高温热解的生物炭稳定性较好, 不易被氧化。
2.3.3 理化性质本研究发现热解温度升高时, 生物炭的C、H、O、N元素含量减少, pH值、比表面积增加, Zeta电位降低 (表 4), 与前人研究结果一致[21]。牛粪中含有较多有机物及大量灰分, 热解温度升高, 生物质的热解和有机质的挥发导致生物炭的C、N含量降低[22]。生物炭的元素含量在老化前后没有发生显著的变化, 说明生物炭是一种稳定性较好的吸附剂。
CEC是决定生物炭吸附氨氮的重要因素[22]。本研究中生物炭的CEC范围为7.53~13.23 cmol·kg-1, 且热解温度升高, CEC降低。冻融循环作用使得PBC300、PBC450、PBC600的CEC比老化前分别增加了0.4%、9.1%和75.7%, 可以看出, 热解温度越高的生物炭老化后CEC增加越显著。PBC600的CEC显著增加, 与其比表面积增大了2.3倍有关, 比表面积的增大使得生物炭表面的官能团暴露, 从而导致CEC增加。CEC的增加是老化炭对氨氮吸附作用增强的重要原因之一。
冻融循环作用对生物炭的pH值和Zeta电位影响较大。PBC300的pH值、Zeta电位比老化前分别降低了7.4%、21.6%; PBC450的pH值不变, Zeta电位降低了17.6%; PBC600的pH值、Zeta分别降低了6.9%、18.3%。冻融循环后, 生物炭的pH值降低表示生物炭酸性增强, 表面的酸性官能团增加[23], 与前人研究结果[7-10]一致。Zeta电位降低表示生物炭粒子之间的静电斥力减弱, 生物炭表面酸性官能团增加或者静电斥力减弱均能够增强生物炭对氨氮的吸附作用[8]。
3 结论(1) 冻融循环前后牦牛粪生物炭对氨氮的吸附均以多分子层不均匀吸附的化学吸附为主。
(2) 冻融循环对牦牛粪生物炭的表面官能团、元素含量影响不显著, 但能够对牦牛粪生物炭的Zeta电位、pH值、CEC和比表面积产生不同程度的影响。牦牛粪生物炭的比表面积和CEC是影响其吸附氨氮的主要因素, 且热解温度越高的牦牛粪生物炭, 老化后比表面积和CEC增加越显著。
(3) 不同热解温度的牦牛粪生物炭对氨氮的吸附作用存在显著性差异, BC300对氨氮的吸附量显著高于BC600, 显著低于BC450。随着氨氮初始浓度的增加 (C0 < 20 mg·L-1), 常规炭和老化炭对氨氮的吸附量显著性差异减弱, 且热解温度越低的生物炭显著性差异越小; 当氨氮的初始浓度大于20 mg·L-1时, 老化炭对氨氮的吸附量显著低于常规炭。
(4) 利用牦牛粪生物炭吸附低浓度氨氮具有良好的应用前景。
| [1] | Jellali S, Wahab M A, Anane M, et al. Biosorption characteristics of ammonium from aqueous solutions onto Posidonia oceanica (L.) fibers[J]. Desalination, 2011, 270(1/2/3): 40–49. |
| [2] | Rozic M, Cerjan-Stefanovic S, Kurajica S, et al. Ammoniacal nitrogen removal from water by treatment with clays and zeolites[J]. Water Research, 2000, 34(14): 3675–3681. DOI:10.1016/S0043-1354(00)00113-5 |
| [3] | Lehmann J, Joseph S. Biochar for environmental management:Science, technology and implementation[M]. New York: Routledge, 2015: 1-2. |
| [4] | Zhang H, Voroney R P, Price G W. Effects of temperature and processing conditions on biochar chemical properties and their influence on soil C and N transformations[J]. Soil Biology and Biochemistry, 2015, 83: 19–28. DOI:10.1016/j.soilbio.2015.01.006 |
| [5] | 杨放, 李心清, 王兵, 等. 热解材料对生物炭理化性质的影响[J]. 农业环境科学学报, 2015, 34(9): 1822–1828. YANG Fang, LI Xin-qing, WANG Bing, et al. Effects of different feedstocks on physicochemical characteristics of pyrolyzed biochars[J]. Journal of Agro-Environment Science, 2015, 34(9): 1822–1828. |
| [6] | Reverchon F, Flicker R C, Yang H, et al. Changes in δ15N in a soil-plant system under different biochar feedstocks and application rates[J]. Biology and Fertility of Soils, 2014, 50(2): 275–283. DOI:10.1007/s00374-013-0850-2 |
| [7] | Shi K S, Xie Y, Qiu Y P. Natural oxidation of a temperature series of biochars:Opposite effect on the sorption of aromatic cationic herbicides[J]. Ecotoxicology and Environmental Safety, 2015, 114: 102–108. DOI:10.1016/j.ecoenv.2015.01.015 |
| [8] | Liu Z Y, Demisie W, Zhang M K. Simulated degradation of biochar and its potential environmental implications[J]. Environmental Pollution, 2013, 179: 146–152. DOI:10.1016/j.envpol.2013.04.030 |
| [9] | Ghaffar A, Ghosh S, Li F, et al. Effect of biochar aging on surface characteristics and adsorption behavior of dialkyl phthalates[J]. Environmental Pollution, 2015, 206: 502–509. DOI:10.1016/j.envpol.2015.08.001 |
| [10] | Zhao R D, Coles N, Kong Z, et al. Effects of aged and fresh biochars on soil acidity under different incubation conditions[J]. Soil and Tillage Research, 2015, 146: 133–138. DOI:10.1016/j.still.2014.10.014 |
| [11] | Heitkötter J, Marschner B. Interactive effects of biochar ageing in soils related to feedstock, pyrolysis temperature, and historic charcoal production[J]. Geoderma, 2015, 245-246: 56–64. DOI:10.1016/j.geoderma.2015.01.012 |
| [12] | 李阳.生物炭输入对纳帕海青稞生长与土壤微生物生态学特征的影响[D].昆明:昆明理工大学, 2015:2-3. LI Yang. Effects of biochar input on highland barley growth and edaphon's synecological characteristics within the Napa Lake basin[D]. Kunming:Kunming University of Science and Technology, 2015:2-3. |
| [13] | Jassal R S, Johnson M S, Molodovskaya M, et al. Nitrogen enrichment potential of biochar in relation to pyrolysis temperature and feedstock quality[J]. Journal of Environmental Management, 2015, 152: 140–144. DOI:10.1016/j.jenvman.2015.01.021 |
| [14] | 鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2000: 170-172. BAO Shi-dan. Soil Agro-chemistrical analysis[M]. 3rd edition. Beijing: China Agriculture Press, 2000: 170-172. |
| [15] | Zhao Y F, Zhang B, Zhang X, et al. Preparation of highly ordered cubic NaA zeolite from halloysite mineral for adsorption of ammonium ions[J]. Journal of Hazardous Materials, 2010, 178(1/2/3): 658–664. |
| [16] | 马锋锋, 赵保卫, 刁静茹, 等. 牛粪生物炭对水中氨氮的吸附特性[J]. 环境科学, 2015, 36(5): 1678–1685. MA Feng-feng, ZHAO Bao-wei, DIAO Jing-ru, et al. Ammonium adsorption characteristics in aqueous solution by dairy manure biochar[J]. Environmental Science, 2015, 36(5): 1678–1685. |
| [17] | Paramashivam D, Clough T J, Dickinson N M, et al. Effect of pine waste and pine biochar on nitrogen mobility in biosolids[J]. Journal of Environmental Quality, 2016, 45(1): 360–367. DOI:10.2134/jeq2015.06.0298 |
| [18] | Clough T, Condron L, Kammann C, et al. A review of biochar and soil nitrogen dynamics[J]. Agronomy, 2013, 3(2): 275–293. DOI:10.3390/agronomy3020275 |
| [19] | Janus A, Pelfrene A, Heymans S, et al. Elaboration, characteristics and advantages of biochars for the management of contaminated soils with a specific overview on Miscanthus biochars[J]. J Environ Manage, 2015, 162: 275–289. DOI:10.1016/j.jenvman.2015.07.056 |
| [20] | Wang Z H, Guo H Y, Shen F, et al. Biochar produced from oak sawdust by lanthanum (La)-involved pyrolysis for adsorption of ammonium (NH4+), nitrate (NO3-), and phosphate (PO43-)[J]. Chemosphere, 2015, 119: 646–653. DOI:10.1016/j.chemosphere.2014.07.084 |
| [21] | Wang X B, Zhou W, Liang G Q, et al. Characteristics of maize biochar with different pyrolysis temperatures and its effects on organic carbon, nitrogen and enzymatic activities after addition to fluvo-aquic soil[J]. The Science of the Total Environment, 2015, 538: 137–144. DOI:10.1016/j.scitotenv.2015.08.026 |
| [22] | Wang T, Camps M, Hedley M, et al. Chemical and bioassay characterisation of nitrogen availability in biochar produced from dairy manure and biosolids[J]. Organic Geochemistry, 2012, 51: 45–54. DOI:10.1016/j.orggeochem.2012.07.009 |
| [23] | Anyika C, Abdul M Z, Ibrahim Z, et al. The impact of biochars on sorption and biodegradation of polycyclic aromatic hydrocarbons in soils:A review[J]. Environmental Science and Pollution Research International, 2015, 22(5): 3314–3341. DOI:10.1007/s11356-014-3719-5 |
 2017, Vol. 36
2017, Vol. 36








