文章信息
- 顾博文, 曹心德, 赵玲, 赵英豪
- GU Bo-wen, CAO Xin-de, ZHAO Ling, ZHAO Ying-hao
- 生物质内源矿物对热解过程及生物炭稳定性的影响
- Influence of inherent minerals on biomass pyrolysis and carbon stability in biochar
- 农业环境科学学报, 2017, 36(3): 591-597
- Journal of Agro-Environment Science, 2017, 36(3): 591-597
- http://dx.doi.org/10.11654/jaes.2016-1160
文章历史
- 收稿日期: 2016-09-08
近年来, 利用生物质废弃物如农作物残体、畜禽粪便等制备生物炭获得国内外学者的广泛关注[1]。生物质在无氧状态下热解转化为芳香化的富碳物质即生物炭。生物炭具有高度的碳稳定性, 被认为是一种能有效缓解温室效应的固碳材料[2], 制备出高产率、富碳且高稳定性的生物炭对固碳有重要意义[3]。生物质热解包含有机质分解、炭化、气化和液化, 且不同成分和过程相互叠加, 过程复杂; 生物质的性质及热解条件都将影响最终产品的组分和性质[4]。尽管生物质中主要成分为有机质, 但其中含有的少量金属矿物对生物质的热解起着不可忽视的催化作用[5-6]。矿物元素一般以氧化物、硅化物、碳酸盐、氯盐和磷酸盐等形式存在, 还有极少部分以有机形式存在。植物类生物质中一般KCl含量较高, K元素含量约1.5%~5.5%;畜禽粪便和污泥生物质中P元素含量较高; 而SiO2、CaCO3、Ca3(PO4)2等也在这两类生物质中检测出含量较高[7]。这些矿物组分都可能影响热解过程进而影响碳结构和产物性质, 从而影响生物炭的固碳效果。
已有学者通过酸洗去除矿物的方法研究了矿物对生物质热解特性的影响[8-9]。Raveendran等[4]选取了13种生物质进行酸洗去矿并外加不同矿物, 发现大部分生物质去除矿物后增大了生物质的分解温度和分解速率, 并得到比表面积较大的生物炭; Williams等[10]在热解分析仪 (TGA) 和固定床反应器上研究了金属盐对生物质热解的影响, 发现添加金属盐如NaCl、Na2CO3等降低了纤维素的分解速率, 增加了焦炭产量; Mourant等[11]在固定床反应器上研究发现, 碱金属作用并没有显著改变固相和液相的产率, 但对生物油的性质有很大影响。Stephanidis等[12]认为去矿提升了左旋葡萄糖的产量, 同时其他的一些小分子如羧酸、酚类、酮等的含量下降; Patwardhan等[13]探究了碱金属K、Na、Ca及Mg盐对纤维素裂解产物的作用, 结果表明这些无机盐促进了低分子量化合物的裂解。Varhegyi等[14]采用热重质谱分析无机矿物质 (NaCl、MgCl2、FeSO4、ZnCl2) 对纤维素热解的影响, 发现当添加无机矿物时分解温度和最大失重速率均降低, 矿物不仅催化解聚反应, 并且促进大分子二次降解向小分子转化。
综合分析已有的研究, 金属矿物对生物质热解起着不可忽视的作用, 但影响的规律却依据不同的矿物种类和不同的生物质而有差异。碱金属、碱土金属对生物质热解起着催化分解的作用, 而某些过渡金属如Zn, 对生物质热分解起抑制作用[4]。在生物炭形成过程中, 内源矿物如何通过影响生物质的热解及生物炭碳结构, 进而改变生物质碳元素在生物炭中的保留以及生物炭的碳稳定性, 尚未有系统研究。因此, 本研究选用花生壳和牛粪两种典型富碳生物质, 通过酸洗去除矿物和外加目标矿物的方法, 结合热重分析仪等仪器分析手段, 考察生物质内源矿物对热解行为和生物炭碳稳定性的影响。
1 材料与方法 1.1 生物质样品采集和预处理花生壳和牛粪两种农业生物质废弃物均取自上海市宝山区某农场。首先将生物质通过晾晒的方式自然风干, 再通过破碎设备 (6202小型高速粉碎机, 台湾) 破碎成1 cm左右的小段, 经球磨机 (QM-3SPO4, 行星球磨机) 进一步粉碎成粉状物料。在60 ℃左右干燥至含水率小于1.0%后保存。
1.2 生物质中矿物的酸洗去除本研究选用酸洗的方法去除生物质中的矿物[8], 选用HCl与HF混合酸对生物质进行去矿处理, 二者的浓度均为0.5 mol·L-1。分别取30 g生物质, 添加1 L混合酸, 浸泡在聚四氟乙烯塑料瓶中, 搅拌均匀后置于60 ℃条件下保持2 h, 再于振荡器中振荡2 h后固液分离。将酸处理后的生物质用去离子水冲洗至pH为中性, 放置在干燥箱内80 ℃下干燥24 h。
1.3 向去矿生物质中外加目标矿物为了进一步确认主要矿物的作用, 向去矿生物质中添加矿物以观察其对热解过程的影响。由于KCl为农作物类生物质中最常见的物质, 而CaCl2为牛粪中的主要矿物, 实验分别选取这两类物质加入去矿生物质中。实验首先验证了矿物与生物质简单混合后共热解的添加方式对生物质热解行为没有显著影响 (TGA), 因此选用了浸渍负载法进行矿物添加。将一定量去矿生物质与配制好的KCl和CaCl2溶液用磁力搅拌器 (X85-2S型号) 搅拌均匀后, 干燥至无水状态, 使矿物成分被粉末态生物质充分浸渍吸附, 均匀负载到物料上。
1.4 生物质热解为了精确控制热解条件 (温度、氮气流量), 并观察热解过程, 首先采用热重分析仪进行生物质的热解 (TGA/DSC 1, Netzsch, 德国)。称取约20 mg生物质样品放置于Al2O3坩埚中, 置于热重分析仪内, 最高热解温度设定为500 ℃, 载气为高纯N2, 流速50 mL·min-1, 升温速率为15 ℃·min-1。
1.5 生物炭的制备为了得到一定量的生物炭产物, 采用管式马弗炉热解系统进行生物炭的制备, 制备条件同上, 即最高热解温度设定为500 ℃, 载气为高纯N2, 流速50 mL·min-1, 升温速率为15 ℃·min-1。
生物炭的产率是由生物质热解前后物料质量差来计算得到, 产率Y(%) 和有机质转化率Yo(%) 计算公式:
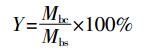 (1)
(1) 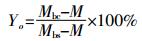 (2)
(2) 式中: Mbc为热解后生物炭质量; Mbs为热解前生物质质量; M为生物质内源矿物质量 (假定质量恒定)。生物炭的元素分析方法同生物质。
生物炭的碳保留计算公式:
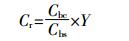 (3)
(3) 式中: Cr为生物炭的碳保留量, %; Cbc为生物炭含碳量, %; Cbs为生物质含碳量, %; Y为生物炭产率, %。
1.6 性质表征方法生物质及生物炭中C、H、N、S元素的含量采用元素分析仪测定 (Vario EL Ⅲ, Elementar, 德国); 生物质及生物炭中金属类矿物元素的测定采用先灰化、后微波消解的方法。灰化法参考国家GB/T 6438-1992的方法:在恒重的坩埚内称取1 g物料, 于马弗炉中550 ℃灼烧5 h, 冷却称重后再灼烧1 h至两次质量差小于0.001 g即可。得到的灰分采用质量分数为65%的HNO3与48%的HF进行消解 (Topwave, Analytik Jena, 德国), 消解液在250 ℃下除酸, 再经0.45 μm滤膜过滤后使用电感耦合等离子体原子发射光谱法 (ICP-AES PS3500 DD, 日立, 日本) 测定金属元素浓度; 采用色散型共聚焦拉曼光谱仪 (Senterra R200-L, Bruker Optics, 德国) 分析生物炭碳骨架的结构, 通过G峰和D峰的相对大小判断其无序化程度, 拉曼激发光源为5 mW、532 nm的激光器, 光谱范围在80~4500 cm-1之间, 每个生物炭样品取三个不同区域进行测试。计算三个区域ID/IG的平均值, ID/IG可用于表示样品的无序化程度。选取重铬酸钾 (K2Cr2O7) 来评估生物炭的化学稳定性。称取约含0.1 g碳当量的生物炭样品于50 mL锥形瓶中, 配制0.1 mol·L-1 K2Cr2O7与2 mol·L-1 H2SO4的混合液作为氧化剂, 振荡混匀后与生物炭混合, 在55 ℃恒温水浴中加热60 h, 过滤分离后在分光光度计585 nm下测定吸光度。
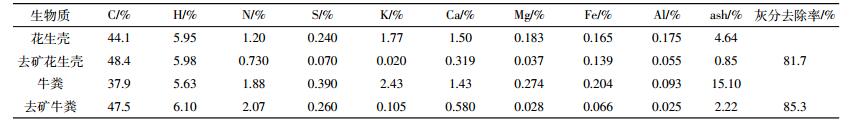
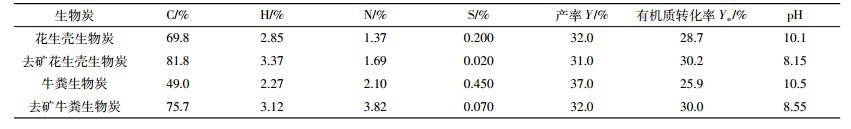
2 结果与讨论 2.1 生物质的性质及内源矿物去除效果生物质去矿前后的有机元素及矿物元素含量结果见表 1。由表 1可知, 生物质中的矿物去除之后, 其C含量显著提高。花生壳和牛粪的C含量分别由原始的44.1%和37.9%升高至去矿后的48.4%和47.5%;灰分含量分别由4.64%和15.10%降低至0.85%和2.22%。对于矿物元素, 花生壳中K含量为1.77%, 牛粪中Ca含量达1.43%, 相对于其他矿物元素含量较高; 另外, 两种生物质中的Fe、Al、Mg含量分别在0.165%~0.204%、0.093%~0.175%、0.183%~0.274%之间。生物质在酸洗之后主要矿物元素均发生了显著变化, 由表 1可见, 碱金属和碱土金属被去除最明显。两种生物质中, K的平均去除率高达97.3%, 而Ca、Mg的平均去除率分别为69.2%和84.8%。表明K盐大多为可溶物, 最易去除; 而Ca盐及Mg盐次之, 这是由于生物质Ca和Mg的主要存在形态为CaCO3、Ca3(PO4)2、Mg3(PO4)2[7]。对于花生壳和牛粪, 酸洗之后其总的灰分的去除率分别为81.7%和85.3%。本研究所得去除效果与文献中所报道的K、Ca、Na、Mg的平均去除效果较为吻合 (85%~99%)[15]。因此, HCl与HF混合酸洗方法可用于研究矿物的影响。
去除矿物前后的生物质热解曲线如图 1所示。由图 1可以看出两种生物质去矿前后的热解性质差异明显, 且主要差异发生在热解阶段的150~470 ℃, 此阶段为有机质主体分解阶段, 致密的纤维素和木质素碳骨架受热, 向无定形态转化, 并分解产生大量小分子有机物[16-17]。从图中TGA及DTG曲线可以看出, 经过酸洗去矿后, 生物质的主体分解温度都显著提高, 从约330 ℃提高到了约365 ℃; 从DTG曲线可以看出, 在300 ℃前, 去矿生物质的失重速率略低于原始生物质, 而在300~400 ℃区间, 去除矿物后的花生壳和牛粪分解速率明显提高, 从约0.6%·K-1提高到约0.9%·K-1(图 1b、图 1d)。去矿后分解温度的提高, 说明生物质中内源矿物具有催化效应[4-6]。牛粪去矿后其分解温度提高得更为明显一些 (图 1c、图 1d), 可能是因为牛粪中Ca和K的含量均较高, 总的矿物含量要远高于花生壳。由DTG曲线可见, 去矿生物质的失重速率明显增加, 且对于不同种类生物质均呈现这种现象。这是因为在最高分解速率阶段 (350~400 ℃), 主要是碳骨架的分裂, 去矿后单位时间内物料失重的百分比增大, 从而呈现出速率增大的效果, 本研究约增大0.3%·K-1; 另外, 去除矿物后, 生物质孔道被疏通暴露, 更利于传热及小分子挥发性物质的溢出, 也可能对速率有微弱的影响[18]。
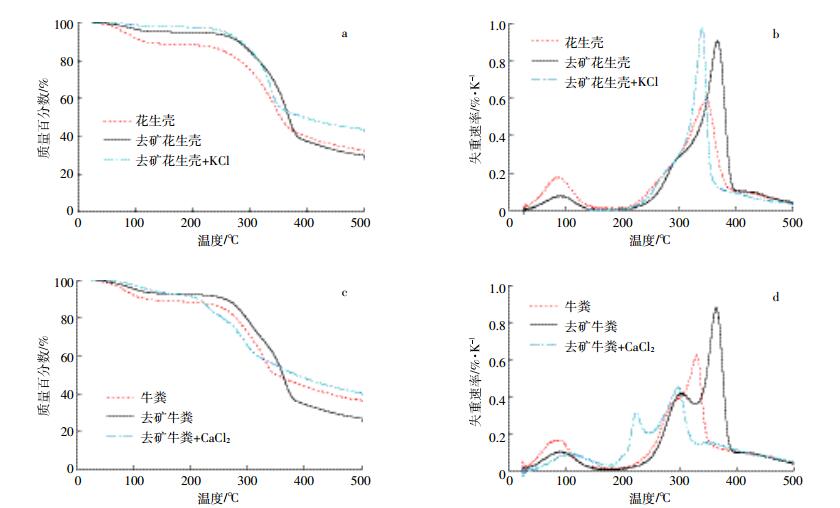
|
| 图 1 生物质去矿与加矿的热解 (TGA和DTG) 曲线 Figure 1 TGA and DTG curves of original, demineralized and mineral-added biomass |
因此, 无机矿物的影响主要发生在纤维素分解阶段。降低其分解温度, 说明矿物元素通过化学作用降低了生物质碳结构的分解能。
2.3 矿物KCl和CaCl2的影响为了进一步验证主要内源矿物的影响, 实验通过分别向去矿花生壳和去矿牛粪中外加KCl和CaCl2的方法来考查其作用。矿物与生物质通过充分浸渍后再干燥的方法紧密结合, 使之接近内源矿物的存在形态。添加后花生壳中K元素含量为8.36%, 牛粪中Ca元素含量为4.38%。
由图 1a可见, 添加KCl后, 热分解温度明显左移, 主体分解温度从约370 ℃左移至330 ℃附近。由图 1c可见, CaCl2的添加使牛粪的分解峰更为明显地左移。其中, DTG峰 (图 1d) 呈明显的两峰, 说明牛粪中有机质由两类性质有差异的组分构成, 可能分别代表了半纤维素与纤维素; 半纤维素达到最大分解速率的温度由约300 ℃左移至230 ℃附近, 纤维素最大分解速率峰由约360 ℃左移至300 ℃附近。KCl与CaCl2均呈现出了对碳骨架催化裂解的作用[19-21]。从化学机制上来分析, Ca2+容易吸附在纤维素的吡喃环单体上, 与部分较活泼呈极性的羟基氧原子结合[22], 使之发生电子偏移, 引起C-C和C-O键角发生改变, 键长变长、键能降低, 继而促进吡喃环变形, 从而有利于碳骨架分解[23]。在主体热解阶段, 通常纤维素、半纤维素主要发生脱聚反应, 其主要热解产物为左旋葡萄糖、羟基乙醛、羟基丙酮等[24], 但在金属离子作用下, 则主要发生开环反应, 使得热解向小分子方向转化。KCl也产生类似的效应, 如Nowakowski等[21]观察到KCl浸渍的柳木热解产生了更多的苯酚, 这可能源于KCl对木质素的催化分解或源于焦炭的二次分裂反应[25-26]。但金属K+的离子效应次于Ca2+, 这是由于Ca2+与O的化学键更强[22]。
2.4 内源矿物对热解过程碳保留的影响生物炭的固碳效果, 取决于热解过程中的碳保留比例和生物炭本身的碳稳定性。我们通过考察去矿前后生物炭的产率、有机质转化率 (表 2), 以及碳元素在生物炭中的保留率 (图 2) 来评估内源矿物的影响。
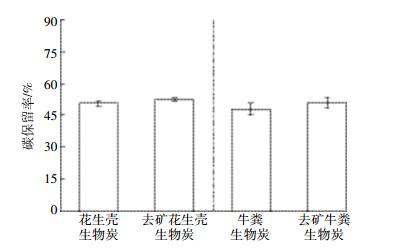
|
| 图 2 去除矿物前后生物质碳元素在生物炭中的保留率 Figure 2 Carbon retention in the biochar derived from the original and demineralized biomass |
|
由表 2可见, 去矿生物质的产率略低于未去矿生物质, 这是因为大部分矿物在500 ℃的热解过程中较为稳定, 留在产物中使产率较高。扣除这部分矿物重量的影响, 根据公式 (2) 计算出有机质转化率Yo, 可以看出花生壳和牛粪去矿后有机质转化率分别相较于未去矿时小幅升高了4.97%和13.7%, 说明矿物降低了有机质的转化率 (表 2)。根据公式 (3) 计算, 去矿前后在热解产物生物炭中的碳保留见图 2。去矿后碳元素的保留率略微升高, 理论上来说矿物确有促进碳的分解和向小分子转化的趋势, 但由于矿物在生物质中含量较低, 其对碳元素保留的影响并不显著。
总体来说, 内源矿物的存在对于提高生物炭中碳元素的保留率是有负面影响的, 但这种影响对于常规的生物质以及典型矿物来说并不显著。更多种矿物对生物质中碳元素保留率的影响, 需要进一步实验验证。
2.5 内源矿物对生物炭碳稳定的影响我们通过化学氧化法研究生物炭碳稳定性 (图 3), 并通过拉曼光谱研究碳结构的变化 (图 4)。采用重铬酸钾氧化法评估生物炭的稳定性, 可以快速准确地评估其抗氧化性, 有助于模拟生物炭在土壤中的长期稳定性[27]。由图 3可见, 去矿后制备的生物炭, 化学稳定性有明显提高, 碳损失率从未去矿的8.64%(花生壳) 和11.6%(牛粪) 降低到去矿后的4.09%(花生壳) 和8.05%(牛粪), 无矿物时制备的生物炭碳骨架碳损失率减少52.7%(花生壳) 和30.6%(牛粪)。
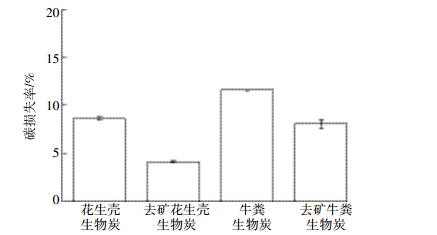
|
| 图 3 生物炭经K2Cr2O7氧化后的碳损失率 Figure 3 Carbon loss rate of biochars through K2Cr2O7 chemical oxidation |

|
| 图 4 去矿前后所制备生物炭的拉曼光谱 Figure 4 Raman spectroscopy of biochars produced before and after demineralization |
由图 4中的曲线计算可得, D-band和G-band的积分面积比 (ID/IG) 分别为:花生壳生物炭为1.28, 去矿花生壳生物炭为1.26, 牛粪生物炭和去矿牛粪生物炭分别为1.48和1.29。D峰 (1350 cm-1) 是由碳层结构中的缺陷导致的, 代表了碳材料中乱层结构以及不小于6个环的多环芳烃, 在1575 cm-1附近出现的峰称为G峰, 代表稠芳环结构以及类石墨微晶的sp2杂化振动[28]。因此, ID/IG的大小被认为与碳结构的石墨化程度, 即与有序化程度成反比。对于两种生物质来说, 去矿后制备的生物炭, 其ID/IG值均有不同程度的减小, 说明去矿生物质制备的生物炭, 碳结构有序化程度更高。矿物的存在使得生物质中的石墨化结构即芳香环易于断裂, 大分子物质向小分子物质转化, 从而导致了生物炭更易产生晶格缺陷, sp2杂化的无定形碳比例降低, 最终影响了生物炭的碳稳定性。矿物的存在使得生物炭产物更易产生晶格缺陷, 稳定性降低。
综上, 生物质内源矿物对生物质热解有催化效应, 生物质去矿后制备的生物炭碳保留率没有显著性提高, 但生物炭碳更趋于有序化排列, 且稳定性有明显增强。
3 结论生物质残体中含有一定量的内源矿物, 其对生物质热解制备生物炭的过程有催化作用。在本研究选取的花生壳和牛粪中, 内源矿物能够将碳骨架的主体分解温度从250~400 ℃降低到200~350 ℃; 其中存在的主要矿物KCl和CaCl2表现出显著的催化效应。这种催化效应并未使热解过程中碳保留率发生显著变化, 可能是由于内源矿物含量不高, 其影响被热解温度 (500 ℃) 的影响所掩盖。生物质内源矿物的存在, 在热解时催化碳分解, 使得生物炭碳结构更无序化, 降低产物稳定性, 但对过程中碳保留率的影响, 取决于矿物含量以及制备条件。
| [1] | Ippolito J A, Laird D A, Busscher W J. Environmental benefits of biochar[J]. Journal of Environmental Quality, 2012, 41(4): 967–972. DOI:10.2134/jeq2012.0151 |
| [2] | Lehmann J. A handful of carbon[J]. Nature, 2007, 447(7141): 143–144. DOI:10.1038/447143a |
| [3] | Li F Y, Cao X D, Zhao L, et al. Effects of mineral additives on biochar formation:carbon retention, stability, and properties[J]. Environmental Science and Technology, 2014, 48(19): 11211–11217. DOI:10.1021/es501885n |
| [4] | Raveendran K, Ganesh A, Khilar K C. Influence of mineral matter on biomass pyrolysis characteristics[J]. Fuel, 1995, 74(12): 1812–1822. DOI:10.1016/0016-2361(95)80013-8 |
| [5] | Shi L, Yu S, Wang F C, et al. Pyrolytic characteristics of rice straw and its constituents catalyzed by internal alkali and alkali earth metals[J]. Fuel, 2012, 96: 586–594. DOI:10.1016/j.fuel.2012.01.013 |
| [6] | Burhenne L, Messmer J, Aicher T, et al. The effect of the biomass components lignin, cellulose and hemicellulose on TGA and fixed bed pyrolysis[J]. Journal of Analytical and Applied Pyrolysis, 2013, 101: 177–184. DOI:10.1016/j.jaap.2013.01.012 |
| [7] | Zhao L, Cao X D, Wang Q, et al. Mineral constituents profile of biochar derived from diversified waste biomasses:Implications for agricultural applications[J]. Journal of Environmental Quality, 2013, 42(2): 545–552. DOI:10.2134/jeq2012.0232 |
| [8] | Das P, Ganesh A, Wangikar P. Influence of pretreatment for deashing of sugarcane bagasse on pyrolysis products[J]. Biomass and Bioenergy, 2004, 27(5): 445–457. DOI:10.1016/j.biombioe.2004.04.002 |
| [9] | Jiang L, Hu S, Sun L, et al. Influence of different demineralization treatments on physicochemical structure and thermal degradation of biomass[J]. Bioresource Technology, 2013, 146: 254–260. DOI:10.1016/j.biortech.2013.07.063 |
| [10] | Williams P T, Horne P A. The role of metal salts in the pyrolysis of biomass[J]. Renewable Energy, 1994, 4(1): 1–13. DOI:10.1016/0960-1481(94)90058-2 |
| [11] | Mourant D, Wang Z, He M, et al. Mallee wood fast pyrolysis:effects of alkali and alkaline earth metallic species on the yield and composition of bio-oil[J]. Fuel, 2011, 90(9): 2915–2922. DOI:10.1016/j.fuel.2011.04.033 |
| [12] | Stephanidis S, Nitsos C, Kalogiannis K, et al. Catalytic upgrading of lignocellulosic biomass pyrolysis vapours:Effect of hydrothermal pre-treatment of biomass[J]. Catalysis Today, 2011, 167(1): 37–45. DOI:10.1016/j.cattod.2010.12.049 |
| [13] | Patwardhan P R, Satrio J A, Brown R C, et al. Influence of inorganic salts on the primary pyrolysis products of cellulose[J]. Bioresource Technology, 2010, 101(12): 4646–4655. DOI:10.1016/j.biortech.2010.01.112 |
| [14] | Varhegyi G, Antal Jr M J, Szekely T, et al. Simultaneous thermogravimetric-mass spectrometric studies of the thermal decomposition of biopolymers. 1. Avicel cellulose in the presence and absence of catalysts[J]. Energy and Fuels, 1988, 2(3): 267–272. DOI:10.1021/ef00009a007 |
| [15] | Hu S, Jiang L, Wang Y, et al. Effects of inherent alkali and alkaline earth metallic species on biomass pyrolysis at different temperatures[J]. Bioresource Technology, 2015, 192: 23–30. DOI:10.1016/j.biortech.2015.05.042 |
| [16] | 袁振宏, 吴创之, 马隆龙. 生物质能利用原理与技术[M]. 北京: 化学工业出版社, 2005. YUAN Zhen-hong, WU Chuang-zhi, MA Long-long. Principles and technologies of bioenergy utilization[M]. Beijing: Chemical Industry Press, 2005. |
| [17] | 翟秀静, 刘奎仁, 韩庆. 新能源技术[M]. 北京: 化学工业出版社, 2010. ZHAI Xiu-jing, LIU Kui-ren, HAN Qing. New energy technology[M]. Beijing: Chemical Industry Press, 2010. |
| [18] | 王贤华, 陈汉平, 王静, 等. 无机矿物质盐对生物质热解特性的影响[J]. 燃料化学学报, 2008, 36(6): 679–683. WANG Xian-hua, CHEN Han-ping, WANG Jing, et al. Influence of mineral matters on biomass pyrolysis characteristics[J]. Journal of Fuel Chemistry and Technology, 2008, 36(6): 679–683. |
| [19] | Jensen A, Dam-Johansen K, Wójtowicz M A, et al. TG-FTIR study of the influence of potassium chloride on wheat straw pyrolysis[J]. Energy and Fuels, 1998, 12(5): 929–938. DOI:10.1021/ef980008i |
| [20] | Müller-Hagedorn M, Bockhorn H, Krebs L, et al. A comparative kinetic study on the pyrolysis of three different wood species[J]. Journal of Analytical and Applied Pyrolysis, 2003, 68: 231–249. |
| [21] | Nowakowski D J, Jones J M, Brydson R M D, et al. Potassium catalysis in the pyrolysis behaviour of short rotation willow coppice[J]. Fuel, 2007, 86(15): 2389–2402. DOI:10.1016/j.fuel.2007.01.026 |
| [22] | Yang C Y, Lu X S, Lin W G, et al. TG-FTIR study on corn straw pyrolysis-influence of minerals[J]. Chemical Research in Chinese Universities, 2006, 22(4): 524–532. DOI:10.1016/S1005-9040(06)60155-4 |
| [23] | Wornat M J, Nelson P F. Effects of ion-exchanged calcium on brown coal tar composition as determined by Fourier transform infrared spectroscopy[J]. Energy and Fuels, 1992, 6(2): 136–142. DOI:10.1021/ef00032a004 |
| [24] | Beaumont O. Flash pyrolysis products from beech wood[J]. Wood and Fiber Science, 2007, 17(2): 228–239. |
| [25] | Hawley M C, Boyd M, Anderson C, et al. Gasification of wood char and effects of intraparticle transport[J]. Fuel, 1983, 62(2): 213–216. DOI:10.1016/0016-2361(83)90201-6 |
| [26] | Takarada T, Tamai Y, Tomita A. Effectiveness of K2CO3 and Ni as catalysts in steam gasification[J]. Fuel, 1986, 65(5): 679–683. DOI:10.1016/0016-2361(86)90364-9 |
| [27] | Yang F, Zhao L, Gao B, et al. The interfacial behavior between biochar and soil minerals and its effect on biochar stability[J]. Environmental Science and Technology, 2016, 50(5): 2264–2271. DOI:10.1021/acs.est.5b03656 |
| [28] | 王定美, 王跃强, 袁浩然, 等. 水热炭化制备污泥生物炭的碳固定[J]. 化工学报, 2013, 64(7): 2625–2632. WANG Ding-mei, WANG Yue-qiang, YUAN Hao-ran, et al. Carbon fixation of sludge biochar by hydrothermal carbonization[J]. CIESC Journal, 2013, 64(7): 2625–2632. |
 2017, Vol. 36
2017, Vol. 36