文章信息
- 杨惠子, 陈明龙, 周怡然, 李璇, 穆清, 王丽娜, 王贵鑫, 张园
- YANG Hui-zi, CHEN Ming-long, ZHOU Yi-ran, LI Xuan, MU Qing, WANG Li-na, WANG Gui-xin, ZHANG Yuan
- 有机质添加对铅污染农田土生态功能稳定性的影响研究
- Effects of organic matter on the ecological stability of lead contaminated agricultural soil
- 农业环境科学学报, 2017, 36(4): 694-701
- Journal of Agro-Environment Science, 2017, 36(4): 694-701
- http://dx.doi.org/10.11654/jaes.2016-1383
文章历史
- 收稿日期: 2016-10-30
土壤是人类赖以生存的主要资源之一, 作为全球生态系统的一部分, 土壤生态系统的稳定性对人类可持续发展具有重要意义[1]。然而, 2014年《全国土壤污染状况调查公报》[2]显示, 全国耕地土壤重金属点位超标率高达12.1%。因重金属在土壤中存在生物累积效应, 可通过水、植物等介质影响人类健康, 重金属污染已成为国际上严峻的环境问题之一[3-6]。铅作为一种毒性较高的重金属, 其对土壤的危害随着铅矿开采、冶炼以及制造业的快速发展而日益加剧[7]。
目前, 铅污染防治的科技支撑还较薄弱, 主要体现在研究广度和深度不够[8]。因为研究土壤微生物群落是通过微生物分离方法进行的, 不仅工作量大、研究成本高, 而且许多微生物是无法人工分离培养的[9]。所以本研究在宏观上以生态功能稳定性为切入点, 来评价土壤的质量和健康水平。生态功能稳定性可以利用抵抗力和恢复力两个指标进行度量[10], 并预测重金属胁迫下土壤生态功能的恢复速率与程度, 其大小可由土壤微生物活性、多样性及均匀性共同衡量, 故本研究引入存在于活体微生物细胞膜的磷脂脂肪酸 (Phospholipid Fatty Acid, PLFA), 作为微生物的生物标记 (Biomarker)[11], 用于鉴定土壤微生物种类和识别微生物类群[12], 从而实现对微生物多样性及均匀性的量化。通过对受到铅污染并作相关处理的土壤中微生物群落的组成与活力的研究, 体现土壤质量以及微生物群落结构与土壤质量的相关性[13]。而MIDI Sherlock微生物自动鉴定系统在速度与鉴定数量上占据明显的优势, 是一种能够快速、准确鉴定微生物的方法[14]。
本实验采用磷脂脂肪酸分析和MIDI Sherlock微生物鉴定系统结合, 研究受铅胁迫的农田土壤的微生物群落结构及土壤微生物和土壤稳定性的相关影响。通过测定土壤微生物的呼吸强度来衡量土壤功能的抵抗力、恢复力及稳定性, 借助PLFA生态标记的生态学参数, 从微生物群落结构多样性、均匀性及优势度方面, 阐明土壤微生物对重金属胁迫的敏感程度及其群落结果的动态响应。旨在探讨土壤有机质含量对铅污染土壤生态系统功能恢复的影响, 为土壤生态功能的修复提供参考。
1 材料与方法 1.1 实验方案及样品采集本实验所用土壤采集于江苏省苏州市郊区农田土 (31°15´4.39″N, 120°34´28.74″E)。随机选择彼此相距10 m的3个地块 (范围0.5 m×0.5 m) 采集土壤, 除去表层1 cm左右的浮土, 采集表层1~20 cm处的洁净土壤样品, 收集混合后进行风干并研磨过2 mm筛网备用。
1.2 底物诱导呼吸实验将预处理过的土壤含水率调节至15%, 分别进行处理A和处理B (表 1)。处理A:按土壤与芦苇叶 (C/N=14.96) 干重比3:1混合, 共800 g, 添加不同浓度的PbCl2溶液 (Pb的等效浓度依次为50、100、200 mg·kg-1混样干重), 处理编号分别为A1、A2、A3。处理B:纯土壤800 g, 不添加芦苇叶, 向其中添加与处理A相同浓度梯度的PbCl2溶液, 编号分别为B1、B2、B3。设置空白组 (Blank):纯土壤800 g, 不添加芦苇及PbCl2溶液。处理A、B和Blank的土壤含水率均调节为18%。以土壤环境质量标准GB 15618-1995(铅的自然背景值为Pb ≤ 35 mg·kg-1) 作为铅浓度添加的基本原则。
将每种处理后的土壤分别混合均匀, 分装于塑料瓶中28℃下培养, 培养期间土壤含水率保持在18%。定义加入铅胁迫当天为第0 d, 在加入铅胁迫后第1、7、15、30、60 d进行底物诱导呼吸速率实验 (SIR) 的测定[15], 各处理组分别设置3个平行重复, 每次实验设置1组空白对照。
通过计算加Pb胁迫处理和无胁迫处理的相关底物诱导呼吸速率f (t), 量化土壤微生物对扰动的抵抗力f (1)、恢复力f (60) 和功能稳定性Sb (图 1), 从而确定受Pb胁迫后的抵抗力和恢复力。定义Sb为弹性曲线面积。f (t) 和Sb的计算公式见公式 (1) 和公式 (2)[16]。

|
| 图 1 土壤功能稳定性计算分析 Figure 1 Analysis of soil stability |
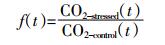 (1)
(1) 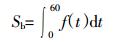 (2)
(2) 式中:f (t) 为第t d试验组CO2与对照组CO2的浓度比值; CO2-stressed (t) 为试验组第t d的CO2的浓度; CO2-control (t) 为对照组第t d的CO2的浓度; Sb为土壤稳定性。
1.3 PLFA的提取与样品检测称取4 g (干重) 土壤, 置于离心管中, 剩余土样于烘箱中烘24 h, 测得含水率。向离心管中加入1:1.2:2.4的磷酸缓冲液、三氯甲烷、甲醇, 于暗处剧烈振荡2 h, 离心; 转移上清液并加入磷酸缓冲液和三氯甲烷, 剧烈振荡, 加入11.5 mL提取液于剩余土壤中, 摇动, 离心, 转移上清液, 摇动, 封口静置过夜。液体分为两相, 将试管中下层溶液放入大试管中, 30℃水浴加热后氮吹至1 mL。调解萃取小柱, 将浓缩液及冲洗液加入萃取小柱, 向萃取小柱加入1:2的三氯甲烷、丙酮, 弃去, 向萃取小柱中加入5 mL甲醇并收集淋洗液, 32℃水浴, 氮吹浓缩, 加入1:1甲醇:甲苯和氢氧化钾溶液, 摇匀, 37℃水浴加热, 加入0.15:1:1的1 mol·L-1醋酸溶液、己烷、超纯水, 振荡, 将上层溶液移入小瓶氮吹至干, 下层加己烷, 振荡。用移液枪加己烷于干燥样品中, 摇动, 检测前转入色谱仪专用的内衬管。此后2~3 d在-20℃保存, 超过3 d在-80℃保存[17]。
PLFA鉴定采用美国MIDI公司 (MIDI, Newark, Delaware, 美国) 开发的Sherlock微生物鉴定系统 (Sherlock MIS 6.2)[18]。此系统备有图谱识别软件和迄今为止微生物鉴定系统中最大的数据库资源, 包括嗜氧菌1100余种, 厌氧菌800余种, 酵母菌和放线菌300余种, 共计超过2200种[19]。
1.4 数据分析 1.4.1 PLFA生物标记生态学参数本研究将PLFA生物标记作为数量测度, 引入生态学多样性测度Shannon-Wiener指数 (H)[20]、丰富度 (S)[20-21]和Pielou均匀度指数 (J)[20-21]、Simpson优势度指数 (D)[21]等方法, 计算微生物PLFA生物标记生态学参数, 通过相关系数, 分析各参数的相关性。重要生态学参数的计算方法如下:
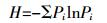 (3)
(3) 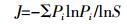 (4)
(4) 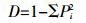 (5)
(5) 式中:Pi指第i种特征磷脂脂肪酸占实验中总的特征磷脂脂肪酸个数的比例, Pi=Ni/N, Ni为处理i的特征磷脂脂肪酸个数, N为该实验中总特征磷脂脂肪酸个数; S为微生物群落中PLFA生物标记出现的频次, 即丰富度。
1.4.2 数据处理方法所有测定结果均为3次重复的平均值。用SPSS 22.0进行PLFA的主成分分析、相关性分析、分层聚类分析, 为保证结果可靠性, 减少误差, 仅分析含量高于0.1%的脂肪酸[22]。所用图表统一采用Origin 8.0处理。
2 结果与讨论 2.1 底物诱导呼吸底物诱导呼吸作用是一种广泛用于测定土壤微生物量的生理方法, 并能在一定程度上揭示环境胁迫情况, 与土壤环境质量密切相关[23]。当土壤中加入易降解底物或基质 (例如葡萄糖) 时, 呼吸速率立即提高, 提高量与微生物生物量的大小成正比[24]。据此通过测定加入底物后短时间内呼吸产生的CO2量, 来估测土壤中微生物群落多样性[25-26]。由图 2可以看出, 无论Pb浓度高低, 在第1、7、15 d处理A、B中底物诱导呼吸强度均为先增强后减弱, 且呼吸强度均在第7 d达到峰值, 但处理A中底物诱导呼吸强度高于处理B中的呼吸强度, 说明微生物生物量在15 d中呈现先增长后降低的趋势, 但处理A中的微生物生物量高于处理B。在第30 d后, 处理A中底物诱导呼吸大幅度增强, 但处理B中底物诱导呼吸增强缓慢并趋于平缓, 在有机质添加的情况下, 处理A中的土壤微生物量增加, 土壤的生物多样性提高, 而处理B的生物多样性基本无显著变化。因此, 对于处理A, 添加有机质后会将土壤中的铅离子固定, 从而对土壤重金属的生物有效性有一定的抑制效果[27], 对于微生物的生长繁殖有较好的促进作用, 促使微生物生物量增加, 增强土壤的恢复能力。而对于处理B, 由于缺少有机质对铅的吸附固定作用, 增强了铅对微生物的毒性作用, 抑制了微生物的生命活动, 因而不利于微生物对铅离子的吸附和转化, 使土壤的恢复能力下降。

|
| 图 2 不同处理方式下土壤二氧化碳呼吸量与时间的关系 Figure 2 Respiration of CO2 during incubation time under different treatments |
通过对土壤微生物呼吸强度的数据结果采用公式 (1) 进行处理转换, 计算得到各组抵抗力f (1) 和恢复力f (60), 并由公式 (2) 计算出土壤的稳定性 (Sb), 如表 2所示。处理B中土壤的抵抗力随着土壤铅含量的增加而降低, 而处理A中土壤的抵抗力随着土壤铅含量的增加先升高后降低。这是由于重金属铅会与土壤中有机质发生吸附作用, 使铅的生物毒性减弱[28], 故在处理A中有机质的加入对重金属铅的毒性起到了一定的缓冲作用。因此, 有机质含量高的土壤可以抵抗更高浓度的铅污染。处理A、B中土壤的恢复力均随着土壤中铅浓度的增加先升高后降低。这是由于一定浓度的铅胁迫可以刺激土壤中的微生物通过加快新陈代谢来抵御这种逆境, 从而增强了微生物的呼吸作用[29], 反映在恢复力上则是使其升高; 而当铅污染的程度过重时, 土壤微生物的活性则会遭到抑制[28], 故土壤恢复力下降。处理A、B中土壤稳定性均随着土壤中铅离子含量的升高而降低。但由于有机质表面富含的官能团对重金属元素有较强的富集和配位能力, 能使土壤中的重金属形态由交换态和溶液态转变为碳酸盐结合态、氧化物结合态和残渣态, 从而起到固化 (沉淀) 或钝化作用[30], 故与处理B相比, 处理A中土壤的恢复力及稳定性高。

|
各菌落占微生物总量的百分比见图 3。从中可以发现, Blank土壤中主要微生物的总体分布情况是:革兰氏阴性菌>革兰氏阳性菌>真菌。在处理A中:A1中革兰氏阴性菌>真菌>革兰氏阳性菌, A2中革兰氏阴性菌占比最高且真菌的占比与革兰氏阳性菌相近, A3中革兰氏阴性菌>革兰氏阳性菌>真菌。而在处理B中:革兰氏阳性菌>革兰氏阴性菌>真菌。除此之外, A1、A2、A3中的革兰氏阳性菌所占比重呈递增趋势; B1、B2、B3中的各菌落含量无明显差异。处理B中的优势菌种是革兰氏阳性菌, 占微生物量的百分比最高 (约为62%), 而添加有机质的处理A中革兰氏阴性菌与真菌占微生物量的百分比明显增加, 其对应的稳定性也较高, 具体的相关性分析见2.6节。

|
| 图 3 不同处理方式下菌种分类累加值所占百分比 Figure 3 Ratio of accumulated content of microbial communities under different treatments |
不同处理下土壤微生物群落PLFA生物标记共检测到89个, 根据公式 (3)~公式 (5), 计算得到土壤微生物群落的丰富度 (S)、多样性 (H)、均匀度 (J) 及优势度 (D), 统计结果见表 3。在处理A中, 革兰氏阳性菌的优势度高, 各微生物群落的丰富度高; 而在处理B中, 革兰氏阴性菌和真菌的优势度高, 各微生物群落的丰富度较高。与Blank对比, 处理A、B中微生物群落的多样性和均匀度均有所下降, 这是由于重金属铅的加入使微生物代谢活性滞后, 对土壤养分利用低所导致[31]; 但丰富度均有所增加且处理A高于处理B, 说明添加有机质有利于增加土壤微生物的丰富度, 并能对土壤微生物多样性的减少起到阻碍作用, 进而提高土壤的抵抗力、恢复力和稳定性; 对均匀度的影响则不大。
以各PLFA生物标记参数值为指标, 以各PLFA为样本, 构建分析矩阵, 并以欧氏距离为尺度, 用最小距离法进行系统聚类, 结果见图 4。结果表明, 可将其分成八大类, 各类PLFA生物标记相对生物量大小顺序为:Ⅰ类>Ⅱ类>Ⅲ类>Ⅳ类>Ⅴ类>Ⅵ类>Ⅶ类>Ⅷ类。

|
| 图 4 微生物群落PLFA生物标记各生态学参数聚类分析 Figure 4 Cluster analysis of PLFA ecological parameters value of microbial community |
第Ⅰ类:PLFA生物标记含量高, 在样方中分布的频次较高, 多样性指数高, 属于该类的PLFA为16:0, 表征假单胞菌[32]。
第Ⅱ类:PLFA生物量高, 在样方中分布的频次较高, 多样性较高, 属于该类的PLFA为18:1 ω8c, 代表着主导革兰氏阴性菌的属性, 生物量含量较高; 以及18:2 ω6c, 代表着主导真菌的属性。
第Ⅲ类:PLFA生物量高, 在样方中分布的频次较高, 多样性中等偏低, 属于该类的PLFA为16:1 ω3c, 代表着主导革兰氏阴性菌的属性, 生物量含量较高。
第Ⅳ类:PLFA含量中等, 在样方中分布的频次较高, 多样性中等或较高, 属于该类的PLFA有20:0 10-methyl, 代表着主导放线菌的属性; 以及18:1 ω9c, 代表着主导细菌的属性。
第Ⅴ类:PLFA生物标记含量中等, 在样方中分布的频次较高, 多样性中等偏高, 属于该类的PLFA有16:0 10-methyl, 代表着主导放线菌的属性; 以及15:0 iso, 代表着主导革兰氏阳性菌的属性。
第Ⅵ类:PLFA生物标记含量中等, 在样方中分布的频次中等偏低, 多样性中等偏低, 属于该类的PLFA有18:1 ω7c DMA, 代表着主导厌氧菌的属性; 18:1 ω7c和19:0 cyclo ω9c, 代表着主导革兰氏阴性菌的属性。
第Ⅶ类:PLFA生物标记含量较低, 在样方中分布的频次中等偏低, 多样性中等偏低, 属于该类的PLFA有19:0 cyclo ω7c, 代表着主导革兰氏阴性菌的属性; 16:3 ω6c和18:0 cyclo ω6c, 分别代表着主导原生动植物和细菌的属性。
第Ⅷ类:其余PLFA全部归为第Ⅷ类, 其特点为PLFA生物标记含量低, 在样方中分布的频次低, 多样性低。
分层聚类结果显示, 第Ⅰ、Ⅱ、Ⅲ类PLFA生物标记在处理A中的含量明显高于处理B, 生物标记含量较高, 多表征革兰氏阴性菌和真菌; 第Ⅳ、Ⅴ、Ⅵ类PLFA生物标记属于过渡型生物标记, 特点是随时间的变化其含量在不同处理方式下的波动较大, 生物标记含量中等; 第Ⅶ类PLFA生物标记仅在处理B中出现, 生物标记含量低, 多表征原生动物和细菌; 第Ⅷ类PLFA生物标记在各组处理中的分布较为分散, 无显著规律性。这说明添加有机质可显著促进第Ⅰ、Ⅱ、Ⅲ类PLFA所表征菌群的生长繁殖, 借助此类菌群对土壤铅污染的净化作用, 达到改善土壤环境质量, 提高土壤的抵抗力、恢复力及稳定性的目的。
2.6 不同类型菌群与土壤理化性质的相关性分析实验测得未添加铅污染的土壤中铅的含量为5.58 mg·kg-1, 有机质含量的占比为4.05%, 可溶性有机碳 (DOC) 的含量为23.49 g·kg-1。所有处理中不同类型菌落含量占比与土壤理化性质的Pearson相关系数见表 4。从表中可以看出:
(1) 不同类型菌落与土壤中有机质的含量、恢复力和稳定性呈显著相关关系, 而与土壤铅含量、抵抗力无显著相关性 (P<0.05)。
(2) 革兰氏阳性菌与革兰氏阴性菌含量与土壤稳定性高度线性相关 (P<0.01)。革兰氏阴性菌细胞壁表面的羧基与革兰氏阳性菌细胞壁表面的羧基和糖醛酸上的磷酸基对重金属具有富集作用[33], 有利于富集转化铅离子, 因此与土壤稳定性具有显著相关性。
(3) 革兰氏阴性菌、真菌与土壤中有机质的含量、恢复力和稳定性呈显著正相关。这与2.3节中稳定性高的组别革兰氏阴性菌与真菌占微生物量的百分比更高相对应。研究表明, 霉菌、酵母菌等真菌有较好的重金属吸附能力, 原因是真菌具有菌丝体粗大、吸附后易脱离以及吸附量大等特点[34]。在2.5节聚类分析Ⅰ类中生物标记含量最高的假单胞菌为革兰氏阴性细菌, 而革兰氏阴性菌的富集作用与真菌的吸附作用是其与土壤恢复力、稳定性呈显著正相关的原因之一。
3 结论(1) 土壤中的微生物普遍对低浓度的铅污染表现出一定的抵抗性, 在较高浓度的铅污染下, 革兰氏阳性菌表现出了较好的抵抗性, 而真菌含量与土壤微生物的丰富度都显著降低。
(2) 有机质含量高且稳定性高的土壤中16:0、18:1 ω8c、18:2 ω6c和16:1 ω3c等PLFA的含量较高, 而19:0 cyclo ω7c、16:3 ω6c和18:0 cyclo ω6c等PLFA仅在铅污染较为严重的土壤中出现。
(3) 有机质的添加使微生物群落中革兰氏阴性菌和真菌比例明显增加, 革兰氏阴性菌对重金属的富集能力与真菌对重金属的吸附能力减弱了土壤中铅污染的影响, 从而使土壤的稳定性提高。
上述土壤微生物生物量、微生物群落结构变化的过程、耐性和机理, 特别是对特征功能基因的鉴定和筛选及其在土壤污染修复过程中的作用机制, 今后需要进一步加强研究, 以便为重金属污染土壤的修复提供科学依据。
致谢 感谢南京师范大学邓欢老师及其团队对本项目实验的技术支持。| [1] | 李小方, 邓欢, 黄益宗, 等. 土壤生态系统稳定性研究进展[J]. 生态学报, 2009, 29(12): 6712–6722. LI Xiao-fang, DENG Huan, HUANG Yi-zong, et al. Resistance and resilience of soil ecosystem:A review[J]. Acta Ecologica Sinica, 2009, 29(12): 6712–6722. DOI:10.3321/j.issn:1000-0933.2009.12.048 |
| [2] | 环境保护部和国土资源部. 全国土壤污染状况调查公报[R]. 北京, 2014. Ministry of Environmental Protection and Ministry of Land and Resources.The soil pollution condition investigation communique[R].Beijing, 2014. |
| [3] | Olawoyin R, Oyewole S A, Grayson R L. Potential risk effect from elevated levels of soil heavy metals on human health in the Niger Delta[J]. Ecotoxicology and Environmental Safety, 2012, 85(3): 120–130. |
| [4] | 高彦鑫, 冯金国, 唐磊, 等. 密云水库上游金属矿区土壤中重金属形态分布及风险评价[J]. 环境科学, 2012, 33(5): 1707–1717. GAO Yan-xin, FENG Jin-guo, TANG Lei, et al. Fraction distribution and risk assessment of heavy metals in iron and gold mine soil of Miyun reservoir upstream[J]. Environmental Science, 2012, 33(5): 1707–1717. |
| [5] | 孙清斌, 尹春芹, 邓金峰, 等. 大冶矿区土壤-蔬菜重金属污染特征及健康风险评价[J]. 环境化学, 2013, 32(4): 671–677. SUN Qing-bin, YIN Chun-qin, DENG Jin-feng, et al. Characteristics of soil-vegetable pollution of heavy metals and health risk assessment in Daye mining area[J]. Environmental Chemistry, 2013, 32(4): 671–677. DOI:10.7524/j.issn.0254-6108.2013.04.020 |
| [6] | 魏本杰, 文新宇, 朱生翠, 等. 湘江流域某冶炼厂周边土壤重金属含量检测及污染评价[J]. 中南大学学报 (自然科学版), 2013, 44(12): 5180–5187. WEI Ben-jie, WEN Xin-yu, ZHU Sheng-cui, et al. Detection and evaluation of soil contamination by heavy metals around one of smelters beside Xiangjiang River[J]. Journal of Central South University (Science and Technology), 2013, 44(12): 5180–5187. |
| [7] | 熊亚. 环境铅接触对健康的影响[J]. 广东微量元素科学, 2002, 9(9): 49–53. XIONG Ya. Effect of environmental Pb exposure on health of human body[J]. Guangdong Trace Elements Science, 2002, 9(9): 49–53. |
| [8] | 刘舒. 我国铅污染防治工作进展存在的问题及对策[J]. 资源再生, 2014(2): 65–68. LIU Shu. Lead pollution prevention and control work progress and exiting problems in China and the counter measures[J]. Resource Recycling, 2014(2): 65–68. |
| [9] | 张洪勋, 王晓谊, 齐鸿雁. 微生物生态学研究方法进展[J]. 生态学报, 2003, 23(5): 988–995. ZHANG Hong-xun, WANG Xiao-yi, QI Hong-yan. Development in research methods of microbial ecology[J]. Acta Ecologica Sinica, 2003, 23(5): 988–995. |
| [10] | McCann K S. The diversity-stability debate[J]. Nature, 2000, 405(6788): 228–233. |
| [11] | 王曙光, 侯彦林. 磷脂脂肪酸方法在土壤微生物分析中的应用[J]. 微生物学通报, 2004, 31(1): 114–117. WANG Shu-guang, HOU Yan-lin. Application of phospholipids fatty acid method in soil microbial analysis[J]. Microbiology China, 2004, 31(1): 114–117. |
| [12] | 白震, 何红波, 张威, 等. 磷脂脂肪酸技术及其在土壤微生物研究中的应用[J]. 生态学报, 2006, 26(7): 2387–2394. BAI Zhen, HE Hong-bo, ZHANG Wei, et al. PLFAs technique and its application in the study of soil microbiology[J]. Acta Ecologica Sinica, 2006, 26(7): 2387–2394. |
| [13] | Giller K E, Witter E, McGrath S P. Toxicity of heavy metals to microorganisms and microbial processes in agricultural soils:A review[J]. Soil Biology & Biochemistry, 1998, 30(10811): 1389–1414. |
| [14] | 李冬梅, 施雪华, 孙丽欣, 等. 磷脂脂肪酸谱图分析方法及其在环境微生物学领域的应用[J]. 科技导报, 2012, 30(2): 65–69. LI Dong-mei, SHI Xue-hua, SUN Li-xin, et al. Applications of Phospholipid Fatty Acid (PLFA) analysis in environmental microbial study[J]. Science & Technology Review, 2012, 30(2): 65–69. |
| [15] | 陈欣瑶, 陈楸健, 李敏, 等. 农业土壤生态功能稳定性的影响因素研究及其相关性分析[J]. 山东农业大学学报 (自然科学报), 2015, 46(6): 838–846. CHEN Xin-yao, CHEN Qiu-jian, LI Min, et al. Influence factors of ecological function stability of soil and their correlation[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2015, 46(6): 838–846. |
| [16] | Zhang B, Deng H, Wang H L, et al. Does microbial habitat or community structure drive the functional stability of microbes to stresses following re-vegetation of a severely degraded soil?[J]. Soil Biology and Biochemistry, 2010, 42(5): 850–859. DOI:10.1016/j.soilbio.2010.02.004 |
| [17] | 颜慧, 蔡祖聪, 钟文辉. 磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J]. 土壤学报, 2006, 43(5): 851–859. YAN Hui, CAI Zu-cong, ZHONG Wen-hui. The application of phospholipid fatty acid analysis method in the research of soil microbial diversity[J]. Acta Pedologica Sinica, 2006, 43(5): 851–859. |
| [18] | Shah H N.The genus bacteroides and related taxa[M]//The Prokaryotes.Springer New York, 1992:3593-3607. |
| [19] | 黄朱梁, 裘迪红. MIDI Sherlock微生物自动鉴定系统鉴定方法的建立:以贻贝中分离的蜡样芽胞杆菌为例[J]. 宁波大学学报, 2011, 24(2): 8–13. HUANG Zhu-liang, QIU Di-hong. Identification of Bacillus cereus separated from mussels using MIDI Sherlock microorganism Auto Identification System[J]. Journal of Ningbo University, 2011, 24(2): 8–13. |
| [20] | 戈峰. 现代生态学[M]. 北京: 科学出版社, 2002: 252-254. GE Feng. Modern ecology[M]. Beijing: Science Publishing House, 2002: 252-254. |
| [21] | 孙海新, 刘训理. 茶树根际微生物研究[J]. 生态学报, 2004, 24(7): 1353–1357. SUN Hai-xin, LIU Xun-li. Microbes studies of tea rhizosphere[J]. Acta Ecological Sinica, 2004, 24(7): 1353–1357. |
| [22] | 卜洪震, 王丽宏, 肖小平, 等. 双季稻区稻田不同土壤类型的微生物群落多样性分析[J]. 作物学报, 2010, 36(5): 826–832. BU Hong-zhen, WANG Li-hong, XIAO Xiao-ping, et al. Diversity of microbial community of paddy soil types in Double-Rice cropping System[J]. Acta Agronomica Sinica, 2010, 36(5): 826–832. |
| [23] | 张彦, 张惠文, 苏振成, 等. 长期重金属胁迫对农田土壤微生物生物量、活性和种群的影响[J]. 应用生态学报, 2007, 18(7): 1491–1497. ZHANG Yan, ZHANG Hui-wen, SU Zhen-cheng, et al. Effects of long-term heavy metals stress on farm land soil microbial population, biomass and activity[J]. Institute of Applied Ecology, 2007, 18(7): 1491–1497. |
| [24] | JohnStenström, BoStenberg, MatsJohansson, 等. 底物诱导呼吸作用 (SIR) 的动力学:理论[J]. AMBIO-人类环境杂志, 1998, 27(1): 34–38. John S, Bo S, Mats J, et al. The dynamics of the substrate induced respiration (SIR):Theory[J]. Ambio-A Journal of the Human Environment Ambio, 1998, 27(1): 34–38. |
| [25] | Kourtev P, Ehrenfeld J, Häggblom M. Exotic plant species alter the microbial community structure and function in the soil[J]. Ecology, 2002, 83(11): 3152–3166. DOI:10.1890/0012-9658(2002)083[3152:EPSATM]2.0.CO;2 |
| [26] | Kourtev P, Ehrenfeld J, Häggblom M. Experimental analysis of the effect of exotic and native plant species on the structure and function of soil microbial communities[J]. Soil Biology and Biochemistry, 2003, 35(7): 895–905. DOI:10.1016/S0038-0717(03)00120-2 |
| [27] | 梅娟, 谢华, 阎秀兰, 等. 铅污染及酸化的农田改良与利用研究[J]. 农业环境科学学报, 2014, 33(1): 75–80. MEI Juan, XIE Hua, YAN Xiu-lan, et al. Amelioration and reutilization of lead contaminated and acidified farmland[J]. Journal of Agro-environment Science, 2014, 33(1): 75–80. DOI:10.11654/jaes.2014.01.009 |
| [28] | 朱红梅, 李国华, 崔静, 等. 重金属铅对土壤微生物活性的影响[J]. 南京农业大学学报, 2011, 34(6): 125–128. ZHU Hong-mei, LI Guo-hua, CUI Jing, et al. Effect of lead on microbial activities in vegetable soil[J]. Journal of Nanjing Agricultural University, 2011, 34(6): 125–128. |
| [29] | 杨娟娟. 铅污染土壤中施用有机肥对土壤肥力及小白菜的影响[D]. 贵阳: 贵州大学, 2009: 21-43. YANG Juan-juan.The effect of soil fertility and pakchoi in lead polluted soil by adding organic fertilizer[D].Guiyang:Guizhou University, 2009:21-43. |
| [30] | 毛建华, 赵伯居. 促进生物炭工业生产与土地利用推动21世纪农业“黑色革命”:生物炭在土壤改良与修复中的作用[J]. 天津农业科学, 2016, 22(1): 1–4. MAO Jian-hua, ZHAO Bo-ju. Facilitating industrialized production and utilization of biochar, and promoting 21th agricultural revolution:Roles of biochar in land improvement and restoration[J]. Tianjin Institute of Agricultural Resources and Environment, 2016, 22(1): 1–4. |
| [31] | 康敏明, 陈红跃, 陈传国, 等. 重金属污染下台湾相思和尾叶桉根区土壤微生物群落多样性[J]. 华东师范大学学报 (自然科学版), 2009(2): 50–60. KANG Min-ming, CHEN Hong-yue, CHEN Chuan-guo, et al. Microbial diversity in root zone soils of Acacia confuse and Eucalyptus urophylla polluted by heavy metals[J]. Journal of East China Normal University (Na tural Science), 2009(2): 50–60. |
| [32] | 滕应, 骆永明, 李振高. 污染土壤的微生物多样性研究[J]. 土壤学报, 2006, 43(6): 1018–1026. TENG Ying, LUO Yong-ming, LI Zhen-gao. Microbial diversity in polluted soils:An overview[J]. Acta Pedologica Sinica, 2006, 43(6): 1018–1026. DOI:10.11766/trxb200512080620 |
| [33] | 方临川. 重金属与细菌-土壤活性颗粒微界面互作的分子机制[D]. 武汉: 华中农业大学, 2011. FANG Lin-chuan.The molecular mechanisms of heavy metals interactions with the bacteria-soil active particles micro-interfaces[D].Wuhan:Huazhong Agricultural University, 2011. |
| [34] | 刘文钊. 几种大型真菌对重金属吸附特性的研究[D]. 长春: 吉林农业大学, 2011. LIU Wen-zhao.Research on heavy metal biosorption of some macrom-ycetes[D].Changchun:Jilin Agricultural University, 2011. |
 2017, Vol. 36
2017, Vol. 36