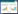文章信息
- 刘红梅, 张海芳, 皇甫超河, 李洁, 周广帆, 杨殿林
- LIU Hong-mei, ZHANG Hai-fang, HUANGFU Chao-he, LI Jie, ZHOU Guang-fan, YANG Dian-lin
- 长期氮添加对贝加尔针茅草原土壤微生物群落多样性的影响
- Effects of different long-term nitrogen addition on soil microbial diversity of Stipa baicalensis steppe in Inner Mongolia, China
- 农业环境科学学报, 2017, 36(4): 709-717
- Journal of Agro-Environment Science, 2017, 36(4): 709-717
- http://dx.doi.org/10.11654/jaes.2016-1267
文章历史
- 收稿日期: 2016-09-30
土壤微生物作为草地土壤生态系统中极为重要的组成部分, 参与土壤碳、氮的循环及土壤有机物的矿化过程, 对有机物的分解和养分的转化、供应起着主导作用, 是草地土壤质量变化的重要指标[1-2]。一些研究者认为, 土壤质量指标应当包括微生物生物量碳、氮以及矿化氮、土壤微生物熵等[3-5]。土壤温度、含水量和化学性质等生态因子可能影响土壤微生物生物量的大小[6], 土壤微生物群落组成的变化会导致土壤物质循环和养分利用的改变。因此, 研究草地土壤微生物及其功能多样性, 对合理利用土壤、防止地力衰退和改善生态环境具有重要意义。
氮素是陆地生态系统植物生长的重要限制因子, 氮的添加可能改变土壤底物养分, 从而影响到微生物群落多样性和活性[7], 最终影响到养分循环过程。Treseder[8]总结分析了82个野外实验, 认为在陆地生态系统中氮添加抑制土壤微生物生物量, 且施氮量越大, 负面作用越大。氮添加可引起植物群落地上部氮吸收量增加, 从而使植物群落组成发生变化, 进而造成植物凋落物组成相应改变, 使得土壤中来自于植物的碳源种类和数量发生改变[9]。另外, 氮添加会改变土壤微生物功能多样性和结构组成[1, 10]。为揭示氮添加对我国北方温带草原生态系统土壤微生物群落功能多样性的影响, 本研究以贝加尔针茅草原为对象, 运用Biolog生态板法研究了不同氮添加处理下贝加尔针茅草地土壤微生物群落功能多样性的变化规律及其与土壤理化性质的相关关系, 以期为该区合理施肥和科学管理提供依据, 从而促进天然草地的合理利用和退化草地的恢复。
1 材料与方法 1.1 研究区域概况研究区域位于大兴安岭西麓, 内蒙古自治区鄂温克自治旗伊敏苏木境内, 地理位置为北纬48°27´~48°35´, 东经119°35´~119°41´, 海拔高度为760~770 m, 地势平坦, 属于温带草甸草原区, 为半干旱大陆性季风气候, 年均气温-1.6℃, 年降水量328.7 mm, 年蒸发量1 478.8 mm, ≥ 0℃年积温2 567.5℃, 年均风速4 m·s-1, 无霜期113 d。土壤类型为暗栗钙土[11]。试验开始时土壤基础理化性质:土壤pH 7.07, 总有机碳27.92 g·kg-1, 全氮1.85 g·kg-1, 全磷0.45 g·kg-1。
植被类型为贝加尔针茅 (Stipa baicalensis) 草甸草原, 共有植物66种, 分属21科49属。其中, 贝加尔针茅为建群种, 羊草 (Leymus chinensis) 为优势种, 草地麻花头 (Serratulay amatsutanna)、线叶菊 (Filifolium sibicum)、扁蓿豆 (Melissitus ruthenica)、羽茅 (Achnatherum sibiricum)、日荫菅 (Carex pediformis)、裂叶蒿 (Artemisia tanacetifolia)、变蒿 (Artemisia commutata)、多茎野豌豆 (Vicia multicaulis)、祁州漏芦 (Rhaponticum uniflorum)、寸草苔 (Carex duriuscula)、肾叶唐松草 (Thaictrum petaloideum)、狭叶柴胡 (Bupleurum scorzonerifolium)、草地早熟禾 (Poa pratensis) 等为常见种或伴生种。
1.2 样地设置与样品采集试验开始于2010年6月, 在围栏样地内设置氮添加试验, 氮素添加处理设8个水平, 依次为0 kg N·hm-2(N0, 对照)、15 kg N·hm-2(N15)、30 kg N·hm-2(N30)、50 kg N·hm-2(N50)、100 kg N·hm-2(N100)、150 kg N·hm-2(N150)、200 kg N·hm-2(N200)、300 kg N·hm-2(N300), 每年分2次施入。第1次6月15日施氮50%, 第2次7月15日施氮50%, 氮素为NH4NO3。根据各处理的氮添加量, 将每个处理每次所需要施加的NH4NO3分别溶解在8 L水中 (全年增加的水量相当于新增降水1.0 mm), 水溶后均匀喷施到相应小区内。共8个小区, 4次重复, 小区面积8 m×8 m, 小区间设2 m隔离带, 重复间设5 m隔离带。
2015年8月10日在各个处理小区内按照S型取样法选取10个点, 去除表面植被, 取0~10 cm和10~20 cm土层土壤各自混匀, 去除根系和土壤入侵物, 采用“四分法”选取1 kg土壤, 将其分成两份:一份迅速装入无菌封口袋, 放在冰盒中带回实验室, 4℃低温保存, 用于测定土壤微生物量碳、氮和土壤微生物群落功能多样性; 另一份土样于室内自然风干, 用于土壤理化性质测定。
1.3 测定方法土壤总有机碳采用重铬酸钾外加热法, 土壤全氮用凯氏定氮法, 土壤全磷采用钼锑抗比色法, 土壤pH采用玻璃电极法 (土水比1:2.5), 土壤铵态氮和硝态氮含量采用氯化钾溶液提取-流动分析仪 (QC8000) 测定, 土壤速效磷采用碳酸氢钠提取-钼锑抗比色法[12]。
土壤微生物生物量碳、氮采用氯仿熏蒸-K2SO4提取法[13], 土壤微生物生物量碳换算系数为2.64, 土壤微生物生物量氮换算系数为1.85。
土壤微生物群落功能多样性测定:采用刘红梅等[14]Biolog试验方法, 称取相当于10 g烘干土壤的新鲜土壤样品, 加入90 mL灭菌生理盐水 (0.85%) 稀释, 用封口膜将瓶口封好, 在摇床上振荡30 min, 转速为250 r·min-1。摇匀, 静置10 min后, 依次稀释至1 000倍。稀释液加入到Biolog-Eco板的96个孔中, 将Biolog-Eco板在28℃条件下培养, 在Biolog微孔板读数仪 (BIOLOG Inc., 美国) 上连续读数7 d, 每24 h读数一次。
Biolog数据采用Garland等[15]提出的微平板平均颜色变化率 (AWCD) 来表示, 计算方法如下:
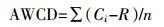
式中:Ci为每个有培养基孔的光密度值; R为对照孔的光密度值; n为Biolog-Eco微平板上供试碳源的种类数, n值为31, 重复3次。
用Shannon指数H、Simpson优势度指数D和Shannon均匀度指数E来表征土壤微生物群落代谢功能多样性。采用培养96 h时的Biolog-Eco平板孔中吸光值来计算土壤微生物群落功能多样性指数[16], 计算公式分别为:

式中:Pi为第i孔相对吸光值与整个平板相对吸光值总和的比率; S为有颜色变化的孔的数目。
1.4 数据统计与分析应用SPSS 16.0统计软件进行单因素方差分析 (One-Way ANOVA)、相关性分析和主成分分析。
2 结果与分析 2.1 土壤化学性质和微生物生物量碳、氮变化连续6年不同氮添加条件下土壤化学性质见表 1。0~10 cm土层, 7个氮添加处理土壤pH值均低于对照, 高氮处理 (N100、N150、N200、N300) 有机碳、硝态氮、铵态氮和速效磷含量高于或显著高于对照, 各处理全氮含量没有显著差异。10~20 cm土层, 高氮处理 (N100、N150、N200、N300) pH值显著低于对照, 有机碳、硝态氮、铵态氮和速效磷含量高于或显著高于对照。相同氮添加处理不同土层有机碳、全氮、全磷、硝态氮、铵态氮含量大致表现为0~10 cm土层>10~20 cm土层。
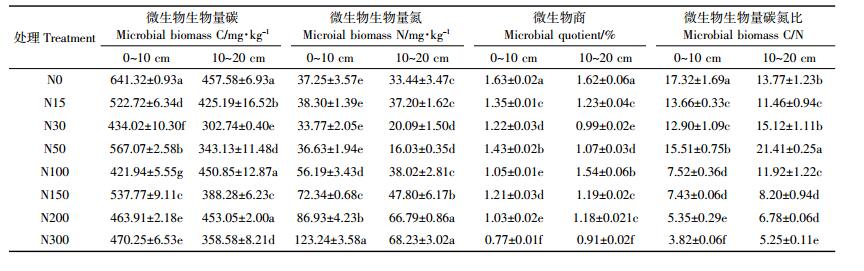
连续6年不同氮添加条件下土壤微生物生物量碳、氮含量变幅很大 (表 2)。0~10 cm土层氮添加处理的土壤微生物生物量碳含量显著低于对照。10~20 cm土层N15、N30、N50、N150、N300处理土壤微生物生物量碳显著低于对照, N100、N200与对照间没有显著差异。高氮处理 (N100、N150、N200、N300)0~10、10~20 cm土层土壤微生物生物量氮含量均高于或显著高于对照。0~10、10~20 cm土层氮添加处理的微生物熵均显著低于对照。0~10 cm土层与10~20 cm高氮处理 (N100、N150、N200、N300) 微生物生物量碳氮比均显著低于对照。上述结果表明, 高氮添加降低了土壤微生物生物量碳与土壤微生物生物量碳氮比, 改变了贝加尔针茅草原土壤微生物群落结构。
|
AWCD值反映土壤微生物利用单一碳源的能力, 是土壤微生物活性及群落功能多样性的重要指标[17]。从图 1可知, 随培养时间的延长, 土壤微生物利用碳源的能力逐渐增加。同一土层不同氮添加下, AWCD值增长速率各不相同, 说明不同处理间微生物对碳源利用能力有较大差异。培养第96 h时, 0~10 cm土层AWCD值顺序为N50>N30>N100>N15>N0>N200>N150>N300, 方差分析表明, 各处理间AWCD值差异显著, 低氮添加 (N15、N30、N50) 显著高于高氮添加 (N150、N200、N300);10~20 cm土层, 不同氮添加处理下AWCD值大小顺序与0~10 cm土层结果不同。相同氮添加处理下不同土层土壤的AWCD值差异也很明显。培养168 h时, N0、N15、N30、N50、N100、N150、N200、N300处理0~10 cm土层的AWCD值分别是10~20 cm土层的121.64%、126.09%、138.74%、194.01%、113.64%、104.74%、119.51%、116.58%。整体来看, 培养期内0~10 cm土层土壤微生物的碳源利用能力高于10~20 cm土层。
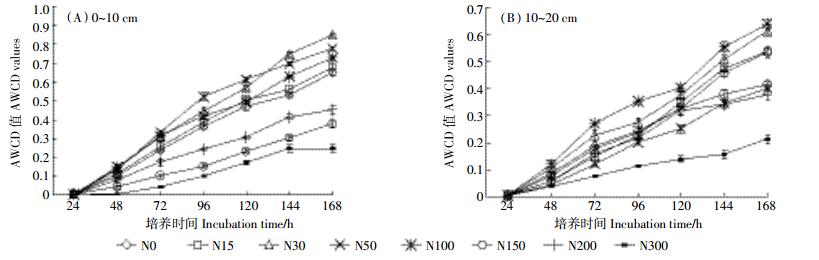
|
| 图 1 不同氮添加和土壤深度土壤微生物群落的平均颜色变化率随时间的变化 Figure 1 Changes of soil average well color development of soil microbe community with time under different nitrogen addition and soil depths |
不同氮添加下土壤微生物群落的功能多样性指数不同 (表 3)。高氮添加 (N150、N200、N300) 在0~10 cm、10~20 cm土层的Shannon指数H均显著低于对照 (P<0.05), 优势度指数D也均低于对照, 但不同处理间无显著差异 (P>0.05)。10~20 cm土层除N100处理的Shannon指数H与对照无显著差异外, 其余6个N处理的Shannon指数H均显著低于对照; 优势度指数D和均匀度指数E与对照相比, 均无显著差异 (P>0.05)。相同氮添加处理不同土层Shannon指数H和优势度指数D大致表现为0~10 cm土层>10~20 cm土层。
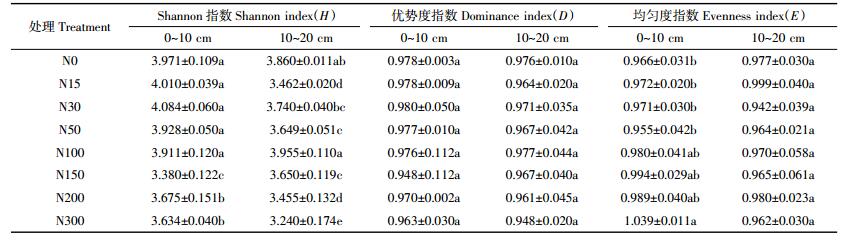
|
Biolog微孔中的31种碳源根据官能团的不同分为6大类, 分别为碳水类、氨基酸类、羧酸类、酚酸类、多聚物类、胺类[18]。利用培养96 h的AWCD值, 在不同土层内对31种碳源底物利用情况进行主成分分析。主成分提取的原则是提取特征值大于1的前m个主成分。根据此原则, 在不同土层内提取6个主成分, 0~10 cm土层, PC1轴贡献率为44.89%, PC2为18.08%。10~20 cm土层, PC1轴贡献率为32.49%, PC2为16.60%。图 2结果表明, 不同氮添加处理的PC值在PC轴上出现了明显的分布差异, 说明氮添加量显著影响了土壤微生物群落对碳源的利用能力。碳源利用能力分布差异表明, 0~10 cm土层与10~20 cm土层N150、N200、N300处理中微生物群落对PC1、PC2相关碳源利用能力偏低。0~10 cm土层, N30、N50处理中微生物群落主要利用PC1相关碳源, N0、N15、N100处理中主要利用PC2相关碳源; 10~20 cm土层, N0、N30处理中微生物群落主要利用PC1相关碳源, N15、N50处理中主要利用PC2相关碳源, N100处理中对PC1、PC2碳源利用能力均较高。
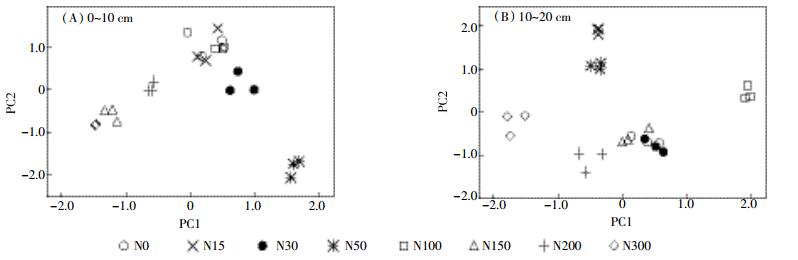
|
| 图 2 不同氮添加条件下土壤微生物碳源利用的主成分分析 Figure 2 Principal components analysis for carbon utilization of soil microbial communities in different nitrogen addition |
相关分析 (表 4) 表明, 土壤pH、微生物熵、微生物生物量碳氮比与土壤微生物Shannon指数H (0~10 cm、10~20 cm) 呈显著正相关, 与均匀度指数E (0~10 cm) 之间呈显著负相关。土壤全氮与土壤微生物Shannon指数H (10~20 cm)、优势度指数D (0~10 cm)、均匀度指数E (0~10 cm、10~20 cm) 之间呈极显著正相关。土壤全磷与土壤微生物Shannon指数H (10~20 cm)、优势度指数D (0~10 cm) 呈显著相关, 与优势度指数D (10~20 cm)、均匀度指数E (10~20 cm) 之间呈极显著正相关。土壤有机碳、微生物生物量氮、硝态氮与微生物Shannon指数H (0~10 cm、10~20 cm) 呈极显著负相关, 与均匀度指数E (0~10 cm) 之间呈极显著正相关。土壤pH、有机碳、全氮、全磷、微生物生物量氮、微生物熵、微生物生物量碳氮比、硝态氮是影响土壤微生物群落功能多样性的重要环境因子。这说明, 长期的氮素添加使土壤的理化性质、微生物生物量发生了变化, 从而影响微生物的功能多样性。
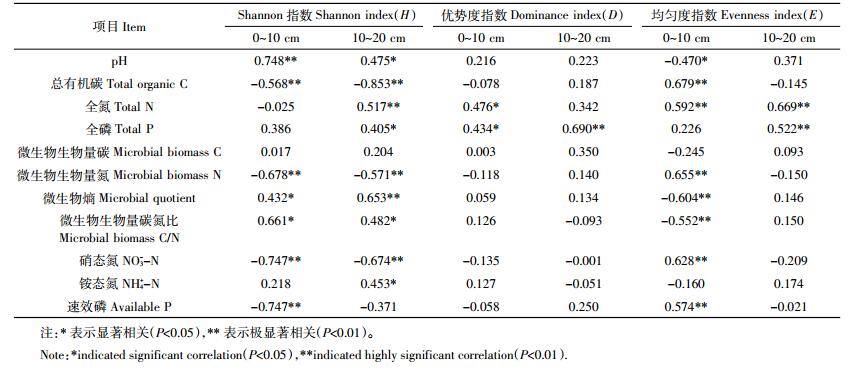
|
土壤微生物生物量是植物营养物质的源和库, 与养分循环密切相关[19], 常被用来评价土壤质量的生物学性状。在不同生态系统中, 氮添加对土壤微生物多样性的影响不尽相同。Maaroufi等[20]研究表明, 低浓度的氮添加可以提高微生物生物量。但另一些研究表明, 氮添加降低了微生物生物量[21-22]。本研究表明, 高氮添加降低了微生物生物量碳, 提高了土壤微生物生物量氮。这与洪丕征等[23]在模拟氮沉降对红椎人工幼龄林和Li等[24]在科尔沁沙质草地上开展的氮添加试验对土壤微生物生物量影响的研究结果一致。分析认为, 高氮添加弥补了由于植物生长和氮素损失造成的氮素消耗, 加大了土壤微生物生物量氮的固持, 但另一方面, 则因加速了土壤原有有机碳的分解而降低了土壤微生物生物量碳。
土壤微生物熵是指土壤微生物生物量碳占土壤有机碳含量的百分比[25], 反映土壤中活性有机碳所占的比例。一般土壤中微生物熵值为1%~4%, 由于土壤类型、采样时间、分析方法和管理措施等的不同, 文献报道的微生物熵值扩大为0.27%~7%。本研究中微生物熵的范围为0.77%~2.29%, 与文献的报道数值相符。高氮处理 (N100、N150、N200、N300) 的微生物熵值显著低于对照。表明长期单施化肥会降低土壤微生物熵, 土壤活性有机碳的周转速率变慢。土壤微生物生物量碳氮比可反映微生物群落结构信息, 其显著变化预示着微生物群落结构变化[26]。本研究中高氮添加处理的土壤微生物生物量碳氮比与低氮添加、无氮添加有显著差异 (表 2), 说明长期高氮添加使以主要碳源为代谢基质的微生物类群组成发生了明显变化。
3.2 氮添加对土壤微生物多样性的影响AWCD值高低反映了微生物群落代谢活性高低[16]。N15、N30、N50和N100的AWCD值高于对照, N150、N200和N300的AWCD值则低于对照 (图 1)。表明适量的氮添加对贝加尔针茅草原土壤微生物群落代谢活性具有积极影响, 过量氮添加则抑制微生物群落代谢活性。不同氮处理下0~10 cm土层微生物的AWCD值高于10~20 cm土层, 与吴则焰等[27]和蔡进军等[28]的研究结果一致。贝加尔针茅草地大部分的根系存在于0~10 cm土层, 相较于10~20 cm土层有更多的植物根际分泌物, 而植物根际分泌物对其周围微生物群落生长和代谢的促进作用可能是导致这一结果的主要原因[29-30]。主成分分析结果表明, 相同土层不同氮添加量下微生物群落对第一和第二主成分相关碳源利用能力不同, 各处理在PC轴上出现了明显的分异, N150、N200、N300处理中微生物群落对第一和第二主成分相关碳源的利用能力偏低。分析认为, 过量氮素添加打破了土壤原有的养分平衡, 改变了土壤养分的循环转化过程, 加大了微生物群落的不稳定性。
氮添加引起贝加尔针茅草地土壤化学性质发生改变 (表 1), 使土壤微生境发生改变, 从而影响了微生物多样性[31]。氮添加所导致的土壤pH的降低是影响土壤微生物功能多样性发生变化的主要因素之一[1]。本研究发现土壤硝态氮与土壤微生物Shannon指数H (0~10 cm、10~20 cm) 呈极显著负相关, 说明土壤微生物群落的氮素供应状况影响其功能多样性。其原因可能在于氮添加后土壤硝态氮增加, 土壤中游离氮离子增多, 导致土壤酸化[32], 而通常认为土壤细菌群落在中性pH条件下更趋于均一, 丰富度和多样性也越高[33]。本研究还发现, 土壤微生物Shannon指数H与pH之间呈显著正相关, 表明氮添加造成的pH值降低, 导致了土壤微生物功能多样性的降低。Freitag等[34]在研究草地土壤微生物对外源氮输入的响应中, 发现施氮不利于提高草原土壤微生物α-多样性。高氮添加与低氮添加及无氮添加在碳源利用能力上有很大差异, 原因可能在于高氮添加引起土壤高渗环境, 对微生物群落造成胁迫, 也可能由于高氮添加使贝加尔针茅草地植物群落多样性发生改变[35], 从而造成凋落物产量及生化性质改变[36], 进而影响异养微生物底物可获得性。本研究中土壤Shannon指数H与土壤有机碳含量呈负相关, 可能是因为施用无机氮肥提高了植物生产力, 增加了凋落物、植物根茬等的残留, 使土壤中积累的有机碳总量增加。氮添加对土壤微生物群落结构和功能的影响存在阈值效应, 如Yao等[37]在对羊草草地生态系统研究中发现了氮添加的阈值效应。本研究也发现了阈值, 即N100处理是研究区贝加尔针茅草地氮添加的阈值, 添加氮超过100 kg·hm-2后土壤微生物活性降低。刘蔚秋等[38]的研究表明, 草地生态系统未达到氮饱和时, 适量的氮素添加能够降低土壤微生物的营养压力, 但是过量的氮添加将增加土壤环境变化对微生物群落的胁迫程度, 使微生物的生长和活性受到抑制[39]。
4 结论(1) 连续高浓度氮添加降低贝加尔针茅草原土壤微生物生物量碳, 提高微生物生物量氮, 改变土壤微生物碳源利用能力, 不利于草地土壤微生物多样性的提高。在该试验条件下, 施氮量100 kg N·hm-2是研究区微生物活性从促进到抑制的一个阈值。因此选择合适的氮添加量对于促进贝加尔针茅草原土壤微生物碳源利用能力尤为重要。
(2) 土壤微生物功能多样性与土壤pH、有机碳、全氮、全磷、微生物生物量氮、微生物熵、微生物生物量碳氮比、硝态氮密切相关, 说明土壤pH、微生物生物量和土壤养分影响土壤微生物功能多样性。
| [1] | 王杰, 李刚, 修伟明, 等. 贝加尔针茅草原土壤微生物功能多样性对氮素和水分添加的响应[J]. 草业学报, 2014, 23(4): 343–350. WANG Jie, LI Gang, XIU Wei-ming, et al. Responses of soil microbial functional diversity to nitrogen and water input in Stipa baicalensis steppe, Inner Mongolia, Northern China[J]. Acta Prataculturae Sinica, 2014, 23(4): 343–350. DOI:10.11686/cyxb20140441 |
| [2] | 刘飞渡, 韩蕾. 亚热带红壤丘陵区不同人工林型对土壤理化性质, 微生物类群和酶活性的影响[J]. 生态环境学报, 2015, 24(9): 1441–1446. LIU Fei-du, HAN Lei. Effects of Different artificial forestry on soil physio-chemical properties, microbial groups and enzyme activities in subtropical red soil Hilly Region[J]. Ecology and Environmental Sciences, 2015, 24(9): 1441–1446. |
| [3] | 赵彤, 闫浩, 蒋跃利, 等. 黄土丘陵区植被类型对土壤微生物量碳氮磷的影响[J]. 生态学报, 2013, 33(18): 5615–5622. ZHAO Tong, YAN Hao, JIANG Yue-li, et al. Effects of vegetation types on soil microbial biomass C, N, P on the Loess Hilly Area[J]. Acta Ecologica Sinica, 2013, 33(18): 5615–5622. |
| [4] | 臧逸飞, 郝明德, 张丽琼, 等. 26年长期施肥对土壤微生物量碳、氮及土壤呼吸的影响[J]. 生态学报, 2015, 35(3): 1445–1451. ZANG Yi-fei, HAO Ming-de, ZHANG Li-qiong, et al. Effects of wheat cultivation and fertilization on soil microbial biomass carbon, soil microbial biomass nitrogen and soil basal respiration in 26 years[J]. Acta Ecologica Sinica, 2015, 35(3): 1445–1451. |
| [5] | 刘恩科, 梅旭荣, 赵秉强, 等. 长期不同施肥制度对土壤微生物生物量碳、氮、磷的影响[J]. 中国农业大学学报, 2009, 14(3): 63–68. LIU En-ke, MEI Xu-rong, ZHAO Bing-qiang, et al. Long-term effects of different fertilizer management on microbial biomass C, N and P in a Fluvo-aquic soil[J]. Journal of China Agricultural University, 2009, 14(3): 63–68. |
| [6] | 沈菊培, 贺纪正. 微生物介导的碳氮循环过程对全球气候变化的响应[J]. 生态学报, 2011, 31(11): 2957–2967. SHEN Ju-pei, HE Ji-zheng. Responses of microbes-mediated carbon and nitrogen cycles to global climate change[J]. Acta Ecologica Sinica, 2011, 31(11): 2957–2967. |
| [7] | Fierer N, Lauber C L, Ramirez K S, et al. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients[J]. Isme Journal, 2012, 6(5): 1007–1017. DOI:10.1038/ismej.2011.159 |
| [8] | Treseder K K. Nitrogen additions and microbial biomass:A meta-analysis of ecosystem studies[J]. Ecology letters, 2008, 11(10): 1111–1120. DOI:10.1111/ele.2008.11.issue-10 |
| [9] | Yang H, Wu M, Liu W X, et al. Community structure and composition in response to climate change in a temperate steppe[J]. Global Change Biology, 2011, 17(1): 452–465. DOI:10.1111/gcb.2010.17.issue-1 |
| [10] | Allison S D, Lu Y, Weihe C, et al. Microbial abundance and composition influence litter decomposition response to environmental change[J]. Ecology, 2013, 94(3): 714–725. DOI:10.1890/12-1243.1 |
| [11] | Zhang N L, Wan S Q, Li L H, et al. Impacts of urea N addition on soil microbial community in a semi-arid temperate steppe in Northern China[J]. Plant & Soil, 2008, 311(1): 19–28. |
| [12] | 鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. Third Edition. Beijing: China Agricultural Press, 2000. |
| [13] | 吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006. WU Jin-shui, LIN Qi-mei, HUANG Qiao-yun, et al. Method for measuring soil microbial biomass and its application[M]. Beijing: China Meteorological Press, 2006. |
| [14] | 刘红梅, 赖欣, 宋晓龙, 等. 转双价基因 (Bt+CpTI) 棉种植对根际土壤微生物群落功能多样性的影响[J]. 中国农学通报, 2012, 28(36): 231–236. LIU Hong-mei, LAI Xin, SONG Xiao-long, et al. Effects of transgenic Bt+CpTI cotton planting on functional diversity of rhizosphere soil microbial community[J]. Chinese Agricultural Science Bulletin, 2012, 28(36): 231–236. DOI:10.3969/j.issn.1000-6850.2012.36.039 |
| [15] | Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole carbon source utilization[J]. Applied and Environmental Microbiology, 1991, 57(18): 2351–2359. |
| [16] | 赵晓琛, 刘红梅, 皇甫超河, 等. 贝加尔针茅草原土壤微生物功能多样性对养分添加的响应[J]. 农业环境科学学报, 2014, 33(10): 1933–1939. ZHAO Xiao-chen, LIU Hong-mei, HUANGPU Chao-he, et al. Responses of functional diversity of soil microbial communities to nutrient additions in Stipa baicalensis steppe in Inner Mongolia, China[J]. Journal of Agro-Environmental Science, 2014, 33(10): 1933–1939. DOI:10.11654/jaes.2014.10.009 |
| [17] | 袁颖红, 樊后保, 刘文飞, 等. 模拟氮沉降对杉木人工林 (Cunninghamia lanceolata) 土壤酶活性及微生物群落功能多样性的影响[J]. 土壤, 2013, 45(1): 120–128. YUAN Ying-hong, FAN Hou-bao, LIU Wen-fei, et al. Effects of simulated nitrogen deposition on soil enzyme activities and microbial community functional diversities in a Chinese fir plantation[J]. Soils, 2013, 45(1): 120–128. DOI:10.11766/trxb201112290509 |
| [18] | 王楠楠, 韩冬雪, 孙雪, 等. 降水变化对红松阔叶林土壤微生物功能多样性的影响[J]. 生态学报, 2017, 37(3): 1–9. WANG Nan-nan, HAN Dong-xue, SUN Xue, et al. Effects of precipitation change on soil microbial functional diversity in the primitive Korean pine and broadleaved forests[J]. Acta Ecologica Sinica, 2017, 37(3): 1–9. |
| [19] | 何亚婷, 董云社, 齐玉春, 等. 草地生态系统土壤微生物量及其影响因子研究进展[J]. 地理科学进展, 2010, 29(11): 1350–1359. HE Ya-ting, DONG Yun-she, QI Yu-chun, et al. Advances in researches on soil microbial biomass of grassland ecosystems and its influencing factors[J]. Progress in Geography, 2010, 29(11): 1350–1359. DOI:10.11820/dlkxjz.2010.11.020 |
| [20] | Maaroufi N I, Nordin A, Hasselquist N J, et al. Anthropogenic nitrogen deposition enhances carbon sequestration in boreal soils[J]. Global Change Biology, 2015, 21(8): 3169–3180. DOI:10.1111/gcb.12904 |
| [21] | Bradley K, Drijber R A, Knops J. Increased N availability in grassland soils modifies their microbial communities and decreases the abundance of arbuscular mycorrhizal fungi[J]. Soil Biology & Biochemistry, 2006, 38(7): 1583–1595. |
| [22] | Chen D M, Lan Z C, Hu S J, et al. Effects of nitrogen enrichment on belowground communities in grassland:Relative role of soil nitrogen availability vs.soil acidification[J]. Soil Biology & Biochemistry, 2015, 89: 99–108. |
| [23] | 洪丕征, 刘世荣, 于浩龙, 等. 模拟氮沉降对红椎人工幼龄林土壤微生物生物量和微生物群落结构的影响[J]. 山东大学学报, 2016, 51(5): 18–28. HONG Pi-zheng, LIU Shi-rong, YU Hao-long, et al. Effects of simulated nitrogen deposition on soil microbial biomass and community structure in a young plantation of Castanopsis hystrix[J]. Journal of Shandong University, 2016, 51(5): 18–28. |
| [24] | Li L J, Zeng D H, Yu Z Y, et al. Soil microbial properties under N and P additions in a semi-arid, sandy grassland[J]. Biology and Fertility of Soils, 2010, 46(6): 653–658. DOI:10.1007/s00374-010-0463-y |
| [25] | 刘满强, 胡锋, 何园球, 等. 退化红壤不同植被恢复下土壤微生物量季节动态及其指示意义[J]. 土壤学报, 2003, 40(6): 937–944. LIU Man-qiang, HU Feng, HE Yuan-qiu, et al. Seasonal dynamics of soil microbial biomass and its significance to indicate soil quality under different vegetations restored on degraded red soils[J]. Acta Pedologica Sinica, 2003, 40(6): 937–944. DOI:10.11766/trxb20030620 |
| [26] | 孙瑞, 孙本华, 高明霞, 等. 长期不同土地利用方式下塿土土壤微生物特性的变化[J]. 植物营养与肥料学报, 2015, 21(3): 655–663. SUN Rui, SUN Ben-hua, GAO Ming-xia, et al. Changes of soil microbial characteristics under long-term different land use patterns on an anthropogenic loess soil[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(3): 655–663. DOI:10.11674/zwyf.2015.0312 |
| [27] | 吴则焰, 林文雄, 陈志芳, 等. 中亚热带森林土壤微生物群落多样性随海拔梯度的变化[J]. 植物生态学报, 2013, 37(5): 397–406. WU Ze-yan, LIN Wen-xiong, CHEN Zhi-fang, et al. Variations of soil microbial community diversity along an elevational gradient in mid-subtropical forest[J]. Chinese Journal of Plant Ecology, 2013, 37(5): 397–406. |
| [28] | 蔡进军, 董立国, 李生宝, 等. 黄土丘陵区不同土地利用方式土壤微生物功能多样性特征[J]. 生态环境学报, 2016, 25(4): 555–562. CAI Jin-jun, DONG Li-guo, LI Sheng-bao, et al. The characteristics of soil microbe function diversity in semi-arid loess hilly region[J]. Ecology and Environmental Sciences, 2016, 25(4): 555–562. |
| [29] | Wang C T, Cao G M, Wang Q L, et al. Changes in plant biomass and species composition of alpine Kobresia meadows along altitudinal gradient on the Qinghai-Tibetan Plateau[J]. Science in China Series C:Life Sciences, 2008, 51(1): 86–94. DOI:10.1007/s11427-008-0011-2 |
| [30] | Lovieno P, Alfani A, Bååth E. Soil microbial community structure and biomass as affected by Pinus pinea plantation in two mediterranean areas[J]. Applied Soil Ecology, 2010, 45(1): 56–63. DOI:10.1016/j.apsoil.2010.02.001 |
| [31] | 齐莎, 赵小蓉, 郑海霞, 等. 内蒙古典型草原连续5年施用氮磷肥土壤生物多样性的变化[J]. 生态学报, 2010, 30(20): 5518–5526. QI Sha, ZHAO Xiao-rong, ZHENG Hai-xia, et al. Changes of soil biodiversity in Inner Mongolia steppe after 5 years of N and P fertilizer applications[J]. Acta Ecologica Sinica, 2010, 30(20): 5518–5526. |
| [32] | Chen D M, Lan Z C, Bai X, et al. Evidence that acidification-induced declines in plant diversity and productivity are mediated by changes in belowground communities and soil properties in a semi-arid steppe[J]. Journal of Ecology, 2013, 101(5): 1322–1334. DOI:10.1111/jec.2013.101.issue-5 |
| [33] | Lauber C L, Hamady M, Knight R, et al. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Applied and Environmental Microbiology, 2009, 75(15): 5111–5120. DOI:10.1128/AEM.00335-09 |
| [34] | Freitag T E, Chang L, Clegg C D, et al. Influence of inorganic nitrogen management regime on the diversity of nitrite-oxidizing bacteria in agricultural grassland soils[J]. Applied and Environmental Microbiology, 2005, 71(12): 8323–8334. DOI:10.1128/AEM.71.12.8323-8334.2005 |
| [35] | 李文娇, 刘红梅, 赵建宁, 等. 氮素和水分添加对贝加尔针茅草原植物多样性及生物量的影响[J]. 生态学报, 2015, 35(19): 6460–6469. LI Wen-jiao, LIU Hong-mei, ZHAO Jian-ning, et al. Effects of nitrogen and water addition on plant species diversity and biomass of common species in the Stipa baiclensis steppe, Inner Mongolia, China[J]. Acta Ecologica Sinica, 2015, 35(19): 6460–6469. |
| [36] | 于雯超, 宋晓龙, 修伟明, 等. 氮素添加对贝加尔针茅草原凋落物分解的影响[J]. 草业学报, 2014, 23(5): 49–60. YU Wen-chao, SONG Xiao-long, XIU Wei-ming, et al. Effects of additional nitrogen on litter decomposition in Stipa baicalensis grassland[J]. Acta Prataculturae Sinica, 2014, 23(5): 49–60. DOI:10.11686/cyxb20140506 |
| [37] | Yao M J, Rui J P, Li J B, et al. Rate-specific responses of prokaryotic diversity and structure to nitrogen deposition in the Leymus chinensis steppe[J]. Soil Biology & Biochemisty, 2014, 79: 81–90. |
| [38] | 刘蔚秋, 刘滨扬, 王江, 等. 不同环境条件下土壤微生物对模拟大气氮沉降的响应[J]. 生态学报, 2010, 30(7): 1691–1698. LIU Wei-qiu, LIU Bin-yang, WANG Jiang, et al. Responses of soil microbial communities to moss cover and nitrogen addition[J]. Acta Ecologica Sinica, 2010, 30(7): 1691–1698. |
| [39] | 张成霞, 南志标. 土壤微生物生物量的研究进展[J]. 草业科学, 2010, 27(6): 50–57. ZHANG Cheng-xia, NAN Zhi-biao. Research progress of soil microbial biomass in China[J]. Pratacultural Science, 2010, 27(6): 50–57. |
 2017, Vol. 36
2017, Vol. 36