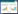文章信息
- 刘慧云, 鲜青松, 刘琛, 唐翔宇
- LIU Hui-yun, XIAN Qing-song, LIU Chen, TANG Xiang-yu
- 生物质炭对紫色土耕地土壤中溶解性有机物含量和组成特征的影响
- Effects of biochar application on content and characteristics of dissolved organic matter in arable land of purple soil
- 农业环境科学学报, 2017, 36(4): 718-726
- Journal of Agro-Environment Science, 2017, 36(4): 718-726
- http://dx.doi.org/10.11654/jaes.2016-1538
文章历史
- 收稿日期: 2016-12-01
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Science, Beijing 100049, China
生物质炭在土壤改良、固碳减排、污染土壤修复及迁移阻控等方面的应用已引起国内外的广泛关注[1-2]。溶解性有机物 (Dissolved organic matter, DOM) 虽然是土壤有机质中很少的一部分, 却是土壤中最活跃的组分之一, 对土壤肥力、微生物生长代谢及有机质循环等有重要影响[3]。DOM的淋失也是土壤有机碳损失的重要途径。在水体环境中, DOM扮演着重要的角色, 它可作为重金属及小分子有机污染物迁移的载体, 也是形成消毒副产物 (DBPs) 的主要前驱物, 因而是影响水环境质量的重要因素。研究生物质炭施用后土壤中DOM组成及其释放规律, 对明确其环境效应及其对农业生产的影响具有重要意义。
目前, 相关研究得出的结论并不一致, 例如:研究发现, 温带森林土壤中施用木屑生物质炭半年后DOM含量显著高于不添加生物质炭的对照土壤[4], 而在巴西甘蔗田里施用四个月生物质炭则造成土壤中DOM的溶出显著降低[5]。这表明, 土壤DOM对生物质炭添加的响应规律受生物质炭种类、土壤及试验条件等因素的影响, 因此有必要针对不同土壤进行系统、深入的研究。同时, 除了考察生物质炭施用后土壤DOM在浓度上的变化, 还需要关注生物质炭对DOM组成特征的影响, 然而这方面的研究仍十分欠缺。
三维激发-发射荧光光谱 (EEM) 特征能用于表征DOM组成, 具有高灵敏度、快速测定且不破坏样品等优点[6-7]。目前, 该技术多用于研究湖泊、海湾等水体中DOM的性质及来源, 在土壤中生物质炭添加效应研究中的应用极少, 已有的研究进展包括:Eykelbosh等[5]依据光谱学指标发现添加生物质炭后土壤中高分子量的类腐殖质的含量更高; Jamieson等[8]运用紫外-可见吸收和三维荧光光谱-平行因子分析法研究了不同热解温度下制得的生物质炭的添加效应, 发现土壤DOM是由三种类腐殖质和一种类蛋白质组成, 其中高温短时制备的生物质炭使DOM的含量与芳香性更高; Uchimiya等[9]则对比了采用弱碱和热水分别提取不同生物质炭中DOM的三维荧光光谱特征。由此可见, 现有研究中多以生物质炭本身为对象, 较少研究施炭对土壤中DOM形成与性质的影响, 也很少考虑老化作用的影响及不同土壤类型间的差异。
紫色土在四川盆地分布最广, 是重要的旱作农业土壤。国内已有不少关于生物质炭施用对典型土壤, 如酸性红壤或中性水稻土碳循环的影响研究[3, 10], 但针对有机质含量较低的紫色土 (新成土) 的研究十分缺乏。因此, 本文以长江上游低山丘陵区代表性的石灰性和中性紫色土的两种典型耕地土壤 (旱地和菜地) 为研究对象, 利用三维荧光光谱-平行因子分析紫色土DOM的组分特征并研究添加秸秆生物质炭的影响, 为紫色土区农田土壤有机质组成特征分析、生物质炭改土技术的环境效应评价及可行性分析提供一定的理论依据。
1 材料与方法 1.1 供试土壤在四川省盐亭县林山乡 (105°27´E、31°16´N) 和重庆市忠县石宝镇 (108°10´E, 30°25´N), 分别采集菜地和旱地0~20 cm的耕层土壤 (旱地为坡耕地土壤, 主要种植玉米)。土样置于通风处阴干后碾碎过2 mm筛, 装入自封袋于阴凉干燥处保存。4种供试土壤的基本性质见表 1。
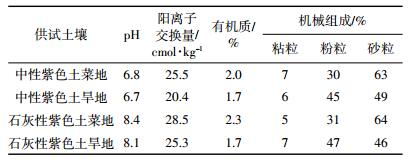
供试生物质炭购自商丘三利新能源公司, 是以小麦、花生等农作物秸秆混合物为原料, 在500℃采用连续式炭化炉制备得到。基本理化性质见表 2。
将生物质炭置于烘箱中60℃烘干, 分别按0、0.5%、1%、2%、3%(质量比) 加入250 g的4种供试土壤中, 充分混均匀后置于塑料小盆内。各处理均设三个重复。干湿交替作用为每周一个周期, 称取一定的蒸馏水浇入小盆内, 使土壤体积含水率达到0.5 cm3·cm-3, 在室内自然蒸发及排水。如此老化三个月后, 盆内土壤施炭后的化学性质已基本达到稳定状态。将盆内土壤全部取出, 风干后过2 mm筛待用。
土壤DOM的浸提采用批实验方法, 水土比为10:1, 提取液采用10 mmol·L-1氯化钙溶液作为支持电解质[11], 设置三次重复, 振荡4 h, 3000 r·min-1、25℃下离心5 min, 用0.45 μm的聚醚砜膜过滤, 测定滤液的三维荧光光谱。
1.4 分析方法土壤理化性质分析:pH值采用精密酸度计测定 (固液比1 g/5 mL); 土壤有机质采用重铬酸钾容量法测定; 阳离子交换量分别采用乙酸铵交换法 (中性土壤) 和乙酸钠法 (石灰性土壤) 测定; 机械组成通过Stoke定律采用吸管法测定[12]。
生物质炭理化性质分析:精密酸度计测定pH值 (固液比1 g/5 mL); 元素分析仪 (型号Euro EA 3000, 意大利Eurovector公司) 测定C、H、N含量; 比表面积自动分析仪 (型号ZXF-06, 西北化工研究院) 测定BET比表面积; 压汞仪 (型号PoreMaster 33/60, 美国康塔仪器有限公司) 测定平均孔隙直径。
DOM含量与组分特征分析:DOC浓度采用TOC自动分析仪 (型号Auto Analyzer 3, 德国SEAL Analytical公司) 测定。组分特征采用紫外吸收-三维激发-发射荧光光谱仪 (型号Aqualog, 日本Horiba JY公司) 进行表征 (3 mL石英比色皿, 10×10 mm), 检测参数为激发波长扫描范围240~600 nm, 发射波长扫描范围250~800 nm, 扫描波长间隔1 nm, 扫描速度1200 nm·min-1, 积分时间0.5 s。测样前, 以Milli-Q超纯水拉曼光谱的峰位和信噪比验证仪器的稳定性, 以超纯水为空白, 利用仪器的软件平台扣除样品测得的三维荧光光谱 (EEM) 背景噪音, 并进行瑞利散射和内滤效应的校正。在测定EEM光谱的同时, 获得相应的紫外-吸收光谱, UV波长扫描范围为200~600 nm, 用于校正内滤效应及计算光谱学参数。
1.5 吸收光谱和荧光光谱参数紫外-可见吸收光谱参数SUVA254是254 nm波长处的紫外-可见吸光系数与样品的溶解性有机碳 (DOC) 浓度的比值, 表征溶解性有机物的芳香性强弱, 其值越大, 芳香化程度越高[13]。
腐殖化指数HIX用来表征溶解性有机物的腐殖化程度, 其值越高表明有机物的腐殖化程度越高, 稳定性越好[14]。本文采用避免内滤效应干扰的计算公式, 如下:
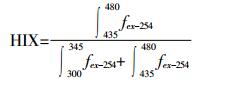 (1)
(1) 式中: 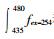
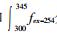
荧光指数FI是激发波长为370 nm时, 发射波长分别在470 nm和520 nm处的荧光强度的比值, 用来表征溶解性有机物的类腐殖质来源, 可作为DOM降解程度的指标[15]。
1.6 平行因子算法平行因子算法 (PARAFAC) 是采用交替最小二乘原理的迭代类型的一种三维数阵分解算法[16], 其将多个EEMs数据构成的三维矩阵X (I×J×K) 分解为三个荷载矩阵A、B和C。分解模型可表示为
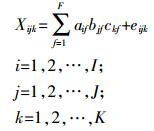 (2)
(2) 式中:I为激发波长数, J为发射波长数, K为样本数, F为对体系有贡献的独立荧光组分数; Xijk为第k个样本在激发波长为i、发射波长为j时的荧光强度; ckf为相对浓度阵C (K×F) 中的元素 (k, f); aif为相对激发光谱阵A (I×F) 中的元素 (i, f); bjf为相对发射光谱阵B (J×F) 中的元素 (j, f); eijk为三维残差数阵E (I×J×K) 中的元素 (i, j, k)。
利用SOLO软件 (美国Eigenvector Research Incorporated公司) 对EEM光谱数据进行平行因子分析。运行模型前, 将一级和二级瑞利散射区域的荧光强度设置为缺省值, 并对数据模型进行非负限制。组分数范围拟选为2~6个, 通过比较不同组分数时模型的激发和发射光谱的方差以及模型拟合的EEM光谱与样品实测的光谱图是否基本一致来验证模型的可靠性, 去除异常值; 同时, 参考核一致性分析 (CORCONDIA)[17]的结果来最终确定组分个数。
1.7 数据处理利用SPSS17.0统计软件进行单因素方差分析, 差异显著性分析采用LSD分析, 显著水平设定为0.05;利用Excel 2010进行数据计算及图表制作。
2 结果与讨论 2.1 添加生物质炭对土壤DOM含量的影响在光谱学被较多地用于表征DOM的组分特性之前, 传统方法通常以DOC来表征DOM的总体含量。如图 1所示, 石灰性和中性紫色土旱地的对照土壤DOM的平均含量分别为43、65 mg DOC·kg-1, 相应菜地的对照土壤分别为110、105 mg DOC·kg-1, 两种紫色土菜地土壤的DOM含量都高于旱地土壤。一方面是由于DOM含量与土壤总有机质含量呈正相关关系, 菜地土壤的有机质总量高于旱地; 另一方面与土壤颗粒组成有关, 一般认为有机碳在土壤砂粒中的活性最强, 粉粒次之, 而在粘粒中处于惰性状态。本文中菜地土壤具有更高的砂粒含量, 石灰性和中性紫色土分别为64%和63%, 而旱地土壤相应为47%和49%。因此, 菜地土壤中的有机碳可能具有更高的活性, 也更容易被水提取出来。
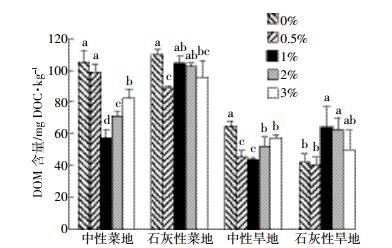
|
| 图 1 生物质炭施用量对供试紫色土DOM含量的影响 Figure 1 Effects of applying different amount of biochar on DOC concentration of extracted DOM in the tested soils 图中值为平均值+标准差;条形图上方不同字母表示在该生物质炭投加量下与其他投加量间的差异显著 (P<0.05) |
供试土壤中投加生物质炭并经过老化后, 相同投加量下不同土壤中提取的DOM含量有所差异, 同种土壤在不同投加量下的DOM含量也有所不同。大体上看, 两种中性紫色土DOM含量的变化规律一致, 均呈先降低后增加的趋势:在投加量1%时最低 (菜地和旱地土壤浸提液中DOM含量分别减少了45%和32%), 而当投加量增加至3%时仍然低于对照土壤。另外, 菜地和旱地石灰性紫色土的变化规律也一致, 均呈降低后增加又降低的趋势, DOM含量在投加量0.5%时最低 (如菜地土壤减少了20%)。
由此看出, 施炭的影响因土壤种类及土地利用类型而异。一般认为, DOM主要来源于土壤有机质中腐殖质的矿化溶出、微生物分解及植物残体的腐解, 所以, 加炭后所引起的土壤性质、微生物活动的变化及生物质炭本身的性质是影响土壤中DOM产生的主要因素。一方面, 加炭可导致DOM增加:DOM是土壤微生物最直接利用的有机碳源, 加炭后土壤pH值增加, 可增强微生物活性, 从而促进土壤有机质的分解[17]。也有研究发现, 生物质炭中有一部分有机成分比较活跃, 相对土壤中的有机物更容易被微生物利用, 使微生物活性增强, 从而促进土壤自身有机质的分解代谢[18]。pH值的增加也可导致DOM的可溶性增加, 并促进DOM在土壤矿物上的解吸。本文中施炭对中性紫色土pH值的影响更为显著 (数据未显示), 两种中性紫色土在高投加量下DOM的增加趋势也许与这种作用有关。另一方面, 也存在加炭使DOM减少的机理:由于生物质炭本身为多孔吸附材料, 具有较大的比表面积, 能够吸附固定一部分的有机质分子[19]。还有研究认为, 生物质炭向土壤中引入大量的钙离子, 可促使土壤保持更多的腐殖质, 从而在一定程度上抑制DOM的形成[20]。
因此, 土壤DOM的含量在不同生物质炭投加量下表现出增加或减少的非单调性变化, 是受以上两方面作用共同影响的, 取决于相互消涨关系的变化。此外, 上述结果也可能受到干湿交替周期及DOM浸提水土比等实验条件的影响。需要指出, 本文中DOM的提取是在不考虑土壤物理结构 (尤其是孔隙系统) 的变化下进行的, 而施炭对土壤结构尤其是孔隙分布的影响可能是造成土壤DOM含量变化的潜在因素。田间条件下生物炭施用对土壤孔隙水中DOM含量的影响需通过野外小区试验加以系统研究。
2.2 添加生物质炭对土壤DOM光谱学特征的影响 2.2.1 光谱学特征参数分析本研究采用的生物质炭与加炭土壤中所提取DOM的三维荧光光谱如图 2和图 3所示。
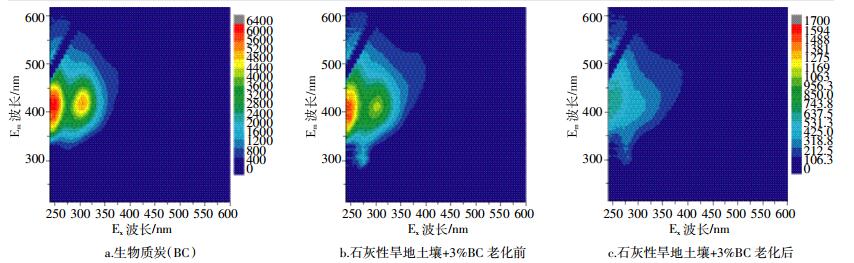
|
| 图 2 生物质炭与老化前后施炭土壤中DOM的三维荧光光谱图 Figure 2 EEM fluorescence spectra of biochar and one studied biochar-added soil prior to and after ageing |
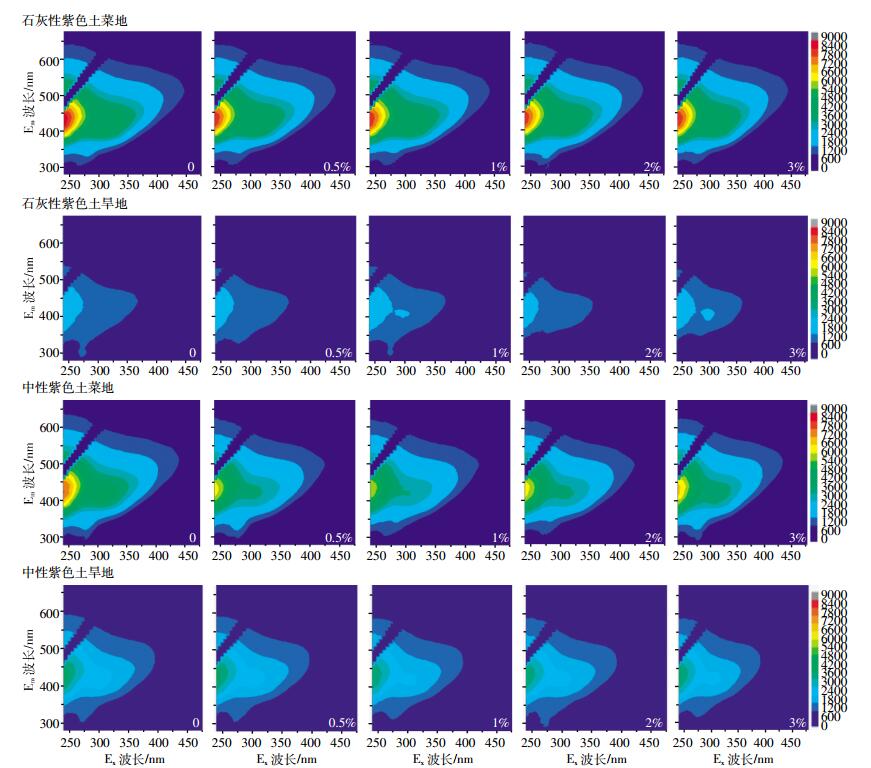
|
| 图 3 不同生物质炭投加量下老化供试土壤中DOM的三维荧光光谱图 Figure 3 EEM fluorescence spectra of studied soils applied with varying amount of biochar |
生物炭本身含有可溶出的DOM组分, 并具有较强的荧光响应。以纤维素为主的秸秆在热解过程中逐渐形成高度芳香化的炭基结构, 但通常由于炭化不完全, 得到的生物质炭中除了含有无机盐等灰分还具有一部分有机的活性成分, 其组分特征及含量取决于生物质炭的原料种类及炭化条件。如图 2a所示, 本研究采用的生物质炭中DOM具有2个激发峰 (Ex) 和1个发射峰 (Em), 分别位于Ex/Em为230~270 nm/370~450 nm和290~320 nm/400~420 nm区域。相比之下, 以石灰性紫色土旱地土壤为例 (图 2b、图 2c), 在相同浸提条件下获得的土壤DOM的荧光强度明显低于生物质炭中的DOM, 却具有更大的荧光响应区域, 反映了土壤中更为复杂的有机质成分。例如, 在Ex/Em为260~280 nm/280~320 nm区域出现的响应, 表明土壤DOM含有一个生物质炭中没有的类蛋白组分。
图 2的结果还表明, 老化对加炭土壤DOM的含量与组分特征有显著的影响。土壤中新鲜加炭后立刻提取DOM, 其荧光强度会大幅增强, 可能是生物炭自身溶出DOM的贡献, 但考虑到投加量最高仅为3%, 这种贡献也十分有限。实验发现, 新鲜加炭后土壤溶液的pH值显著增加 (由7.11增加至7.66), 从而导致土壤DOM的溶解性增加。这可能是荧光增强的直接原因, 在文献中也有相关的报道[19]。然而, 这种变化是暂时的, 经过干湿交替的老化作用, 这种影响会逐渐消失, 土壤溶液的pH值会降低到对照土壤的水平 (7.18~7.14), DOM的荧光强度也相应地明显减弱。现有的有关生物质炭施用对土壤性质以及土壤中污染物吸附-解吸过程的影响研究中, 研究者往往采用土壤中新鲜加炭的室内实验方法, 然而老化才更接近田间土壤的实际情况, 因而老化过程是该类研究应当考虑的一个重要环节。
图 3为四种供试土壤在添加不同量的生物质炭并老化后所提取DOM的荧光光谱图。结果表明, 不同紫色土类型及土地利用方式间具有明显的差异。大体上看, 菜地土壤DOM的荧光强度都高于旱地土壤, 并且石灰性土壤略高于中性土壤。这与它们相应的DOM含量的趋势基本一致, 反映了荧光强度与DOM含量在一定程度上的相关性。对于同种土壤中DOM的荧光强度和响应区域, 加炭与否并无明显不同, 不同生物质炭投加量处理间的荧光强度只是略有增强或减弱。
为了明确量化施炭前后土壤DOM的差异, 本文对光谱学数据进一步处理并计算了三个经典的光谱学特征参数, 结果如图 4所示。首先, SUVA254指数 (以均值显示, |标准差|<0.69) 为单位溶解性有机碳的紫外吸收强度, 可反映DOM的芳构化程度。不同土地利用类型的紫色土DOM在该值上有较大差异。两种紫色土菜地对照土壤DOM的SUVA254指数为0.028和0.029, 都高于旱地土壤 (0.015), 反映出菜地土壤有机质的芳香性高于旱地。加炭后, 石灰性紫色土旱地土壤DOM的SUVA254指数介于1.842~4.145 L·mg-1·m-1之间, 中性紫色土旱地略高 (3.455~4.606 L·mg-1·m-1); 两种紫色土的菜地土壤则差异不大, 与均介于4.606~7.370 L·mg-1·m-1之间。
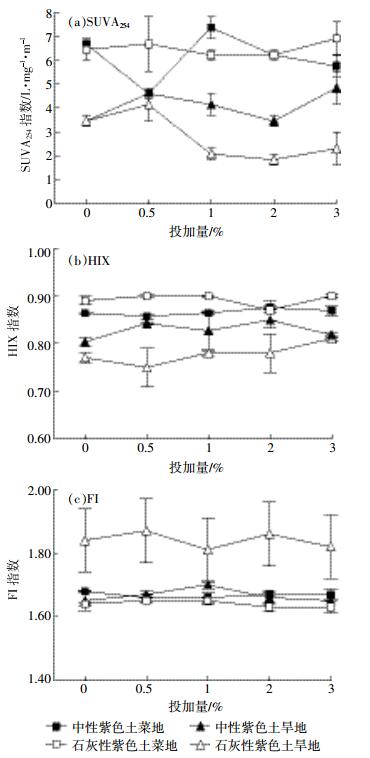
|
| 图 4 不同生物质炭投加量下供试紫色土DOM的光谱学特征参数 Figure 4 Spectroscopic indices of DOM extracted from soils amended with varying amount of biochar |
其次, 供试土壤的HIX指数介于0.75~0.90之间, 石灰性紫色土旱地总体最低, 在0.75~0.81之间, 两种紫色土的菜地土壤均高于旱地土壤, 表明菜地土壤中溶出DOM的腐殖化程度最高。这与菜地一年多季作物种植、翻耕和施农家肥等有关, 因为这些种植活动和农艺措施的强度高于旱地 (以冬小麦-夏玉米轮作最为常见)。此外, 各处理的FI指数范围在1.6~1.9之间。依据水体中DOM的来源分类[21]:当FI>1.9时, DOM源于水体中细菌和蓝藻的胞外释放及渗出液; FI<1.4时, DOM源于陆生植物和土壤有机质。本研究中, 除石灰性紫色土旱地外, 所测土壤DOM的FI值均集中在1.6~1.7之间, 基本反映了土壤有机质源的基本特征。
在本研究所采用的投加量范围内, 生物质炭并未对上述光谱学特征参数值产生明显的影响, 表明盆钵培养和干湿交替处理实验条件下, 生物质炭带入土壤的荧光活性组分经老化淋湿作用后不能影响土壤的荧光特性。
2.2.2 三维荧光光谱平行因子分析通过EEM光谱的平行因子三线性分解法, 本文首次分析了长江上游中性和石灰性紫色土地区典型耕地土壤中DOM的组成特征。在对光谱数据进行模型分析时, 当组分数由2提高到3时激发和发射光谱的残差平方和曲线变得更加平滑, 而当组分数增至4时, 没有发生明显变化。样品实测的EEM图谱与模型拟合的结果基本一致, 相应的残差强度很低且没有明显的荧光峰, 仅个别样品在激发波长200~300 nm处有微弱的小峰出现, 系由二级瑞利散射区边缘的干扰所致, 不会对模型分析结果产生明显影响。当组分由3增加至4时, 核一致性由90%迅速降低至0附近, 因此将本研究中模型的最佳因子数确定为3。
图 5为模型拟合出的三个DOM单组分的EEM图谱。它们分别以C1、C2和C3表示, 相应的荧光峰位置分别为Ex:240/Em:480;Ex:240(320)/Em:400; Ex:240(280)/Em:340。
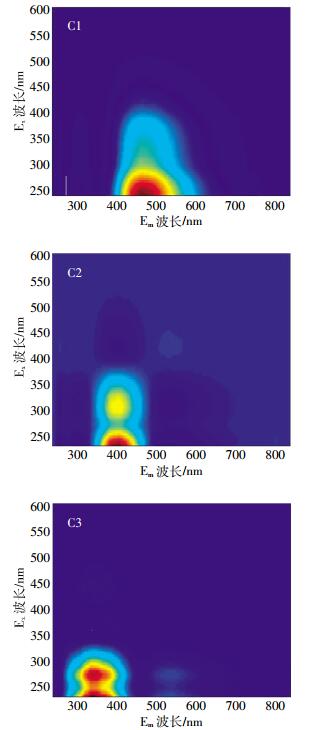
|
| 图 5 PARAFAC模型拟合的供试紫色土DOM单组分的三维荧光光谱图 Figure 5 EEM spectra of three PARAFAC-identified fluorescent components of DOM in the tested soils |
组分C1具有单一激发峰和发射峰, 主要为长波类腐殖质, 以腐植酸为代表, 在其他文献中也有类似组分的报道[21-24]。该组分较为常见, 主要为陆源的分子量较大的芳香氨基酸腐殖质, 也是湿地和森林环境中含量最高的一类腐殖物质。
组分C2具有2个激发峰和1个发射峰, 位于传统的A峰 (230~260 nm/380~460 nm) 和M峰 (290~310 nm/370~420 nm) 区域, 与文献[25]中的C1(250、320 nm/400 nm) 相似, 文献[6]和[21]也有类似的组分。文献[26]指出该组分为短波类腐殖质, 以富里酸为代表, 主要来源于陆生植物或土壤有机物 (除浮游植物和水体微生物代谢外的陆源输入)[22]。
组分C3也有2个激发峰和1个发射峰, 对应于传统的T峰[270~280(<240 nm)/330~370 nm], 主要为类蛋白物质, 以类色氨酸为代表, 主要由内源或微生物过程产生, 游离或结合在蛋白质中以指示完整的蛋白质或较少的降解的缩氨酸[26]。农田土壤中存在的该类物质也可能与居民生活污水的影响有关[27]。
平行因子分析结果表明, 供试土壤中含有两种类腐殖质 (C1和C2) 及一种类蛋白质 (C3) 组分, 图 6显示了不同土壤中各组分的相对含量 (以三个平行样品的载荷平均值±标准差表示) 的差异及其随生物质炭添加量的变化规律。模型计算的结果与图 3中各土壤相应的实测荧光强度的相对关系非常一致。三种组分的含量在不同土壤中均表现为C1>C2>C3, 即DOM中腐植酸含量较高, 类蛋白质含量最低。三种组分在不同类型土壤中的含量有所差异, 菜地土壤中各组分的含量都高于旱地土壤, 其中石灰性紫色土菜地土壤中DOM的C1组分高, 而石灰性紫色土旱地最低。这可能与菜地土壤中农家肥和有机物料的投入强度以及有机质含量均高于旱地土壤有关。生物质炭投加量的不同并未造成溶出DOM各组分含量的显著改变 (P>0.05)。
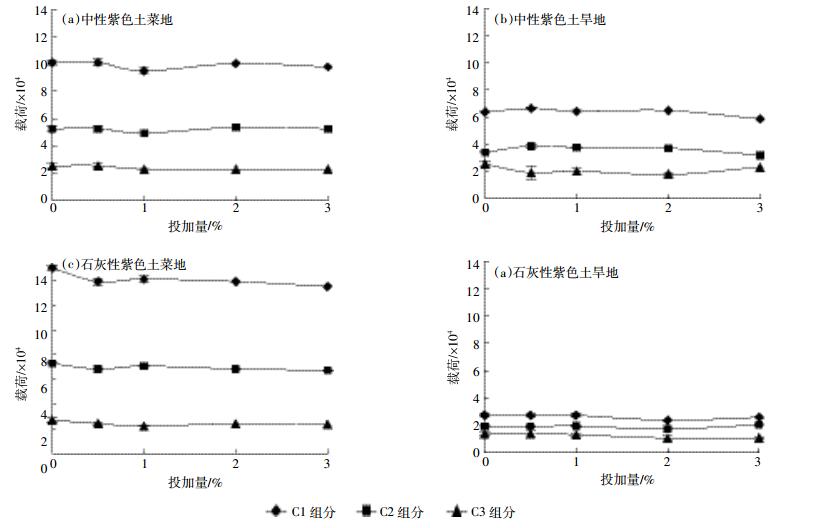
|
| 图 6 不同土壤中DOM三种PARAFAC组分的载荷及其随生物质炭投加量的变化 Figure 6 Loadings of three PARAFAC-identified components of DOM in the tested soils with/without biochar amendment |
综上, 本文主要结果表明, 在紫色土农田中投加该种生物质炭不会改变土壤中可能溶出的有机物的组成特征。未来应进一步探索在田间条件下紫色土DOM的溶出及淋失规律, 并考察生物质炭施用的长期影响。
3 结论(1) 紫色土耕地土壤中溶出DOM由两种类腐殖质和一种类蛋白质组成, 其中类腐殖质的荧光强度均高于类蛋白质; 两种紫色土的菜地土壤中各组分的含量都高于旱地土壤, 其芳香性和腐殖化程度也都高于旱地土壤。
(2) 土壤DOM含量在加炭后有显著变化, 在投加量范围 (0.5%~3%) 内中性与石灰性土壤分别表现出不同的变化规律, 但在低投加量 (0.5%) 下的DOM含量都低于对照土壤。
(3) 以多种光谱学参数表征的土壤DOM组成特征在加炭并老化后无显著变化。
| [1] | Atkinson C J, Fitzgerald J D, Hipps N A. Potential mechanisms for achieving agricultural benefits from biochar application to temperate soils:A review[J]. Plant Soil, 2010, 337(1): 1–18. |
| [2] | 袁金华, 徐仁扣. 生物质炭的性质及其对土壤环境功能影响的研究进展[J]. 生态环境学报, 2011, 20(4): 779–785. YUAN Jin-hua, XU Ren-kou. Progress of the research on the properties of biochars and their influence on soil environmental functions[J]. Ecology and Environmental Sciences, 2011, 20(4): 779–785. |
| [3] | 付琳琳, 蔺海红, 李恋卿, 等. 生物质炭对稻田土壤有机碳组分的持效影响[J]. 土壤通报, 2013, 44(6): 1379–1384. FU Lin-lin, LIN Hai-hong, LI Lian-qing, et al. Persistent effects of biochar application on organic carbon fractions of paddy soil[J]. Chinese Journal of Soil Science, 2013, 44(6): 1379–1384. |
| [4] | Mitchell P J, Simpson A J, Soong R, et al. Shifts in microbial community and water-extractable organic matter composition with biachar amendment in a temperate forest soil[J]. Soil Biology & Biochemistry, 2015, 81: 244–254. |
| [5] | Eykelbosh A J, Johnson M S, Couto E G. Biochar decreases dissolved organic carbon but not nitrate leaching in relation to vinasse application in a Brazilian sugarcane soil[J]. Journal of Environmental Management, 2015, 149: 9–16. DOI:10.1016/j.jenvman.2014.09.033 |
| [6] | Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry, 1996, 51(4): 325–346. DOI:10.1016/0304-4203(95)00062-3 |
| [7] | Chen J, LeBoeuf E J, Dai S, et al. Fluorescence spectroscopic studies of natural organic matter fractions[J]. Chemosphere, 2003, 50(5): 639–647. DOI:10.1016/S0045-6535(02)00616-1 |
| [8] | Jamieson T, Sager E, Guéguen C. Characterization of biochar-derived dissolve organic matter using UV-visible absorption and excitation-emission fluorescence[J]. Chemosphere, 2014, 103(5): 197–204. |
| [9] | Uchimiya M, Dhno T, He Z Q. Pyrolysis temperature-dependent release of dissolved organic carbon from plant, manure, and biorefinery wastes[J]. Journal of Analytical and Applied Pyrolysis, 2013, 104: 84–94. DOI:10.1016/j.jaap.2013.09.003 |
| [10] | 章明奎, WalelignD B, 唐红娟. 生物质炭对土壤有机质活性的影响[J]. 水土保持学报, 2012, 26(2): 127–131. ZHANG Ming-kui, Walelign D B, TANG Hong-juan. Effects of biochar's application on active organic carbon fractions in soil[J]. Journal of Soil and Water Conservation, 2012, 26(2): 127–131. |
| [11] | Corvasce M, Zsolnay A, D'Orazio V, et al. Characterization of water extractable organic matter in a deep soil profile[J]. Chemosphere, 2006, 62(10): 1583–1590. DOI:10.1016/j.chemosphere.2005.07.065 |
| [12] | 鲁如坤. 土壤农业化学分析法[M]. 北京: 中国农业科技出版社, 2000. LU Ru-kun. Soil and agro-chemical analysis methods[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [13] | Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science & Technology, 2003, 37(20): 4702–4708. |
| [14] | Ohno T. Fluorescence inner-filtering correction for determining the humification index of dissolved organic matter[J]. Environmental Science & Technology, 2002, 36(4): 742–746. |
| [15] | Cory R M, McKnight D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones in dissolved organic matter[J]. Environmental Science & Technology, 2005, 39(21): 8142–8149. |
| [16] | Olivieri A C. Computing sensitivity and selectivity in parallel factor analysis and related multiway techniques:The need for further developments in net analyte signal theory[J]. Analytical Chemistry, 2005, 77(15): 4936–4946. DOI:10.1021/ac050146m |
| [17] | Aciego Pietri J C, Brookes P C. Relationship between soil pH and microbial properties in a UK arable soil[J]. Soil Biology & Biochemistry, 2008, 40(7): 1856–1861. |
| [18] | 丁艳丽, 刘杰, 王莹莹. 生物炭对农田土壤微生物生态的影响研究进展[J]. 应用生态学报, 2013, 24(11): 3311–3317. DING Yan-li, LIU Jie, WANG Ying-ying. Effects of biochar on microbial ecology in agriculture soil:A review[J]. Chinese Journal of Applied Ecology, 2013, 24(11): 3311–3317. |
| [19] | Smebye A, Alling V, Vogt D R, et al. Biochar amendment to soil changes dissolved organic matter content and composition[J]. Chemosphere, 2015, 142: 100–105. |
| [20] | 邢英, 李心清, 房彬, 等. 生物炭添加对两种类型土壤DOC淋失影响[J]. 地球与环境, 2015, 43(2): 133–137. XING Ying, LI Xin-qing, FANG Bin, et al. Effects of biochar addition on DOC leaching from two different types of soils[J]. Earth and Environment, 2015, 43(2): 133–137. |
| [21] | Stedmon C A, Markager S, Bro R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy[J]. Marine Chemistry, 2003, 82(3/4): 239–254. |
| [22] | Stedmon C A, Markager S. Tracing the production and degradation of autochthonous fractions of dissolved organic matter by fluorescence analysis[J]. Limnology Oceanography, 2005, 50(5): 1415–1426. DOI:10.4319/lo.2005.50.5.1415 |
| [23] | Cory R M, McKnight D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinines in dissolved organic matter[J]. Environment Science & Technology, 2005, 39(21): 8142–8149. |
| [24] | Murphy K R, Ruiz G M, Dunsmuir W T M, et al. Optimized parameters for fluorescence-based verification of ballast water exchange by ships[J]. Environment Science & Technology, 2006, 40(7): 2357–2362. |
| [25] | 蔡文良, 许晓毅, 杜娴, 等. 嘉陵江重庆段DOM三维荧光光谱的平行因子分析[J]. 环境科学研究, 2012, 25(3): 276–281. CAI Wen-liang, XU Xiao-yi, DU Xian, et al. Parallel factor analysis with EEM on dissolved organic matter in Chongqing section of Jialing River[J]. Research of Environmental Science, 2012, 25(3): 276–281. |
| [26] | 刘笑菡, 张运林, 殷燕, 等. 三维荧光光谱及平行因子分析法在CDOM研究中的应用[J]. 海洋湖沼通报, 2012(3): 133–145. LIU Xiao-han, ZHANG Yun-lin, YIN Yan, et al. Application of three-dimensional fluorescence spectroscopy and parallel factor analysis in CDOM study[J]. Transactions of Oceanology and Limnology, 2012(3): 133–145. |
| [27] | 傅平青, 刘丛强, 吴丰昌. 溶解有机质的三维荧光光谱特征研究[J]. 光谱学与光谱分析, 2005, 25(12): 2024–2028. FU Ping-qing, LIU Cong-qiang, WU Feng-chang. Three-dimensional excitation emission matrix fluorescence spectroscopic characterization of dissolved organic matter[J]. Spectroscopy and Spectral Analysis, 2005, 25(12): 2024–2028. DOI:10.3321/j.issn:1000-0593.2005.12.031 |
 2017, Vol. 36
2017, Vol. 36