文章信息
- 甘龙, 罗玉红, 李晓玲, 胥焘, 戴泽龙, 王林泉, 黄应平
- GAN Long, LUO Yu-hong, LI Xiao-ling, XU Tao, DAI Ze-long, WANG Lin-quan, HUANG Ying-ping
- 铅污染条件下小飞蓬的铅积累与生长及叶绿素荧光动力学响应
- Pb accumulation, growth and chlorophyll fluorescence of Conyza canadensis to different concentrations of Pb stress
- 农业环境科学学报, 2017, 36(5): 876-883
- Journal of Agro-Environment Science, 2017, 36(5): 876-883
- http://dx.doi.org/10.11654/jaes.2016-1520
文章历史
- 收稿日期: 2016-11-29
2. 三峡库区生态环境教育部工程研究中心, 三峡大学, 湖北 宜昌 443002;
3. 三峡地区地质灾害与生态环境湖北省协同创新中心, 三峡大学, 湖北 宜昌 443002
2. Engineering Research Center of Eco-environment in Three Gorges Reservoir Region, Ministry of Education, China Three Gorges University, Yichang 443002;
3. Innovation Center for Geo-Hazards and Eco-Environment in Three Gorges Area, Hubei Province, Yichang 443002, China
随着工农业的发展,各种环境污染问题也日益严重,其中土壤重金属污染问题最为突出。由于人类活动使重金属在土壤中的累积量明显高于土壤环境背景值,致使土壤环境质量下降、生态恶化[1-4],其中铅被纳入国家(重金属污染综合防治十二五规划)重点监控与污染物排放量控制的五种重金属之一[5]。目前开展的很多关于治理重金属污染的研究中,应用最广泛的是植物修复技术,即通过植物对土壤中重金属的富集与转移以实现降低土壤中重金属污染的目的[6-7]。重金属污染土壤胁迫会导致植物叶绿素含量的下降,影响PSⅡ光反应中心和电子传递,影响光合作用的酶活性,进而抑制光合作用并导致生物量下降[8-9]。田保华等[10]研究的谷子幼苗生长和NADPH氧化酶及抗氧化酶体系认为,重金属胁迫影响了光合作用的酶活性,减少了色素含量,进而抑制光合作用。邓培雁等[11]研究的宝山堇菜在重金属胁迫下,叶绿素结构遭到破坏、电子传递受到阻碍。姚广等[12]的研究表明,铅胁迫作用显著抑制了玉米幼苗地上部和地下部的生长,降低了叶片光合色素含量和酶活性。
小飞蓬属一年生菊科植物,具有分布广、生物量大的特点。目前关于小飞蓬对重金属耐性的研究很多,例如丁佳红等[13]研究土壤中不同浓度铜对小飞蓬毒害及耐受性,吴惠芳等[14]研究锰胁迫对小飞蓬生长及叶绿素荧光特性的影响。而小飞蓬受重金属铅胁迫下其荧光特性的响应尚未见文献报道。本文以人工盆栽小飞蓬幼苗为对象,研究不同浓度铅胁迫下小飞蓬幼苗的生物量、叶绿素含量和叶绿素荧光特性的影响以及小飞蓬各部分的铅积累量,探讨小飞蓬对铅的积累及其生物量和光合适应能力的变化,旨在揭示小飞蓬对重金属铅的耐性机制,为小飞蓬有效用于土壤铅污染区域提供科学依据。
1 材料与方法 1.1 实验设计在三峡大学植物园中选取实验土和小飞蓬幼苗(长势一致),分别用于土壤理化指标的检测(表 1)和植株各项生理指标的测定。用硝酸铅分别配制5个铅浓度梯度(0、200、500、1000、1500 mg·kg-1)的实验土,每盆装5 kg实验土[15],每个处理设定3个平行实验。于2016年4月在每盆中栽种幼苗两株,实验过程保持土壤水分、空气和温度等实验条件一致,30 d后测定定植于5个铅浓度土壤中的植株叶片的荧光参数以及叶绿素总量,90 d后测定植株的高度、生物量(干重)以及地上部与地下部的铅含量。
在栽种30 d后,选取长势良好的叶片,使用叶绿素仪(SPAD-502Plus)对叶绿素含量进行测定,每个浓度平行测定10次。采用(LI-6400XT)便携式光合仪在叶片相同位置测定叶绿素荧光,控制CO2浓度为400 μmol·mol-1,室内温度为25 ℃。将植株充分暗适应,用弱测量光测定初始荧光(Fo),然后给1个饱和脉冲光(6000 μmol·m-2·s-1,脉冲时间0.8 s)测得最大荧光(Fm);在天气晴朗时,打开光化学光(1000 μmol·m-2·s-1),持续照射得到稳态荧光Fs,然后照射1次饱和脉冲光(6000 μmol·m-2·s-1,脉冲时间为0.8 s),测得Fm′;关闭光化学光,同时打开远红光照射3 s,测得Fo′。每个梯度平行测定10次,计算光反应中心PSⅡ的光化学效率(Fv/Fm)、光化学淬灭系数qP、非光化学淬灭系数qN、电子传递速率ETR等荧光参数[16]。
种植90 d后,采集整株植物并分为地上部和地下部,用去离子水冲洗干净后烘干,测定植株的生物量干重,用原子吸收分光光度计测定植株地上部与地下部的铅含量(测定3次),计算富集系数(BCF)和转移系数(TF),公式如下:
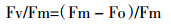 (1)
(1) 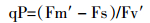 (2)
(2) 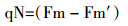 (3)
(3) 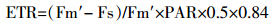 (4)
(4)  (5)
(5)  (6)
(6) 用Office 2007对实验数据进行前期处理。使用SPSS 20.0进行单因素方差分析LSD(Least Significance difference,最小显著差异法),差异显著性P < 0.05。利用Origin 8进行图表的制作。
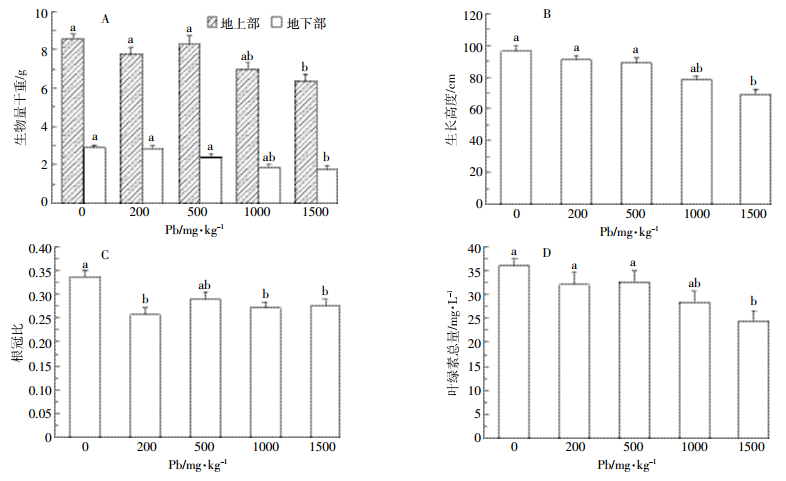
2 结果与分析 2.1 铅胁迫对小飞蓬生物量(干重)以及叶绿素总量的影响由图 1A可知,在铅胁迫90 d后,铅浓度为200、500、1000、1500 mg·kg-1组的地上部生物量(干重)分别是空白组的90.7%、96.5%、75.8%和65.5%,地下部生物量(干重)是空白组的96.5%、86.4%、69.5%和60.7%。200、500、1000 mg·kg-1组地上部与地下部生物量(干重)相对于空白组变化不大(P>0.05),小飞蓬可正常生长;1500 mg·kg-1组小飞蓬的生物量(干重)相对于0、200、500 mg·kg-1组差异显著(P < 0.05)。由图 1B可得,小飞蓬生长高度与生物量(干重)变化趋势相似,小飞蓬在200、500、1000 mg·kg-1时的生长高度与空白组差异不显著(P>0.05),1500 mg·kg-1时的生长高度仅为空白组的71.8%。这表明当铅浓度达到1500 mg·kg-1时,小飞蓬地上部与地下部的生长会受到显著的抑制作用(P < 0.05)。根冠比是植物地下部与地上部鲜重或干重的比值,可以反映植物地下部与地上部的相关性。铅胁迫下200、1000、1500 mg·kg-1组根冠比与空白组相比变化显著(P < 0.05),分别为76.3%、80.4%、81.6%,而200、1000、1500 mg·kg-1各实验组间根冠比差异不显著(P>0.05,图 1C),说明铅胁迫对小飞蓬地上部生物量(干重)的影响更显著。
|
| 不同小写字母表示处理间差异显著(P<0.05),下同 Different small letters mean significant differences between treatment (P<0.05), The same below 图 1铅胁迫对小飞蓬生物量(干重)、生长高度及叶绿素总量的影响 Figure 1Responses of biomass dry weight, plant height and total chlorophyll of C. canadensis is to Pb stress |
叶绿素作为植物光合强弱的指针,承担对光能吸收、传递和转化的作用。由图 1D得出,在铅胁迫30 d后,小飞蓬叶绿素总量随铅浓度上升而降低,200、500、1000 mg·kg-1组的叶绿素总量相对与空白组变化不大(P>0.05),分别为空白组的83.4%、88.8%和78.8%,而1500 mg·kg-1组相比空白组差异性显著,为空白组的68.1%(P < 0.05)。说明在铅浓度达到1500 mg·kg-1时,小飞蓬的叶绿素总量受抑制作用明显。
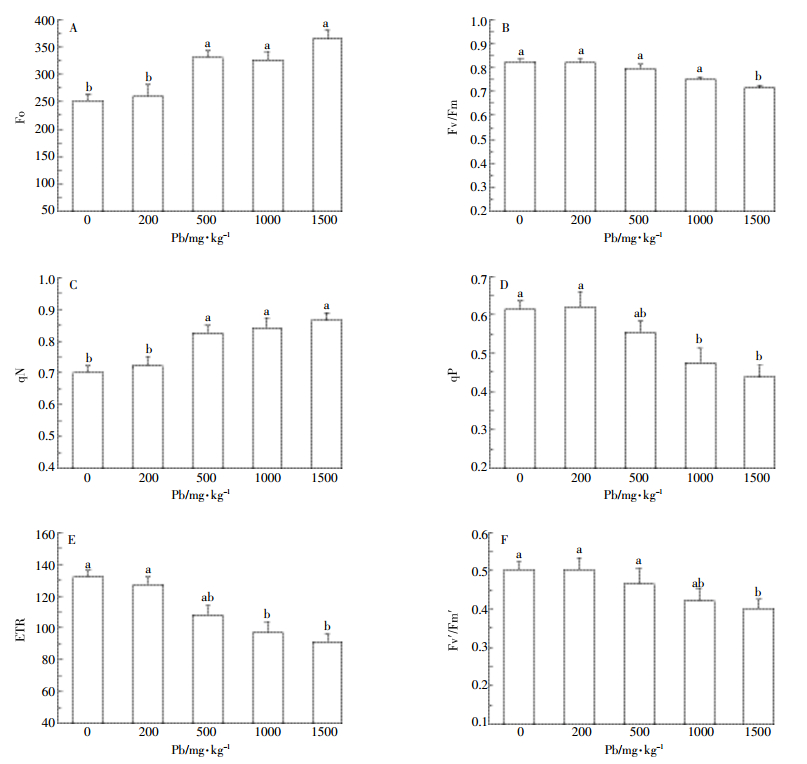
2.2 铅胁迫对小飞蓬叶片荧光参数的影响初始荧光(Fo)指充分暗适应的光合机构光系统(PSⅡ)反应中心全部开放(qP=1)且非光化学过程处于最小值(qN=0)的叶绿素荧光产量。由图 2A方差分析可知,200、500、1000、1500 mg·kg-1组的Fo值分别为空白组的1.03、1.31、1.29、1.45倍,且铅浓度越高Fo值差异越显著,500、1000、1500 mg·kg-1组相对于0、200 mg·kg-1组均有显著差异(P < 0.05)。
|
| 图 2铅胁迫对小飞蓬Fo、Fv/Fm、qN、qP、ETR以及Fv'/Fm'的影响 Figure 2Responses of Fo, Fv / Fm, qN, qP, ETR and Fv'/Fm' of C. canadensis to Pb stress |
光化学效率(Fv/Fm)指经过充分暗适应的叶片其PSⅡ的最大光化学量子效率,也被称为反应中心最大光能捕获效率,正常情况下植物的Fv/Fm在0.75~0.85。由图 2B分析得出,在铅胁迫下,200、500、1000 mg·kg-1组的光化学效率相对于空白组差异不显著(P>0.05),分别为空白组的99.6%、96.3%和91.1%。1500 mg·kg-1组的Fv/Fm值为空白组的86.6%,差异明显(P < 0.05)。说明实验组铅浓度低于1500 mg·kg-1时,Fv/Fm相较于空白组变化不大,铅胁迫对反应中心捕获光能的效率影响不显著;而铅浓度在1500 mg·kg-1时,Fv/Fm值减小,捕获光能的效率降低。
非光化学淬灭系数(qN)代表光反应中心PSⅡ对天线色素吸收多余光能然后将光能通过热能形式散失的部分,qN也反映了光反应中心的光合机构受铅胁迫的损伤程度。由图 2C可知,200、500、1000、1500 mg·kg-1组的qN值分别为空白组的1.03、1.15、1.16、1.19倍,即铅浓度达到500 mg·kg-1时,qN值显著上升(P < 0.05),而500、1000、1500 mg·kg-1组间的qN值差异不大(P>0.05)。说明在低于500 mg·kg-1铅胁迫时,小飞蓬光合机构未受损伤,能够进行正常的光合作用,当铅浓度增加到500 mg·kg-1时,铅胁迫可能使光合机构受到影响,光反应中心吸收的光能多以热能的形式散失。
光化学淬灭系数(qP)指光反应中心PSⅡ天线色素吸收光能用于光合作用电子传递的比例,qP值代表光反应中心PSⅡ开放程度的大小。由图 2D可知,200 mg·kg-1组相对于空白组差异不显著(P>0.05),铅浓度1000 mg·kg-1时qP值显著降低(P < 0.05),且1000、1500 mg·kg-1相对于空白组降到最低,分别为空白组的77.3%和71.1%。说明当铅浓度达到1000 mg·kg-1时,qP值减小,光合电子传递的比例降低,光反应中心PSⅡ开放程度减小。
电子传递速率(ETR)是指光反应中心PSⅡ在光适应条件下真实的电子传递。ETR与qP的变化趋势相似(图 2E),200、500、1000、1500 mg·kg-1组的ETR值分别为空白组的96.2%、81.5%、71.9%和68.9%;即铅浓度达到1000 mg·kg-1时,ETR值显著降低(P < 0.05),光反应中心的真实电子传递和吸收光用于光化学过程的比例降低,光合效率减弱。
Fv′/Fm′是PSⅡ有效光化学量子产量,其值反映开放的PSⅡ反应中心原初光能捕获效率。200、500 mg·kg-1组Fv′/Fm′值分别为空白组的97.8%和92.6%,变化趋势不显著(P>0.05)。当铅浓度达到1500 mg·kg-1时,Fv′/Fm′值显著降低(P < 0.05),为空白组的79.6%,即光能原初捕获效率在铅浓度1500 mg·kg-1时降到最低(图 2F)。
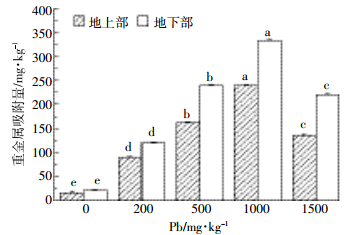
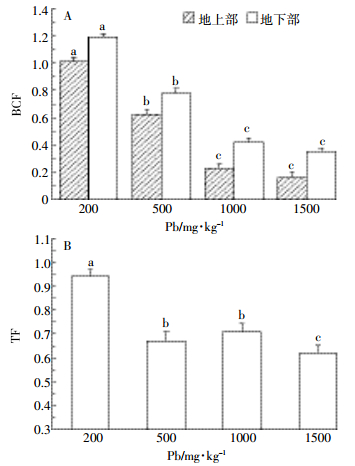
2.3 铅在小飞蓬各器官中的富集与转移经过90 d的铅胁迫实验,如图 3所示,小飞蓬地上部和地下部各组间的铅含量差异显著(P < 0.05),小飞蓬地上部和地下部对铅的吸附量随铅浓度增加分别线性增长(Y=0.22x+32.2,r2=0.96;Y=0.31x+16.7,r2=0.94),且吸附量均在1000 mg·kg-1组达到最大值240.2 mg·kg-1和333.5 mg·kg-1。在铅浓度超过1000 mg·kg-1时,小飞蓬地上部与地下部吸附的铅含量降低。同一浓度条件下,地下部吸附铅的含量大于地上部,且随铅浓度上升各部位的铅含量差异性也增大。如图 4A所示,小飞蓬地下部对铅的富集系数BCF在200 mg·kg-1时达到最大(为1.19),随铅浓度的增加,BCF显著降低(P < 0.05)。地上部的富集系数BCF变化趋势与地下部相同(P < 0.05),也在200 mg·kg-1时达到最大(为1.01)。如图 4B所示,小飞蓬地上部的转移系数TF在各组间的差异性显著(P=0.01 < 0.05),在200 mg·kg-1时TF接近于1,随铅浓度的增加,TF值显著降低(P < 0.05)。由此可知,在铅浓度200 mg·kg-1时BCF和TF值最大,小飞蓬吸附铅的效率最高,地上部的铅含量接近地下部,即小飞蓬从地下部向地上部运输重金属铅的能力达到峰值。
|
| 图 3小飞蓬各部位的铅含量 Figure 3Pb content in different parts of the C. canadensis |
|
| 图 4小飞蓬各部位对铅的富集与转移 Figure 4Enrichment and transfer of Pb in different parts of the C. canadensis |
重金属土壤通过影响植物的光合作用或降低酶活性,来抑制植物的生长发育[18-19]。小飞蓬的地上部与地下部生物量(干重)、株高在1500 mg·kg-1铅处理时相对于空白组受胁迫显著,其生长受到明显抑制,与林芳芳等[20]研究人工湿地植物对重金属铅的抗性所得出的生物量随铅添加量的增加而减少的结论相符。光合作用是植物的生命之源,叶绿素总量作为光合作用的指针与光合作用效率密切相关[21]。图 1D中叶绿素总量随铅浓度增加而显著下降,在铅浓度达到1500 mg·kg-1时小飞蓬的叶绿素总量受到显著抑制。杨帆等[22]研究的小飞蓬对重金属的耐性与吸收特性,同样证实高浓度重金属污染对小飞蓬胁迫作用明显。这可能与叶片在胁迫下积累了大量的铅,破坏了叶绿体的超微结构,抑制了叶绿素还原酶、氨基-γ-酮戊酸的合成有关[23]。
光合电子传递、叶绿素荧光以及热散失是植物耗散光能的三种途径,而在逆境中三者的比例会发生变化,通过不同荧光参数的变化,揭示植物应对外界变化特别是环境胁迫时的内在光能利用机制[24]。一般条件下,植物的荧光参数稳定,不会出现大的波动[25]。光合机构与光反应中心PSⅡ联系紧密,且Fo与光反应中心的活性有关,在铅胁迫下,Fo值上升可能是植物的光反应中心PSⅡ受到了损伤[26]。Fv/Fm作为光能转换效率高低的依据,在铅浓度为1500 mg·kg-1时降低,有研究认为这是重金属的毒害作用使酶活性降低对光反应中心的PSⅡ系统产生了抑制作用[27-28]。从小飞蓬的qP、qN、ETR和Fv′/Fm′的变化可以得知光适应状态下光反应中心PSⅡ进行光化学反应的能力[29-30]。在铅胁迫30 d后,ETR、qP、Fv′/Fm′均随铅浓度升高而降低,与qN的趋势相反。吴惠芳等[14]研究也表明,Mn胁迫下小飞蓬的光化学量子产量(Fv/Fm)、光合电子传递速率(ETR)均随着Mn离子浓度的增加明显降低,非光化学荧光淬灭系数(NPQ)则有上升趋势。这表明在Mn和Pb的胁迫下,小飞蓬的光合作用的光反应中心部分失活或者破坏,PSⅡ的电子传递受到胁迫作用,可能是铅胁迫抑制了小飞蓬PSⅡ原初醌受体QA的光化学还原效率,降低了PSⅡ向PSⅠ的电子传递[31],使得叶片吸收的光能在传递到达反应中心之前,主要通过热耗散的形式散失,从而增强自身的光保护能力,以避免或减轻光抑制甚至光氧化对光合机构的损害,使之维持一定水平的光合作用[32]。
小飞蓬地上部与地下部的BCF与TF值在200~500 mg·kg-1铅污染时接近于1,而随着铅浓度增加BCF和TF降低。根据魏树和等[35]研究结果,BCF与TF均大于1就是超富集植物,说明在200~500 mg·kg-1铅污染时,小飞蓬属于超富集的植物[36],且小飞蓬生物量大、根系发达,有固定和转移土壤中重金属的优点。小飞蓬的修复效率与土壤的铅污染程度有关,针对目前国内铅污染的现状,小飞蓬对铅污染的土壤具有很高的修复效率,所以加强这方面的研究有助于筛选出高修复率的植物[6]。后期在小飞蓬与其他重金属的作用效果以及重金属对酶活性的影响等问题上还需进一步的研究。
4 结论(1)随铅浓度的增加,小飞蓬光反应中心捕获激发能的效率和光合电子传递显著下降。光化学效率、光化学淬灭系数、电子传递速率、有效光化学量子产量在铅浓度为1000 mg·kg-1时分别为对照植株的91.1%、77.3%、71.9%和83.2%;在1500 mg·kg-1时分别为对照植株的86.6%、71.1%、68.9%和79.6%。这说明小飞蓬在1000 mg·kg-1以上的铅胁迫下,反应中心光合活性受到了损伤,但仍有较高的光合适应能力。
(2)植株地上部生物量(干重)在1000 mg·kg-1铅胁迫下为空白组的81.4%,地下部生物量(干重)为空白组的65.5%,表明在铅1000 mg·kg-1以下小飞蓬仍具有能正常生长的能力。由于土壤铅污染浓度远小于1000 mg·kg-1,可以考虑将小飞蓬用于铅污染严重区域进行植物修复。
| [1] | White P J, Brown P H. Plant nutrition for sustainable development and global health[J]. Annals of Botany, 2010, 105(7): 1073–1080. DOI:10.1093/aob/mcq085 |
| [2] | Gao B, Zhou H, Liang X, et al. Cd2+ isotopes as a potential source tracer of metal pollution in river sediments[J]. Environmental Pollution, 2013, 181: 340–343. DOI:10.1016/j.envpol.2013.05.048 |
| [3] | 谭婷, 王昌全, 李冰, 等. 成都平原土壤铅污染及其评价[J]. 长江流域资源与环境, 2005, 14(1): 71–75. TAN Ting, WANG Chang-quan, LI Bing, et al. Pollution and evaluation of Pb in soil in Chengdu plain[J]. Resources and Environment in the Yangtze Basin, 2005, 14(1): 71–75. |
| [4] | 江巧君, 周琴, 韩亮亮, 等. 有机肥对镉胁迫下不同基因型水稻镉吸收和分配的影响[J]. 农业环境科学学报, 2013, 32(1): 9–14. JIANG Qiao-jun, ZHOU Qin, HAN Liang-liang, et al. Effects of organic manure on uptake and distribution of cadmium in different rice genotypes under cadmium stress[J]. Journal of Agro-Environment Science, 2013, 32(1): 9–14. DOI:10.11654/jaes.2013.01.002 |
| [5] | Li Z, Ma Z, van der Kuijp T J, et al. A review of soil heavy metal pollution from mines in China:Pollution and health risk assessment[J]. Scienceof the Total Environment, 2014, 468/469: 843–853. DOI:10.1016/j.scitotenv.2013.08.090 |
| [6] | 杨启良, 武振中, 陈金陵, 等. 植物修复重金属污染土壤的研究现状及其水肥调控技术展望[J]. 生态环境学报, 2015, 24(6): 1075–1084. YANG Qi-liang, WU Zhen-zhong, CHEN Jin-ling, et al. Research status of phytoremediation of heavy metals contaminated soil and prospects of water and fertilizer regulating technology[J]. Ecology and Environmental Sciences, 2015, 24(6): 1075–1084. |
| [7] | 樊霆, 叶文玲, 陈海燕, 等. 农田土壤重金属污染状况及修复技术研究[J]. 生态环境学报, 2013, 22(10): 1727–1736. FAN Ting, YE Wen-ling, CHEN Hai-yan, et al. Review on contamination and remediation technology of heavy metal in agricultural soil[J]. Ecology and Environmental Sciences, 2013, 22(10): 1727–1736. DOI:10.3969/j.issn.1674-5906.2013.10.015 |
| [8] | Prasad M N V. Heavy metal stress in plants:From biomoleculesto ecosystems[M]. 2nd ed. Berlin: Springer Press, 2004: 148-170. |
| [9] | Qin T C, Wu Y S, Wang H X, et al. Effect of cadmium lead and their interactions on the physiological and ecological characteristics of root system of Brassica chinensis[J]. Acta Ecologica Sinica, 1998, 18(3): 320–325. |
| [10] | 田保华, 张彦洁, 张丽萍, 等. 镉/铬胁迫对谷子幼苗生长和NADPH氧化酶及抗氧化酶体系的影响[J]. 农业环境科学学报, 2016, 35(2): 240–246. TIAN Bao-hua, ZHANG Yan-jie, ZHANG Li-ping, et al. Effects of cadmium or chromium on growth and NADPH oxidase and antioxidant enzyme system offoxtail millet seedlings[J]. Journal of Agro-Environment Science, 2016, 35(2): 240–246. DOI:10.11654/jaes.2016.02.005 |
| [11] | 邓培雁, 刘威, 韩博平. 宝山堇菜镉胁迫下的光合作用[J]. 生态学报, 2007, 27(5): 1858–1862. DENG Pei-yan, LIU Wei, HAN Bo-ping. Photosynthesis of Viola baoshanensis under cadmium stress[J]. Acta Ecologica Sinica, 2007, 27(5): 1858–1862. |
| [12] | 姚广, 高辉远, 王未未, 等. 铅胁迫对玉米幼苗叶片光系统功能及光合作用的影响[J]. 生态学报, 2009, 29(3): 1162–1169. YAO Guang, GAO Hui-yuan, WANG Wei-wei, et al. The effects of Pb-stress on functions of photosystems and photosynthetic rate in maize seedling leaves[J]. Acta Ecologica Sinica, 2009, 29(3): 1162–1169. |
| [13] | 丁佳红, 刘登义, 李征, 等. 土壤不同浓度铜对小飞蓬毒害及耐受性研究[J]. 应用生态学报, 2005, 16(4): 668–672. DING Jia-hong, LIU Deng-yi, LI Zheng, et al. Responses of Conyza canadensis to different concentrations of copper in soil[J]. Chinese Journal of Applied Ecology, 2005, 16(4): 668–672. |
| [14] | 吴惠芳, 刘鹏, 龚春风. Mn胁迫对龙葵和小飞蓬生长及叶绿素荧光特性的影响[J]. 农业环境科学学报, 2010, 29(4): 653–658. WU Hui-fang, LIU Peng, GONG Chun-feng. Effects of manganese stress on growth, chlorophyll fluorescence parameters of Solanum nigrum L. and Conyza canadensis L.[J]. Journal of Agro-Environment Science, 2010, 29(4): 653–658. |
| [15] | 易自成, 贺俊波, 程华, 等. 镉对皇竹草构件生长及生理特性的影响[J]. 农业环境科学学报, 2014, 33(2): 276–282. YI Zi-cheng, HE Jun-bo, CHENG Hua, et al. Effects of Cd polluted soil on the modular growth and physiological characteristics of Pennisetum hydridum[J]. Journal of Agro-Environment Science, 2014, 33(2): 276–282. DOI:10.11654/jaes.2014.02.011 |
| [16] | 林琭, 汤昀, 张纪涛, 等. 不同水势对黄瓜花后叶片气体交换及叶绿素荧光参数的影响[J]. 应用生态学报, 2015, 26(7): 2030–2040. LIN Lu, TANG Yun, ZHANG Ji-tao, et al. Effects of different water potentials on leaf gas exchange and chlorophyll fluorescence parameters of cucumber during post-flowering growth stage[J]. Chinese Journal of Applied Ecology, 2015, 26(7): 2030–2040. |
| [17] | Maxwell K, Johnson G N. Chlorophyll fluorescence a practical guide[J]. Journal of Experimental Botany, 2000, 51(345): 659–668. |
| [18] | Li S, Yang W, Yang T, et al. Effects of cadmium stress on leaf chlorophyll fluorescence and photosynthesis of elsholtzia argyi:A cadmium accumulating plant[J]. International Journal of Phytoremediation, 2015, 17(1): 85–92. DOI:10.1080/15226514.2013.828020 |
| [19] | Liu J X, Sun Z Y, Gou P, et al. Response of photosynthetic physiology of perennial ryegrass(Lolium perenne) to Cd2+ stress[J]. Acta Prataculturae Sinica, 2012, 21(3): 191–197. |
| [20] | 林芳芳, 丛鑫, 黄锦楼, 等. 人工湿地植物对重金属铅的抗性[J]. 环境工程学报, 2014, 8(6): 2329–2334. LIN Fang-fang, CONG Xin, HUANG Jin-lou, et al. Resistance of artificial wetland plants to lead[J]. Chinese Journal of Environmental Engineering, 2014, 8(6): 2329–2334. |
| [21] | 卜令铎, 张仁和, 常宇, 等. 苗期玉米叶片光合特性对水分胁迫的响应[J]. 生态学报, 2010, 30(5): 1184–1191. BU Ling-duo, ZHANG Ren-he, CHANG Yu, et al. Response of photosynthetic characteristics to water stress of maize leaf in seedling[J]. Acta Ecologica Sinica, 2010, 30(5): 1184–1191. |
| [22] | 杨帆, 刘雷, 刘足根, 等. 小飞蓬对Cd的耐性与吸收特性研究[J]. 安徽农业科学, 2008, 36(6): 2501–2503. YANG Fan, LIU Lei, LIU Zu-gen, et al. Tolerance and adsorption characteristic of Conyza canadensis to cadmium[J]. Journal of Anhui Agricultural Sciences, 2008, 36(6): 2501–2503. |
| [23] | Truong P N V, Claridge J. Effects of heavy metals toxicities on vetiver growth[J]. Vetiver Newsletter, 1996, 15: 32–36. |
| [24] | Poschenrieder C, Gunse B, Barcelo J. Influence of cadmium on water relations, stomatal resistance and abscisi acid content in expanding bean leaves[J]. Plant Physiology, 1989, 90(4): 1365–1371. DOI:10.1104/pp.90.4.1365 |
| [25] | Rohaceck K. Chlorophyll fluorescence parameters:The definitions, photosynthetic meaning and mutual relationships[J]. Photosynthetica, 2002, 40(1): 13–29. DOI:10.1023/A:1020125719386 |
| [26] | 王文杰, 李文馨, 祖元刚. 紫茎泽兰茎和叶片及叶绿素荧光相关参数对不同温度处理的响应差异[J]. 生态学报, 2009, 29(10): 5424–5433. WANG Wen-jie, LI Wen-xin, ZU Yuan-gang. Differences in pigments and chlorophyll fluorescence parameters between stems and leaves Eupatorium adcnophorum under different temperature treatments[J]. Acta Ecologica Sinica, 2009, 29(10): 5424–5433. DOI:10.3321/j.issn:1000-0933.2009.10.029 |
| [27] | 姚春娟, 郭圣茂, 陈兰兰, 等. 二种决明属植物叶绿素荧光特性的比较研究[J]. 北方园艺, 2016(2): 151–153. YAO Chun-juan, GUO Sheng-mao, CHEN Lan-lan, et al. Research on the rule of absorbing fertilizer of Dictamnus dasycarpus[J]. Northern Horticulture, 2016(2): 151–153. |
| [28] | 钱永强, 周晓星, 韩蕾, 等. Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J]. 生态学报, 2100, 31(20): 6134–6142. QIAN Yong-qiang, ZHOU Xiao-xing, HAN Lei, et al. Rapid light-response curves of PSⅡ chlorophyll fluorescence parameters in leaves of Salix leucopithecia subjected to cadmium-ion stress[J]. Acta Ecologica Sinica, 2100, 31(20): 6134–6142. |
| [29] | 卢广超, 许建新, 薛立, 等. 干旱胁迫下4种常用植物幼苗的光合和荧光特性综合评价[J]. 生态学报, 2013, 33(24): 7872–7881. LU Guang-chao, XU Jian-xin, XUE Li, et al. Comprehensive evaluation on photosynthetic and fluorescence characteristics in seedlings of 4 drought resistance species[J]. Acta Ecologica Sinica, 2013, 33(24): 7872–7881. |
| [30] | Pirselova B, Boleoek P, Galusova T. Effect of cadmium and arsenic on chlorophyll fluorescence of selected soybean cultivars[J]. Russian Journal of Plant Physiology, 2016, 63(4): 469–473. DOI:10.1134/S1021443716040129 |
| [31] | Kupper H, Parameswaran A, Leitenmaier B, et al. Cadmium-induced inhibition of photosynthesis and long-term acclimation to cadmium stress in the hyperaccumulator Thlaspi caerulescens[J]. New Phytologist, 2007, 175(4): 655–674. DOI:10.1111/nph.2007.175.issue-4 |
| [32] | 贾中民, 程华, 魏虹, 等. 三峡库区岸生植物秋华柳对镉胁迫的光合响应[J]. 林业科学, 2012, 44(6): 152–158. JIA Zhong-min, CHENG Hua, WEI Hong, et al. Photosynthetic responses of the riparian Salix variegata to cadmium stress in Three Gorges Reservoir region[J]. Scientia Silvae Sinicae, 2012, 44(6): 152–158. DOI:10.11707/j.1001-7488.20120623 |
| [33] | Jackson B, Ordaz O. Genotypic difference in the inhibition of photosynthesis and chlorophyll fluorescence by salinity and cadmium stresses in wheat[J]. Journal of Plant Nutrition, 2011, 34(3): 315–323. DOI:10.1080/01904167.2011.536874 |
| [34] | 杨扬, 王晓燕, 王江, 等. 物种多样性对植物生长与土壤镉污染修复的影响[J]. 环境科学学报, 2016, 36(6): 2103–2113. YANG Yang, WANG Xiao-yan, WANG Jiang, et al. Effects of species diversity on plant growth and remediation of Cd2+ contamination in soil[J]. Acta Scientiae Circumstantiae, 2016, 36(6): 2103–2113. |
| [35] | 魏树和, 周启星, 王新. 超积累植物龙葵及其对镉的富集特征[J]. 环境科学学报, 2005, 26(3): 167–171. WEI Shu-he, ZHOU Qi-xing, WANG Xin. Cadmium-hyperaccumulator Solanum nigrum L. and its accumulating characteristics[J]. Environmental Science, 2005, 26(3): 167–171. |
| [36] | 林立金, 罗丽, 廖明安, 等. 挺水植物水田芥对镉的积累特性研究[J]. 长江流域资源与环境, 2015, 24(4): 684–689. LIN Li-jin, LUO Li, LIAO Ming-an, et al. Cadmium accumulation plant Nasturtium officinale R. BR[J]. Resources and Environment in the Yangtze Basin, 2015, 24(4): 684–689. |
 2017, Vol. 36
2017, Vol. 36