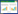文章信息
- 陈顺钰, 韩航, 陈加松, 蔡丽平, 侯晓龙, 刘爱琴, 周垂帆
- CHEN Shun-yu, HAN Hang, CHEN Jia-song, CAI Li-ping, HOU Xiao-long, LIU Ai-qin, ZHOU Chui-fan
- 柳叶箬对Pb胁迫的生理响应及其体内Pb的亚细胞分布研究
- Effects of Pb stress on physiological characteristics and subcellular distribution of Pb in Isachne globosa
- 农业环境科学学报, 2017, 36(5): 884-890
- Journal of Agro-Environment Science, 2017, 36(5): 884-890
- http://dx.doi.org/10.11654/jaes.2016-1575
文章历史
- 收稿日期: 2016-12-09
2. 海峡两岸红壤区水土保持协同创新中心, 福州 350002;
3. 福建农林大学资源与环境学院, 福州 350002
2. Co-innovation Center for Soil and Water Conservation in Red Soil Region of the Cross-straits, Fuzhou 350002, China;
3. College of Resource and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, China
随着我国工农业的快速发展,许多富含重金属的污染物通过地矿渗漏、工业废水、大气沉降、不合理施用农用物资等途径进入土壤,造成大面积土壤重金属污染。重金属具有难被植物吸收利用、不能被微生物降解和在土壤中难迁移等特征,对土壤环境造成严重破坏,并通过食物链威胁人类健康。因此,重金属污染土壤修复成为当前研究的热点[1-2]。常见污染物中,Pb是对植物产生毒性、污染频率高的重金属之一,且具有导致人体疾病的潜质[3]。土壤重金属污染治理的工程和物理化学方法一般都存在高能耗、费时、破坏土壤结构等缺点,影响修复效果[4]。植物修复技术具有安全经济、绿色环保等优点而备受关注[5]。植物修复技术的前提是筛选重金属的超富集植物。柳叶箬(Isachne globosa)是一种在南方矿区筛选出的Pb超富集植物,最高可在Pb含量超过土壤环境质量三级标准近34倍的福建尤溪铅锌矿正常生长,且在Pb浓度为1000 mg·L-1处理下,其地上部Pb含量超过1000 mg·kg-1,对Pb的转运系数达6.5,达到了Pb超富集植物的标准[6-7]。柳叶箬对Pb的耐性和超富集能力是长期适应高浓度Pb胁迫环境而造就的,其中可能蕴藏着特殊的耐性策略和解毒机理。国内外学者在超富集植物对重金属的富集能力及解毒机制方面已有部分研究[8-9],结果表明通过螯合作用固定重金属离子,在组织水平,细胞的区室化作用、细胞壁的固定作用等在耐性植物消解重金属毒害方面发挥重要作用[10]。但目前发现的Pb超富集植物种类较少,对Pb超富集植物的解毒机理尚不清楚。
鉴于此,通过室内模拟Pb胁迫水培试验,测定不同Pb浓度处理下,柳叶箬体内Pb的化学形态以及非蛋白巯基和有机酸含量,利用电镜分析其体内Pb的亚细胞分布,探讨柳叶箬如何通过生理调控来适应高浓度Pb胁迫的环境,研究其对Pb胁迫的响应策略,以期为揭示Pb超富集植物的解毒机理提供依据。
1 材料与方法 1.1 材料培养以采自福建尤溪铅锌矿的柳叶箬种子为基础材料,置于人工气候箱(温度27 ℃、湿度75%)中,待种子发芽后,选取长势较为一致的幼苗移栽于Hoagland营养液中培养,调节pH为6.0,每日蒸发的营养液用超纯水补足,每4 d更换一次营养液。待种子生根并长出新叶,选取苗高为7~10 cm的植株用于胁迫试验。
1.2 试验处理将柳叶箬植株移入装有营养液的培养桶中,每桶5株,分别加入Pb胁迫浓度为0、250、500、1000、1500 mg·L-1的溶液,每个处理3次重复。
在Pb胁迫第10 d,制备柳叶箬电镜样品。从各组中随机取1株幼苗,依次用蒸馏水和去离子水将植株叶片表面和根系冲洗干净后,用锋利刀片截取植株顶端第三片叶和白色根尖,叶片取2 mm×5 mm的小块,根尖取2 mm长,立即放入2.5%的戊二醛,在黑暗条件下固定6 h。在试验第12 d,采集鲜样进行有机酸和非蛋白巯基的测定,从培养桶中取出2株植株用去离子水反复冲洗后立即置于液氮中保存。试验进行15 d后收获植株,用蒸馏水反复冲洗,再用20 mmol·L-1 Na2EDTA浸泡15 min,将吸附于根表面的Pb交换下来,用去离子水反复冲洗干净并擦干,将地上部与根分开,置于105 ℃烘箱中杀青10 min,60 ℃烘干至恒重,经植物粉碎机磨碎处理后过0.5 mm尼龙筛备用,作为柳叶箬体内Pb化学形态的待测样品。
1.3 测定指标及方法 1.3.1 Pb在柳叶箬体内的化学形态采用化学试剂逐步提取法测定Pb在柳叶箬体内的化学形态[11],其中5种提取剂及提取顺序为:(1)FE为80%的乙醇提取态,提取醇溶性蛋白和硝酸盐、氨基酸盐等;(2)FW为去离子水提取态,提取水溶性有机盐;(3)FNaCl为1 mol·L-1的NaCl提取态,提取果胶酸盐、蛋白质结合态或吸附态重金属等;(4)FHAc为2%的醋酸提取态,提取难溶于水的重金属磷酸盐等;(5)FHCl为0.6 mol·L-1的盐酸提取态,提取草酸盐等;(6)FR为残渣态。
称取地上部和根各0.5 g,加入20 mL 80%的乙醇提取液,研磨匀浆后转入50 mL离心管,在25 ℃恒温振荡2 h后,5000 r·min-1离心10 min,倒出上清液回收;再加入20 mL乙醇提取液,浸泡2 h后回收。集中2次提取液于250 mL的三角瓶中,将提取液蒸发至近干后,用8 mL硝酸和2 mL高氯酸加热消煮至澄清,放置过夜后加热,直至三角瓶中溶液近干,冷却至室温后用去离子水定容至50 mL容量瓶中,作为待测液。将乙醇提取后的残渣用去离子水提取,依次按以上方法继续提取直至所有提取剂都完成提取后,残渣经消化后也定容至50 mL容量瓶中,作为待测液。采用SpectrAA-220原子吸收分光光度计,测定待测液中Pb的含量。
1.3.2 柳叶箬叶片有机酸含量从液氮中取柳叶箬植株相同部位叶片0.5 g用超纯水冲洗干净,吸净表面水分,加入2 mL 0.5 mol·L-1的HCl充分研磨成匀浆,于60 ℃水浴中提取1 h,将样液转入离心管内振荡15 min,置于12 000 r·min-1转速下离心10 min,过滤提取上清液,用去离子水定容至50 mL容量瓶中,取1 mL过0.45 μm微孔滤膜,放入4 ℃冰箱待测。
采用逐级提取-高效液相色谱法[12],测定待测液中草酸、柠檬酸、乙酸、苹果酸4种有机酸的含量。
1.3.3 柳叶箬体内非蛋白巯基(NPT)含量NPT含量的测定采用DTNB显色法[13]。称取柳叶箬相同部位叶片0.5 g及2 cm长根尖0.5 g,加入2 mL预冷的5%(W/V)磺基水杨酸,冰浴研磨,冰浴30 min后转移到离心管,12 000 r·min-1离心15 min;取上清液0.4 mL,依次加入3.05 mL 0.25 mol·L-1的Tris-HCl(pH8.3)和0.15 mL 10 mmol·L-1的DTNB,室温下放置20 min,然后用分光光度计(波长412 nm)测定样品吸光度值。
1.3.4 亚细胞分布采用电镜观察法对柳叶箬亚细胞的分布进行测定。将在黑暗条件下用2.5%的戊二醛固定6 h后的待测样品,用pH 7.2的磷酸缓冲液冲洗4次(每次15 min);洗涤后将样品用2%的锇酸浸泡过夜;用梯度浓度酒精逐级脱水(50%、70%、85%、90%、95%各5 min),最后在100%酒精中脱水两次,时长分别为5、10 min;Spur包埋,70 ℃聚合8 h后,用LKB8800型超薄切片机切片,在JEM-100CX型(上海秉新生物科技有限公司)透射电镜下观察并拍照。
1.4 数据处理方法所有数据均采用SPSS 19.0进行统计分析,图表中数据用平均值±标准差表示(n=3),采用单因子方差分析(One-way ANOVA)和多重比较法进行统计分析,用Tukey HSD法对处理数据进行差异显著性分析,以P < 0.05表示处理间数据差异显著。
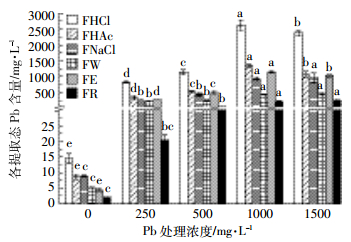
2 结果与分析 2.1 Pb在柳叶箬体内的化学形态 2.1.1 Pb在柳叶箬叶片中的化学形态由图 1可知,随着Pb胁迫浓度的增加,柳叶箬叶中各提取态Pb含量均显著增加(P < 0.05),且均在Pb处理浓度为1000 mg·L-1时达到最大,之后略有下降,说明1000 mg·L-1的Pb处理可能是柳叶箬的耐受极限。各提取态Pb含量表现为盐酸提取态>醋酸提取态>乙醇提取态>氯化钠提取态>去离子水提取态>残渣态,说明随Pb处理浓度的增大,柳叶箬叶片醇溶性蛋白、氨基酸盐、磷酸盐等含量增加,与Pb2+螯合转化为蛋白质结合态、磷酸盐结合态等难迁移的化学形态。
|
| 不同字母表示处理间在0.05水平差异显著。下同 图 1Pb胁迫下柳叶箬叶片中不同化学形态Pb含量 Figure 1Concentrations of different chemical forms of Pb in leaves of Isachne globosa under Pb stress |
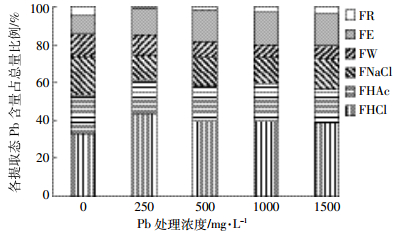
由图 2可知,不同Pb浓度处理,柳叶箬叶片中盐酸提取态Pb所占比例均最大,达到33%以上,其次是磷酸盐结合态17.5%~22%、蛋白质结合态12.5%~20.4%和氨基酸盐9.9%~17.1%,水溶性有机盐6.6%~11.8%和残渣态1.0%~4.5%占比最低。
|
| 图 2柳叶箬叶片中各提取态Pb占总量的比例 Figure 2Percentage of each extractable forms of Pb in leaves Isachne globosa in concentration |
以上结果表明,Pb胁迫条件下,柳叶箬叶片中Pb主要与磷酸根离子、草酸根离子等形成稳定难容、难迁移的螯合物,以此避免Pb对柳叶箬的毒性。
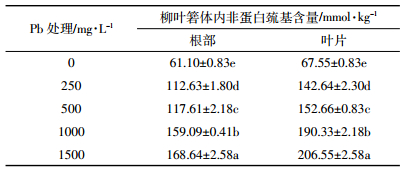
2.1.2 Pb在柳叶箬根系中的化学形态由图 3可知,随着Pb处理浓度的增加,柳叶箬根系中各提取态Pb含量先呈显著增加的趋势(P < 0.05),除残渣态以外,其他提取态均在Pb浓度为1000 mg·L-1处理时达到最大,然后有所下降;各提取态Pb含量表现为盐酸提取态>醋酸提取态>氯化钠提取态>乙醇提取态>去离子水提取态>残渣态,表明Pb在柳叶箬根系以盐酸提取态为主要存在形式。随着Pb胁迫浓度的增加,根系中草酸盐、果胶盐及蛋白质结合态的含量增加,与Pb2+螯合形成难溶于水的盐酸提取态、氯化钠提取态。
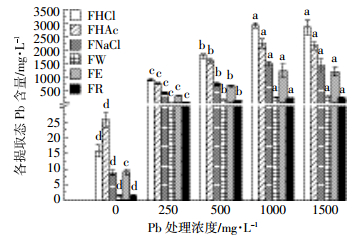
|
| 图 3Pb胁迫下柳叶箬根部各化学形态Pb含量 Figure 3Concentrations of different chemical forms of Pb in roots of Isachne globosa under Pb stress |
由图 4可知,不同Pb浓度处理,柳叶箬根系中醋酸提取态Pb所占比例最大,占26.3%~41.1%,其次是盐酸提取态25.4%~35.9%,氯化钠提取态14.1%~17.7%和乙醇提取态12.1%~17.8%,去离子水提取态2.1%~3.4%和残渣态2.5%~2.9%最低。这说明进入柳叶箬根系的Pb除磷酸盐形式外主要以草酸盐结合态、蛋白质结合态等迁移活性较弱的形态存在,从而避免Pb对柳叶箬根系的伤害。
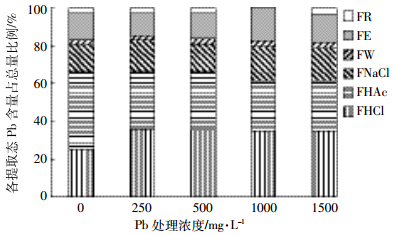
|
| 图 4柳叶箬根部各提取态Pb占总量的比例 Figure 4Percentage of each extractable forms of Pb in roots Isachne globosa in concentration |
由表 1可得,随着Pb处理浓度的增加,柳叶箬叶片中各有机酸的含量均呈增加的趋势。不同Pb胁迫处理下,柳叶箬叶片中苹果酸、草酸和柠檬酸含量均显著大于对照(P < 0.05),而乙酸不同处理间均无显著差异(P>0.05);不同Pb胁迫处理下,柳叶箬叶片中的有机酸含量表现为草酸>苹果酸>柠檬酸>乙酸,说明Pb胁迫可促进柳叶箬叶片苹果酸、草酸和柠檬酸的分泌,螯合进入体内的Pb,从而避免Pb的毒害作用。
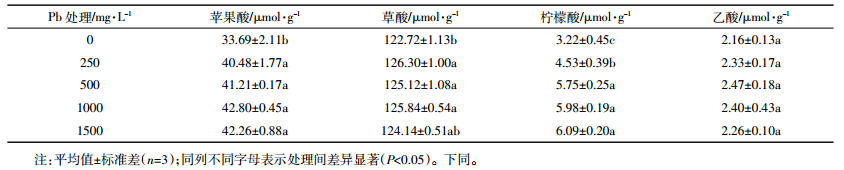
|
由表 2可得,随着Pb处理浓度的增加,柳叶箬根部和叶片的NPT含量均呈逐渐增加的趋势,并在Pb处理浓度为1500 mg·L-1时达到最大,分别为对照的2.76、3.06倍;不同Pb胁迫条件下,柳叶箬根系和叶片的NPT含量差异达显著水平(P < 0.05),且均显著大于对照(P < 0.05)。
由电镜图 5a和图 5b可以清楚的看到柳叶箬叶片中完好无损的各细胞器,在无Pb胁迫条件下细胞壁及细胞质膜表面清晰、光滑且连续,细胞核双层膜结构清晰,核仁完整,染色质均匀。从放大1000倍的图 5a中没有看到黑色颗粒沉淀。在Pb处理浓度为1000 mg·L-1条件下,与图 5a和图 5b相比,图 5c和图 5d可以明显看出Pb胁迫对柳叶箬叶片的亚细胞结构产生了一定损伤,部分细胞壁细胞膜被破环,在细胞间隙、细胞膜与细胞壁之间存在许多黑色颗粒,细胞中叶绿体基粒类囊体膨胀,基质片层排列无序,被膜结构模糊。黑色颗粒主要沉淀于细胞壁中,液泡、叶绿体中没有发现颗粒沉淀,表明大部分黑色颗粒被细胞壁固定。黄玫英等[14]、徐劼[15]通过EDS分别探讨Pb在类芦组织和茶树组织及亚细胞中的毒害效应,证实了大量沉淀于类芦细胞壁以及叶绿体等细胞器中的黑色颗粒的主要成分是Pb。因此,可以推断Pb胁迫条件下,柳叶箬叶可将Pb2+固定在细胞壁,从而对减少Pb的毒害起到重要作用。
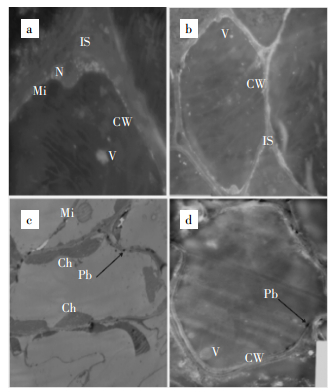
|
|
a×1000,b×1200,c×2500,d×1200 a、b为对照;c、d为Pb 1000 mg· L-1处理 CW.细胞壁Cell Wall;Ch.叶绿体Chloroplast;Mi.线粒体Mitochondria;N.细胞核Nucleus;V.液泡Vacuole;IS.细胞间隙Istercellular space。下同 图 5不同处理下的柳叶箬叶细胞透射电镜图 Figure 5Ultrastructure of leave cells of Isachne globosa in the different control treatment |
由电镜图 6a和图 6b中可以看出,在对照柳叶箬根细胞中细胞壁、线粒体、液泡清晰可见,各细胞器结构无损伤,从放大2500倍的图 6a中没有发现黑色颗粒沉淀。与对照相比图 6c和图 6d明显可以看出线粒体被膜出现破裂,内部出现空泡化现象,脊突排列无序。细胞中有黑色颗粒沉淀,且沉积密集,形成黑斑。黑斑主要沉淀于细胞壁中,与叶片细胞相比,液泡、细胞质中含有少量的黑斑。这说明Pb胁迫条件下,柳叶箬根细胞壁对Pb的区室化作用在减轻Pb的毒害时有一定作用,但Pb胁迫也对柳叶箬根系产生了危害。

|
|
a×2500,b×1200,c×1500,d×1200 a、b为对照;c、d为Pb1000 mg· L-1处理 图 6不同处理下的柳叶箬根细胞透射电镜图 Figure 6Ultrastructure of root cells of Isachne globosa in the different control treatment |
重金属对植物的毒害程度与重金属在植物体内的化学形态有密切关系[16]。本试验发现,Pb胁迫条件下,柳叶箬叶片和根系的Pb均以草酸结合态、磷酸盐结合态和蛋白质结合态等难溶、迁移能力弱、毒性低的结合态存在。杨素勤等[17]研究发现,Pb胁迫条件下,在小麦百农160和偃展4110体内Pb以醋酸提取态和盐酸提取态为主,其次是氯化钠提取态,并随Pb浓度增加难溶的草酸盐等含量增多,有效降低了Pb的毒害。崔研等[18]研究证实了芦苇体内重金属以不同的化学形态存在,其迁移能力和从基质分离的难易程度及活性有明显差异,水溶性的有机酸盐、氯化物的迁移能力比难溶于水的重磷酸盐、草酸盐强,其毒性也更强。这些研究结果与本研究一致,说明将体内Pb转化为难溶性的结合态可能是柳叶箬耐Pb的重要机理之一。
NPT是植物抵抗重金属胁迫的主要物质之一[19],巯基(-SH)与重金属离子可以形成无毒或低毒的络合物存在于植物体内,是植物解毒机理之一[20]。如Cd胁迫诱导了两个品种水稻体内NPT含量的增加,部分Cd2+与大分子量蛋白质结合,大部分与植物螯合肽(PCs)结合,从而降低Cd的毒害性[20]。本研究发现,随着Pb处理浓度的增大,柳叶箬根系和叶片的NPT含量显著增加,与前人的研究结果一致[21]。同时,有机酸对重金属胁迫下植物抵抗重金属毒害具有重要意义,低分子有机酸与多种重金属离子形成不同的可溶性络合物,抑制重金属的跨膜运输,降低植物体内的重金属浓度,减轻伤害[22-23]。在本研究中,Pb胁迫下柳叶箬叶片中柠檬酸、苹果酸、草酸等有机酸含量增加,与Pb2+发生螯合作用,形成可溶性的低毒或无毒的螯合态,此可能为柳叶箬耐Pb的重要机理之一。
细胞壁由含有负电基团(羧基、醛基、氨基及磷酸基)的纤维素、半纤维素和果胶组成,其代谢能力弱、活性低,并易与金属离子发生各种物理、化学反应,可有效防止植物体内重金属离子的跨膜转运[24-25]。徐义昆等[26]通过对Pb胁迫下香蒲细胞超微结构的观察发现,随着Pb胁迫的增加,其对香蒲亚细胞中各细胞器造成不可逆的损伤,叶绿体数目减少、线粒体结构破裂、核膜破损、核仁消失。从柳叶箬叶片和根部亚细胞结构中也发现,各细胞器在Pb处理下受到损伤以及大部分Pb2+被束缚于细胞壁中,细胞壁中亲金属离子的配位基团与进入植物体内的Pb2+相互作用形成稳定的螯合物。这对提高柳叶箬对抗Pb毒害具有重要意义,其各细胞器沉积的Pb含量还有待进一步研究。
4 结论Pb胁迫条件下,柳叶箬体内的Pb主要以草酸盐结合态、磷酸盐结合态和蛋白质结合态等难迁移的形态存在。Pb胁迫可诱导柳叶箬体内柠檬酸和苹果酸的增加,与Pb2+发生螯合作用,以降低Pb2+的毒害。Pb胁迫显著增加了柳叶箬体内非蛋白巯基含量。柳叶箬叶片和根内大部分Pb2+被束缚在细胞壁中,细胞区室化作用显著,避免了Pb对柳叶箬植株的进一步伤害。因此,有机酸和非蛋白巯基对Pb的螯合作用以及Pb的细胞区室化作用对柳叶箬在Pb胁迫过程中具有重要解毒作用。
| [1] | 薛永, 王苑螈, 姚泉洪, 等. 植物对土壤重金属镉抗性的研究进展[J]. 生态环境学报, 2014, 23(3): 528–534. XUE Yong, WANG Yuan-yuan, YAO Quan-hong, et al. Research progress of plants resistance to heavy metal Cd in soil[J]. Ecology and Environmental Sciences, 2014, 23(3): 528–534. |
| [2] | 谭九洲, 黄迎波. 植物重金属耐受分子机理的研究进展[J]. 安徽农业科学, 2014, 42(35): 12782–12785. TAN Jiu-zhou, HUANG Ying-bo. Research progress of the molecular mechanism of heavy metal tolerance of plants[J]. Journal of Anhui Agriculture Sciences, 2014, 42(35): 12782–12785. DOI:10.3969/j.issn.0517-6611.2014.35.142 |
| [3] | 乔绪强. 铅(Pb2+)胁迫下荇菜和菹草无菌苗的生理生化特性与容忍机制[D]. 南京: 南京师范大学, 2014. QIAO Xu-qiang. Under the lead stress physico-chemical responses and tolerance mechanism in Nymp hoiles peltata and Potamogeton crispus[D]. Nanjing:Nanjing Normal University, 2014. http://d.wanfangdata.com.cn/Thesis_Y2624623.aspx |
| [4] | 肖青青, 王宏镔, 王海娟, 等. 滇白前(Silene viscidula)对铅、锌、镉的共超富集特征[J]. 生态环境学报, 2009, 18(4): 1299–1306. XIAO Qing-qing, WANG Hong-bin, WANG Hai-juan, et al. Cohyper accumulative characteristics of lead, zinc and cadmium by Silene viscidula franch[J]. Ecology and Environmental Sciences, 2009, 18(4): 1299–1306. |
| [5] | Insook L, Kyunghwa B, Hyunhee K, et al. Phytoremediation of soil co-contaminated with heavy metals and TNT using four plant species[J]. Journal of Environmental Science and Health, 2007, 42(3): 2039–2045. |
| [6] | 侯晓龙, 常青山, 刘国锋, 等. Pb超富集植物金丝草(Pogonatherum crinitum), 柳叶箬(Isachne globosa)[J]. 环境工程学报, 2012, 6(3): 889–995. HOU Xiao-long, CHANG Qing-shan, LIU Guo-feng, et al. Two lead-hyperaccumulator:Pogonatherum crinitum and Isachne globosa[J]. Chinese Journal of Environmental Engineering, 2012, 6(3): 889–995. |
| [7] | Liu J G, Dong Y, Xu H. Accumulation of Cd, Pb and Zn by 19 wetland plant species in constructed wetland[J]. Journal of Hazardous Materials, 2007, 147(3): 947–953. DOI:10.1016/j.jhazmat.2007.01.125 |
| [8] | 郭晓宏, 朱广龙, 魏学智. 5种草本植物对土壤重金属铅的吸收、富集及转运[J]. 水土保持研究, 2016, 23(1): 183–186. GUO Xiao-hong, ZHU Guang-long, WEI Xue-zhi. Characteristics of up-take, bioaccumulation and tranlocation of soil lead in five species of herbaceous plants[J]. Research of Soil and Water Conservation, 2016, 23(1): 183–186. |
| [9] | 张富运, 陈永华, 吴晓芙, 等. 铅锌超富集植物及耐性植物筛选研究进展[J]. 中南林业科技大学学报, 2012, 32(12): 92–96. ZHANG Fu-yun, CHEN Yong-hua, WU Xiao-fu, et al. Research advances on screening of hyperaccumulator and tolerant plant species of Pb-Zn[J]. Journal of Central South University of Forestry & Technology, 2012, 32(12): 92–96. |
| [10] | 孙念礼, 陈琳煜, 丁培培, 等. 铅超富集植物筛选的研究进展[J]. 科学中国人, 2014, 14: 25–26. SUN Nian-li, CHEN Lin-yu, DING Pei-pei, et al. The research progress of screening Pb hyperaccumulator[J]. Scientific Chinese, 2014, 14: 25–26. DOI:10.3969/j.issn.1005-3573.2014.03.022 |
| [11] | Peronnet K, Schwartz C, Mbrel J L. Distribution of cadmium and zinc in the hyperaccumulator Thlaspi caerulescens grown on multicontaminated soil[J]. Plant and Soil, 2003, 249(1): 19–25. DOI:10.1023/A:1022560711597 |
| [12] | 黄天志, 王世杰, 刘秀明, 等. 逐级提取-高效液相色谱法快速测定植物组织中8种有机酸[J]. 色谱, 2014, 32(12): 1356–1361. HUANG Tian-zhi, WANG Shi-jie, LIU Xiu-ming, et al. Rapid determination of eight organic acids in plant tissue by sequential extraction and high performance liquld chromatography[J]. Chinese Journal of Chromatography, 2014, 32(12): 1356–1361. |
| [13] | 黄凯丰, 江解增. 复合胁迫下茭白体内镉、铅的亚细胞分布和植物络合素的合成[J]. 植物科学学报, 2011, 29(4): 502–506. HUANG Kai-feng, JIANG Jie-zeng. Sub-cellular fraction of heavy metals and production of phytochelatins in Zizania latifolia exposed to cadmium and lead[J]. Plant Science Journal, 2011, 29(4): 502–506. |
| [14] | 黄玫英, 罗洁文, 黄彩凤, 等. Pb在类芦组织和亚细胞中的分布规律和毒害效应[J]. 农业环境科学学报, 2016, 35(11): 2077–2085. HUANG Mei-ying, LUO Jie-wen, HUANG Cai-feng, et al. The distribution and toxic effects of Pb at the levels of the tissue and sub-cellular in Neyraudia reynaudiana[J]. Journal of Agro-Environmet Science, 2016, 35(11): 2077–2085. DOI:10.11654/jaes.2016-0627 |
| [15] | 徐劼. 茶树(Camellia sinensis L. )对铅的吸收累积及耐性机制研究[D]. 杭州: 浙江大学, 2011. XU Jie. Mechanisms of lead uptake/accumulation and tolerance in tea plant(Camellia sinensis L.)[D]. Hangzhou:Zhejiang University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10335-1012278223.htm |
| [16] | 梁亮, 林华, 田静, 等. 多重金属富集植物李氏禾体内铜的化学形态研究[J]. 工业安全与环保, 2016, 42(3): 4–7. LIANG Liang, LIN Hua, TIAN Jing, et al. Chemical forms of Cu in Co-accumulator Leersia hexandra Swartz[J]. Industrial Safety and Environmental Protection, 2016, 42(3): 4–7. |
| [17] | 杨素勤, 程海宽, 景鑫鑫, 等. 不同铅吸收特性小麦Pb的亚细胞分布和化学提取态[J]. 中国农业科学, 2015, 48(14): 2848–2856. YANG Su-qin, CHENG Hai-kuan, JING Xin-xin, et al. Subcellular distribution and chemical-extraction of lead in wheat with different characteristics of lead absorption[J]. Scientia Agricultura Sinica, 2015, 48(14): 2848–2856. DOI:10.3864/j.issn.0578-1752.2015.14.016 |
| [18] | 崔妍, 丁永生, 公维民, 等. 土壤中重金属化学形态与植物吸收的关系[J]. 大连海事大学学报(自然科学版), 2005, 31(2): 59–63. CUI Yan, DING Yong-sheng, GONG Wei-min, et al. Relations with chemical speciation of heavy metals in the soil and plant absorption[J]. Journal of Dalian Maritime University(Natural Science), 2005, 31(2): 59–63. |
| [19] | 王芳, 丁杉, 张春华, 等. 不同镉耐性水稻非蛋白巯基及镉的亚细胞和分子分布[J]. 农业环境科学学报, 2010, 29(4): 625–629. WANG Fang, DING Shan, ZHANG Chun-hua, et al. Non-protein thiols, subcellular and molecular distribution of cadmium in two rice cultivars with difference tolerance[J]. Journal of Agro-Environment Science, 2010, 29(4): 625–629. |
| [20] | 王朋, 邓小娟, 黄益安, 等. 镉胁迫下不同大豆品种各器官中镉和非蛋白巯基物质的动态变化[J]. 华南农业大学学报, 2016, 37(2): 42–50. WANG Peng, DENG Xiao-juan, HUANG Yi-an, et al. Dynamic changes of cadmium and non-protein thiol in different organs of different soybean genotypes under cadmium stress[J]. Journal of South China Agricultural University, 2016, 37(2): 42–50. DOI:10.7671/j.issn.1001-411X.2016.02.007 |
| [21] | Sun R, Zhou Q. Heavy metal tolerance and hyperaccumulation of higher plants and their molecular mechanisms[J]. Acta Ecologica Sinica, 2005, 29(3): 497–504. |
| [22] | 陈美静, 刘倩雯, 谭佳缘, 等. 重金属胁迫对植物有机酸代谢影响研究进展[J]. 广东农业科学, 2015, 42(24): 86–91. CHEN Mei-jing, LIU Qian-wen, TAN Jia-yuan, et al. Research advance on effects of heavy metal stress on plant organic acid metabolism[J]. Guangdong Agricultural Sciences, 2015, 42(24): 86–91. DOI:10.3969/j.issn.1004-874X.2015.24.017 |
| [23] | 刘福春. 锌胁迫对互花米草生长、金属累积和有机酸变化的影响[J]. 安徽大学学报, 2016(4): 80–86. LIU Fu-chun. Effects of zinc stress on growth, metal accumulation and organic acids changes of Spartina alterniflora Loisel[J]. Journal of Anhui University, 2016(4): 80–86. |
| [24] | 刘小文, 齐成媚, 李园, 等. 不同铅水平下紫茎泽兰细胞内铅的分布和化学形态的分析[J]. 广西植物, 2016, 36(3): 335–341. LIU Xiao-wen, QI Cheng-mei, LI Yuan, et al. Subcellular distribution and chemical forms of lead in Eupatorium adenophorum at different lead levels[J]. Guihaia, 2016, 36(3): 335–341. DOI:10.11931/guihaia.gxzw201404010 |
| [25] | 陈丽鹃, 周冀衡, 李强, 等. 镉对烟草的毒害及烟草抗镉机理研究进展[J]. 中国烟草科学, 2014, 35(6): 93–97. CHEN Li-juan, ZHOU Ji-heng, LI Qiang, et al. Advance in cadmium toxicity to tobacco and its resistance mechanism[J]. Chinese Tobacco Science, 2014, 35(6): 93–97. |
| [26] | 徐义昆, 徐小颖, 池源, 等. 香蒲对不同浓度Pb2+胁迫的生理应答及其细胞超微结构变化[J]. 西北植物学报, 2015, 35(10): 2018–2025. XU Yi-kun, XU Xiao-ying, CHI Yuan, et al. Physiological responses and ultrastructural changes of Typha orientalis Presl under Pb2+ stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(10): 2018–2025. |
 2017, Vol. 36
2017, Vol. 36