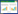文章信息
- 张金莲, 丁疆峰, 林浩忠, 党志, 易筱筠, 卢桂宁
- ZHANG Jin-lian, DING Jiang-feng, LIN Hao-zhong, DANG Zhi, YI Xiao-yun, LU Gui-ning
- 电子垃圾不当处置的重金属和多氯联苯污染及其生态毒理效应
- Pollution of heavy metals and polychlorinated biphenyls by improper e-waste dismantling activities and its ecotoxicological effect
- 农业环境科学学报, 2017, 36(5): 891-899
- Journal of Agro-Environment Science, 2017, 36(5): 891-899
- http://dx.doi.org/10.11654/jaes.2016-1616
文章历史
- 收稿日期: 2016-12-16
2. 广西大学环境学院, 南宁 530004;
3. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. School of The Environment, Guangxi University, Nanning 530004, China;
3. The Key Lab of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006, China
电子垃圾,也称电子电器废弃物,具有资源再生性和潜在环境污染性双重特点。一方面,电子垃圾中含有大量的铜、铝、铅、锌等有色金属和金、银等贵金属,回收利用可以带来巨大的经济效益;另一方面,如果回收利用处置不当或者随意丢弃,将成为重要的环境污染源并对生态系统和人体健康产生严重威胁[1-6]。作为华南地区典型电子垃圾处理集散地,广东清远市龙塘镇和石角镇的一些大型露天焚烧场和拆解作坊已在环保部门的监督下关闭,但过去数十年不当处置带来的历史污染以及现在仍然存在的零散家庭作坊式拆解给当地造成了比较突出的环境问题。
重金属和多氯联苯(Polychlorinated biphenyls,PCBs)是电子垃圾拆解场地及周边土壤检出率较高的污染物[7-11],有关不当电子垃圾处置的重金属和PCBs污染及其对土壤微生物生态毒理效应方面的研究较少,而微生物活性与群落结构多样性一直是微生物生态学和环境学科研究的重点[12-13]。因此,本实验在开展自然环境条件下电子垃圾拆解地重金属和PCBs对土壤酶活性影响研究的同时,采用现代分子生物学技术聚合酶链式反应-变性梯度凝胶电泳(Polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)对拆解区微生物群落结构进行解析,以期为土壤污染的早期预警、政府部门监管政策的制定以及土壤功能的恢复提供科学依据。
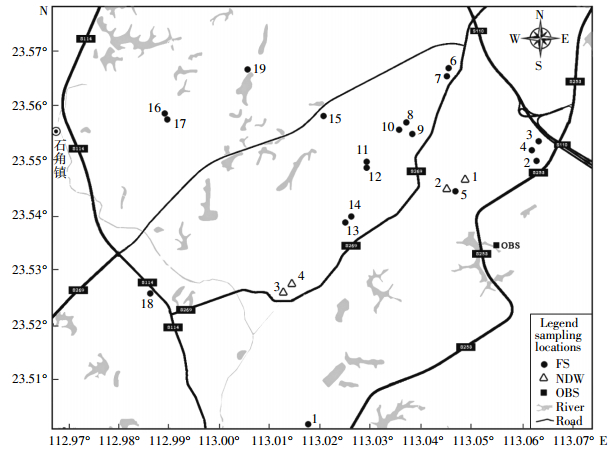
1 材料与方法 1.1 样品采集2014年3月,在清远市龙塘镇和石角镇电子垃圾拆解作坊附近及周边农田分别采集4个和19个表层0~20 cm土壤样品,同时在位于龙塘镇的一处焚烧迹地采集3个0~20 cm样品(计算时取三个样品平均值作为焚烧迹地测定值),使用手持GPS(Garmin eTrex 30)进行采样点定位,采样点的分布情况如图 1所示。所有样品置于移动冰箱中保存,返回实验室后,新鲜土样拣去植物残体杂物,分成两部分,一部分直接过20目筛,保存于4 ℃冰箱,用于微生物指标测定;另一部分室内避光风干以供土壤理化性质、重金属和PCBs分析使用。
|
| FS,农田;NDW,拆解作坊附近;OBS,焚烧迹地 FS, farmland soil; NDW, area near dismantling workshop; OBS, at the open burning site 图 1电子垃圾拆解区土壤采样示意图 Figure 1Distribution outline of sampling sites in the e-waste dismantling area |
采用土壤农化常规分析方法[14]测定土样pH值,烧失量法(Loss on Ignition,LOI)[15]测定有机质含量,半微量凯氏定氮法[16]和磷钼蓝比色法[16]分别测定全氮和全磷含量。
1.2.2 土壤重金属和PCBs含量测定土壤样品经氢氟酸-硝酸-高氯酸微波消解(Milestone ETHOS1型微波消解仪)后采用Hitachi Z-2300型原子吸收光谱仪分别测定土样中Pb、Cu、Cd、Zn、Cr和Ni这6种重金属元素含量[17]。测定重金属含量时,每批样品(19个)中做1个方法空白,并用参比物质污染土壤(GBW07430)进行土壤重金属含量分析的流程、方法以及仪器控制。
采用超声提取法提取土样中PCBs,柱层析法进行净化后,使用DSQ Ⅱ型单四极杆气相色谱-质谱联用仪分析土样中PCBs含量[18]。PCBs测定质量控制为每10个样品添加一个空白样,同时用清洁土壤配制Aroclor1254浓度为12 mg·kg-1的质控土壤,土壤老化3个月后按上述方法测定回收率为85%~91%。
1.2.3 土壤酶活性测定采用苯酚-次氯酸钠比色法[19]测定脲酶活性,3,5-二硝基水杨酸比色法[19]测定蔗糖酶活性,紫外分光光度法[20]测定土壤过氧化氢酶活性,磷酸苯二钠比色法[21]测定磷酸酶活性。脲酶、蔗糖酶和磷酸酶活性分别以24 h内每克土壤产生的氨态氮、葡萄糖和酚的量来表示,过氧化氢酶活性则用20 min内每克土壤分解的过氧化氢毫克数表示。
1.2.4 土壤微生物群落结构分析采用土壤基因组快速抽提试剂盒(生工SK8233)提取样品DNA,分装后于-20 ℃存放。
采用V3高变区通用引物357F和518R进行目的片段扩增[22]。正向引物为357F:5′-CCTACGGGA-GGCAGCAG-3′,反向引物为518R:5′-ATTACCGCGGCTGCTGG-3′,40个GC夹(CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCC-C)加到F357前,以保证DGGE实验的稳定和片断的分离。
反应体系为50 μL总体积,其中灭菌超纯水41.25 μL,10×Buffer(含2.0 mmol·L-1 MgCl2)5 μL,dNTP(10 mmol·L-1)1 μL,357F-GC(10 μmol·L-1)1 μL,518 R(10 μmol·L-1)1 μL,Taq酶(5 U/μL)0.25 μL,模板DNA 0.5 μL。
反应程序:94 ℃预变性4 min;94 ℃变性0.5 min,56 ℃退火1 min,72 ℃延伸0.5 min,30个循环;72 ℃延伸7 min。PCR产物用1.5%琼脂糖凝胶电泳检测。
利用DGGE分离PCR产物,变性梯度为30%~60%,聚丙烯酰胺凝胶浓度为8%,在60 V电压下,60 ℃恒温,1×TAE中电泳16 h。电泳完毕采用溴化乙锭进行染色,凝胶成像系统(美国Bio-Rad)中观察。
选取优势条带进行切胶回收,使用不含GC夹子的相同引物进行PCR扩增,PCR反应体系与程序同上。所得PCR产物采用生工SK8131试剂盒进行回收纯化后委托上海生工生物工程有限公司进行克隆测序。
1.3 数据分析采用Excel 2007和SPSS 19.0软件进行数据处理和分析。
2 结果与讨论 2.1 土壤基本理化性质土壤样品主要理化性质见表 1。本研究中焚烧迹地设置1个采样点,拆解作坊附近及周边农田分别设置4个和19个采样点,每个点位采集3个或3个以上土壤样品充分混匀后用四分法取1~2 kg作为1个样本,焚烧迹地土壤pH值、全磷、全氮和有机质含量用平均值(标准差)表示,拆解作坊附近及周边农田各项指标数值用平均值(范围)表示。由表 1可知,采集土样以酸性土壤为主,其中农田土壤pH平均值最低,拆解作坊附近土壤pH平均值最高;土壤全磷和全氮含量平均值以拆解作坊附近最高,农田次之,焚烧迹地最低;有机质含量平均值以拆解作坊附近最高,焚烧迹地次之,农田最低。由于拆解作坊分布于居民区,日常生活污水和垃圾的随意排放和倾倒可能是造成拆解作坊附近土壤偏中、碱性以及全磷、全氮和有机质含量较高的重要原因。
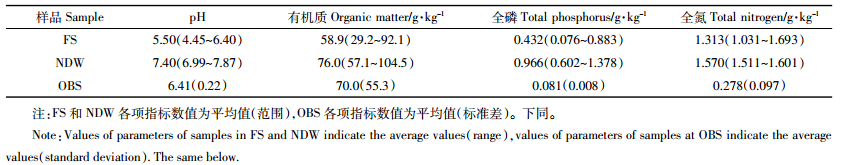
土样重金属和PCBs含量如表 2所示。无序电子垃圾回收活动产生的污染非常严重,龙塘镇和石角镇拆解作坊周边农田土壤也受到一定程度的污染。农田土样Cd和Cu含量平均值以及部分采样点位Pb和Zn含量超过国家《食用农产品产地环境质量评价标准》(HJ/T 332—2006)的限值要求(Pb≤80、Cd≤0.3、Cu≤50、Zn≤200、Cr≤150、Ni≤40 mg·kg-1);农田表土PCBs含量平均值为170.5 μg·kg-1,为Ren等[23]报道的我国土壤PCBs含量平均值(0.515 μg·kg-1)的331倍,少数采样点位PCBs含量平均值超过加拿大为保护环境和人体健康设置的土壤中PCBs指导值(500 μg·kg-1)[24]。因此,本研究重点关注重金属Cd、Cu、Pb、Zn以及PCBs对土壤微生物的生态毒理效应。
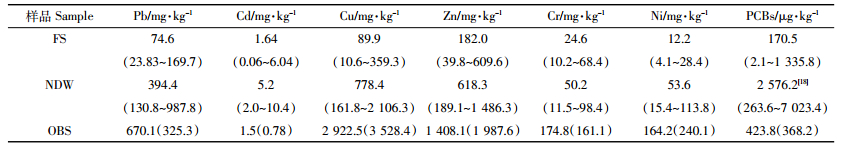
土壤酶是一种具有生物催化能力和蛋白质性质的高分子活性物质,作为土壤组分中最活跃的有机成分之一,不仅可以表征土壤物质能量代谢旺盛程度,而且可以作为评价土壤肥力高低、生态环境质量优劣的一个重要生物指标。测定焚烧迹地、拆解作坊附近和周边农田表层土壤酶活性,结果如表 3所示。
由表 3可知,不同种类土壤酶对不当电子垃圾拆解污染的响应存在较大差异,酸性磷酸酶和碱性磷酸酶均在农田土壤中活性最高,焚烧迹地中活性最低;过氧化氢酶、脲酶和蔗糖酶变化趋势一致,3种酶在拆解作坊附近表土中活性最高,焚烧迹地和农田土壤中活性相差不大。本研究中农田受重金属和PCBs污染程度最轻,农田土壤中酸性磷酸酶和碱性磷酸酶活性相应地高于拆解作坊附近和焚烧迹地表土中酶活性,反映了不当电子垃圾拆解污染对土壤的生化毒性。线性回归分析显示酸性磷酸酶活性与Pb、Cu和Zn含量在P < 0.01水平上显著负相关,与Cd和PCBs含量在P < 0.05水平上显著负相关。由于不当电子垃圾拆解产生的污染物种类比较复杂,虽然目前尚不能确定重金属和PCBs是影响微生物活性的主要因素,但从统计分析结果来看,Pb、Cu、Zn、Cd和PCBs污染是不可忽略的因素。酸性磷酸酶活性还与土壤pH值在P < 0.01水平上显著负相关,说明理化性质也是影响土壤酶活性的重要因素之一。过氧化氢酶、脲酶和蔗糖酶并没有同酸性磷酸酶一样呈现随重金属和PCBs浓度升高活性显著下降的规律,相反这3种酶在重金属和PCBs污染程度较重的拆解作坊附近表土中的活性高于其在污染程度相对较轻的农田土样中的活性,线性回归分析结果表明过氧化氢酶活性与Cd含量和PCBs含量均在P < 0.05水平上显著正相关。此外,过氧化氢酶活性与土壤pH值和全磷含量在P < 0.01水平上显著正相关,再次证明土壤酶活性不仅只受电子垃圾拆解所释放污染物的影响,还与包括土壤养分、pH值在内的理化性质等因素关系密切。过氧化氢酶是抗氧化防御系统酶中重要的酶类之一,为减小环境有害因素对微生物的影响起重要作用,它能被环境有害因素所诱导,过氧化氢酶活性状况在一定程度上能反映污染物对环境的胁迫情况。陈立涛[25]发现离电子垃圾拆解区域越近,PCBs污染越严重区域,土壤过氧化氢酶活性越高,本研究中过氧化氢酶活性与PCBs含量在P < 0.05水平上显著正相关,与其研究结果一致。至于过氧化氢酶活性与Cd含量之间亦呈显著正相关关系,则可能与电子垃圾回收活动中伴随重金属排放的其他具有生物毒性的污染物(如PCBs、多溴联苯醚等)有关。
在长期持续受不当电子垃圾拆解污染区域,重金属和PCBs等污染物进入土壤后,对微生物的作用可能主要表现在早期阶段,随着时间的推移,生理生化活性更强的耐性微生物逐渐替代了敏感微生物,部分土壤酶受抑制程度减轻甚至被激活,故而出现拆解作坊附近土壤重金属和PCBs含量高于农田,其土壤过氧化氢酶、脲酶和蔗糖酶活性亦高于农田的现象。总之,由于自然条件下电子垃圾拆解区污染物往往以各类污染物复合污染的形式存在,再加上pH、土壤养分、污染物生物有效性、植被等因素,土壤酶活性的变化更为复杂,过氧化氢酶、脲酶和蔗糖酶活性随重金属和PCBs含量增加而升高的原因有待进一步探讨。
2.4 重金属和PCBs污染对土壤微生物多样性的影响在研究重金属和PCBs污染对土壤微生物多样性的影响时,除焚烧迹地3个平行样品外,从4个拆解作坊附近土样中随机挑选1和4号点位样品作为龙塘镇和石角镇拆解作坊附近代表样品。同时,因为焚烧迹地和拆解作坊主要位于龙塘镇到石角镇的省道公路两旁村庄内,所以随机选取离公路较近的1、6、12号点位作为距离拆解中心区域较近的农田代表样品,离公路较远的2、3、15、16、17、19号采样点样品作为距离拆解中心区域较远的农田代表样品,以考察污染物迁移对土壤微生物群落结构的影响。
2.4.1 总细菌DGGE图谱分析从环境样品直接提取总DNA,经PCR扩增得到含有某一高变区的目的DNA序列产物,通过DGGE得到指纹图谱。如图 2所示,不同样品的DGGE图谱在条带的数量、位置及亮度上均存在一定差异,3、6、7、8、11、12号条带在每个样品中均有出现,且随着污染程度的减轻,6条条带的亮度逐渐增强;1号条带在S1和S2样品中出现;2号条带在S1~S4样品中出现;4、5、14号条带仅在S3样品中出现;9、15号条带在S9~S14样品中出现;10号条带在S1~S4和S6~S8样品中出现;13号条带在S3、S4、S6和S8样品中出现。14个泳道中均出现的6条条带,不仅广泛存在于污染程度低的样品中,而且对较高含量的重金属和PCBs也有一定的耐受性,对环境变化有较强的适应性。这6条条带在不同泳道的亮度不同,表明其代表的微生物类群在数量上存在一定的差异,例如样品S9~S14所在泳道的条带明显变亮加宽,说明其所代表细菌的数量大幅增加。1、2、4、5和14号条带在重金属和PCBs污染程度较高的焚烧迹地和拆解作坊附近样品中(S1~S4)出现,说明这些微生物类群对高浓度重金属和PCBs有较高的耐受性;9和15号条带仅在离拆解中心区域较远的农田土壤中(S9~S14)出现,说明其代表的微生物类群对低含量重金属和PCBs有一定的耐受性;10和13号条带在部分焚烧迹地、拆解作坊附近和分布于拆解作坊周边的农田土样中同时出现,表明其所代表的微生物类群对环境中重金属和PCBs含量有较高的选择性。这些特征微生物的出现可以作为电子垃圾拆解区土壤受某浓度范围重金属和PCBs胁迫的指示菌。

|
| S1、S2、S3为焚烧迹地土样;S4、S5为拆解作坊附近土样;S6、S7、S8为距离拆解中心区域较近的农田土样;S9~S14为距离拆解中心区域较远的农田土样 S1, S2 and S3 represented samples at open burning site; S4 and S5 represented samples nearby the dismantling workshops; S6, S7 and S8 represented farmland samples around the central dismantling area; S9~S14 represented samples far away from the central dismantling area 图 2土壤样品DGGE图谱 Figure 2DGGE fingerprint of surface soil samples |
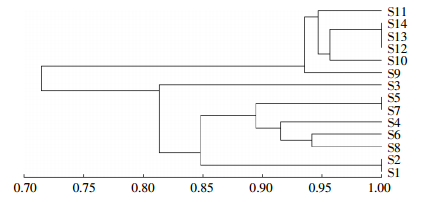
通过非加权组平均法(UPGMA算法)作出聚类分析图(图 3),说明微生物群落的同源性。由图 3可以看出,对于14个土壤样品,微生物群落结构的差异较为明显,可分为两大族群:S9~S14归为一族,S1~S8归为一族。这说明距离拆解中心区域较远,污染程度较轻的土壤微生物群落结构不同于焚烧迹地、拆解作坊附近等从事无序电子垃圾回收活动的场地或距离拆解中心区域较近的土壤微生物群落结构,不当电子垃圾拆解污染对土壤微生物群落结构产生一定影响。
|
| 图 3样品聚类分析图 Figure 3Clustering analysis of soil samples |
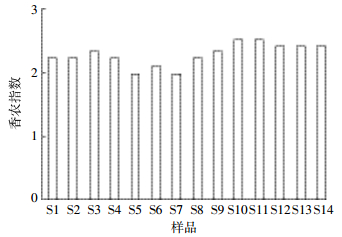
香农多样性指数愈大,群落中生物种类复杂程度越高,群落所含的信息量愈大。从图 4可以看出,土壤样品香农指数变化范围为1.946~2.485,长期持续受电子垃圾拆解污染的焚烧迹地、拆解作坊附近及周边农田样品(S1~S8)微生物多样性指数平均值(2.133)低于离拆解中心区域较远农田土样(S9~S14)指数平均值(2.411),某种程度上反映了无序电子垃圾拆解对当地土壤微生物的损伤。
|
| 图 4不同土壤样品总细菌香农多样性指数 Figure 4Shannon diversity index of bacteria in different samples |
本研究中尽管不当电子垃圾拆解污染对微生物群落结构产生影响,但是重金属和PCBs含量与多样性指数之间的相关性并不显著。自然条件下土壤微生物群落结构的影响因素较为复杂,主要包括物理、化学以及生物因素等方面。首先,微生物活性和群落组成与土壤肥力和环境质量有关,本实验所采集龙塘镇和石角镇土样具有不同的特点和环境质量,例如大多数土样被重金属和有机物污染,研究表明重金属和PCBs是影响微生物群落结构的重要因素[25-26];其次,重金属和有机物进入土壤后,不仅可以通过降低物种丰度影响微生物群落组成,还可以通过增加某些耐重金属和有机污染物的菌群改变土壤微生物群落结构。香农指数是一个既包括物种丰富度又包括物种均匀度的综合指标,因此多样性指数的变化,可能归因于抗性微生物的多寡或者物种均匀度的高低。此外,对农田土壤来说,微生物群落结构还与其管理方式(如喷洒农药、施用肥料及不同土地耕作方式等)有关,不同农田管理方式下,土壤理化性质会发生变化,直接影响到土壤微生物多样性[27-28]。
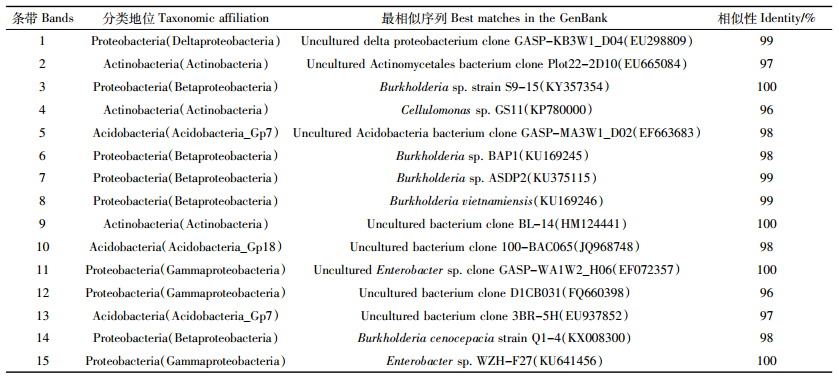
2.4.3 特异性条带测序结果一共有15条条带从凝胶上(见图 2)切割并克隆测序,所得序列在核糖体数据库(http://rdp.cme.msu.edu/seqmatch/seqmatch_intro.jsp)中获得序列所代表微生物的分类等级,并在GenBank数据库(http://www.ncbi.nlm.nih.gov/BLAST/)中搜索最相似序列,结果如表 4所示。这15条序列分属于变形菌门Proteobacteria(Beta-、Delta-和Gammaproteobacteria纲),放线菌门Actinobacteria(Actinobacteria纲)和酸杆菌门Acidobacteria(Acidobacteria_Gp7和Acidobacteria_Gp18纲),Proteobacteria门占60%,是最优势的类群。在Proteobacteria门中,Beta纲占55.6%、Delta纲占11.1%,Gamma纲占33.3%。出现在所有土样中的3、6、7、8、11、12号条带所代表的Proteobacteria类群所占比例最大,说明Proteobacteria类群在不当电子垃圾拆解污染土壤微生物群落中具有重要地位。其中,3号克隆序列与GenBank中从酸性矿山废水污染河流流域分离得到的耐重金属菌株Burkholderia sp. strain S9-15(KY357354)相似性高达100%,6、7、8和12号序列均与GenBank中多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)降解菌株最为接近,相似性分别为98%、99%、99%和96%,这些序列所代表的微生物可能对土壤中包括PAHs在内的物质和能量转化及微生物生态有重要的影响。4号序列与GenBank中从富含重金属矿山湖泊沉积物分离获得的一株菌株Cellulomonas sp. GS11(KP780000)相似性为96%,14号序列与GenBank中耐重金属菌株Burkholderia cenocepacia strain Q1-4(KX008300)相似性为98%,4号和14号条带仅在焚烧迹地样品中出现,它们所属的微生物类别对高浓度重金属有着较强的耐受性。与10号条带序列最相似序列(相似性98%)为未培养bacterium clone 100-BAC065(JQ968748),来源于PCBs污染沉积物,10号条带所代表的特征微生物可以作为焚烧迹地、拆解作坊附近和分布于拆解作坊周边农田土样PCBs浓度范围胁迫的指示菌。13号序列与GenBank中来自中性淡水生境中的序列(EU937852)具有97%的相似性,对生态系统中铁氧化物的生物地球化学循环以及有机物、无机营养物和微量金属等循环至关重要[29]。
|
(1)不同种类土壤酶对不当电子垃圾拆解污染的响应存在较大差异,其中酸性磷酸酶活性与土壤中几种主要污染重金属Cd、Cu、Pb和Zn以及PCBs含量之间具有显著的负相关关系,是对重金属和PCBs污染响应最为敏感的指标。此外,酸性磷酸酶与土壤pH值在P < 0.01水平上显著负相关,过氧化氢酶活性与土壤pH值和全磷含量在P < 0.01水平上显著正相关,说明土壤酶活性不仅受重金属和多氯联苯等污染物的影响,还与土壤养分、pH值等因素密切相关。
(2)焚烧迹地、拆解作坊附近以及离拆解中心区域较近的农田土壤微生物多样性指数低于距离拆解地中心区域较远的农田土壤微生物多样性指数,一定程度上反映了不当电子垃圾拆解污染对当地土壤微生物的损伤。Proteobacteria门是拆解区土壤样品中优势微生物类群,占克隆总数的60%,重金属和PCBs对土壤微生物群落结构产生一定影响。部分克隆测序序列在GenBank中最相似序列与PAHs和PCBs等有机物降解和重金属抗性微生物有关。
| [1] | Chen S J, Tian M, Zheng J, et al. Elevated levels of polychlorinated biphenyls in plants, air, and soils at an e-waste site in Southern China and enantioselective biotransformation of chiral PCBs in plants[J]. Environmental Science and Technology, 2014, 48(7): 3847–3855. DOI:10.1021/es405632v |
| [2] | 唐斌, 罗孝俊, 曾艳红, 等. 电子垃圾拆解区污染池塘中鱼类多氯联苯及其代谢产物的组织分配及暴露风险[J]. 环境科学, 2014, 35(12): 4655–4662. TANG Bin, LUO Xiao-jun, ZENG Yan-hong, et al. Polychlorinated biphenyls and their methylsulfonyl metabolites in fish from an electronic waste recycling site in China:Tissue distribution and human dietary exposure[J]. Environmental Science, 2014, 35(12): 4655–4662. |
| [3] | 邓绍坡, 骆永明, 宋静, 等. 电子废弃物拆解地PM10中多氯联苯、镉和铜含量调查及人体健康风险评估[J]. 环境科学研究, 2010, 23(6): 733–740. DENG Shao-po, LUO Yong-ming, SONG Jing, et al. Concentrations of polychlorinated biphenyls, cadmium and copper in inhalable particulate(PM10) from an e-waste recycling area and human health risk assessment[J]. Research of Environmental Sciences, 2010, 23(6): 733–740. |
| [4] | 周翠, 杨祥田, 何贤彪, 等. 电子垃圾拆解区农作物可食部重金属污染评价[J]. 浙江农业学报, 2011, 23(4): 798–801. ZHOU Cui, YANG Xiang-tian, HE Xian-biao, et al. Heavy metals pollution assessment of edible parts of crops grown around e-waste disassembling areas[J]. Acta Agriculturae Zhejiangensis, 2011, 23(4): 798–801. |
| [5] | 黄晋荣. 电子垃圾拆解区学龄儿童重金属暴露对尿视黄醇结合蛋白和β-2-微球蛋白含量的影响[D]. 汕头: 汕头大学, 2010. HANG Jin-rong. Elevated heavy metals levels and its effect on urinary retinol binding protein and Beta-2-microglobulin of school children in an e-waste recycling town[D]. Shantou:Shantou University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10560-2010270026.htm |
| [6] | 黄超胜. 贵屿及周边地区农业土壤中多环芳烃的空间分布研究和生态风险评价[D]. 广州: 暨南大学, 2012. HUANG Chao-sheng. Spatial distribution and ecological risk assessment of PAHs in agricultural soil of Guiyu and surrounding areas[D]. Guangzhou:Jinan University, 2012. http://cdmd.cnki.com.cn/article/cdmd-10559-1012032026.htm |
| [7] | Tang X J, Shen C F, Shi D Z, et al. Heavy metal and persistent organic compound contamination in soil from Wenling:An emerging e-waste recycling city in Taizhou area, China[J]. Journal of Hazardous Materials, 2010, 173(1/2/3): 653–660. |
| [8] | 张朝阳, 彭平安, 刘承帅, 等. 华南电子垃圾回收区农田土壤重金属污染及其化学形态分布[J]. 生态环境学报, 2012, 21(10): 1742–1748. ZHANG Chao-yang, PENG Ping-an, LIU Cheng-shuai, et al. Heavy metal contaminations and chemical speciation of farmland soils in an e-waste recycling town in South China[J]. Ecology and Environmental Sciences, 2012, 21(10): 1742–1748. DOI:10.3969/j.issn.1674-5906.2012.10.019 |
| [9] | Liu M, Huang B, Bi X H, et al. Heavy metals and organic compounds contamination in soil from an e-waste region in South China[J]. Environmental Science:Processes & Impacts, 2013, 15(5): 919–929. |
| [10] | 张微. 台州某废弃电子垃圾拆解区土壤中PCBs和重金属污染及生态风险评估[D]. 杭州: 浙江工业大学, 2013. ZHANG Wei. Characterization and risk assessment of polychlorinated biphenyls and heavy metals in soils from an abandoned e-waste recycling area in Taizhou, China[D]. Hangzhou:Zhejiang University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10337-1013365444.htm |
| [11] | 朱崇岭. 珠三角主要电子垃圾拆解地底泥、土壤中重金属的分布及源解析[D]. 广州: 华南理工大学, 2013. ZHU Chong-ling. Distribution and source apportionment of heavy metals in sediment, soil of PRD major electronic waste dismantling ground[D]. Guangzhou:South China University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10561-1014152086.htm |
| [12] | Zhang J M, Ming H. Eco-toxicity and metal contamination of paddy soil in an e-wastes recycling area[J]. Journal of Hazardous Materials, 2009, 165(1): 744–750. |
| [13] | Correa P A, Lin L, Just C L, et al. The effects of individual PCB congeners on the soil bacterial community structure and the abundance of biphenyl dioxygenase genes[J]. Environment International, 2010, 36(8): 901–906. DOI:10.1016/j.envint.2009.07.015 |
| [14] | 李酋开. 土壤农化常规分析法[M]. 北京: 科学出版社, 1984: 67-69. LI You-kai. Common methods for soil agro-chemistrical analysis[M]. Beijing: Science Press, 1984: 67-69. |
| [15] | Heiri O, Lotter A F, Lemcke G. Loss on ignition as a method for estimating organic and carbonate content in sediments:Reproducibility and comparability of results[J]. Journal of Paleolimnology, 2001, 25(1): 101–110. DOI:10.1023/A:1008119611481 |
| [16] | 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000: 34-35. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. Beijing: Chinese Agricultural Press, 2000: 34-35. |
| [17] | 张金莲, 丁疆峰, 卢桂宁, 等. 广东清远电子垃圾拆解区农田土壤重金属污染评价[J]. 环境科学, 2015, 36(7): 2633–2640. ZHANG Jin-lian, DING Jiang-feng, LU Gui-ning, et al. Heavy metal contamination in farmland soils at an e-waste disassembling site in Qingyuan, Guangdong, South China[J]. Environmental Science, 2015, 36(7): 2633–2640. |
| [18] | 丁疆峰, 张金莲, 党志, 等. 多氯联苯在电子垃圾拆解地周边农田土壤中的分布及其对土壤微生物数量的影响[J]. 科学技术与工程, 2015, 15(19): 48–53. DING Jiang-feng, ZHANG Jin-lian, DANG Zhi, et al. Polychlorinated biphenyls contamination and its effect on microbial population in soil near e-waste dismantling area in Qingyuan, Guangdong, South China[J]. Science Technology and Engineering, 2015, 15(19): 48–53. DOI:10.3969/j.issn.1671-1815.2015.19.009 |
| [19] | 关松荫. 土壤酶及其研究方法[M]. 北京: 农业出版社, 1986: 274-340. GUAN Song-yin. Soil enzyme and research method[M]. Beijing: Agricultural Press, 1986: 274-340. |
| [20] | 杨兰芳, 曾巧, 李海波, 等. 紫外分光光度法测定土壤过氧化氢酶活性[J]. 土壤通报, 2011, 42(1): 207–210. YANG Lan-fang, ZENG Qiao, LI Hai-bo, et al. Measurement of catalase activity in soil by ultraviolet spectrophotometry[J]. Chinese Journal of Soil Science, 2011, 42(1): 207–210. |
| [21] | 中国科学院南京土壤研究所.土壤微生物研究法[M].北京:科学出版社, 1985:273-275. Nanjing Institute of Soil Science, Chinese Academy of Science. Research methods on soil microorganism[M]. Beijing:Science Press, 1985:273-275. |
| [22] | 郭建华, 李华平, 朱红惠. 大宝山重金属污染土壤微生物群落优势种群分析[J]. 华南农业大学学报, 2010, 31(3): 56–60, 89. GUO Jian-hua, LI Hua-ping, ZHU Hong-hui. Analysis of dominant species of microbial community in heavy metals contaminated soil from Dabaoshan area[J]. Journal of South China Agricultural University, 2010, 31(3): 56–60, 89. |
| [23] | Ren N, Que M, Li Y F, et al. Polychlorinated biphenyls in Chinese surface soils[J]. Environmental Science & Technology, 2007, 41(11): 3871–3876. |
| [24] | 王学彤, 李元成, 张媛, 等. 电子废物拆解区农业土壤中多氯联苯的污染特征[J]. 环境科学, 2012, 33(2): 587–591. WANG Xue-tong, LI Yuan-cheng, ZHANG Yuan, et al. Characteristics of polychlorinated biphenyls in soils from an electronic waste recycling area[J]. Environmental Science, 2012, 33(2): 587–591. |
| [25] | 陈立涛. 电子电器废弃物拆解污染农田土壤微生物生态研究[D]. 杭州: 浙江大学, 2007. CHEN Li-tao. Microbial ecology of contaminated farmland around e-waste recycling sites[D]. Hangzhou:Zhejiang University, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10335-2008145478.htm |
| [26] | Wang Y P, Yan J Y, Wang H, et al. The influence of soil heavy metals pollution on soil microbial biomass, enzyme activity, and community composition near a copper smelter[J]. Ecotoxicology and Environmental Safety, 2007, 67(1): 75–81. DOI:10.1016/j.ecoenv.2006.03.007 |
| [27] | Ma X Y, Liu M, Li Z P. Shifts in microbial biomass and community composition in subtropical paddy soils under a gradient of manure amendment[J]. Biology and Fertility of Soils, 2016, 52(6): 775–787. DOI:10.1007/s00374-016-1118-4 |
| [28] | Dong W Y, Zhang X Y, Dai X Q, et al. Changes in soil microbial community composition in response to fertilization of paddy soils in subtropical China[J]. Applied Soil Ecology, 2014, 84(3): 140–147. |
| [29] | Duckworth O W, Holmström S J M, Peña J, et al. Biogeochemistry of iron oxidation in a circumneutral freshwater habitat[J]. Chemical Geology, 2007, 260(3/4): 149–158. |
 2017, Vol. 36
2017, Vol. 36