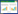文章信息
- 董志强, 徐素玮, 孙境蔚, 施心怡, 邱宇平
- DONG Zhi-qiang, XU Su-wei, SUN jing-wei, SHI Xin-yi, QIU Yu-ping
- 咪唑离子液体在砂土中的吸附与运移
- Sorption and transport of imidazolium-based ionic liquid (IBILs) in sand soil columns
- 农业环境科学学报, 2017, 36(5): 930-935
- Journal of Agro-Environment Science, 2017, 36(5): 930-935
- http://dx.doi.org/10.11654/jaes.2016-1503
文章历史
- 收稿日期: 2016-11-25
离子液体是室温或近室温下,完全由阴离子和阳离子组成的液态熔盐化合物[1]。其蒸汽压低、不可燃、难降解,可替代传统有机溶剂用于绿色合成工业[2-3]。咪唑类离子液体是应用最广泛的类型,它通常由1-烷基-3-甲基取代的咪唑阳离子和无机/有机阴离子所组成,该物质水溶性较大,会随工业废水的排放进入土壤/水环境,并对动植物产生毒害[4-5]。
探究离子液体在土壤中的吸附与迁移规律,是解读离子液体其他系列环境行为的关键。已有研究指出,离子液体在土壤中的吸附机理较为复杂,包括静电作用、疏水作用、氢键和π-π作用等。吸附行为主要受制于离子液体自身结构以及土壤粒径、阳离子交换量和有机质含量[6-7]。现有研究主要集中于探究土壤对离子液体阳离子的吸附行为[6-8],对离子液体阴离子的角色和作用还缺乏研究[9],且大多集中于静态吸附层面,没有考察动态吸附的变化和迁移规律特征。虽然Studzińska等[10]首次采用柱动态实验研究了离子液体阳离子的运移规律,但缺乏对实验结果深入的模型分析。阴离子对离子液体迁移的影响则未见报道。
本研究将以离子液体在砂土体系中的动态淋溶实验为基础,运用一维对流弥散方程 (CDE) 运移模型对数据进行拟合,以获得不同离子液体的吸附穿透曲线 (BTCs),进而比较阴/阳离子结构差异对咪唑类离子液体在环境中吸附和迁移行为的影响。此外,本文还进行了不同土柱高度的运移实验,以探究不同运移深度对离子液体运移的影响,同时也可得到更多的观测数据,提升本实验理论预测的准确性。
1 材料与方法 1.1 砂土与离子液体供试土壤采自上海市杨浦区黄兴公园,为公园绿地表层土 (0~15 cm)。实验用砂为河砂,粒径为1 mm。土壤样品经105 ℃烘干,研磨,过1 mm筛备用。砂与土质量比为15:1,在此比例下,通过合理调控流速,能够杜绝柱体堵塞现象。样品有机碳 (TOC) 的测定采用TC/TN analyzer (TOC-VCPN,Shimadzu,Japan),阳离子交换量 (CEC) 的测定采用Gillman等1986年提出的强制交换法[11]。样品理化性质如表 1所示。
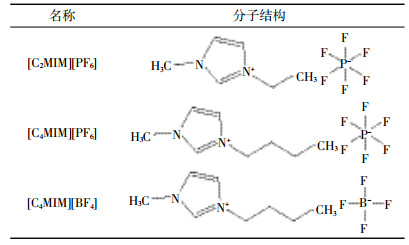
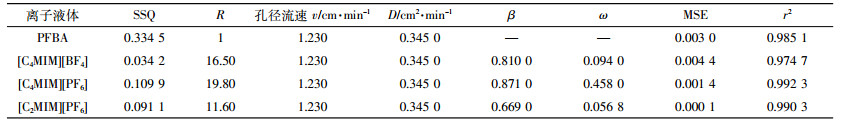
实验用咪唑离子液体 (纯度>98%) 购自上海成捷化学有限公司,包括1-乙基-3-甲基咪唑六氟磷酸盐[C2MIM][PF6]、1-丁基-3-甲基咪唑六氟磷酸盐[C4MIM][PF6]和1-丁基-3-甲基咪唑四氟硼酸盐[C4MIM][BF4]。这三种化合物拥有不同的阳离子碳链长度以及不同的阴离子类型,离子液体的阴/阳离子部分结构采用Chemdraw软件所绘制,结果如表 2所示。
采用批平衡方法进行静态等温吸附实验。称取砂土混合物 (质量比为砂:土=15:1)0.8±0.001 g于25 mL玻璃管瓶中,并分别加入20 mL不同浓度 (0.3~2.4 mmol·L-1) 的离子液体,背景液为0.005 mol·L-1的氯化钙,置于转速为40 r·min-1的转盘上垂直翻转,25±0.1 ℃条件下恒温吸附24 h。预实验表明上述时间能保证达到吸附平衡。反应后离心分离,取上层清液过0.22 μm滤膜,选用高效液相色谱 (Agilent 1200 Series HPLC System) 测定离子液体的浓度。具体方法为:采用C18反相色谱柱 (Water C18,5 mm,4.6×250 nm;Water,Milford,MA,USA);UV检测器,检测波长为218 nm,进样量为10 μL,流速为1 mL·min-1,流动相为乙腈和pH 3.0的磷酸缓冲盐,流动相体积比为30/70,出峰时间为3.2 min。
吸附数据采用Frendlich模型进行拟合[12]:
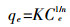 (1)
(1) 式中:Ce为吸附平衡后水相中离子液体的浓度,mmol·L-1;qe为平衡吸附量,mmol·g-1;K为Freundlich常数,代表砂土混合物对离子液体的吸附能力,(mmol·g-1)·(mmol·L-1)-n;n表示非线性的程度。
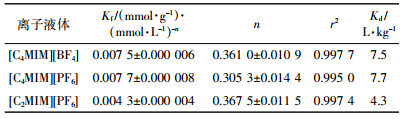
K和n的值与吸附剂、吸附质的种类和吸附温度等条件有关[13]。吸附系数Kd(L·kg-1) 值取Ce为1 mmol·L-1时的值。吸附等温线采用Sigmaplot 12.0拟合Freundlich方程得到。
1.3 柱动态吸附实验柱实验在25±0.1 ℃下进行,采用砂土混合物 (砂:土为15:1) 填充玻璃管 (口径2.2 cm、高24 cm)。实验前,土柱经浓度为0.005 mol·L-1的氯化钙背景液浸泡至饱和。柱顶部设置约200 mL的球状玻璃容器贮存离子液体,柱底部设置2 mm石英砂层以防止砂土流失,柱侧面分别在球体以下深度为7、11、15、20 cm的位置开有侧孔,以探究不同高度对离子液体运移的影响。柱下端出口接橡胶软管,由蠕动泵调控流速,泵转速设为10 r·min-1。流出液采用一次性注射器收集,过0.22 μm滤膜待测。离子液体溶液的初始浓度 (C0) 为2 mmol·L-1,流出液中离子液体的检测如上文所述。
柱实验采用五氟苯甲酸 (PFBA) 作为示踪剂,浓度为100 mg·L-1。PFBA的定量检测采用高效液相色谱仪 (Agilent 1200 Series HPLC System),色谱柱为C18反相色谱柱 (Water C18,5mm,4.6×250 nm;Water,Milford,MA,USA),UV检测器的检测波长为220 nm,进样量为10 μL,流速为1 mL·min-1,流动相为乙腈和pH 3.0的磷酸缓冲盐,流动相体积比为60/40,出峰时间为4.5 min。
砂土混合物的孔隙度φ按以下公式计算:
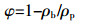 (2)
(2) 式中:ρb为实测的砂土混合物密度,g·cm-3;ρp为土粒密度,g·cm-3,一般取经验值2.65 g·cm-3[14]。
在柱实验中,一维对流弥散方程 (CDE) 是常用溶质运移模型,主要分为两种类型:平衡模型 (CDEeq) 和非平衡模型 (CDEnon-eq)。两种模型表达式如下:
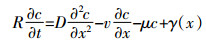 (3)
(3) 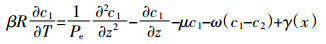 (4)
(4) 式中:c为水相中溶质浓度,下标1和2分别表示平衡吸附位点和非平衡吸附位点,M·L-3;D为水动力弥散系数,L2·T-1;v为孔隙水平均流速,L·T-1;γ(x) 为平衡迁移的产出系数;β为平衡吸附点分数f的函数 (随着f的增加而增加);μ为一阶降解系数;ω为平衡吸附位点与非平衡吸附位点的物质交换系数;T=vt/L=qt/θL,z=x/L,Pe=vL/D是Peclet值;R为阻滞系数,计算公式如下:
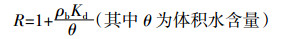 (5)
(5) 由于示踪剂PFBA以及离子液体具有蒸气压低和难降解等特点[15],且不存在新的产物生成,可忽略方程 (3) 和 (4) 中的降解系数μ和产出速率γ(x),则方程 (3) 和 (4) 可简化为:
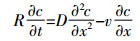 (6)
(6) 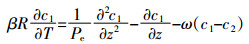 (7)
(7) 溶质穿透曲线BTCs和运移参数在CXTFIT2.1中进行拟合和反演。示踪剂PFBA穿透曲线BTCs的拟合采用CDEeq模型,并通过参数反演得到柱实验基本水动力参数:孔径流速v和弥散系数D。离子液体穿透曲线和溶质运移参数的描述采用CDEnon-eq模型,从而得到溶质运移关键参数:阻滞系数R、物质交换系数ω以及非平衡模型参数β。
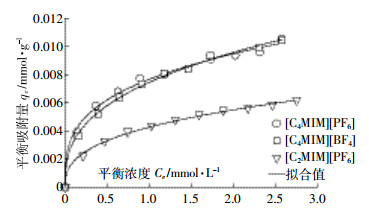
2 结果与分析 2.1 离子液体结构对其砂土吸附行为的影响[C2MIM][PF6]、[C4MIM][PF6]和[C4MIM][BF4]在砂土混合体系中的静态吸附等温线如图 1所示,拟合参数如表 3所示。从表 3可以看出,r2均不小于0.995 0,因此Freundlich吸附等温线对离子液体在砂土上的静态吸附具有较高的拟合度。三种离子液体的n值接近且均小于1,因此砂土对离子液体的吸附属于浓度型吸附[16]。[C4MIM][BF4]和[C4MIM][PF6]的吸附等温线相互交错,Kd分别为7.5、7.7 L·kg-1,说明离子液体阴离子的改变 (PF6-换成BF4-) 对离子液体静态吸附量的影响不大。而[C2MIM][PF6]和[C4MIM][PF6]吸附等温线的对比则表明,保持阴离子PF6-不变,阳离子1位碳链从乙基变为丁基,离子液体的吸附常数Kd从4.3 L·kg-1提高到7.7 L·kg-1。其主要原因是:随着碳链长度的增加,离子液体的疏水性增加,碳侧链与砂土的亲和力提升,进而导致吸附量增加[15]。三种离子液体在砂土体系中的整体吸附能力都较低,意味着其在砂土/水介质中容易发生迁移。因此,有必要进行柱穿透实验,以解读离子液体的运移规律。
|
| 图 1离子液体吸附实验值 (点) 和Freundlich拟合曲线 (线) Figure 1Experimental equilibrium data (dots) and Freundlich fits (curves) for the adsorption of ILs |
|
PFBA在土柱中的运移穿透曲线 (BTCs) 如图 2所示,拟合参数如表 4所示。从图 2a可以看出,BTCs不存在明显的拖尾现象。表 4中拟合参数也显示,r2为0.985 1,MSE (均方误差) 为0.003 0。这表明作为示踪剂,PFBA在运移过程中,受到物理和化学的非平衡影响较小。因此,将PFBA用作示踪剂,辅以平衡模型 (CDEeq) 拟合,可以得到较为精确的水动力学参数。值得注意的是,运移距离为20 cm和24 cm时,运移的拟合值和观察值之间的差异有所增大,其原因可能是:随着运移距离的增加,PFBA运移受到砂土不均匀性影响增大。此外,作为示踪剂,PFBA与砂土相互作用并非完全不存在,因此设阻滞系数R为1是近似处理。经拟合后,得到孔径流速的值为1.230 cm·min-1,扩散系数D的值为0.345 0 cm2·min-1。
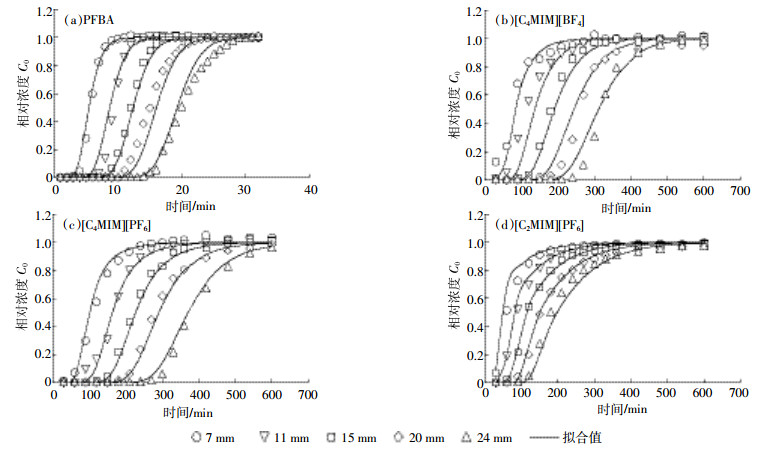
|
| 图 2PFBA和离子液体穿透曲线观察值和拟合值 Figure 2The measured and modelled breakthrough curves for transport of PFBA and ILs |
土柱实验中[C4MIM][BF4]、[C4MIM][PF6]和[C2MIM][PF6]三种离子液体穿透曲线见图 2b、图 2c和图 2d。与PFBA穿透曲线相比,离子液体穿透曲线的滞后现象明显,而且存在明显的拖尾现象,其程度随运移深度的增加而增加。这表明离子液体在砂土环境中的运移适用于非平衡模型 (CDEnon-eq),即在运移过程中受到砂土的吸附作用影响,因而移动性下降。表 4结果表明,r2值均大于0.970 0,MSE值均小于0.004 4,意味着观察值和模拟值高度吻合,进一步验证了非平衡模型应用于离子液体柱运移的可行性。
由于三种离子液体阴/阳离子的组成存在差异,其柱穿透曲线也存在不同。与[C2MIM][PF6]相比,[C4MIM][PF6]穿透曲线变得更加平滑,曲线的滞后性和拖尾性更明显,在土柱中的保留时间进一步增加。具体而言,阳离子碳链由乙基变为丁基,阻滞系数R值从11.60提高到19.80。这表明碳链增长导致离子液体柱迁移能力的下降,与静态吸附的结论一致。碳链增加,离子液体与砂土间的亲和力增加,从而使其迁移能力下降[10]。对比不同阴离子基离子液体的柱迁移实验发现,[C4MIM][PF6]和[C4MIM][BF4]的阻滞系数R值分别为19.80和16.60。造成这种差异的原因是PF6-的疏水性高于BF4-[9],因而水体中[C4MIM][PF6]更容易被砂土吸附,导致其迁移能力减弱。
2.4 运移距离对PFBA和离子液体运移行为的影响从图 2可以看出,随着运移距离的增加,溶质的流出时间增加。运移增加的影响不仅体现在溶质保留时间的增加,也体现在流出溶质的浓度变化上,即穿透曲线形状的变化。为了定量描述分析运移距离对穿透曲线形状的影响,我们引入了“坡度时间”概念,用Ts表示。设定Ts等于溶质运移至枯竭浓度 (C0=0.9) 的时间减去溶质运移至穿透点 (C0=0.1) 的时间[17]。Ts与运移距离S的关系如图 3所示,四种溶质的Ts随着运移距离的增加而上升,线性拟合度均高于0.960 0,表明运移深度影响PFBA和离子液体运移行为。
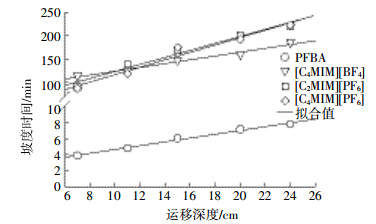
|
| 图 3运移深度与坡度时间的关系 Figure 3The relationship between Ts versus travel distance |
在本实验中,离子液体的阳离子碳链从乙基变为丁基,离子液体在砂土表面的吸附系数Kd提高约80%,在砂土中的迁移阻滞系数R提升约71%。该趋势与现有关于离子液体环境吸附行为的研究结论一致:碳链长度增加,离子液体与水分子之间亲和力减弱,而与吸附剂之间的相互作用增强,因此更容易被吸附。Kurnia等[18]深入分析离子液体碳链与水分子的相互作用指出,较长碳链拥有更多的正焓值和更少的分子空间,故难以与极性的水分子相结合,从而使得疏水性增强,溶解度降低。
然而在静态吸附体系中,阴离子对离子液体在砂土中吸附的影响却未存在明显差异。[C4MIM][BF4]和[C4MIM][PF6]在静态吸附实验中的Kd值分别为7.5、7.7 L·kg-1,差异仅为2.7%。相比而言,在柱动态迁移实验中,阻滞系数R的值从16.60提升到19.80,增幅为19.3%。阴离子是离子液体的重要组成部分,主要通过亲/疏水性的改变来影响离子液体的环境行为。由文献可知,[C4MIM][BF4]和[C4MIM][PF6]的lgKow分别为-2.40和-1.49[29]。因此,[C4MIM][PF6]和砂土具有更强的亲和力。造成[C4MIM][BF4]和[C4MIM][PF6]疏水性差异的原因在于:PF6-拥有更多的氟离子,可以与水中的氢离子形成较多的氢键。但由于氟离子间的排斥作用以及氢离子间的排斥作用,使得PF6-的氢键键长较大,导致与水形成氢键的作用力弱于BF4-[19-20]。静态吸附和动态迁移实验中,阴离子影响呈现差异的原因可能是:静态吸附实验中,体系存在少量的吸附剂 (0.8±0.001 g),砂土对离子液体的整体吸附能力较低;其主要吸附机制为阳离子交换作用,阴离子变化引发的吸附变化差异很小,难以通过等温线的差异来体现。而在柱动态吸附实验中,加载有约105 g的土柱,离子液体要在土柱中经历反复的吸附-脱附过程,从而使阴离子之间的差异得以放大,反映到阻滞系数R值上,便有了明显的差别[21]。
研究不同运移深度 (7、11、15、20、24 cm) 的影响是基于以下考虑:首先,农作物的土壤耕作深度主要集中在0~30 cm;其次,增加实验观测点可以提高模拟的准确性[22]。在本研究中,运移深度对溶质穿透曲线的影响主要体现在两个方面。
一是穿透曲线滞后 (图 2),即溶质保留时间增加。PFBA和离子液体穿透曲线,随运移深度增加均出现滞后效应,但滞后程度存在明显差异。PFBA滞后时间随运移距离的变化率约为0.72 min·cm-1,该值与柱实验中水流速 (1.230 cm·min-1) 的倒数0.81 min·cm-1非常接近,说明PFBA的穿透曲线的滞后效应主要由对流作用决定。[C4MIM][PF6]滞后时间随运移距离的变化率约为12.93 min·cm-1,该值比0.81 min·cm-1高一个数量级,说明运移深度对离子液体运移保留时间的影响主要是由于砂土吸附作用的存在,即砂土总量的增加为溶质的吸附提供了更多的吸附位点[23-24]。
二是穿透曲线坡度变缓,Ts时间增加。PFBA与砂土的相互作用力较弱,其穿透曲线形状主要受到水动力弥散作用影响,运移深度从7 cm增加到24 cm,PFBA的Ts增量仅为3.91 min。离子液体 ([C4MIM][BF4]、[C2MIM][PF6]和[C4MIM][PF6]) 运移深度从7 cm增加到24 cm时,其穿透曲线的Ts值增量分别为71.0、130.0 min和135.0 min。该现象说明离子液体穿透曲线的形状是水动力弥散作用和砂土吸附作用的结果。造成这种现象的原因还可能有初始浓度效应,即随着深度的增加,深层砂土中 (如24 cm) 离子液体的浓度是从零开始逐渐增加,而非初始的注入浓度。使深层砂土中固相和液相之间浓度梯度较低,传质阻力较大,达到平衡吸附位点饱和的时间将延长[21, 25]。
4 结论通过静态和柱动态实验及数值模拟的方法,探究了三种咪唑类离子液体在砂土中的吸附和迁移规律。结果显示,离子液体的吸附与迁移行为主要受到阳离子的影响;阴离子对离子液体的静态吸附行为影响微弱,但对柱动态迁移影响较显著。鉴于本实验砂土样较单一、离子液体种类较少、土柱尺度较小,若要精准预测离子液体在环境中的归趋,还需进一步的系统研究。
| [1] | 宋萍, 施凯顺, 邱宇平. 离子液体的土壤环境行为研究进展[J]. 环境科学与技术, 2014, 37(Suppl2): 231–236. SONG Ping, SHI Kai-shun, QIU Yu-ping. Advance in research of the environmental behavious of ionic liquids in the soils[J]. Environmental Science & Technology, 2014, 37(Suppl2): 231–236. |
| [2] | Li X, Zhao D, Fei Z, et al. Applications of functionalized ionic liquids[J]. Science in China Series B:Chemistry, 2006, 49(5): 385–401. DOI:10.1007/s11426-006-2020-y |
| [3] | Hajipour A R, Rafiee F. Basic ionic liquids:A short review[J]. Journal of the Iranian Chemical Society, 2009, 6(4): 647–678. DOI:10.1007/BF03246155 |
| [4] | Biczak R, Pawlowska B, Balczewski P, et al. The role of the anion in the toxicity of imidazolium ionic liquids[J]. Journal of Hazardous Materials, 2014, 274: 181–190. DOI:10.1016/j.jhazmat.2014.03.021 |
| [5] | Thuy Pham T P, Cho C, Yun Y. Environmental fate and toxicity of ionic liquids:A review[J]. Water Research, 2010, 44(2): 352–372. DOI:10.1016/j.watres.2009.09.030 |
| [6] | Stepnowski P, Mrozik W, Nichthauser J. Adsorption of Alkylimidazolium and Alkylpyridinium ionic liquids onto natural soils[J]. Environmental Science & Technology, 2007, 41(2): 511–516. |
| [7] | Mrozik W, Kotlowska A, Kamysz W, et al. Sorption of ionic liquids onto soils:Experimental and chemometric studies[J]. Chemosphere, 2012, 88(10): 1202–1207. DOI:10.1016/j.chemosphere.2012.03.070 |
| [8] | Matzke M, Thiele K, Müller A, et al. Sorption and desorption of imidazolium based ionic liquids in different soil types[J]. Chemosphere, 2009, 74(4): 568–574. DOI:10.1016/j.chemosphere.2008.09.049 |
| [9] | Palomar J, Lemus J, Gilarranz M A, et al. Adsorption of ionic liquids from aqueous effluents by activated carbon[J]. Carbon, 2009, 47(7): 1846–1856. DOI:10.1016/j.carbon.2009.03.028 |
| [10] | Studzińska S, Kowalkowski T, Buszewski B. Study of ionic liquid cations transport in soil[J]. Journal of Hazardous Materials, 2009, 168(2/3): 1542–1547. |
| [11] | Gillman G P, Sumpter E A. Modification to the compulsive exchange method for measuring exchange characteristics of soils[J]. Soil Research, 1986, 24(1): 61–66. DOI:10.1071/SR9860061 |
| [12] | Lee C M. Environmental Organic Chemistry[M]. 2nd Edition. Washington:Journal of Chemical Education, 2003. |
| [13] | 近藤精一, 石川达雄, 安部郁夫. 吸附科学[M]. 北京: 化学工业出版, 2006: 123-124. Kondo S, Ishikawa T, Abe I. Adsorption science[M]. Beijing: Chemical Industry Press, 2006: 123-124. |
| [14] | Klute A. Physical and mineralogical methods[M]. American Society of Agronomy:Soil Science Society of America, 1986. |
| [15] | Jungnickel C, Mrozik W, Markiewicz M, et al. Fate of ionic liquids in soils and sediments[J]. Current Organic Chemistry, 2011, 15(12): 1928–1945. DOI:10.2174/138527211795703702 |
| [16] | Shi K, Qiu Y, Li B, et al. Effectiveness and potential of straw-and wood-based biochars for adsorption of imidazolium-type ionic liquids[J]. Ecotoxicology & Environmental Safety, 2016, 130: 155–162. |
| [17] | Ali I. Water treatment by adsorption columns:Evaluation at ground level[J]. Separation & Purification Reviews, 2014, 43(3): 175–205. |
| [18] | Kurnia K A, Neves C M S S, Freire M G, et al. Comprehensive study on the impact of the cation alkyl side chain length on the solubility of water in ionic liquids[J]. Journal of Molecular Liquids, 2015, 210: 264–271. DOI:10.1016/j.molliq.2015.03.040 |
| [19] | 郑晓林. 离子液体与水混合体系的分子动力学模拟研究[D]. 沈阳: 辽宁大学, 2013. ZHENG Xiao-lin. Molecular dynamics simulation of ionic liquid-water mixtures[D]. Shenyang:Liaoning University, 2013. |
| [20] | Lemus J, Palomar J, Heras F, et al. Developing criteria for the recovery of ionic liquids from aqueous phase by adsorption with activated carbon[J]. Separation and Purification Technology, 2012, 97: 11–19. DOI:10.1016/j.seppur.2012.02.027 |
| [21] | 李静, 张美一, 潘纲, 等. 不同吸附模式对As (Ⅴ) 在TiO2颗粒上亚稳态吸附的影响[J]. 物理化学学报, 2013, 29(7): 1541–1549. LI Jing, ZHANG Mei-yi, PAN Gang, et al. Influence of adsorption mode on metastable-equilibrium adsorption of As (Ⅴ) on TiO2 particles[J]. Acta Physico-Chimica Sinica, 2013, 29(7): 1541–1549. |
| [22] | Jabro J D, Stevens W B, Iversen W M, et al. Tillage depth effects on soil physical properties, sugarbeet yield, and sugarbeet quality[J]. Communications in Soil Science and Plant Analysis, 2010, 41(7): 908–916. DOI:10.1080/00103621003594677 |
| [23] | Liu J, Huang X, Liu J, et al. Adsorption of arsenic (Ⅴ) on bone char:Batch, column and modeling studies[J]. Environmental Earth Sciences, 2014, 72(6): 2081–2090. DOI:10.1007/s12665-014-3116-x |
| [24] | Zhi-Ming Q I, Feng S Y, Helmers M J. Modeling cadmium transport in neutral and alkaline soil columns at various depths[J]. Pedosphere, 2012, 22(3): 273–282. DOI:10.1016/S1002-0160(12)60014-9 |
| [25] | 张美一. As (Ⅴ) 在TiO2表面吸附的初始浓度效应研究[D]. 北京: 中国科学院大学, 2009. ZHANG Mei-yi. Study on initial concentration effect of arsenate adsorption on TiO2 surface[D]. Beijing:University of Chinese Academy of Science, 2009. |
 2017, Vol. 36
2017, Vol. 36