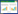文章信息
- 刘娟, 赵玲, 王辉, 董元华
- LIU Juan, ZHAO Ling, WANG Hui, DONG Yuan-hua
- 诺氟沙星对胡敏酸吸附铜的影响
- Effect of norfloxcian on sorption of copper onto humic acid
- 农业环境科学学报, 2017, 36(5): 936-942
- Journal of Agro-Environment Science, 2017, 36(5): 936-942
- http://dx.doi.org/10.11654/jaes.2016-1611
文章历史
- 收稿日期: 2016-12-15
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
重金属是一类典型的污染物,具有毒性大、非生物降解、可沿食物链富集等特点,并且易与环境中的某些有机物结合形成重金属-有机复合物,这些复合污染物会对生物体产生协同、拮抗、甚至加和等复杂的生态毒理效应[1],严重威胁人体健康和生态系统。随着集约化养殖业的快速发展[2],重金属和抗生素被添加到饲料中用来预防动物疾病和促进动物的快速生长。然而,由于动物的不完全吸收,重金属和抗生素在畜禽粪便中有较高的残留[3-4],使得重金属-抗生素成为了一种常见的重金属-有机物的复合污染。未经处理的畜禽粪便常常作为有机肥施用进入到土壤环境,这种重金属-抗生素复合污染物还可能通过淋溶作用对地表水和地下水造成威胁。
抗生素本身含有特殊的官能团,如羧基、羰基、氨基、酚酮等基团,可以与重金属发生相互作用[5-7],影响重金属在环境中的行为。已有研究表明,铜与磺胺甲恶唑可以在碳纳米管上形成三元配合物促进铜的吸附[8];环丙沙星通过竞争吸附抑制了镍在活性炭上的吸附[9];四环素的桥键合作用增加了镉在褐土上的吸附和解吸滞后性[10]。Jia等[11]指出铜与四环素可以形成络合物,pH低于5.0时,该络合物带正电且红壤上的亲和力比铜高,增加了铜在红壤上的吸附,而pH高于7.0时,该络合物易溶于水,在红壤上的亲和力较低,从而降低了铜的吸附。到目前为止,有关抗生素对重金属在有机质上的吸附影响的研究还鲜有报道。众所周知,胡敏酸不仅是有机质的重要组成成分,而且还是一种很好的吸附材料,含有羧基、醇羟基、酚羟基、甲氧基等特有的官能团,且部分官能团含N、P、S等元素,对重金属[12-15]以及抗生素[16-18]都表现出了很强的吸附能力。
因此,本文以诺氟沙星、铜作为抗生素和重金属的代表,研究诺氟沙星对胡敏酸吸附铜的影响,旨在通过批平衡试验探讨诺氟沙星对胡敏酸吸附铜的动力学、吸附等温线以及热力学的影响,以期为重金属与抗生素复合污染对环境生态毒理效应的评估以及畜禽粪便、底泥的合理化利用提供科学依据。
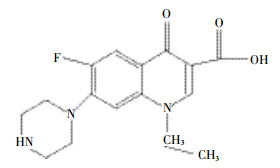
1 材料与方法 1.1 实验材料与仪器 1.1.1 实验试剂胡敏酸 (HA) 购自美国Sigma公司,其中C、H、O、N的含量分别为42.75%、3.61%、26.75%、0.99%。诺氟沙星购自上海百灵威公司 (纯度>98%),其酸碱解离常数pKa1、pKa2分别为6.30、8.38。分子结构见图 1。硝酸铜、硝酸钠均为分析纯,购自南京化学试剂有限公司。乙腈为HPLC级试剂,购自美国Tedia公司。
|
| 图 1诺氟沙星分子结构 Figure 1Molecular structure of norfloxacin |
50 mL聚丙烯塑料管、摇床、低速台式大容量离心机、Milli-Q超纯水系统、Waters Alliance高效液相色谱2695分离单元配置2475荧光检测器和Millinium色谱工作站,电感耦合等离子体原子发射光谱仪 (ICP),荧光分光光度计,TOC仪。
1.2 实验方法 1.2.1 诺氟沙星对胡敏酸吸附铜的动力学试验分别准确称取10 mg HA于50 mL聚丙烯塑料管中,并加入25 mL含有100 mg·L-1的硝酸铜和不同浓度的诺氟沙星的背景电解质溶液,调pH=5.0。背景电解质为0.1 mol·L-1硝酸钠溶液,诺氟沙星 (NOR) 投加浓度为0、5、45 mg·L-1。诺氟沙星浓度水平依据Zhao等[4]测得的畜禽粪便中诺氟沙星浓度的量级设定。加盖后在25 ℃的密闭摇床中振荡,振荡速度为150 r·min-1,分别于5、10、30、60、120、240、360、480、720、1440、2880 min取出样品经4000 r·min-1离心5 min。用0.22 μm滤膜过滤后用电感耦合等离子体原子发射光谱仪 (ICP) 测定溶液中残留的铜离子浓度[19],ICP检测铜的测试波长为324.754 nm,最低检测限为0.01 mg·L-1 [20]。用差量法计算铜的吸附量。每组试验做3份平行。
1.2.2 诺氟沙星对胡敏酸吸附铜的吸附等温线测定分别准确称取10 mg HA于50 mL聚丙烯塑料管中,并加入25 mL含有不同浓度硝酸铜和诺氟沙星的背景电解质溶液,调pH=5.0。背景电解质为0.1 mol·L-1硝酸钠溶液,硝酸铜浓度为10、20、40、60、80、100 mg·L-1,铜离子浓度水平依据文献报道我国畜禽粪便和土壤中铜离子的检出浓度范围设定[21-23],诺氟沙星投加浓度为0、5、45 mg·L-1。加盖后在25 ℃的密闭摇床中振荡,振荡速度为150 r·min-1。振荡72 h后取出样品于4000 r·min-1离心5 min。用0.22 μm滤膜过滤后用ICP测定溶液中残留的铜离子浓度,用差量法计算铜的吸附量。每组试验做3份平行。
1.2.3 溶液初始pH对胡敏酸吸附铜的影响分别准确称取10 mg HA于50 mL聚丙烯塑料管中,并加入25 mL含有不同浓度硝酸铜和诺氟沙星的背景电解质溶液,考虑到铜离子在pH > 5.5条件下出现沉淀现象,本实验设定pH为3.0、4.0、5.0和5.5。背景电解质为0.1 mol·L-1硝酸钠溶液,硝酸铜浓度为10、20、40、60、80、100 mg·L-1,诺氟沙星投加浓度为0、5、45 mg·L-1。加盖后在25 ℃的密闭摇床中振荡,振荡速度为150 r·min-1。振荡72 h后取出样品于4000 r·min-1离心5 min。经0.22 μm滤膜过滤后用ICP测定溶液中残留的铜离子浓度,用差量法计算铜的吸附量。对振荡72 h后pH 5.5条件下的HA对照样品,采用TOC仪测定溶解有机碳的含量,为15.8 mg·L-1,占初始HA浓度的3.95%。每组试验做3份平行。
1.2.4 诺氟沙星对胡敏酸吸附铜的热力学试验分别准确称取10 mg HA于50 mL聚丙烯塑料管中,并加入25 mL含有不同浓度硝酸铜和诺氟沙星的背景电解质溶液,调pH=5.0。背景电解质为0.1 mol·L-1硝酸钠溶液,硝酸铜浓度为10、20、40、60、80、100 mg·L-1,诺氟沙星投加浓度为0、5、45 mg·L-1。加盖后在25 ℃的密闭摇床中振荡,振荡速度为150 r·min-1。振荡72 h后取出样品于4000 r·min-1离心5 min。经0.22 μm滤膜过滤后用ICP测定溶液中残留的铜离子浓度,用差量法计算铜的吸附量。每组试验做3份平行。改变试验温度,分别为15、35 ℃,其余步骤均按上述试验方法进行。
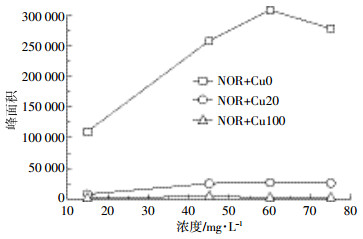
1.2.5 铜对诺氟沙星荧光强度的影响试验配制一系列诺氟沙星溶液,浓度为15、30、60、75 mg·L-1,硝酸铜的投加浓度为0、20、100 mg·L-1,调pH=5.0。在荧光光度计上以激发波长278 nm、发射波长445 nm进行扫描,记录诺氟沙星荧光光谱的峰面积。对单独的诺氟沙星溶液以及诺氟沙星与硝酸铜共存溶液的峰面积进行比较分析。
1.3 数据分析方法 1.3.1 吸附动力学模型为了研究诺氟沙星对胡敏酸吸附铜动力学机制的影响,采用伪一级动力学方程、伪二级动力学方程、颗粒内扩散模型以及Elovich方程4种模型对动力学试验数据进行拟合。
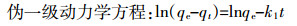 (1)
(1) 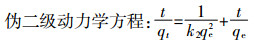 (2)
(2)  (3)
(3) 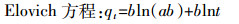 (4)
(4) 式中:qe、qt分别是吸附剂在平衡时间和某时间t的吸附量,mg·g-1;k1(min-1) 和k2(g·mg-1·min-1) 分别是伪一级和伪二级吸附速率常数;Kp是颗粒内扩散模型速率常数,mg·g-1·min-1/2;C是常数,与边界层厚度有关;a(mg·g-1·min-1)、b(g·mg-1) 是Elovich方程参数,分别代表初始吸附速率和解析常数。
1.3.2 吸附等温线模型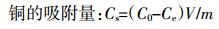 (5)
(5) 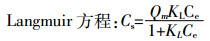 (6)
(6) 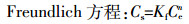 (7)
(7) 式中:Cs为铜的吸附量,mg·g-1;C0为吸附平衡前铜的浓度,mg·L-1;Ce为吸附平衡时铜的浓度,mg·L-1;V为溶液的体积,L;m为胡敏酸的质量,g;Qm为Langmuir方程常数,表示最大吸附量,mg·g-1;KL是有条件的吸附平衡常数,与吸附能力有关,L·mg-1;Kf为Freundlich吸附系数,与吸附能力有关;n与吸附等温线的线性有关。
1.3.3 吸附热力学方程参数计算[24]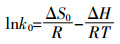 (8)
(8) 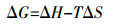 (9)
(9) 式中:k0为条件吸附平衡常数;ΔG为吸附的标准自由能改变量,kJ·moL-1;ΔH为标准吸附热,kJ·moL-1;ΔS为吸附的标准熵变,kJ·K-1;R为气体摩尔常数,8.314 J·moL-1·K-1;T为绝对温度,K。
以lnk0为纵坐标,1/T为横坐标绘制坐标系,则ΔH、ΔS可以分别通过线性回归方程的斜率和截距来计算得到。
2 结果与讨论 2.1 诺氟沙星对胡敏酸吸附铜动力学的影响铜在溶液中的浓度随时间的变化如图 2所示。在3种不同诺氟沙星投加量的条件下,铜在胡敏酸上的吸附量随时间变化趋势基本相同。吸附量 (qt) 随时间 (t) 单调增加,直至达到平衡吸附量 (qe),平衡时间均为24 h。从动力学曲线变化趋势来看,在反应开始2 h内吸附量迅速增加,铜的吸附量均达到最大吸附量的60%以上,此后吸附速率逐渐减小,至12 h,都达到最大吸附量的90%以上,最后接近平衡。本研究与Li等[25]研究的胡敏酸对单一铜离子的吸附动力学特征相似,整个吸附过程可以分为三个阶段:0~2 h内是边界扩散或者是外边面吸附的过程,此时扩散阻力较小,吸附速率较高;2~24 h内属于粒子内部扩散的逐渐吸附阶段,此时扩散阻力变大,吸附速率下降;24 h后吸附基本达到平衡,主要是铜在胡敏酸内部的吸附迁移,此时吸附量与脱附量相当,因此吸附量保持稳定。
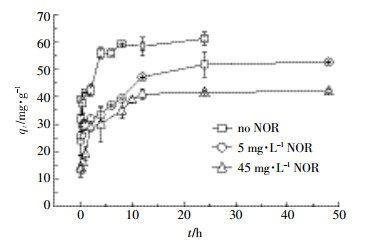
|
| 图 2铜在胡敏酸上的吸附动力学曲线 (pH 5.0,25 ℃) Figure 2Sorption kinetics of copper onto humic acid (pH 5.0, 25 ℃) |
为了量化不同浓度诺氟沙星共存时胡敏酸对铜吸附的动力学特征,采用4种吸附动力学方程进行拟合,结果见表 1。伪二级动力学方程拟合效果最好,R2均达0.99以上,且对铜平衡吸附量的拟合结果 (qe2 cal) 最接近实验所测的真实值 (qe exp)。伪一级动力学和Elovich方程拟合结果次之,颗粒内扩散模型拟合结果较差。伪二级动力学能较好地描述不同诺氟沙星投加量条件下胡敏酸对铜的动力学曲线,表明这3种吸附过程主要受吸附剂表面有效吸附位点数控制,而不是受主体溶液中吸附质含量的控制[26]。研究表明伪二级动力学模型包含吸附的所有过程 (外部液膜扩散、表面吸附、颗粒内扩散等),可以更真实地反映吸附机理[27]。
伪二级动力学常数k2表明,诺氟沙星与铜共存,使得铜在胡敏酸上的吸附速率降低,且低浓度的诺氟沙星降低效果强于高浓度的诺氟沙星。通常k2与吸收分数F存在以下关系[25]:
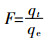 (10)
(10) 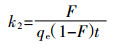 (11)
(11) 从中可以看出,当F值一定时,t与k2成反比,所以更小的k2值代表达到某一相同的吸收分数所需的时间更长。诺氟沙星与铜共存时,铜在胡敏酸上的k2减小,表示胡敏酸想要对铜达到某一特定的去除率,诺氟沙星存在时所需的时间更长。
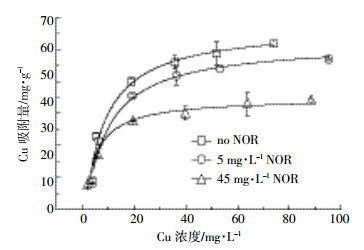
2.2 诺氟沙星对胡敏酸吸附铜的吸附等温线的影响图 3是pH=5.0和铜单独存在以及铜与诺氟沙星共存时,铜在胡敏酸上的吸附等温线。从图中可以看出,有无诺氟沙星共存时,铜在胡敏酸上的吸附量均随着铜在溶液中平衡浓度的增加而增加,且诺氟沙星的存在减少了铜在胡敏酸上的吸附量,且减少程度随诺氟沙星投加量增加而增大。
|
| 图 3铜在胡敏酸上的吸附等温线 (pH 5.0,25 ℃) Figure 3Adsorption isotherm of copper onto the humic acid (pH 5.0, 25 ℃) |
用Freudlich、Langmuir方程对铜在胡敏酸上的吸附等温线进行拟合,结果见表 2。单独的铜离子溶液以及铜与诺氟沙星共存的溶液,Langmuir方程均能较好地描述铜在胡敏酸上的吸附,从拟合参数Qm也可以看出,诺氟沙星共存使得铜在胡敏酸上的最大吸附量减少。
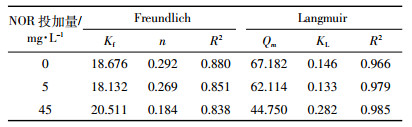
|
一般有机化合物影响重金属离子的吸附可能涉及以下机制:① 通过形成三元表面配合物,促进重金属离子的吸附;② 吸附剂表面配体和有机化合物表面配体与重金属离子结合存在竞争,抑制了重金属离子的吸附;③ 有机化合物和重金属离子在吸附剂表面有效吸附位点存在竞争;④ 有机化合物的加入使得吸附剂表面电荷和溶液pH发生改变,影响了重金属离子的吸附[28-30]。
诺氟沙星是两性化合物,受溶液pH值的控制,通常以正离子、兼性离子、负离子3种形态存在[31]。它可以通过羧基、酮羰基与铜发生络合作用,如图 4所示,当Cu2+存在时诺氟沙星的荧光强度大幅降低,且随着Cu2+浓度的增加,诺氟沙星的荧光强度减弱程度加剧,证明诺氟沙星与铜发生了络合作用,使其分子荧光发生淬灭作用。Pei等[32]根据诺氟沙星和铜络合物的稳定常数值[6]计算得到铜和诺氟沙星在不同pH值下络合物的分子形态分布:pH<5.0时,铜与诺氟沙星共存溶液中主要的分子形态有Cu2+、NOR+、Cu (NOR±)2+;pH=5.0~7.5时,主要分子形态有Cu (NOR±)2+;pH>9.0时,Cu (NOR-)2为主要分子形态。本实验条件是pH=5.0,此时,诺氟沙星对铜在胡敏酸上的吸附抑制作用可能是由于Cu (NOR±)2+的空间位阻效应导致其在胡敏酸上的亲和力比Cu2+低。此外,Zhang等[33]研究表明诺氟沙星在胡敏酸上也有很强的吸附能力,所以也可能是由于NOR+与Cu2+之间存在竞争吸附导致了铜在胡敏酸上的吸附量降低。
|
| 图 4铜对诺氟沙星荧光强度的影响 (pH 5.0) Figure 4Effect of copper on the fluorescence intensity of norfloxacin (pH 5.0) |
图 5是pH=5.0时,诺氟沙星在胡敏酸上的吸附等温线。从图中可以看出铜与诺氟沙星共存时,诺氟沙星也可以吸附到胡敏酸上,但铜的存在使得诺氟沙星在胡敏酸上的吸附量大幅减少,表明虽然诺氟沙星在胡敏酸上的吸附能力要弱于铜,但确实与铜存在竞争吸附作用。
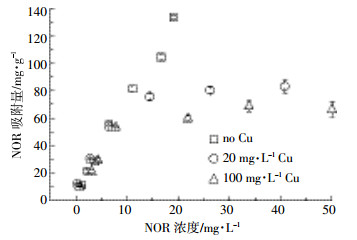
|
| 图 5诺氟沙星在胡敏酸上的吸附等温线 (pH 5.0,25 ℃) Figure 5Adsorption isotherm of norfloxacin onto the humic acid (pH 5.0, 25 ℃) |
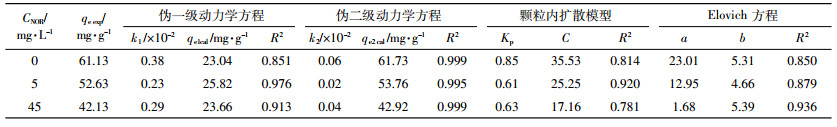
由表 3可见,pH在3.0~5.5范围内,对于单独的铜离子溶液以及铜与诺氟沙星共存的溶液,Langmuir方程对铜在胡敏酸上的吸附等温线拟合效果都好于Freundlich方程。从参数Qm可以看出,无论铜离子溶液中是否存在诺氟沙星,铜在胡敏酸上的最大吸附量都随pH的增加而增加,但是诺氟沙星的存在降低了铜在胡敏酸上的吸附量,且随诺氟沙星浓度的增加,其降低作用增强。胡敏酸是一个含有大量活性基团的有机胶体,张琴等[31]对胡敏酸电位滴定的结果表明:pH>3时胡敏酸开始发生解离作用;pH>4.5时,胡敏酸中较强羧酸基团开始解离,使得胡敏酸表面的电负性增强;pH>6时,羧酸基团全部解离。pH<5.5时铜在胡敏酸上的最大吸附量均呈现随pH的升高而增大的现象,原因可能有两方面:其一,pH=3.0~5.5时,水溶液中铜的存在形态主要有Cu2+、Cu (NOR±)2+,pH>3时胡敏酸开始解离,释放H+到水溶液中,pH的升高促进了H+的释放,则Cu2+、Cu (NOR±)2+与H+的阳离子交换作用增强,铜的吸附量增加;其二,可能是胡敏酸表面酸性官能团的解离使其带有负电荷,可以通过静电吸附作用结合Cu2+、Cu (NOR±)2+,随pH的升高,官能团解离数增加,静电吸附作用增强,致使铜在胡敏酸上的吸附量增加。而诺氟沙星的存在,使得部分Cu2+变成了Cu (NOR±)2+,减弱了其与胡敏酸之间的阳离子交换作用和静电吸附作用,且诺氟沙星的浓度越高,Cu (NOR±)2+的占比就越高,因此对Cu2+吸附作用的降低效果就会越显著。
铜单独存在以及铜与诺氟沙星共存时,不同温度条件下,胡敏酸吸附铜的热力学参数如表 4所示。288、298、308 K时铜在胡敏酸上吸附对应的自由能变 (ΔG0) 均小于0,表明铜在胡敏酸上的吸附是自发进行的,且KL、ΔG0(绝对值) 大小顺序为308 K>298 K>288 K,说明温度升高增强了胡敏酸和铜之间的各种作用力,同时也说明铜在胡敏酸上的吸附为吸热过程,温度升高利于反应的自发性,这点也可以由焓变 (ΔH0) 为正值看出。当诺氟沙星存在时,铜在胡敏酸上的吸附自由能变ΔG0(绝对值) 和ΔH0都有所增加,且随诺氟沙星浓度的增加,ΔG0(绝对值) 和ΔH0增加幅度增大,表明诺氟沙星的存在增大了铜在胡敏酸上的吸附能垒。同样,熵变 (ΔS0) 大于0,表明铜在胡敏酸上的吸附是混乱度增加的过程,可能包含吸附剂胡敏酸大部分结构发生了重排,胡敏酸双电层松弛或金属离子使吸附剂发生脱水作用等过程[34],而诺氟沙星的存在则加剧了铜在胡敏酸上吸附的混乱度。
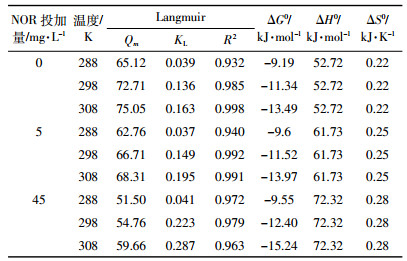
|
(1) 不同浓度的诺氟沙星共存时,胡敏酸吸附铜都呈现为先快后慢的过程,吸附平衡时间为24 h左右,吸附动力学曲线均符合伪二级动力学方程。诺氟沙星的存在降低了铜在胡敏酸上的吸附速率。
(2) 不同浓度诺氟沙星存在时,铜在胡敏酸上的吸附等温线均符合Langmuir方程,且诺氟沙星添加量越大,其抑制铜在胡敏酸上的吸附作用越强。
(3) pH在3.0~5.5范围内,不同浓度诺氟沙星存在时,胡敏酸对铜的吸附量都随pH的升高而增大,且诺氟沙星共存浓度越高,其对铜在胡敏酸上的吸附量降低效应越强。
(4) 诺氟沙星存在时,胡敏酸对铜吸附的热力学特征与单一铜离子的吸附热力学特征相似,都表现为自发、吸热和熵增的过程,但诺氟沙星的存在增加了铜在胡敏酸上的吸附能垒,加剧了吸附后的混乱度。
| [1] | 傅海霞, 刘怡, 董志英, 等. 抗生素与重金属复合污染的生态毒理效应研究进展[J]. 环境工程, 2016, 34(4): 60–63. FU Hai-xia, LIU Yi, DONG Zhi-ying, et al. Progress in research on ecological toxicity of combined pollution of antibiotics and heavy metals[J]. Environmental Engineering, 2016, 34(4): 60–63. |
| [2] | 张绪美, 董元华, 王辉, 等. 中国畜禽养殖结构及其粪便N污染负荷特征分析[J]. 环境科学, 2007, 28(6): 1311–1318. ZHANG Xu-mei, DONG Yuan-hua, WANG Hui, et al. Structure of livestock and variation of fecal nitrogen pollution load in China[J]. Environmental Science, 2007, 28(6): 1311–1318. |
| [3] | 王瑞, 魏源送. 畜禽粪便中残留四环素类抗生素和重金属的污染特征及其控制[J]. 农业环境科学学报, 2013, 32(9): 1705–1719. WANG Rui, WEI Yuan-song. Pollution and control of tetracyclines and heavy metals residues in animal manure[J]. Journal of Agro-Environment Science, 2013, 32(9): 1705–1719. DOI:10.11654/jaes.2013.09.002 |
| [4] | Zhao L, Dong Y H, Wang H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Science of the Total Environment, 2010, 408(5): 1069–1075. DOI:10.1016/j.scitotenv.2009.11.014 |
| [5] | Gu C, Karthikeyan K G. Interaction of tetracycline with aluminum and iron hydrous oxides[J]. Environmental Science & Technology, 2005, 39(8): 2660–2667. |
| [6] | Wallis S C, Gahan L R, Charles B G, et al. Copper (Ⅱ) complexes of the fluoroquinolone antimicrobial ciprofloxacin:Synthesis, X-ray structural characterization, and potentiometric study[J]. Journal of Inorganic Biochemistry, 1996, 62(1): 1–16. DOI:10.1016/0162-0134(95)00082-8 |
| [7] | Zhang D, Pan B, Zhang H, et al. Contribution of different sulfamethoxazole species to their overall adsorption on functionalized carbon nanotubes[J]. Environmental Science & Technology, 2010, 44(10): 3806–3811. |
| [8] | Wu D, Pan B, Wu M, et al. Coadsorption of Cu and sulfamethoxazole on hydroxylized and graphitized carbon nanotubes[J]. Science of the Total Environment, 2012, 427: 247–252. |
| [9] | Sun Y, Yue Q, Gao B, et al. Adsorption and cosorption of ciprofloxacin and Ni (Ⅱ) on activated carbon-mechanism study[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(2): 681–688. DOI:10.1016/j.jtice.2013.05.013 |
| [10] | Wan Y, Bao Y, Zhou Q. Simultaneous adsorption and desorption of cadmium and tetracycline on cinnamon soil[J]. Chemosphere, 2010, 80(7): 807–812. DOI:10.1016/j.chemosphere.2010.04.066 |
| [11] | Jia D A, Zhou D M, Wang Y J, et al. Adsorption and cosorption of Cu (Ⅱ) and tetracycline on two soils with different characteristics[J]. Geoderma, 2008, 146(1): 224–230. |
| [12] | Vasilevich R S, Beznosikov V A, Lodygin E D, et al. Complexation of mercury (Ⅱ) ions with humic acids in tundra soils[J]. Eurasian Soil Science, 2014, 47(3): 162–172. DOI:10.1134/S1064229314030089 |
| [13] | Grassi M, Rosa M. Humic acids of different origin as modifiers of cadmium-ion chemistry:A spectroscopic approach to structural properties and reactivity[J]. Inorganica Chimica Acta, 2010, 363(3): 495–503. DOI:10.1016/j.ica.2009.07.033 |
| [14] | Lishtvan I I, Yanuta Y G, Monich G S, et al. Interaction of humic acids with metal ions in the water medium[J]. Journal of Water Chemistry and Technology, 2012, 34(5): 211–217. DOI:10.3103/S1063455X12050013 |
| [15] | 朱丽珺, 张金池, 俞元春, 等. 胡敏酸吸附重金属Cu2+ Pb2+ Cd2+的特征及影响因素[J]. 农业环境科学学报, 2008, 27(6): 2240–2245. ZHU Li-jun, ZHANG Jin-chi, YU Yuan-chun, et al. Characteristics and affecting factors of humic acid adsorbing heavy metals Cu2+ Pb2+ Cd2+[J]. Journal of Agro-Environment Science, 2008, 27(6): 2240–2245. |
| [16] | Xu J, Yu H Q, Sheng G P. Kinetics and thermodynamics of interaction between sulfonamide antibiotics and humic acids:Surface plasmon resonance and isothermal titration microcalorimetry analysis[J]. Journal of Hazardous Materials, 2016, 302: 262–266. DOI:10.1016/j.jhazmat.2015.09.058 |
| [17] | Guo X, Tu B, Ge J, et al. Sorption of tylosin and sulfamethazine on solid humic acid[J]. Journal of Environmental Sciences, 2016, 43: 208–215. DOI:10.1016/j.jes.2015.10.020 |
| [18] | Antilen M, Bustos O, Ramirez G, et al. Electrochemical evaluation of ciprofloxacin adsorption on soil organic matter[J]. New Journal of Chemistry, 2016, 40(8): 7132–7139. DOI:10.1039/C6NJ00207B |
| [19] | 崔玉侠, 王玉军, 周东美, 等. 草甘膦对重金属污染土壤中铜、锌淋溶的研究[J]. 土壤, 2009, 41(5): 840–843. CUI Yu-xia, WANG Yu-jun, ZHOU Dong-mei, et al. Effects of glyphosate on leaching of Cu and Zn from heavy contaminated soil[J]. Soils, 2009, 41(5): 840–843. DOI:10.11766/trxb200804150512 |
| [20] | 杨倩倩, 吴德军, 王德伦, 等. 电感耦合等离子体原子发射光谱 (ICP-AES) 法测定车用尿素水溶液中的8种杂质元素含量[J]. 中国无机分析化学, 2016, 6(2): 61–63. YANG Qian-qian, WU De-jun, WANG De-lun, et al. Determination of 8 impurities in vehicle urea by inductively coupled plasma atomic emission spectroscopy[J]. Chinese Journal of Inorganic Analytical Chemistry, 2016, 6(2): 61–63. |
| [21] | 张树清, 张夫道, 刘秀梅, 等. 规模化养殖畜禽粪主要有害成分测定分析研究[J]. 植物营养与肥料学报, 2005, 11(6): 822–829. ZHANG Shu-qing, ZHANG Fu-dao, LIU Xiu-mei, et al. Determination and analysis on main harmful composition in excrement of scale livestock and poultry feedlots[J]. Plant Nutrition and Fertilizer Science, 2005, 11(6): 822–829. DOI:10.11674/zwyf.2005.0619 |
| [22] | 郭观林, 周启星. 中国东北北部黑土重金属污染趋势分析[J]. 中国科学院研究生院学报, 2004, 21(3): 386–392. GUO Guan-lin, ZHOU Qi-xing. Contaminative trends of heavy metals in phaiozem of Northeast China[J]. Journal of the Graduate School of the Chinese Academy of Sciences, 2004, 21(3): 386–392. |
| [23] | 施婉君, 靳治国, 周培. 上海市土壤重金属污染研究进展[J]. 上海环境科学, 2009, 28(2): 72–75. SHI Wan-jun, JIN Zhi-guo, ZHOU Pei. Progress in the study on heavy metal contamination of soil in Shanghai[J]. Shanghai Environment Sciences, 2009, 28(2): 72–75. |
| [24] | Shaker M A. Dynamics and thermodynamics of toxic metals adsorption onto soil-extracted humic acid[J]. Chemosphere, 2014, 111: 587–595. DOI:10.1016/j.chemosphere.2014.04.088 |
| [25] | Li Y, Yue Q, Gao B. Adsorption kinetics and desorption of Cu (Ⅱ) and Zn (Ⅱ) from aqueous solution onto humic acid[J]. Journal of Hazardous Materials, 2010, 178(1): 455–461. |
| [26] | Liu Y. New insights into pseudo-second-order kinetic equation for adsorption[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2008, 320(1): 275–278. |
| [27] | Chang M Y, Juang R S. Adsorption of tannic acid, humic acid, and dyes from water using the composite of chitosan and activated clay[J]. Journal of Colloid and Interface Science, 2004, 278(1): 18–25. DOI:10.1016/j.jcis.2004.05.029 |
| [28] | Chubin R G, Street J J. Adsorption of cadmium on soil constituents in the presence of complexing ligands[J]. Journal of Environmental Quality, 1981, 10(2): 225–228. |
| [29] | Collins R N, Merrington G, McLaughlin M J, et al. Organic ligand and pH effects on isotopically exchangeable cadmium in polluted soils[J]. Soil Science Society of America Journal, 2003, 67(1): 112–121. DOI:10.2136/sssaj2003.1120 |
| [30] | Zhou D M, Wang Y J, Cang L, et al. Adsorption and cosorption of cadmium and glyphosate on two soils with different characteristics[J]. Chemosphere, 2004, 57(10): 1237–1244. DOI:10.1016/j.chemosphere.2004.08.043 |
| [31] | 张琴, 黄冠燚, 赵玲, 等. pH值和离子对诺氟沙星在胡敏酸上吸附特征的影响[J]. 中国环境科学, 2011, 31(1): 78–83. ZHANG Qin, HUANG Guan-yi, ZHAO Ling, et al. Influence of pH and ions on sorption of norfloxacin on humic acid[J]. China Environmental Science, 2011, 31(1): 78–83. |
| [32] | Pei Z G, Shan X Q, Zhang S Z, et al. Insight to ternary complexes of co-adsorption of norfloxacin and Cu (Ⅱ) onto montmorillonite at different pH using EXAFS[J]. Journal of Hazardous Materials, 2011, 186(1): 842–848. DOI:10.1016/j.jhazmat.2010.11.076 |
| [33] | Zhang Q, Zhao L, Dong Y H, et al. Sorption of norfloxacin onto humic acid extracted from weathered coal[J]. Journal of Environmental Management, 2012, 102: 165–172. DOI:10.1016/j.jenvman.2011.12.036 |
| [34] | Bryan N D, Jones D M, Appleton M, et al. A physicochemical model of metal-humate interactions[J]. Physical Chemistry Chemical Physics, 2000, 2(6): 1291–1300. DOI:10.1039/a908722b |
 2017, Vol. 36
2017, Vol. 36