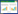文章信息
- 辛鑫, 刘家女
- XIN Xin, LIU Jia-nü
- 鼠李糖脂-混合降解菌强化三角梅去除土壤中对硫磷
- Interaction of rhamnolipids-mixed degrading bacteria to enhance removal of parathion from contaminated soils with Bougainvillea speetabilis
- 农业环境科学学报, 2017, 36(5): 943-949
- Journal of Agro-Environment Science, 2017, 36(5): 943-949
- http://dx.doi.org/10.11654/jaes.2016-1459
文章历史
- 收稿日期: 2016-11-18
有机磷农药为粮食增产、防治疾病传播做出了巨大贡献。然而,有机磷农药的大量生产和不规范使用也引起了一系列环境问题。农药的利用率只有10%~20%,除部分被植物吸收或逸入大气外,大部分农药最终进入土壤[1]。宁夏枸杞主要产区中宁县[2]、浙江省商品竹林[3]、河南省典型农业区域[4]、福州菜地[5]等土壤中有机磷农药残留分析结果表明,部分地区有机磷农药检出率较高。虽然对硫磷、甲基对硫磷等高毒有机磷农药自2007年已全面禁用,但土壤中此类农药残留现象不容忽视。残留在土壤中的有机磷农药不仅会影响土壤的正常结构和功能,降低土壤的正常生产能力,同时严重危害人类健康[6]。有机磷农药主要通过抑制乙酰胆碱酯酶的功能使人等非靶标生物产生瞳孔收缩、肌肉痉挛、昏厥甚至死亡等急性中毒症状[7-8]。有机磷农药污染土壤的治理是关系人类健康和发展的热点问题。
利用植物或微生物辅以环境友好型强化技术来积累和降解土壤中污染物近年来广受关注[9-10]。研究表明,紫茉莉科花卉植物紫茉莉对重金属Cd、石油烃以及人工合成有机物麝香具有较强的耐性和降解性[11-13],与其同属的花卉植物三角梅对重金属Cd具有较强的耐性和积累性[14],为研究三角梅对土壤中对硫磷的耐性和降解性提供了有利基础。但是,由于土壤中对硫磷生物可利用性较低、降解菌缺乏,单一的植物修复对污染土壤的修复效率难以达到预期效果。研究表明,在植物修复的同时向土壤中接种专性降解菌,可以促进有机污染物的降解[15-16],约氏不动杆菌 (Acinetobacter johnsonii) 和环状芽孢杆菌 (Bacillus circulans) 均具有降解对硫磷、马拉硫磷的特性[17-18]。生物表面活性剂不仅具有表面活性剂的性质,而且具有低毒性、可降解性和环境相容性,具有很好的应用前景。鼠李糖脂作为目前应用最为广泛的生物表面活性剂,对土壤中的多种有机污染物包括杀虫剂、石油烃等[19-20]具有增溶效果,可以提高有机物的生物 (植物/微生物) 可利用性和降解速率。尽管鼠李糖脂在污染土壤修复领域具有广阔的应用前景,但是目前关于鼠李糖脂强化植物-微生物联合修复对硫磷污染土壤的研究鲜见报道。因此,本研究选取花卉植物三角梅作为修复植物材料,同时利用鼠李糖脂-混合降解菌的联合作用强化三角梅去除土壤中对硫磷。
目前,大多数研究主要是通过人为添加农药模拟污染土壤,鉴于新添加农药与实际污染土壤中残留农药的活性通常存在差异,本研究以天津地区原主要生产有机磷农药厂厂址的土壤为研究对象,探讨鼠李糖脂-混合降解菌联合作用对三角梅去除土壤中对硫磷的强化效果及其与土壤酶活性的关系,以期为农药污染土壤的生物修复技术提供科学依据。
1 材料与方法 1.1 供试材料 1.1.1 供试植物三角梅 (Bougainvillea spectabilis Willd),紫茉莉科、叶子花属藤状灌木。三角梅幼苗购自福建漳州。
1.1.2 供试土壤土样采自原天津农药股份有限公司所在地,采集的土壤自然风干后压碎,去除砾石和动植物残体,然后过2 mm不锈钢筛,充分混匀,供盆栽试验使用。供试土壤的对硫磷本底值为688 mg·kg-1。
1.1.3 供试生物表面活性剂鼠李糖脂 (Rhamnolipids),纯度99%,购自天津鼎国生物技术有限责任公司。
1.1.4 供试混合降解菌环状芽孢杆菌和约氏不动杆菌购自中国科学院微生物研究所。真空冷冻干燥菌种于营养肉汁琼脂培养基中恢复培养,取培养后的环状芽孢杆菌和约氏不动杆菌按1:1比例配成混合菌剂。
1.1.5 试剂丙酮、二氯甲烷、正己烷、无水乙醇均为分析纯。土壤脲酶、碱性磷酸酶、过氧化氢酶活性测试盒购自北京华夏远洋科技有限公司。
1.2 试验设计本试验共设4个处理组,分别是:① 只种植三角梅 (CK);② 种植三角梅,添加鼠李糖脂 (RH);③ 种植三角梅,接种混合降解菌 (DB);④ 种植三角梅,添加鼠李糖脂和接种混合降解菌 (RH+DB)。与各处理组相对应,设置4个无植物对照组,各处理重复3次。为反映植物的正常生长状况,同时设置1个无污染土壤的植物对照组。试验采用底部有孔的塑料盆 (上口直径16.5 cm,下口直径13 cm,高15 cm),混合降解菌按10%(质量分数) 用量与土壤混合均匀,接菌量为1.0×108 CFU·g-1土壤,鼠李糖脂按50 mg·kg-1与土壤混合均匀装盆,每盆装土500 g。选取生长一致的三角梅幼苗分别移栽入各盆中,每盆1株苗。盆栽试验在玻璃温室中进行,为了使其在自然状况下生长,不施底肥,根据盆中土壤缺水情况,不定期浇水,使土壤含水量保持在田间持水量的80%左右。为防止污染物淋溶渗漏损失,在盆下放置塑料托盘并将渗漏液倒回盆中。50 d后结束培养,收集植物样,供生物量测定和对硫磷含量分析使用。收集土样并分成两份,一份冷冻干燥,供对硫磷含量分析使用,另一份于4 ℃保存,供土壤中酶活性的测定。
1.3 分析方法 1.3.1 植物生物量测定收获的植物样品,首先用自来水充分冲洗以去除粘附于植物样品上的泥土和污物,然后再用去离子水冲洗,用滤纸吸干植物表面水分。将收获的植物样分成地上部和根部,冷冻干燥至恒重,分别用电子天平称量其干重。
1.3.2 植物根际土的采集根际土的采集用抖根法。收获植物时,用剪刀将花盆剪开,得到带完整根系的土块,轻轻抖掉多余土,紧附在根系表面不易被抖下的视为根际土壤,用小毛刷将沾附在根上的土轻轻刷下装入自封袋。
1.3.3 对硫磷的提取与测定土壤和植物中对硫磷提取参照文献[21]的预处理方法,定量称取粉碎后的土样2 g、植物样0.5 g,加二氯甲烷提取液15 mL,微波萃取10 min,温度100 ℃,提取液经过装有无水硫酸钠的漏斗过滤,滤液过硅胶柱粗分后再用0.45 μm有机滤膜除去微粒杂质,最后滤液氮吹至近干,以二氯甲烷定容至2 mL,用GC-MS测定对硫磷含量。
色谱条件:采用色谱柱DB-5MS (30 m×0.25 mm,0.25 μm);载气He (99.999%);进样量1 μL;进样口温度250 ℃;不分流近样;流速1.0 mL·min-1。程序升温:60 ℃·min-1,保持1 min;以30 ℃·min-1升温至180 ℃,保持0 min;再以15 ℃·min-1升温至285 ℃,保持4 min。
质谱条件:电子轰击EI离子源;电子能量70 eV;离子源温度250 ℃;四极杆温度150 ℃;接口温度280 ℃;EM电压1510 V;采样选择离子监测 (SIM) 模式;溶剂延迟4.5 min;自动调谐;NIST08谱库检索。
1.3.4 土壤中酶活性的测定土壤脲酶用靛酚蓝比色法测定,活性以每天每克土样中产生NH3-N的量表示;过氧化氢酶用紫外分光光度法测定,活性以每小时每克土样催化降解H2O2的量表示;碱性磷酸酶用磷酸苯二钠比色法测定,活性以每天每克土壤释放酚的量表示。
1.4 数据处理采用SPSS 16.0对所得数据进行统计分析,差异显著性采用Duncan多重分析法,显著性水平为0.05。采用Origin 9制图。
2 结果与分析 2.1 不同强化处理下三角梅的生物量变化不同处理中三角梅的生物量变化如图 1所示。与无污染土壤相比,对照组 (CK) 中三角梅的生物量并没有产生显著差异 (P>0.05)。4个植物组中三角梅的生物量顺序为:CK < 鼠李糖脂强化处理 (RH) < 混合降解菌强化处理 (DB) < 鼠李糖脂+混合降解菌强化处理 (RH+DB)。对于三角梅地上部生物量,RH、DB、RH+DB处理组比CK分别提高了22%、37%、50%,但RH与CK处理并没有显著差异 (P>0.05)。对于三角梅根部生物量,各处理间差异显著,RH、DB、RH+DB处理均使三角梅根部生物量显著提高,分别提高了29%、41%、69%。各处理组对三角梅根部生长的促进作用均强于地上部。对于三角梅总生物量,RH、DB、RH+DB处理使总生物量显著提高,比CK分别提高23%、37%、52%,接种混合降解菌对三角梅生长的促进作用强于添加鼠李糖脂,鼠李糖脂与混合降解菌的联合作用对三角梅生长的促进作用最为显著。
|
| 不同小写字母表示各处理间差异显著 (P < 0.05)。下同 Different lowercase letters indicate significant differences (P < 0.05) between different treatments. The same below 图 1不同强化处理下三角梅的生物量 Figure 1Biomass of Bougainvillea spectabilis in different enhancement treatments |
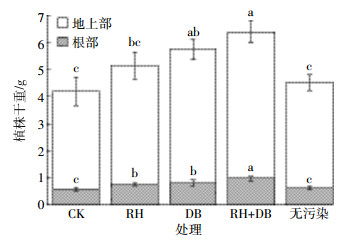
培养50 d后,不同处理土壤中对硫磷的去除率如图 2所示。对于无植物组,添加RH使土壤中对硫磷的去除率比CK提高56.07%,DB处理比CK高了1.75倍,RH+DB联合强化效果最好,使土壤中对硫磷的去除率提高了1.96倍,说明鼠李糖脂和混合降解菌的强化效果优于单一处理。对于植物组,RH、DB处理使土壤中对硫磷的去除率分别提高15.48%和22%,RH+DB联合作用对土壤中对硫磷去除的促进作用强于各自单独作用,使对硫磷去除率提高了45.44%。与无植物组相比,对应的植物组土壤中对硫磷的去除率均显著提高 (P < 0.05),说明通过种植三角梅可以显著促进土壤中对硫磷的去除。在不做任何处理的情况下 (CK),土壤中的对硫磷浓度从初始688 mg·kg-1降低到523 mg·kg-1,去除率达到23.93%。通过种植三角梅,显著提高了土壤中对硫磷的去除率,CK中对硫磷的去除率比不种植植物时提高了1.6倍。
|
| 图 2不同处理土壤中对硫磷的去除率 Figure 2Removal rate of parathion in different treatments |
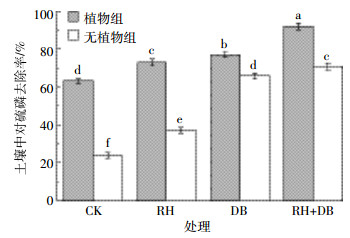
植物体内对硫磷的积累量如图 3所示。不同处理组三角梅根部对硫磷积累量均高于地上部,说明三角梅从土壤中吸收的对硫磷主要积累于根部。在不做任何处理的情况下,三角梅地上部和根部对硫磷的积累量分别达到153.59、289.57 μg·g-1,而且植物的生物量并没有受到明显的影响。RH、DB处理三角梅体内对硫磷积累量显著降低 (P < 0.05),特别是RH+DB联合作用时,三角梅地上部、根部对硫磷含量与CK相比降低了65.22%和60.32%。这可能是因为鼠李糖脂与混合降解菌联合作用加速了土壤中对硫磷的降解,土壤中对硫磷的浓度远低于CK,使三角梅根部从土壤中的吸收量减小。
|
| 图 3植物体内对硫磷积累量 Figure 3Parathion accumulation in plant tissues |
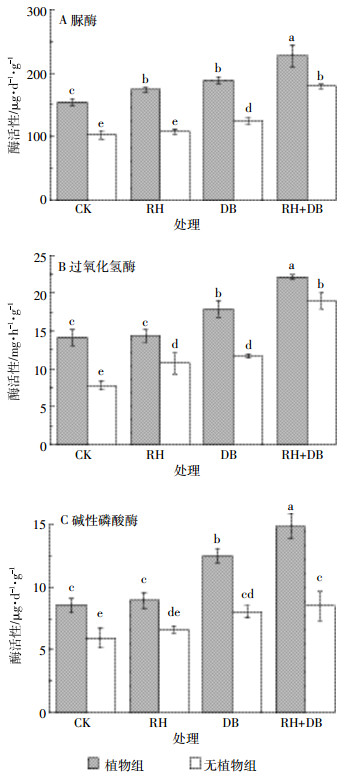
经过50 d培养,各处理组土壤中酶的活性变化如图 4所示。可以看到,三角梅的存在显著 (P < 0.05) 提高了土壤脲酶、过氧化氢酶、碱性磷酸酶活性。RH、DB处理可以在不同程度上提高土壤中3种酶的活性,RH+DB联合作用效果最好。各处理中脲酶的活性为CK < RH < DB < RH+DB,植物组土壤中脲酶的活性均显著高于无植物组 (P < 0.05)。对于植物组,RH+DB处理对土壤中脲酶活性的提高作用显著强于DB、RH处理 (P < 0.05)。各处理中过氧化氢酶的活性为CK < RH < DB < RH+DB,在植物组中,DB和RH+DB处理显著提高了土壤中过氧化氢酶的活性 (P < 0.05)。在不种植三角梅的情况下,RH+DB联合作用同样可以显著提高土壤中过氧化氢酶活性。各处理中碱性磷酸酶活性的变化与过氧化氢酶相似,表现为CK < RH < DB < RH+DB。植物组土壤中碱性磷酸酶活性均显著高于无植物组 (P < 0.05)。对于无植物组,RH与CK、DB处理对土壤中碱性磷酸酶活性的影响没有显著差异,RH+DB处理显著提高了土壤中碱性磷酸酶活性 (P < 0.05)。
|
| 图 4土壤中脲酶、过氧化氢酶、碱性磷酸酶的活性变化 Figure 4The change of urease, catalase and alkaline phosphatase activities in soil |
本试验各处理组中三角梅在收获时从外表看生长状况良好,无落叶、枯萎等明显的毒害症状,与无污染土壤相比,三角梅的生物量均未显著降低,说明三角梅对土壤中对硫磷具备一定的耐性。添加鼠李糖脂、接种混合降解菌可以在不同程度上促进三角梅的生长,且对根部的促进作用最为明显。本研究中,鼠李糖脂使三角梅地上部、根部的生物量分别提高了22%、29%,促进作用显著。鼠李糖脂不仅可以促进三角梅的生长,研究表明,其同样可以显著提高紫花苜蓿、黑麦草的生物量,且对植株根部生物量提高作用最为明显[22-23]。鼠李糖脂促进植物生长的机制主要表现在两方面[24]:一是表面活性剂改变了细胞膜的通透性,使植物可以吸收更多养分;二是鼠李糖脂增加了污染物的生物可利用性,从而促进了土壤中污染物的生物降解,减少了其对三角梅的毒害作用。接种混合降解菌对三角梅生长的促进作用强于添加鼠李糖脂,使三角梅地上部、根部的生物量分别提高了37%、41%。接种混合降解菌可以促进土壤中对硫磷的生物降解,并且对三角梅没有明显的生长毒性。这表明,可以利用鼠李糖脂与混合降解菌的联合作用缓解污染物给植物带来的负面影响,增强三角梅的耐性。
植物根系与土壤微生物之间的相互作用形成一个独特的微生态环境--根际环境,植物根际与微生物的联合代谢是土壤中有机磷农药的主要去除途径之一[25]。本试验中,仅通过种植三角梅就使土壤中对硫磷的去除率比对照组提高了1.6倍,可能是由于三角梅的根系分泌物促进了根际微生物生长、活性和多样性,从而促进对硫磷的降解。试验结果表明,添加鼠李糖脂、接种混合降解菌可以强化对硫磷的根际降解效果。鼠李糖脂对土壤中有机磷农药的增溶作用,可以促进土壤有机磷农药的微生物降解,Mata-Sandoval等[26]研究了添加鼠李糖脂对微生物降解土壤中蝇毒磷的影响,结果表明一定浓度的鼠李糖脂可以提高土壤中蝇毒磷的去除率。对硫磷作为疏水性有机物,鼠李糖脂提高对硫磷的生物可利用性可能体现在两方面[27]:一是通过形成胶束将吸附在土壤颗粒上的对硫磷转移到水相中,增大与细胞的接触面积;二是调节微生物细胞膜表面的疏水性,从而增大细胞与对硫磷之间的亲和力。单独种植三角梅时土壤中对硫磷去除率为51.63%,单独接种混合降解菌时土壤中对硫磷的去除率为55.07%,三角梅和混合降解菌联合作用时土壤中对硫磷去除率为69.98%,可见植物-微生物联合作用将更有利于土壤中对硫磷的去除。
研究表明,植物对有机磷农药的直接吸收是土壤中有机磷农药的另一去除途径,如夏会龙等[28]报道的培养液中乙硫磷的消解中凤眼莲积累贡献率为60%。为了探究三角梅直接吸收对土壤中对硫磷去除的贡献,本试验对三角梅体内对硫磷含量进行了测定,结果显示CK处理中,三角梅地上部、根部对硫磷积累量达到最大值,分别为153.59、289.57 μg·g-1,RH、DB、RH+DB处理均使三角梅体内对硫磷含量降低,可能的原因是添加鼠李糖脂、接种混合降解菌可以在短时间内使土壤中对硫磷含量显著降低,土壤中对硫磷的浓度远低于对照组,三角梅根部从土壤中的吸收相应减小。相对于土壤中对硫磷去除率而言,对硫磷在三角梅体内的积累量较小,三角梅吸收的对硫磷可能在植物体内进一步被同化、代谢或者随着蒸腾挥发转移到大气中,相关机制有待进一步研究验证。
土壤酶在物质转化、能量代谢、污染土壤修复等过程中发挥着重要作用[29]。土壤中酶活性的变化在一定程度上可以反映土壤中微生物降解有机污染物的能力。植物的生长能够显著地影响土壤的酶活,同时污染水平的高低也是影响土壤酶活性的关键因素。土壤脲酶作为一种酰胺酶,可水解尿素为氨和二氧化碳,是氮素转化的重要酶类;过氧化氢酶促进过氧化氢的分解,能有效防止土壤及生物体在新陈代谢过程中产生的过氧化氢对其毒害;磷酸酶是土壤磷素循环、有机磷农药降解的重要酶类[30]。三角梅的存在使污染土壤中脲酶、过氧化氢酶、碱性磷酸酶的活性显著提高,其可能的机理:一是三角梅根细胞释放出胞内酶,使总体酶活性表现为增强;二是三角梅根部释放的有机物促进微生物的生长,进而促进微生物酶的分泌作用。本实验中鼠李糖脂与混合降解菌联合作用提高土壤中酶活性的效果最为明显,可能的机理:一是鼠李糖脂作为表面活性剂促使部分酶分子解吸而表现出更高的活性;二是混合降解菌的使用一定程度上干扰了三角梅根际微生物多样性,增加了产酶微生物的数量。各处理酶活的变化与土壤中对硫磷去除率呈正相关关系,因此土壤酶活 (脲酶、过氧化氢酶和碱性磷酸酶) 可以作为指示三角梅去除土壤对硫磷的效应标志物。
4 结论(1) 添加鼠李糖脂和接种混合降解菌可以降低对硫磷对三角梅的毒害作用,促进三角梅的生长,增加三角梅生物量,其对根部生长的影响大于地上部。
(2) 种植三角梅的情况下,添加鼠李糖脂,提高土壤中对硫磷的生物可利用性;接种混合降解菌,增加土壤微生物数量,两者都促进了土壤中对硫磷的去除。两者联合作用能明显强化三角梅对土壤中对硫磷的去除效果,去除率最高达91.96%。
(3) 三角梅的存在显著提高了土壤脲酶、过氧化氢酶、碱性磷酸酶活性,鼠李糖脂与混合降解菌联合作用同样可以显著提高土壤中酶的活性,其对于土壤对硫磷的去除发挥重要作用。
| [1] | 卢桂宁, 党志, 陶雪琴, 等. 农药污染土壤的植物修复研究进展[J]. 土壤通报, 2006, 37(1): 189–193. LU Gui-ning, DANG Zhi, TAO Xue-qin, et al. A review on phytoremediation of pesticide-contaminated soils[J]. Chinese Journal of Soil Science, 2006, 37(1): 189–193. |
| [2] | 魏淑花, 孙海霞, 沈娟. 宁夏枸杞产区土壤中有机磷农药残留现状分析[J]. 中国农学通报, 2009, 25(24): 488–490. WEI Shu-hua, SUN Hai-xia, SHEN Juan. Study on the residues of organophosphorus pesticides in the soil of Chinese wolfberry produce district in Ningxia[J]. Chinese Agricultural Science Bulletin, 2009, 25(24): 488–490. |
| [3] | 郭子武, 陈双林, 张刚华, 等. 浙江省商品竹林土壤有机农药污染评价[J]. 生态学杂志, 2008, 27(3): 434–438. GUO Zi-wu, CHEN Shuang-lin, ZHANG Gang-hua, et al. Assessment of organic pesticides pollution of commercial bamboo forest soils in Zhejiang[J]. Chinese Journal of Ecology, 2008, 27(3): 434–438. |
| [4] | 申剑, 王宣, 刘丹, 等. 河南省典型农业区域土壤中有机磷、有机氯农药污染状况初探[J]. 环境研究与监测, 2006, 19(3): 35–36. SHEN Jian, WANG Xuan, LIU Dan, et al. Current situation of organochlorine and organophosphorus pesticide pollution in farmland in Henan Province[J]. Environmental Study and Monitoring, 2006, 19(3): 35–36. |
| [5] | 王俊, 胡进锋, 陈峰, 等. 福州菜地土壤中有机磷农药残留特征及风险评价[J]. 农业环境科学学报, 2014, 33(5): 951–957. WANG Jun, HU Jin-feng, CHEN Feng, et al. Residues and risk assessment of organophosphorus pesticides in vegetable soils in Fuzhou, China[J]. Journal of Agro-Environment Science, 2014, 33(5): 951–957. DOI:10.11654/jaes.2014.05.018 |
| [6] | John E M, Shaike J M. Chlorpyrifos:Pollution and remediation[J]. Environmental Chemistry Letters, 2015, 13(3): 269–291. DOI:10.1007/s10311-015-0513-7 |
| [7] | 段海明, 王开运, 王冕, 等. 蜡状芽孢杆菌HY-1降解甲基对硫磷和毒死蜱的影响因素研究[J]. 农业环境科学学报, 2010, 29(3): 437–443. DUAN Hai-ming, WANG Kai-yun, WANG Mian, et al. Degradative characteristics of Bacillus cereus HY-1 to methyl-parathion and chlorpyrifos[J]. Journal of Agro-Environment Science, 2010, 29(3): 437–443. |
| [8] | Bradley M, Rutkiewicz J, Mittal K, et al. In ovo exposure to organophosphorous flame retardants:Survival, development, neurochemical, and behavioral changes in white leghorn chickens[J]. Neurotoxicology and Teratology, 2015, 52(Part B): 228–235. |
| [9] | Chirakkara R A, Cameselle C, Reddy K R. Assessing the applicability of phytoremediation of soils with mixed organic and heavy metal contaminants[J]. Reviews in Environmental Science and Bio/Technology, 2016, 15(2): 299–326. DOI:10.1007/s11157-016-9391-0 |
| [10] | Mahar A, Wang P, Ali A, et al. Challenges and opportunities in the phytoremediation of heavy metals contaminated soils:A review[J]. Ecotoxicology and Environmental Safety, 2016, 126: 111–121. DOI:10.1016/j.ecoenv.2015.12.023 |
| [11] | 周启星, 刘家女. 一种利用紫茉莉花卉植物修复重金属污染土壤的方法: 中国, CN101049603[P]. 2007-10-10. ZHOU Qi-xing, LIU Jia-nü. A new method to remediate Cd-contamination soil by Mirabilis jalapa L.:China, CN101049603[P]. 2007-10-10. |
| [12] | Peng S W, Zhou Q X, Cai Z, et al. Phytoremediation of petroleum contaminated soils by Mirabilis jalapa L. in a greenhouse plot experiment[J]. Journal of Hazardous Materials, 2009, 168(2/3): 1490–1496. |
| [13] | 房晓婷. 紫茉莉对镉-佳乐麝香复合污染土壤的修复研究[D]. 天津: 南开大学, 2015. FANG Xiao-ting. Study on phytoremediation of cadmium and galaxolide by Mirabilis jalapa L.[D]. Tianjin:Nankai University, 2015. |
| [14] | 王文静, 刘家女. 一种利用三角梅花卉植物修复重金属镉污染土壤的方法: 中国, CN104858226A[P]. 2015-08-26. WANG Wen-jing, LIU Jia-nü. Phytoremediation of Cd contaminated soils using Bougainvillea spectabilis:China, CN104858226A[P]. 2015-08-26. |
| [15] | Dubey K K, Fulekar M H. Chlorpyrifos bioremediation in Pennisetum rhizosphere by a novel potential degrader Stenotrophomonas maltophilia MHF ENV20[J]. World Journal of Microbiology and Biotechnology, 2012, 28(4): 1715–1725. DOI:10.1007/s11274-011-0982-1 |
| [16] | Glick B R. Using soil bacteria to facilitate phytoremediation[J]. Biotechnology Advances, 2010, 28(3): 367–374. DOI:10.1016/j.biotechadv.2010.02.001 |
| [17] | Xie S, Liu J X, Li L, et al. Biodegradation of malathion by Acinetobacter johnsonii MA19 and optimization of cometabolism substrates[J]. Journal of Environmental Sciences, 2009, 21(1): 76–82. DOI:10.1016/S1001-0742(09)60014-0 |
| [18] | 彭胜巍, 周启星. 持久性有机污染土壤的植物修复及其机理研究进展[J]. 生态学杂志, 2008, 27(3): 469–475. PENG Sheng-wei, ZHOU Qi-xing. Research advances in phytoremediation and its mechanisms of POPs-contaminated soils[J]. Chinese Journal of Ecology, 2008, 27(3): 469–475. |
| [19] | Mata-Sandoval J C, Karns J, Torrents A. Influence of rhamnolipids and Triton X-100 on the biodegradation of three pesticides in aqueous phase and soil slurries[J]. Journal of Agricultural and Food Chemistry, 2001, 49(7): 3296–3303. DOI:10.1021/jf001432w |
| [20] | Amani H. Evaluation of biosurfactants and surfactants for crude oil contaminated sand washing[J]. Petroleum Science and Technology, 2015, 33(5): 510–519. DOI:10.1080/10916466.2014.999941 |
| [21] | 吕春红. 毛细管气相色谱法测定金银花中敌敌畏、甲基对硫磷和马拉硫磷的残留量[J]. 中国医药导报, 2008, 5(10): 32–33. LÜ Chun-hong. Determination of the residue of dichlorovos, methyl parathion and malathion in Flos lonicerae by capillary gas chromatography[J]. China Medical Herald, 2008, 5(10): 32–33. DOI:10.3969/j.issn.1673-7210.2008.10.018 |
| [22] | 张晶, 林先贵, 李烜桢, 等. 菇渣和鼠李糖脂联合强化苜蓿修复多环芳烃污染土壤[J]. 环境科学, 2010, 31(10): 2431–2438. ZHANG Jing, LIN Xian-gui, LI Xuan-zhen, et al. Interactive effect of spent mushroom compost and rhamnolipids to enhance the effeciency of alfalfa remediation of aged PAHs contaminated soil[J]. Environmental Science, 2010, 31(10): 2431–2438. |
| [23] | Zhu L Z, Zhang M. Effect of rhamnolipids on the uptake of PAHs by ryegrass[J]. Environmental Pollution, 2008, 156(1): 46–52. DOI:10.1016/j.envpol.2008.01.004 |
| [24] | 王冬梅, 陈丽华, 周立辉, 等. 鼠李糖脂对微生物菌剂降解石油的影响[J]. 环境工程学报, 2013, 7(10): 4121–4126. WANG Dong-mei, CHEN Li-hua, ZHOU Li-hui, et al. Effects of rhamnolipid on petroleum degradation of compound microbial inoculant[J]. Chinese Journal of Environmental Engineering, 2013, 7(10): 4121–4126. |
| [25] | 张伟, 张忠明, 王进军, 等. 有机农药污染的植物修复研究进展[J]. 农药, 2007, 46(4): 217–226. ZHANG Wei, ZHANG Zhong-ming, WANG Jin-jun, et al. Progress in research and application of phytoremediation for organic pesticides[J]. Agrochemicals, 2007, 46(4): 217–226. |
| [26] | Mata-Sandoval J C, Karns J, Torrents A. Influence of rhamnolipids and Triton X-100 on the desorption of pesticides from soils[J]. Environmental Science & Technology, 2002, 36(21): 4669–4675. |
| [27] | 姜萍萍, 郭楚玲, 党志, 等. 鼠李糖脂与疏水底物及其降解菌的相互作用[J]. 环境科学, 2011, 32(7): 2144–2151. JIANG Ping-ping, GUO Chu-ling, DANG Zhi, et al. Interrelationships of rhamnolipids, hydrophobic substrate and degrading bacteria[J]. Environmental Science, 2011, 32(7): 2144–2151. |
| [28] | 夏会龙, 吴良欢, 陶勤南. 凤眼莲植物修复几种农药的效应[J]. 浙江大学学报 (农业与生命科学版), 2002, 28(2): 49–52. XIA Hui-long, WU Liang-huan, TAO Qin-nan. Phytoremediation of some pesticides by water hyacinth (Eichhornia crassipes Solms)[J]. Journal of Zhejiang University (Agriculture and Life Science), 2002, 28(2): 49–52. |
| [29] | Liu R, Dai Y, Sun L. Effect of rhizosphere enzymes on phytoremediation in PAH-contaminated soil using five plant species[J]. PloS One, 2015, 10(3): 1–14. |
| [30] | 傅丽君, 杨文金. 4种农药对枇杷园土壤磷酸酶活性及微生物呼吸的影响[J]. 中国生态农业学报, 2007, 15(6): 113–116. FU Li-jun, YANG Wen-jin. Effects of pesticides on soil phosphatase activity and respiration of soil microorganisms in loquat orchard[J]. Chinese Journal of Eco-Agriculture, 2007, 15(6): 113–116. |
 2017, Vol. 36
2017, Vol. 36