文章信息
- 程鹏飞, 潘璐, 王愿珠, 刘天中, 刘德富
- CHENG Peng-fei, PAN Lu, WANG Yuan-zhu, LIU Tian-zhong, LIU De-fu
- 栅藻贴壁培养处理沼液效果的研究
- The treatment of piggery biogas slurry with Scenedesmus sp. by attached culture
- 农业环境科学学报, 2017, 36(5): 996-1002
- Journal of Agro-Environment Science, 2017, 36(5): 996-1002
- http://dx.doi.org/10.11654/jaes.2016-1506
文章历史
- 收稿日期: 2016-11-25
2. 九江学院鄱阳湖生态经济研究中心, 江西 九江 332005;
3. 湖北工业大学土木建筑与环境学院, 武汉 430072;
4. 三峡大学水利与环境学院, 湖北 宜昌 443002;
5. 中国科学院青岛生物能源与过程研究所, 山东 青岛 266101
2. Poyang Lake Eco-economy Research Center of Jiujiang University, Jiujiang 332005, China;
3. School of Architectural and Environment, Hubei University of Technology, Wuhan 430072, China;
4. School of Water Conservancy and Environment, China Three Gorges University, Yichang 443002, China;
5. Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China
生猪养殖产生的污染,尤其是养猪沼液中N、P等污染给水体生态环境与人类安全健康造成严重危害,已经成为农业面源污染的主要来源[1-2]。目前,国内生猪养殖废水出水标准基本执行畜禽污染物排放标准,其出水COD仍高达400 mg·L-1,且含有大量N、P等元素。随着国家对畜禽养殖环境的重视,沼液废水排放标准提高是必然趋势。
当前,生猪养殖废水主要采用厌氧发酵产沼气处理技术,虽然在废水净化效果与经济效益方面均有一定优势,但处理后的沼液仍含有丰富的N、P等大量元素及各种微量元素[3-4]。传统“猪-沼-果”、“猪-沼-鱼”等沼液利用模式能够有效提高土壤肥力、改善果蔬与鱼苗的生长品质,但是这些沼液的规模化利用面临土地不足以消纳及农户不接受等问题,加大了养殖污水处理难度,造成资源的浪费和对社会、环境的不良影响[5-6]。因此,沼液废水的处理迫切需要能使其处理后得以资源化利用的集成技术。
比较而言,利用某些生物本身的化学结构与成分特性来非定向或选择性的吸附、富集或去除废水中N、P及COD等则具有明显的优势。各种生物质资源中,藻类光合效率高、油脂产率高、固碳效率好及含有丰富的高附加值产品,相比于细菌、霉菌、植物等具有更好的优势,因而被认为是最具发展潜力的生物质资源之一[7-8]。微藻在光合作用生长过程中能够吸收大量的N、P等营养物质,或通过富集与结合作用对水体环境中金属离子、微量元素等进行吸附,合成自身脂质及其他附加值产品,进而降低水体中的营养负荷,净化水质[9]。
利用液体悬浮培养微藻进行养猪沼液废水处理的研究已有报道。Franchino等[10]和阮榕生等[11]国内外学者应用微藻进行沼液废水的处理,取得了较好的效果。但传统的微藻悬浮培养净化废水技术因占地面积大、处理效果不稳定、采收成本高等原因一直未能成为污水处理的主流工艺。Ji等[12]将小球藻 (Chlorella vulgaris YSW-04) 在传统的PBRs反应器中悬浮培养并净化沼液废水,结果藻细胞的生长因废水的浓度高而受到抑制,生物产率较低,而且培养后的藻细胞需离心分离才能最终净化水质。因此,微藻培养系统 (反应器) 的构建是实现微藻污水处理工程化应用的关键。基于此,本研究利用贴壁技术培养微藻处理沼液废水。贴壁培养是根据光稀释与固定化的原理,将藻细胞与培养基相分离,并固定在一定生物膜材料上,将极少量的培养基液体通过附着在多孔材料的背面或内部滴入以使藻细胞处于半干湿润状态,并在一定光照强度与营养盐浓度下进行生长的培养方式[13]。利用贴壁方式培养微藻处理沼液废水,培养结束后省去了藻细胞离心的高能耗过程,大幅降低成本。但贴壁培养微藻藻细胞生长状况与悬浮培养相比是否有优势,以及两种培养方式下对培养基中营养物质的去除效率还需要作比较研究。在此实验基础上再对贴壁培养微藻处理沼液废水的效果进行研究才具意义。
藻细胞用于生产生物柴油是微藻沼液废水处理重获新生的主要驱动力之一。微藻培养将污水处理和生物柴油生产相结合,在一定程度上解决了藻类培养的成本以及污水处理问题。选择油脂含量高、生长速率快的微藻在整个技术中至关重要。众多微藻中,由于栅藻在其培养过程中可积累较多油脂,且对污水耐受能力强,是一种典型的生产生物柴油的藻种资源[14]。
本文首先在正常BG11培养基下比较栅藻贴壁培养与传统悬浮培养藻细胞生长及对营养盐利用效率。通过采集武汉某地区养猪沼液废水,利用贴壁方式培养栅藻,考察栅藻在沼液废水中生长、油脂积累及对NH3-N、TP及COD的去除效率,以期探究栅藻贴壁培养处理养猪沼液废水的效果,为沼液污染控制及现代畜禽生态发展提供“绿色生态”途径。
1 材料与方法 1.1 藻种与培养基本实验所用栅藻 (Scendesmus dimorphus) 藻种由湖北工业大学实验室保藏。栅藻种子培养过程所用培养基为BG11培养基[15]。
1.2 沼液废水本实验藻类贴壁培养沼液废水取自武汉市某畜禽企业经厌氧发酵后的污水,取水时间为2016年3月15日14:00。废水经自然沉降2 d后,取上清液测定其初始NH3-N、TP、COD等指标,结果见表 1。
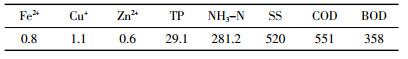
|
本实验栅藻种子培养所用反应器为玻璃柱式反应器,内直径0.05 m,柱高0.55 m,工作体积0.9 L。反应器内部放置直径5 mm的玻璃通气管,混合有1.5% CO2(V/V) 的压缩空气 (0.1 MPa),以0.1 vvm的速率通过通气管从反应器底部鼓泡,从而将藻液搅动并补充碳源。培养过程中连续光照,培养柱表面光强100 μmol·m-2·s-1,培养温度 (25±1) ℃。
贴壁培养反应装置如图 1所示。将一长0.4 m、宽0.2 m、厚3 mm的玻璃板置于0.5 m×0.3 m×0.05 m的玻璃腔中,玻璃板的一面附有滤纸,并接受正上方的光照。将栅藻藻种接种于醋酸纤维素膜上,贴于附着在玻璃板的滤纸上,将附有藻种的玻璃板放入玻璃腔室内,为保持玻璃腔室内的稳定环境,用保鲜膜封住玻璃腔的一面,培养基液体通过循环泵滴加 (循环使用)。为了保证培养液均匀渗入藻细胞内,将玻璃培养腔放置一定倾角,荧光灯置于培养腔正上方提供光源。沼液废水贴壁培养栅藻未通CO2,以空气鼓泡代替,其他培养条件与种子液培养条件相同。
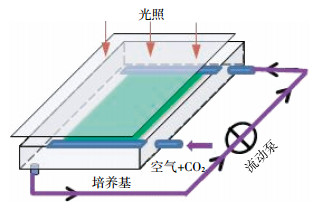
|
| 图 1微藻贴壁培养装置示意图 Figure 1Device of attached culture for microalgae |
为了便于比较正常BG11培养基下栅藻贴壁培养与液体培养藻细胞生长及N盐利用情况,栅藻液体培养置于体积1 L的玻璃缸中 (长50 cm、宽20 cm、厚1 cm),在相同条件下进行比较研究。
1.4 分析方法 1.4.1 藻细胞生物量测定将0.45 μm (直径50 mm) 的醋酸纤维滤膜煮沸3次后,在105 ℃烘箱中烘至恒重 (W1),将待测藻样用去离子水冲至烧杯中,并倒入抽滤装置中抽至已称重的滤膜上,将附着藻的滤膜放入105 ℃烘箱中烘至恒重 (W2),用分析天平称量可得藻样重量 (DW/g·m-2)。
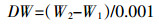 (1)
(1) 栅藻总脂含量的测定采用改进的氯仿-甲醇法[16]。收集藻细胞,用一定量蒸馏水冲洗离心后冷冻干燥。称取约50 mg (重量W1) 藻粉于研钵中,加入200 mg已烘干的石英砂,研碎后加入5 mL甲醇,2.5 mL氯仿,高速振荡5 min。摇床12 h,离心取上清7.5 mL至以新管1。向固相中再加入5 mL甲醇,2.5 mL氯仿,高速振荡5 min,摇床2 h,离心取上清7.5 mL至以新管1,后加入5 mL氯仿和9 mL浓度1% NaCl,保证最终体系为甲醇:氯仿:1% NaCl=2:2:1.8,振荡混匀。将新管1于8000 r·min-1下离心10 min,去上清,下层液转移入20 mL干净玻璃管 (已称重W2)。吹氮气于61 ℃水浴,约10 min待氯仿挥发殆尽后,于105 ℃烘3 h,冷却后,称重W3。
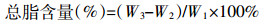 (2)
(2) 分别测定0、24、48、72、96 h时BG11培养液中N浓度,在相同条件下比较栅藻液体培养与贴壁培养对N的吸收效率。培养液中N含量测定方法参照Collos等[17]的实验研究。准确量取2 mL培养基,10 000×g下离心5 min,收集上清液在220 nm下分光光度计测定,N的摩尔浓度 (C,mmol·L-1) 参照以下公式计算:
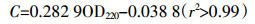 (3)
(3) 取贴壁培养循环装置中沼液废水,每2 d分别进行NH3-N、TP及COD测定。NH3-N测量采用纳氏试剂分光光度法 (HJ 535-2009);TP测量采用钼酸铵分光光度法 (GB 11893-1989);COD的测定采用重铬酸钾氧化处理法 (GB 11914-1989)。
1.5 数据分析方法采用数据统计软件SPSS 10.0进行单因素方差分析 (One-Way ANOVA),采用LSD和Tukey HSD法进行统计检验 (P<0.05)。
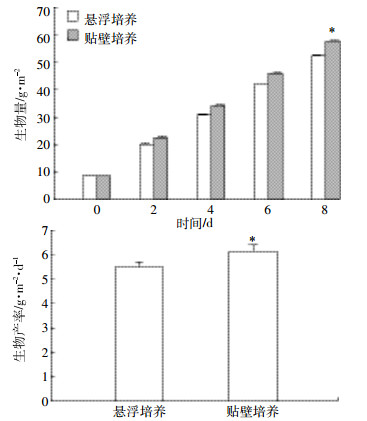
2 结果与分析 2.1 栅藻贴壁培养与悬浮培养的比较将培养至对数期 (经3~4 d) 的栅藻种子液分别接种于贴壁反应器与悬浮培养缸中,在温度 (25±1) ℃,光照强度 (100±10) μmol·m-2·s-1,1% CO2(V/V) 及相同光面积下培养8 d。栅藻的生物量变化情况如图 2所示。结果表明,贴壁培养下栅藻生长状况优于悬浮培养,培养8 d后悬浮培养的生物产率为5.48 g·m-2·d-1,而贴壁培养生物产率为6.15 g·m-2·d-1,高于文献报道的传统液体悬浮培养栅藻的结果[18]。
|
| *表示不同处理间差异显著 (P < 0.05)。下同 * Indicates significant differences among treatments (P < 0.05) 图 2栅藻悬浮培养与贴壁培养生长比较 Figure 2Comparison of the growth of Scendesmus sp. under attached and aqueous-suspension cultivation |
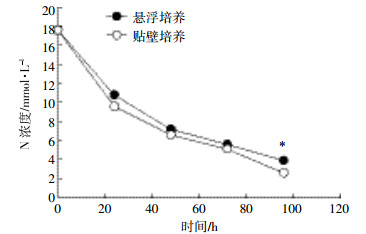
从图 3可知,随着培养时间的延长 (0、24、48、72、96 h),栅藻悬浮培养与贴壁培养BG11培养基中N浓度均由最初17.6 mmol·L-1逐渐降低。栅藻悬浮培养下培养液中N的变化不显著,贴壁培养下藻细胞对N的吸收效率略高,变化较为显著。培养96 h后,贴壁培养下培养液中N的最终浓度为2.6 mmol·L-1,悬浮培养N的浓度为3.9 mmol·L-1;贴壁培养栅藻对N的去除率为85.2%,显著高于悬浮培养N的去除效率77.8%。贴壁培养下栅藻的生长及对N的吸收效率均优于传统悬浮培养,而养猪沼液废水中富含N、P等营养物 (表 1)。因此,利用栅藻贴壁培养处理养猪沼液废水有待进一步尝试。
|
| 图 3栅藻贴壁培养与液体培养下培养基中N含量的变化 Figure 3Consumption of nitrate concentrations in cultivation broth for Scendesmus sp. under attached and aqueous-suspension cultivation |
将对数期栅藻种子液接种于贴壁反应器中,每2 d取样,培养8 d后考察栅藻在沼液废水中生长情况 (图 4a),并与正常BG11培养情况比较 (图 4b)。由图 4a得知,栅藻在养猪沼液废水原水中能较好生长,尤其在培养前2 d生长较快,生物产率为12.5 g·m-2·d-1,显著高于正常BG11培养基。相同条件下培养8 d后,沼液废水中栅藻生物产率为6.26 g·m-2·d-1,与正常BG11培养基的差异不明显 (6.23 g·m-2·d-1)。
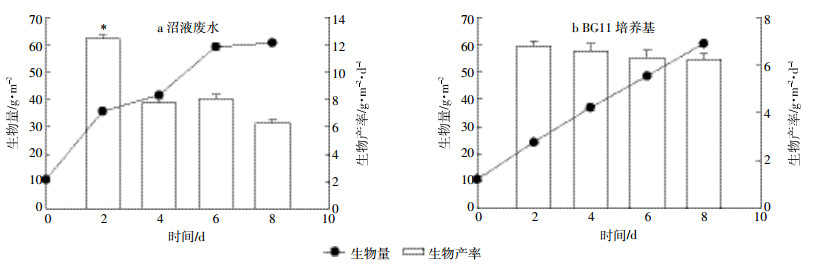
|
| 图 4沼液废水与正常BG11培养基栅藻贴壁生长状况 Figure 4The growth of Scendesmus sp. with attached culture in swine wastewater and BG11 medium |
相同条件下,栅藻分别在沼液废水和BG11培养基中贴壁培养,收集培养8 d后的藻细胞,分别考察油脂积累情况。由图 5可知,栅藻在沼液废水中的油脂含量略低于BG11培养基,分别是34.6%、35.2%。由于藻细胞在两种培养液中生物产率相近 (图 4),其油脂产率也相近,分别为2.17、2.19 g·m-2·d-1。
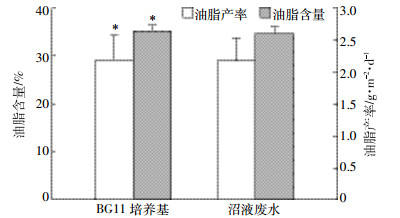
|
| 图 5沼液废水与正常BG11培养基栅藻贴壁培养油脂积累情况 Figure 5Lipid accumulation Scendesmus sp. with attached culture in swine wastewater and BG11 medium |
在光照强度100 μmol·m-2·s-1、温度 (25±1) ℃、通空气条件下贴壁培养栅藻去除沼液废水。同时,在相同条件下贴壁培养装置中不添加栅藻作为参照,考察沼液废水中NH3-N、TP及COD变化情况。由图 6 a可知,废水中NH3-N浓度在最初2 d内降低较快,培养8 d后,由初始的281.2 mg·L-1降为2.7 mg·L-1;由图 6 b可知,废水中TP浓度也是在前4 d内下降最快,培养8 d后,由初始浓度29.1 mg·L-1降为7.8 mg·L-1;由图 6 c可知,废水中COD去除较显著,培养8 d后,由初始542.1 mg·L-1降为150.2 mg·L-1。基于以上数据分析,栅藻贴壁培养处理养猪沼液废水8 d内,废水中NH3-N、TP及COD去除效率分别是99.1%、73.1%和72.3%(图 6 d)。图 7实验结果表明,沼液废水在贴壁培养装置中不添加藻类下运行8 d,废水中NH3-N、COD浓度变化不明显,去除效率分别是13.9%、12.2%;TP去除效率虽然略高 (28.2%),但远低于栅藻培养下的去除率 (73.1%)。
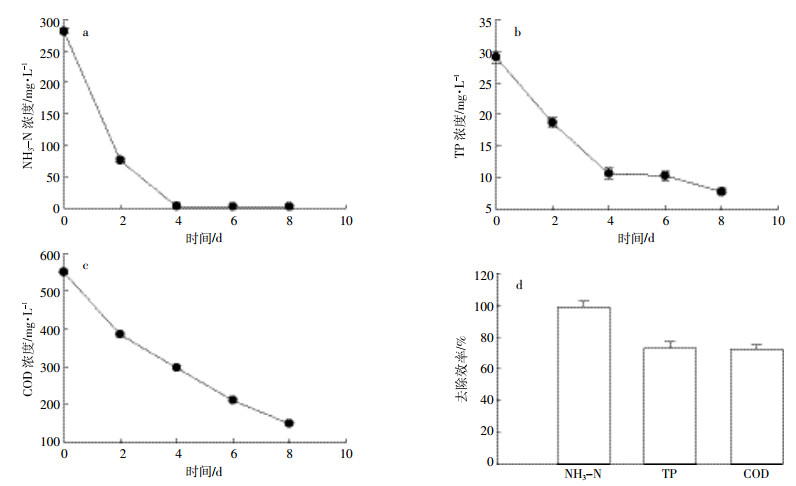
|
| 图 6贴壁培养栅藻去除NH3-N、TP及COD情况 Figure 6The removal of NH3-N, TP and COD of wastewater for Scendesmus sp. with biofilm attached cultivation |
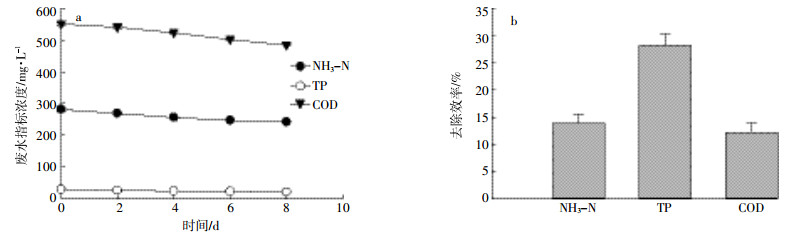
|
| 图 7贴壁装置无藻类下NH3-N、TP及COD变化情况 (空白对比) Figure 7The removal of NH3-N, TP and COD of wastewater in control with biofilm attached cultivation |
当前,养猪废水污染严重,经厌氧发酵产生的沼液仍有部分未能达到排放标准。沼液废水中大量N、P及COD等营养物质应用于藻类的培养,不仅节省微藻培养成本,提高经济效益,而且保护了养猪生态环境。传统微藻的培养方式主要是悬浮式的跑道池与各种PBRs反应器,这些反应装置构建成本高,利用其培养微藻生物产率低,而且培养后需离心、分离等高能耗采收,通过液体悬浮式培养微藻处理沼液的工艺化还未成熟[19]。
本文首先在正常BG11培养基中比较了栅藻贴壁培养与悬浮培养的生长及对培养液中N的吸收情况,结果表明,栅藻贴壁培养的生物产率高于悬浮培养,贴壁培养下藻细胞对培养液中N的吸收率也高于悬浮培养。传统悬浮培养,藻类培养初期由于光抑制或培养后期光衰减等原因,使藻细胞不能充分有效地利用光能,藻细胞生物产率较低[20]。在贴壁培养方式下,藻细胞与培养基分离,光直接照在细胞生物膜表面,没有光衰减,单位藻细胞光子利用率增加,即可加快栅藻细胞的生长,同时也提高了藻细胞对N等营养盐的利用[21]。
栅藻的贴壁培养对培养液中营养物质的利用率高于悬浮培养,表明利用栅藻贴壁培养处理富含N、P等营养物质的养猪沼液废水是有意义的。栅藻在沼液废水中生物产率与正常培养基相当,而培养前期藻细胞在起始NH3-N浓度较高的沼液中生长较好,远高于正常培养基的生长状况。这表明一定浓度范围内,NH3-N可以促进藻细胞的生长。微藻可直接利用的氮源形式主要是NH3-N,其他形态的氮源都要经过氧化还原转化成铵态氮供藻类利用。微藻虽对铵态氮和硝态氮都能吸收和利用,但在吸收速度和利用情况方面均有差异。硝酸盐的还原需要能量,在能量不足时,硝酸盐对藻细胞生长的效用低于铵盐[22]。但NH3-N浓度过高也会对藻细胞产生毒害作用,主要体现在破坏胞内pH值平衡,造成放氧复合体的损伤,以及打破了细胞内部的碳氮平衡等[23]。
微藻因其独特的组成及结构成为获得生物柴油和生物质油的优良原料来源。相比于其他动植物,利用藻类生产油脂生物燃料因具有增值迅速、含油量高以及占地面积小等优点而更具发展潜力。但如何降低微藻油脂燃料的生产成本仍然是国内外商业化开发面临的主要问题。培养基是藻类生活的直接介质,对藻类的生长、发育、繁殖和其他生命活动起到重要的作用。养猪沼液废水富含N、P等营养物质,在一定程度上或可替换传统的培养液。本研究证实,养猪沼液废水贴壁培养栅藻,藻细胞油脂含量、产率与正常BG11培养相当 (图 5),是栅藻贴壁培养较好的培养基替代介质。因此,利用栅藻贴壁培养处理养猪沼液废水并耦合油脂生产,可以降低培养成本,提高藻类生物燃料工业化生产的经济性。
Zhu等[24]通过微藻进行畜禽废水的处理研究,但其采用传统悬浮培养方式处理沼液废水,藻细胞生物产率低,而且处理后还需离心等高能耗方法收集,经济成本较高。在传统沼液废水处理过程中,厌氧发酵产沼气法可以处理废水中那些不易溶解的悬浮物和胶体等污染物,达到废水的初步净化效果。由于该技术不能进行废水的深度脱氮除磷,排放的沼液仍然危害环境。微藻贴壁培养不同于传统的悬浮培养,光几乎直接照到细胞表面而很少有光的衰减,藻类生物产率较高。更为重要的是,贴壁培养处理废水后藻细胞无需离心,只需简单刮取等方法即可收集,节省了能耗,提高了藻类生产效益,降低了废水处理成本[25]。
藻细胞在生长过程中可利用底物水平磷酸化、氧化磷酸化和光合磷酸化三种形式将废水中的有机氮、磷等物质转化成自身所需的高能有机化合物,进而有效地降低废水中有机物的含量[26]。本研究证实,通过贴壁培养栅藻处理沼液废水中NH3-N、TP及COD达到较好的效果,培养一个周期后各自浓度分别降到2.7、7.8、150.2 mg·L-1,达到现行国家环保对畜禽排放标准要求。将微藻应用于养猪沼液废水处理同时生产油脂生物燃料,不仅可以有效降低水体富营养化,而且具低成本、低能耗、低污染、高效率、高收益和高溶氧量等优势,为治理污水中N、P提供了广阔的应用前景,是一项非常有潜力的生态环保技术。本文以养殖废水为原料耦合栅藻贴壁培养的油脂生产,把微藻生产和废水处理相结合,可以创造额外经济效益和生态效益,为实现藻类生物燃料生产与废水处理系统从“处理工艺”向“生产工艺”的转化奠定基础。
4 结论(1) 相比于传统的悬浮培养,栅藻贴壁培养生物产率更高,且贴壁培养藻细胞对培养液中N的利用更具优势,利用藻类贴壁培养处理沼液废水是一种新的有潜力的处理技术。
(2) 利用栅藻贴壁培养处理沼液废水是可行的。培养后生物产率与正常BG11培养相当,栅藻贴壁培养处理沼液废水的同时还可以产生油脂,油脂含量和正常培养基相近,贴壁培养下栅藻对沼液中NH3-N、TP及COD去除效率较高,达到国家现行环保排放的要求。
| [1] | Cai T, Park S Y, Li Y B. Nutrient recovery from wastewater streams by microalgae:Status and prospects[J]. Renewable & Sustainable Energy Reviews, 2013, 19: 360–369. |
| [2] | Kumar M S, Miao Z H, Wyatt S K. Influence of nutrient loads, feeding frequency and inoculum source on growth of Chlorella vulgaris in digested piggery effluent culture medium[J]. Bioresource Technology, 2010, 101(15): 6012–6018. DOI:10.1016/j.biortech.2010.02.080 |
| [3] | 刘荣厚, 郝元元, 叶子良, 等. 沼气发酵工艺参数对沼气及沼液成分影响的实验研究[J]. 农业工程学报, 2006, 22(Suppl 1): 93–96. LIU Rong-hou, HAO Yuan-yuan, YE Zi-liang, et al. Experimental research on technical parameters of anaerobic fermentation for biogas production[J]. Transactions of the Chinese Society of Agricultural Engineering, 2006, 22(Suppl 1): 93–96. |
| [4] | 靳红梅, 常志州, 叶小梅, 等. 江苏省大型沼气工程沼液理化特性分析[J]. 农业工程学报, 2011, 27(1): 291–296. JIN Hong-mei, CHANG Zhi-zhou, YE Xiao-mei, et al. Physical and chemical characteristics of anaerobically digested slurry from large-scale biogas project in Jiangsu Province[J]. Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(1): 291–296. |
| [5] | 张国治, 吴少斌, 王焕玲, 等. 大中型沼气工程沼渣沼液利用意愿现状调研及问题分析[J]. 中国沼气, 2010, 28(1): 21–24. ZHANG Guo-zhi, WU Shao-bin, WANG Huan-ling, et al. Survey and analysis on state quo of public intention for utilizing digestate from large and medium size biogas plants[J]. China Biogas, 2010, 28(1): 21–24. |
| [6] | Zhu L D, Hiltunen E. Application of livestock waste compost to cultivate microalgae for bioproducts production:A feasible framework[J]. Renewable and Sustainable Energy Reviews, 2016, 54: 1285–1290. DOI:10.1016/j.rser.2015.10.093 |
| [7] | Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production:Perspectives and advances[J]. Plant Journal, 2008, 54(4): 621–639. DOI:10.1111/j.1365-313X.2008.03492.x |
| [8] | Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances, 2007, 25(3): 294–306. DOI:10.1016/j.biotechadv.2007.02.001 |
| [9] | Shi J, Podola B, Melkonian M. Removal of nitrogen and phosphorus from wastewater using microalgae immobilized on twin layers:An experimental study[J]. Journal of Applied Phycology, 2007, 19(5): 417–423. DOI:10.1007/s10811-006-9148-1 |
| [10] | Franchino M, Comino E, Bona F, et al. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate[J]. Chemosphere, 2013, 92(6): 738–744. DOI:10.1016/j.chemosphere.2013.04.023 |
| [11] | 阮榕生, 简恩光, 巫小丹, 等. 小球藻处理养猪业沼液研究[J]. 现代化工, 2013, 33(8): 62–64. RUAN Rong-sheng, JIAN En-guang, WU Xiao-dan, et al. Treatment of biogas slurry from pig industry by Chlorella vulgaris[J]. Modern Chemical Industry, 2013, 33(8): 62–64. |
| [12] | Ji M K, Kim H C, Abou-Shanab R A I, et al. Simultaneous nutrient removal and lipid production from pretreated piggery wastewater by Chlorella vulgaris YSW-04[J]. Applied Microbiology and Biotechnology, 2013, 97(6): 2701–2710. DOI:10.1007/s00253-012-4097-x |
| [13] | Liu T Z, Wang J F, Hu Q, et al. Attached cultivation technology of microalgae for efficient biomass feedstock production[J]. Bioresource Technology, 2013, 127: 216–222. DOI:10.1016/j.biortech.2012.09.100 |
| [14] | Mata T M, Martins A A, Caetano N S. Microalgae for biodiesel production and other applications:A review[J]. Renewable & Sustainable Energy Reviews, 2010, 14(1): 217–232. |
| [15] | Rippka R, Deruelles J, Waterbury J B, et al. Generic assignments, strain histories and properties of pure cultures of cyanobacteria[J]. Microbiology, 1979, 111(1): 1–61. DOI:10.1099/00221287-111-1-1 |
| [16] | Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry & Physiology, 1959, 37(8): 911–917. |
| [17] | Collos Y, Mornet F, Sciandra A, et al. An optical method for the rapid measurement of micromolar concentrations of nitrate in marine phytoplankton cultures[J]. Journal of Applied Phycology, 1999, 11(2): 179–184. DOI:10.1023/A:1008046023487 |
| [18] | Yoshimura T, Okada S, Honda M. Culture of the hydrocarbon producing microalga Botryococcus braunii strain Showa:Optimal CO2, salinity, temperature, and irradiance conditions[J]. Bioresource Technology, 2013, 133: 232–239. DOI:10.1016/j.biortech.2013.01.095 |
| [19] | Scott S A, Davey M P, Dennis J S, et al. Biodiesel from algae:Challenges and prospects[J]. Current Opinion in Biotechnology, 2010, 21(3): 277–286. DOI:10.1016/j.copbio.2010.03.005 |
| [20] | Hall D O, Fernandez F G A, Guerrero E C, et al. Outdoor helical tubular photobioreactors for microalgal production:Modeling of fluid-dynamics and mass transfer and assessment of biomass productivity[J]. Biotechnology and Bioengineering, 2003, 82(1): 62–73. DOI:10.1002/bit.v82:1 |
| [21] | Wang J F, Liu J L, Liu T Z. The difference in effective light penetration may explain the superiority in photosynthetic efficiency of attached cultivation over the conventional open pond for microalgae[J]. Biotechnology for Biofuels, 2015, 8(1): 1–17. DOI:10.1186/s13068-014-0179-6 |
| [22] | Bloom A J, Sukrapanna S S, Warner R L. Root respiration associated with ammonium and nitrate absorption and assimilation by barley[J]. Plant Physiology, 1992, 99(4): 1294–1301. DOI:10.1104/pp.99.4.1294 |
| [23] | Dai G Z, Shang J L, Qiu B S. Ammonia may play an important role in the succession of cyanobacterial blooms and the distribution of common algal species in shallow freshwater lakes[J]. Global Change Biology, 2012, 18(5): 1571–1581. DOI:10.1111/j.1365-2486.2012.02638.x |
| [24] | Zhu L, Li Z, Ketola T. Biomass accumulations and nutrient uptake of plants cultivated on artificial floating beds in China's rural area[J]. Ecological Engineering, 2011, 37(10): 1460–1466. DOI:10.1016/j.ecoleng.2011.03.010 |
| [25] | Cheng P F, Ji B, Gao L L, et al. The growth, lipid and hydrocarbon production of Botryococcus braunii with attached cultivation[J]. Bioresource Technology, 2013, 138: 95–100. DOI:10.1016/j.biortech.2013.03.150 |
| [26] | Christenson L, Sims R. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts[J]. Biotechnology Advances, 2011, 29(6): 686–702. DOI:10.1016/j.biotechadv.2011.05.015 |
 2017, Vol. 36
2017, Vol. 36