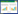文章信息
- 秦余丽, 江玲, 徐卫红, 李桃, 张春来, 李彦华, 王卫中, 迟荪琳, 陈序根, 陈永勤, 赵婉伊, 张进忠, 熊治廷
- QIN Yu-li, JIANG Ling, XU Wei-hong, LI Tao, ZHANG Chun-lai, LI Yan-hua, WANG Wei-zhong, CHI Sun-lin, CHEN Xu-gen, CHEN Yong-qin, ZHAO Wan-yi, ZHANG Jin-zhong, XIONG Zhi-ting
- 黑麦草与丛枝菌根对大田番茄抗性及Cd吸收的影响
- Effect of ryegrass and Arbuscular Mycorrhiza on tomato resistance and Cd absorption in the field
- 农业环境科学学报, 2017, 36(6): 1053-1061
- Journal of Agro-Environment Science, 2017, 36(6): 1053-1061
- http://dx.doi.org/10.11654/jaes.2016-1515
文章历史
- 收稿日期: 2016-11-28
2. 武汉大学资源与环境科学学院, 武汉 430079
2. School of Resources and Environmental Science, Wuhan University, Wuhan 430079, China
Cd(镉)是一种积累性的剧毒重金属元素,为植物生长和发育的非必需元素,具有高毒害性[1-2]。近年来,由于全球范围内化肥和农药的不合理施用、“三废”物质的随意排放以及使用含有重金属的污泥肥田,大面积的农田遭到了不同程度的Cd污染[3-6]。在污染土壤上,Cd通过食物链引起人体的急性或慢性中毒,如“骨痛病”等,镉米污染危害近年来也频频报道[2, 7]。目前土壤Cd污染及其治理和修复问题已受到国际上众多学者的广泛关注。
植物修复成本低,适宜大规模应用,具有良好的社会、生态综合效益,是修复重金属污染土壤的最佳选择。黑麦草(Lolium multiflorum L.)生长快,再生能力强,易种植且生物量大,对土壤重金属具有较强的抗性和富集作用[8]。丛枝菌根真菌(Arbuscular mycorrhiza,AM)接种到植物是生物界最为广泛的一种互惠共生途径,常作为土壤修复的强化措施[9]。有报道显示丛枝菌根能够有效改善宿主植物的生长状况,增强植物在逆境条件下抗(耐)性,降低植株地上部重金属浓度[10-11]。但其他报道指出,丛枝菌根能促进某些植物的根对Cu、Zn和Cd的吸收[2, 12]。
虽然Cd是植物非必需营养元素,但其具有较高的生物有效性,易在蔬菜中积累[13],且蔬菜吸收积累Cd的能力在种类和品种之间表现出显著性差异[1, 14-16]。当Cd积累浓度较高时蔬菜表现出毒害症状,在形态上主要表现为叶面卷曲枯黄、生长缓慢;生理上主要表现在体内酶活性受到影响、引起氧化应激反应和细胞膜损伤等一系列反应,以及导致抗氧化酶活性产生适应性变化。过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物歧化酶(POD)是植物体内最重要的抗氧化酶,这些酶活性的改变可作为机体受到氧化胁迫的指标。丙二醛(MDA)作为生物在逆境条件下膜脂过氧化的终产物,其含量可以指示植物体内脂类过氧化作用的程度,逆境胁迫下植物的抗性通常与其体内MDA含量呈负相关。番茄(Lycopersicon esculintum Mill.)果实营养丰富,具特殊风味,是人们喜食的蔬菜之一。有报道[16]指出,番茄果实中Cd含量因在中低Cd污染土壤上种植而超标,Cd通过食物链方式进入人体而危害人的健康。目前,微生物强化植物修复Cd污染土壤的报道较少,且研究结果不一致[10-12]。因此,本试验在江玲等[1]土培试验基础上,采用田间试验,探讨了在中低Cd污染的菜园土壤上,黑麦草和丛枝菌根真菌单一或联合处理对番茄产量、抗性、Cd浓度及积累量的影响,考察黑麦草能否修复土壤Cd污染以及减少番茄Cd吸收,同时明确丛枝菌根真菌对黑麦草修复Cd污染是否具有强化作用,以期为土壤镉污染修复利用及农产品安全生产提供一定的理论基础。
1 材料与方法 1.1 试验材料黑麦草品种为邦德;番茄品种为“洛贝琪”和“德福mm-8”,由重庆市农林科学院提供;丛枝菌根真菌分别为幼套球囊霉、根内球囊霉、摩西球囊霉,菌种由北京市农林科学院营养与资源研究所提供。土壤为酸性紫色土(酸性紫色湿润雏形土),理化性质如表 1所示。
大田试验在重庆市潼南县双坝村3组进行(2014-03-20至2014-07-15)。试验采用Cd污染浓度为5.943 mg·kg-1的大田土壤,共设置4个处理:“Cd”(对照)、“Cd+黑麦草”(在番茄幼苗移栽15 d后,于两株番茄之间播黑麦草种子,40粒·穴-1)、“Cd+丛枝菌根”(番茄植株根际接种供试的3种丛枝菌根真菌各1 g,共3 g)、“Cd+黑麦草+丛枝菌根”(在番茄幼苗移栽15 d后,于两株番茄之间播黑麦草种子,40粒·穴-1,并于黑麦草种子下面土壤接种供试的3种丛枝菌根真菌各1 g,共3 g)。每个处理设置3次重复,随机排列,小区面积为8 m2,每个小区种植番茄幼苗16株。番茄每666.7 m2基施60 kg复合肥(N:P2O5:K2O=17:17:17),提苗期追施10 kg复合肥,第一穗果膨大期追施20 kg复合肥,盛果期追施15 kg复合肥,施肥量均为当地常规用量。从第一次结果开始,每次采摘果实计入产量,2014年7日15日收获,测定试验小区番茄植株各部位生物量并与之前的产量相加,同时采收黑麦草。鲜样经酶活性分析后,剩余的番茄植株与黑麦草在105 ℃杀青15 min,60 ℃烘干至恒重,用于测定Cd含量。MDA含量和酶活性以鲜质量计,生物量和Cd浓度以干质量计。
1.3 分析方法 1.3.1 土壤基本理化性质土壤基本理化指标和土壤Cd浓度参考鲁如坤[17]的方法测定。采用土壤标准物质(GBW # 08303由国家标准与技术研究所提供)对土壤Cd浓度测定结果进行质量监控,Cd的检测限为0.005 mg·kg-1。所有土壤样品的Cd回收率均高于95%,相对标准偏差(RSD)的精度控制在10%以内。
1.3.2 植株Cd浓度测定番茄植株各部位Cd浓度采用体积比为4:1的HNO3-HClO4混合酸消煮,原子吸收分光光度计(Perkin Elmer SIMMA 6000,Norwalk,美国)测定[18]。用植株标准物质(GBW # 08513由国家标准与技术研究所提供)对测定结果进行质量监控,Cd的检测限为0.005 mg·kg-1。所有植物样品的Cd回收率均高于95%,相对标准偏差(RSD)的精度控制在10%以内。
1.3.3 叶和根抗氧化酶活性和MDA含量测定CAT活性采用高锰酸钾滴定法[19];MDA采用硫代巴比妥酸(TBA)比色法[20];SOD活性采用氮蓝四唑(NBT)还原法[20];POD活性采用愈创木酚法[20]。
1.3.4 根尖电镜将番茄根尖切成小块(1 mm×3 mm),置于2.5%戊二醛固定液中,抽真空使根尖下沉,并于4 ℃下过夜固定。采用超薄切片法获得70~90 nm的样品切片,经染色后在透射电镜(Hitachi-600,日本)下对根尖细胞超微结构进行观察和拍照[21]。
1.4 数据分析采用SPSS 21.0统计软件进行数据方差分析和多重比较。
2 结果与分析 2.1 黑麦草与丛枝菌根处理对番茄生物量的影响如表 2所示,2个番茄品种果实生物量和植株总生物量差异达到了显著水平,各处理间的差异也达到了显著水平。与对照相比,黑麦草和丛枝菌根单一或复合处理使2个品种番茄叶、茎、根、果实生物量和植株总生物量分别增加了2.7%~16.8%、3.0%~16.8%、8.4%~31.5%、4.2%~38.4%和4.5%~36.6%,其中番茄各部位生物量及植株总生物量均以“Cd+黑麦草+丛枝菌根”处理最高,果实生物量增幅最大。供试的2个番茄品种相比较,在对照处理下,果实生物量及植株总生物量均为“洛贝琪”高于“德福mm-8”,而在黑麦草和丛枝菌根复合处理下,果实生物量及植株总生物量为“洛贝琪”低于“德福mm-8”,可见黑麦草和丛枝菌根联合修复对缓解“德福mm-8”Cd胁迫效果更明显。
|
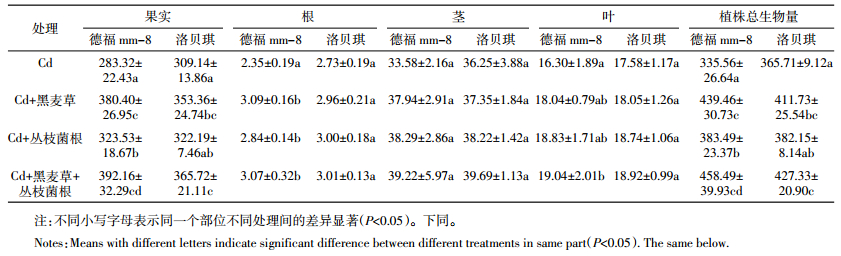
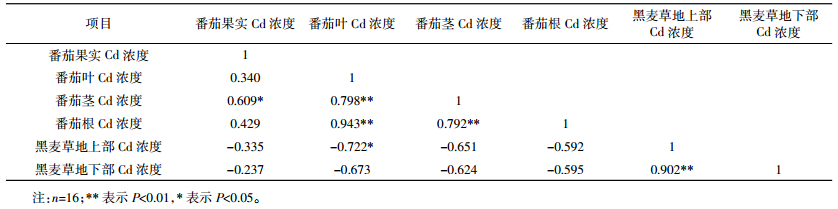
据表 3可知,与对照相比较,黑麦草和丛枝菌根单一或复合处理都不同程度使番茄根、茎、叶和果实中的Cd浓度降低,降幅分别为9.8%~42.4%和21.7%~41.4%(根)、5.6%~34.7%和4.6%~32.6%(茎)、5.7%~38.6%和12.2%~40.1%(叶)、6.9%~37.9%和11.8%~40.9%(果实)。番茄各部位Cd浓度均为“Cd+黑麦草+丛枝菌根”处理降幅最大。2个品种番茄各部位Cd浓度的大小顺序为叶>根>茎>果实,其中“洛贝琪”果实Cd浓度低于“德福mm-8”,“德福mm-8”根Cd浓度低于“洛贝琪”。相关性分析结果显示,番茄各部位Cd浓度相关系数在根与茎、根与叶、茎与叶、果实与茎之间分别为0.792、0.943、0.798、0.609,相关性达到极显著水平(表 5)。
|
|
|
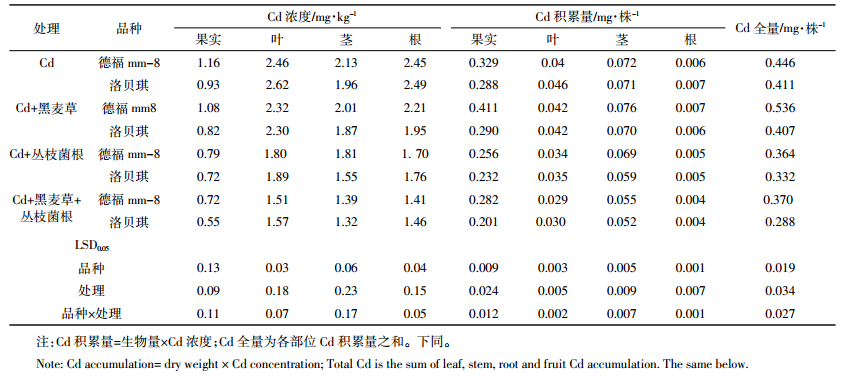
由表 4可知,接种丛枝菌根能促进黑麦草对Cd的吸收,其Cd浓度及Cd积累量均增加显著。黑麦草地上部和地下部Cd浓度增加幅度分别为18.01%和27.20%(与“德福mm-8”套作)、63.46%和33.32%(与“洛贝琪”套作);黑麦草地上部、地下部Cd积累量及全量分别增加26.09%、50.00%及36.59%(与“德福mm-8”套作)和87.50%、61.54%及75.86%(与“洛贝琪”套作)。黑麦草地下部Cd浓度较高,而Cd积累量则为地上部较高。相关性分析结果显示,黑麦草地上部与地下部Cd浓度相关系数为0.902,达到极显著水平;番茄各部位Cd浓度与黑麦草地上部、地下部Cd浓度呈负相关关系,仅番茄叶片Cd浓度及黑麦草地上部Cd含量达显著水平,相关系数为-0.722(表 5)。
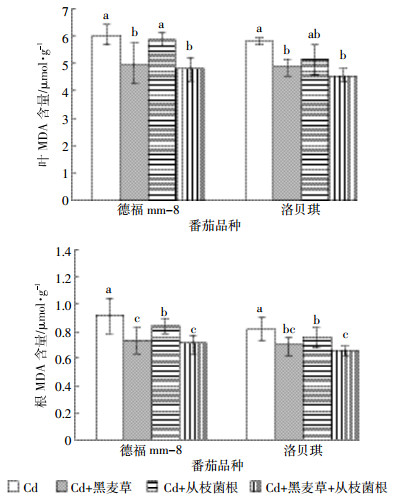
2.4 黑麦草与丛枝菌根处理对番茄叶和根MDA含量的影响MDA是植物在重金属等逆境环境中膜脂过氧化产物之一,MDA含量可作为植物体内脂类过氧化作用大小的指标。从图 1可以看出,与对照相比,黑麦草和丛枝菌根单一或复合处理使2个品种番茄叶片和根部的MDA含量下降了2.6%~22.0%、9.8%~24.4%,降幅最大的是“Cd+黑麦草+丛枝菌根”处理。但2个品种之间的叶MDA含量差异不显著,根MDA含量为“德福mm-8”略高于“洛贝琪”。
|
| 不同小写字母表示同一品种不同处理之间差异达显著水平(P < 0.05)。下同 Means with different letters indicate significant difference among different treatments in same variety at P < 0.05. The same below 图 1不同处理对番茄根和叶MDA含量的影响 Figure 1Influence of different treatments on contents of MDA in roots and leaf of tomato |
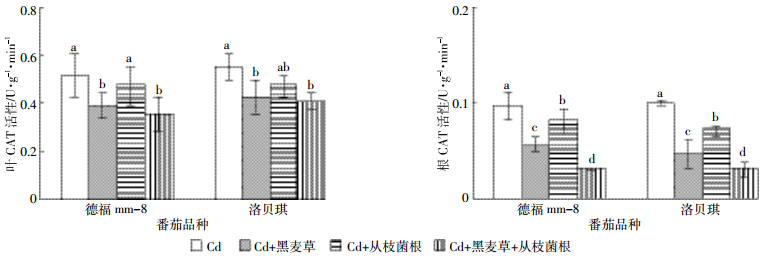
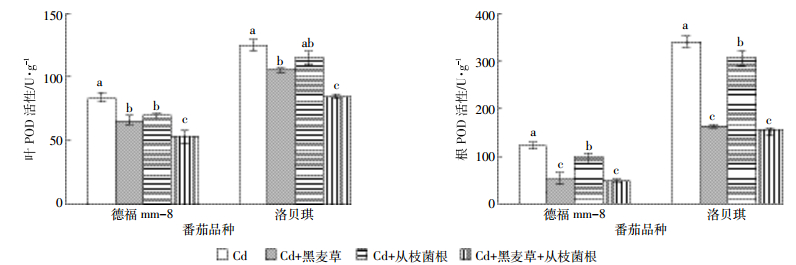
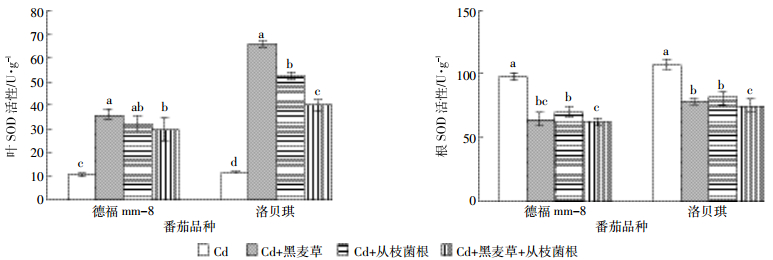
与对照相比较,黑麦草和丛枝菌根单一或复合处理使番茄叶和根CAT活性下降9.8%~31.7%、15.5%~69.0%(图 2),使番茄叶和根POD活性也下降了8.07%~37.4%、10.0%~60.5%(图 3),但SOD活性变化在根和叶表现不同,叶SOD活性升高,根SOD活性下降了25.0%~37.1%(图 4)。在各处理条件下抗氧化酶活性均降低(叶SOD活性除外),且降幅最大的是“Cd+黑麦草+丛枝菌根”处理,其次是“Cd+黑麦草”处理。番茄叶和根的POD、叶SOD活性在2个品种间达到显著性差异,番茄根SOD、叶和根CAT在2个品种之间差异不显著,各处理根和叶的SOD和POD活性均为“德福mm-8”明显低于“洛贝琪”。
|
| 图 2不同处理对番茄根和叶CAT活性的影响 Figure 2Influence of different treatments on activities of CAT in roots and leaf and of tomato |
|
| 图 3不同处理对番茄根和叶POD活性的影响 Figure 3Influence of different treatments on activities of POD in roots and leaf and of tomato |
|
| 图 4不同处理对番茄叶和根SOD活性的影响 Figure 4Influence of different treatments on activities of SOD in leaf and roots of tomato |
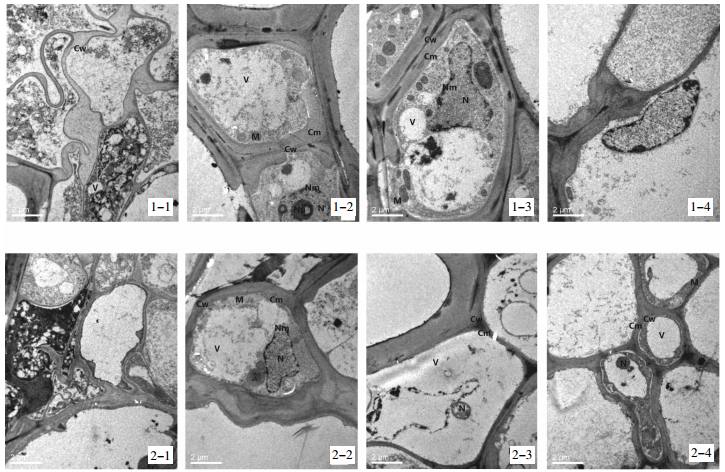
如图 5所示,对照处理2个品种番茄根尖细胞畸形,细胞结构出现异常现象,细胞壁变薄,质壁分离,细胞器匮乏,内含物较多,细胞处于溶解状态。黑麦草和丛枝菌根单一或联合处理不同程度减轻了Cd对番茄根尖细胞的损害。黑麦草处理的番茄根尖细胞,细胞壁较厚、细胞器丰富、细胞结构趋于完整;丛枝菌根处理的番茄根尖细胞也趋于完整,细胞壁也较厚,可见液泡、细胞核、核膜等细胞器。二者相比,在黑麦草和丛枝菌根联合修复下,番茄根尖细胞和液泡均较为完整,可见细胞核,且无任何杂质,但部分细胞质膜呈溶解状态。从超显微结构图可以看出,2个品种有细微区别,尤其在对照处理中,“德福mm-8”根尖细胞质壁分离、细胞器匮乏现象明显比“洛贝琪”更加严重,但二者基本趋势一致。
|
| 1-1、1-2、1-3、1-4分别为“Cd”(对照)、“Cd+黑麦草”、“Cd+丛枝菌根”、“ Cd+黑麦草+丛枝菌根”四个处理下番茄品种“德福mm-8”的根尖细胞超显微结构;2-1、2-2、2-3、2-4分别为四个处理下番茄品种“洛贝琪”的根尖细胞超显微结构。Cw,细胞壁;Cm,细胞膜;M,线粒体;N,细胞核;Nm,核膜;V,液泡 1-1, 1-2, 1-3, 1-4 are "Cd" (CK), "Cd + ryegrass", "Cd + Arbuscular mycorrhiza", "Cd + ryegrass + Arbuscular mycorrhiza" four processing ultrastructure of root tip cells of tomato varieties "Defu mm-8"; 2-1, 2-2, 2-3, 2-4 ultrastructure of root tip cells of tomato varieties "Luobeiqi". Cw, cell wall; Cm, cell membrane; M, mitochondria; N, nucleus; Nm, nuclear membrane; V, vacuole 图 5番茄根尖细胞超显微结构 Figure 5Ultrastructure of root tip cell of tomato |
在Cd污染(5.943 mg·kg-1)条件下,黑麦草和丛枝菌根单一或复合处理增加了2个品种番茄各部位的生物量及植株总生物量,其中黑麦草和丛枝菌根联合修复处理增幅最大,与江玲等[1]土培试验(模拟Cd污染为20 mg·kg-1)结果一致。可见无论在低Cd还是高Cd浓度下,黑麦草和丛枝菌根单一或复合处理均缓解了重金属Cd对番茄的胁迫,从而促进其生长。但是除了果实外,各部位生物量增幅并不显著,这与土培试验不太一致,可能是因为大田土壤Cd浓度相对较低,而对番茄的毒害亦较低。试验还发现,黑麦草和丛枝菌根联合修复效果在低Cd浓度下更好,这为中、轻度Cd污染土壤的修复和利用提供了一定的理论依据[2]。
2个品种番茄Cd积累部位主要为根、茎和叶,果实中含量较少。番茄各部位Cd浓度相关性达到极显著水平,说明番茄叶和茎中Cd主要来源于根中,果实中Cd主要来源于茎中。该结果与周坤[22]研究结果(番茄中的Cd主要积累在叶和茎)一致,但与朱芳等[16]的报道(Cd污染土壤上番茄果实是Cd主要积累部位)不同,原因有待进一步研究。比较2个品种番茄发现,“洛贝琪”果实、茎和总植株Cd浓度和积累量均低于“德福mm-8”。可见,2个品种番茄在Cd吸收富集和Cd耐性方面是存在基因型差异的[16]。
镉胁迫条件下,接种丛枝菌根能减轻Cd对黑麦草的毒害,促进黑麦草生长,黑麦草的地上部生物量和总生物量均显著增加。此外,接种丛枝菌根使黑麦草中Cd浓度及积累量显著增加,说明在低Cd浓度下接种丛枝菌根,可促进黑麦草对Cd的吸收和积累以及促进黑麦草生长。张晓松等[12]研究认为,丛枝菌根在一定程度上可缓解Cd污染对黑麦草株高、根长和生物量积累的抑制;田野等[23]报道接种丛枝菌根改善了黑麦草耐Cd的生长特性,而且增强了耐Cd的生理功能,降低了Cd对黑麦草的毒害。这些研究与本研究结果一致。黑麦草地下部Cd浓度较高,而Cd积累量则是地上部较高,可能是地上部生物量远大于地下部所致。大田试验中,番茄Cd浓度与黑麦草Cd浓度呈显著负相关性,可能与黑麦草根部与番茄根部竞争吸收运输重金属Cd,导致Cd离子在番茄体内的浓度降低[1-2]有关。相关研究结果表明,黑麦草与番茄间套作可以显著降低番茄对Cd的吸收,从而大幅提高番茄的食用安全性。这对在中低浓度Cd污染土壤上的番茄安全生产具有重要意义。
与对照比较,黑麦草和丛枝菌根单一或复合处理均降低了2个品种番茄根和叶的MDA含量以及CAT、SOD、POD活性。MDA是膜脂过氧化的重要产物,可通过与蛋白质、核酸、氨基酸等活性物质交联,形成不溶性的化合物(脂褐素)沉积,干扰细胞的正常活动。MDA含量降低说明黑麦草和丛枝菌根单一或联合修复增强了番茄抵御Cd胁迫的能力,减少了对细胞膜的伤害,增加了番茄产量,与肖家欣等[24]研究结果(在铜污染土壤上对白三叶接种丛枝菌根后显著降低地上部MDA含量)相似。活性氧自由基会导致核酸和蛋白质等生物活性物质膜脂过氧化、变性等,CAT、SOD、POD等组成的抗氧化系统能够清除由重金属污染导致的植物体内产生的大量活性氧自由基,CAT、SOD、POD活性下降,表明黑麦草和从枝菌根单一或复合处理降低了Cd对番茄的胁迫,导致植物体内活性氧自由基降低,从而引起清除自由基酶含量相应下降,而使番茄恢复了正常生理水平[1],同时CAT、SOD、POD活性下降也与番茄产量的变化相呼应。各处理均为“德福mm-8”根和叶的POD、SOD含量明显低于“洛贝琪”,2个品种番茄根和叶POD、叶SOD活性差异达到极显著水平。该结果与张薇等[25]研究的4个品种番茄幼苗生理活性存在差异的结果一致。
在Cd胁迫下,2个番茄品种根尖细胞中无细胞核、细胞质质膜内陷,细胞处于解体状态、线粒体基本消失、液泡膜均被损坏、细胞壁断裂;而在“Cd+黑麦草或丛枝菌根”处理下,2个品种番茄根尖细胞中均可见细胞核,细胞质均趋于正常水平,可见线粒体、液泡,且有少部分线粒体结构正常,细胞壁趋于正常,细胞膜清晰可见,细胞间隙变小。这与肖昕[26]、Cai等[27]和关伟等[28]研究的在Cd胁迫下小麦、水稻和桃树超微结构变化结果基本一致。本试验发现在Cd污染下,“德福mm-8”根尖细胞比“洛贝琪”更加敏感,受到的毒害更严重,原因可能是“洛贝琪”果实、茎和总植株Cd浓度和积累量均低于“德福mm-8”,即“德福mm-8”吸收了更多的Cd在其体内。这是因为2个品种番茄在Cd吸收富集和Cd耐性方面存在基因型差异[16],所以在土壤Cd污染较重的地区,可以通过栽培品种选择来有效降低番茄果实中Cd超标的风险。
4 结论(1)在Cd污染土壤中,番茄间作黑麦草、接种丛枝菌根真菌的单一或复合处理使2个品种番茄的叶、茎、根、果实生物量及植株总生物量增加,同时使2个品种番茄叶和根的MDA含量以及CAT、SOD、POD活性降低,增强了番茄抵御Cd胁迫的能力。
(2)黑麦草和丛枝菌根单一或复合处理降低了2个番茄品种各部位Cd浓度,其中“Cd+黑麦草+丛枝菌根”处理效果最佳。果实Cd浓度及Cd积累量均为“洛贝琪”低于“德福mm-8”。接种丛枝菌根对黑麦草Cd吸收积累有显著促进作用,且套种黑麦草能有效缓解Cd对番茄的毒害作用。
(3)黑麦草和丛枝菌根单一或复合处理减轻了Cd对番茄根尖细胞的毒害作用。
| [1] | 江玲, 杨芸, 徐卫红, 等. 黑麦草-丛枝菌根对不同番茄品种抗氧化酶活性、镉积累及化学形态的影响[J]. 环境科学, 2014, 35(6): 2349–2357. JIANG Ling, YANG Yun, XU Wei-hong, et al. Effects of ryegrass and Arbuscular mycorrhiza on activities of antioxidant enzymes, accumulation and chemical forms of cadmium in different varieties of tomato[J]. Environmental Science, 2014, 35(6): 2349–2357. |
| [2] | 陈永勤, 江玲, 徐卫红, 等. 黑麦草、丛枝菌根对番茄Cd吸收、土壤Cd形态及微生物数量的影响[J]. 环境科学, 2015, 36(12): 4642–4650. CHEN Yong-qin, JIANG Ling, XU Wei-hong, et al. Effect of ryegrass and Arbuscular mycorrhizal on cadmium absorption by varieties of tomatoes and cadmium forms in soil[J]. Environmental Science, 2015, 36(12): 4642–4650. |
| [3] | Huang Y Z, Hu Y. Combined toxicity of copper and cadimium to six rice genotypes(Oryza Sativa L.)[J]. Journal of Environmental Sciences, 2009, 21(5): 647–653. DOI:10.1016/S1001-0742(08)62320-7 |
| [4] | Barbara H N, Sławomir D, Małgorzata W. Selenium affects physiological parameters and phytochelatins accumulation in cucumber(Cucumis sativus L.) plants grown under cadmium exposure[J]. Scientia Horticulturae, 2014, 172(3): 10–18. |
| [5] | Reiser R, Simmler M, Portmann D, et al. Cadmium concentrations in New Zealand pastures:Relationships to soil and climate variables[J]. Journal of Environmental Quality, 2014, 43(3): 917–925. DOI:10.2134/jeq2013.09.0367 |
| [6] | Wong C W, John P B, Guohua C, et al. Kinetics and equilibrium studies for the removal of cadmium ions by ion exchange resin[J]. Journal of Environmental Chemical Engineering, 2014, 2(1): 698–707. DOI:10.1016/j.jece.2013.11.010 |
| [7] | 王守经, 胡鹏, 杜方岭. 我国城郊地区农用地重金属污染与农产品质量安全[J]. 中国食物与营养, 2010(7): 8–10. WANG Shou-jing, HU Peng, DU Fang-ling. Heavy metal pollution of farmland in suburbs in China and its quality security of agro-products[J]. Food & Nutrition in China, 2010(7): 8–10. |
| [8] | 徐卫红, 王宏信, 刘怀, 等. Zn、Cd单一及复合污染对黑麦草根分泌物及根际Zn、Cd形态的影响[J]. 环境科学, 2007, 28(9): 2089–2095. XU Wei-hong, WANG Hong-xin, LIU Huai, et al. Effects of individual and combined pollution of Cd and Zn on root exudates and rhizosphere Zn and Cd fractions in ryegrass(Loliurn perenne L.)[J]. Environmental Science, 2007, 28(9): 2089–2095. |
| [9] | 李晓林, 冯固. 丛枝菌根生态生理[M]. 北京: 华文出版社, 2001. LI Xiao-lin, FENG Gu. Ecological physiology of the mycorrhizal fungi[M]. Beijing: Sino-Culture Press, 2001. |
| [10] | 段建锋. 接种丛枝菌根真菌对小麦根内氮磷转运蛋白基因表达的影响[D]. 杨凌: 西北农林科技大学, 2016. DUAN Jian-feng. Effect of inoculating different Arbuscular mycorrhizal fungi on the expression of nitrogen and phosphate transporter genes in roots of wheat(Triticum aestivum L.)[D]. Yangling:Northwest A ans F University, 2016. |
| [11] | 罗鹏程, 李航, 王曙光. 湿生环境中丛枝菌根(AM)对香蒲耐Cd胁迫的影响[J]. 环境科学, 2016, 37(2): 750–755. LUO Peng-cheng, LI Hang, WANG Shu-guang. Effect of Arbuscular mycorrhiza(AM) on tolerance of cattail to Cd stress in aquatic environment[J]. Environmental Science, 2016, 37(2): 750–755. |
| [12] | 张晓松, 孟祥英, 王薇, 等. 丛枝菌根真菌对镉污染土壤中黑麦草幼苗生长的影响[J]. 中国土壤与肥料, 2015(6): 122–127. ZHANG Xiao-song, MENG Xiang-ying, WANG Wei, et al. Effects of Arbuscular mycorrhiza fungi on growth of ryegrass seedling in cadmium contaminated soils[J]. Soil and Fertilizer Sciences in China, 2015(6): 122–127. DOI:10.11838/sfsc.20150620 |
| [13] | 张金彪, 黄维南. 镉胁迫对草莓光合的影响[J]. 应用生态学报, 2007, 18(7): 1673–1676. ZHANG Jin-biao, HUANG Wei-nan. Effects of cadmium stress on photosynthetic functions of strawberry[J]. Chinese Journal of Applied Ecology, 2007, 18(7): 1673–1676. |
| [14] | Liu J G, Liang J S, Li K Q, et al. Correlations between cadmium and mineral nutrients in absorption and accumulation in various genotypes of rice under cadmium stress[J]. Chemosphere, 2003, 52(9): 1467–1473. DOI:10.1016/S0045-6535(03)00484-3 |
| [15] | 孙建云, 沈振国. 镉胁迫对不同甘蓝基因型光合特性和养分吸收的影响[J]. 应用生态学报, 2007, 18(11): 2605–2610. SUN Jian-yun, SHEN Zhen-guo. Effects of Cd stress on photosynthetic characteristics and nutrient uptake of cabbages with different Cd-tolerance[J]. Chinese Journal of Applied Ecology, 2007, 18(11): 2605–2610. |
| [16] | 朱芳, 方炜, 杨中艺. 番茄吸收和积累Cd能力的品种间差异[J]. 生态学报, 2006, 26(12): 4071–4081. ZHU Fang, FANG Wei, YANG Zhong-yi. Variations of Cd absorption and accumulation of 36 Lycopersicon esculentum cultivars[J]. Acta Ecologica Sinica, 2006, 26(12): 4071–4081. DOI:10.3321/j.issn:1000-0933.2006.12.021 |
| [17] | 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Ru-kun. Methods of soil agricultural chemistry analysis method[M]. Beijing: Chinese Agricultural Science and Technology Press, 2000. |
| [18] | Tessier A W, Campbell P G C, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7): 844–851. DOI:10.1021/ac50043a017 |
| [19] | 许光辉, 郑洪元. 土壤微生物分析方法手册[M]. 北京: 中国农业出版社, 1986. XU Guang-hui, ZHENG Hong-yuan. Handbook of analytical methods for soil microbiology[M]. Beijing: China Agriculture Press, 1986. |
| [20] | Grant C A, Clarke J M, Duguid S, et al. Selection and breeding of plant cultivars to minimize cadmium accumulation[J]. Science of the Total Environment, 2008, 390(2/3): 301–310. |
| [21] | 徐勤松, 施国新, 王学, 等. 铅(Pb)在凤眼莲(Eichhornia crassipes Solms)体细胞中分布的电镜观察[J]. 南京师大学报(自然科学版), 2006, 29(3): 81–85. XU Qin-song, SHI Guo-xin, WANG Xue, et al. Subcellular localization of Pb in cells of Eichhornia crassipes Solms by electron microscopy[J]. Journal of Nanjing Normal University(Natural Science Edition), 2006, 29(3): 81–85. |
| [22] | 周坤. 外源锌、铁对番茄镉积累的影响研究[D]. 重庆: 西南大学, 2014. ZHOU Kun. Study on effects of exogenous zinc and iron on cadmium accumulation in tomato[D]. Chongqing:Southwest University, 2014. |
| [23] | 田野, 张会慧, 孟祥英, 等. 镉(Cd)污染土壤接种丛枝菌根真菌(Glomus mosseae)对黑麦草生长和光合的影响[J]. 草地学报, 2013, 21(1): 135–141. TIAN Ye, ZHANG Hui-hui, Meng Xiang-ying, et al. Effects of Arbuscular mycorrhizal fungi(Glomus mosseae) on growth and photosynthesis characteristics of Lolium perenne L. under Cd contaminated soil[J]. Acta Agrestia Sinica, 2013, 21(1): 135–141. DOI:10.11733/j.issn.1007-0435.2013.01.020 |
| [24] | 肖家欣, 安静, 杨安娜, 等. 五种从枝菌根真菌对白三叶耐铜污染的影响[J]. 中国草地学报, 2011, 33(6): 57–63. XIAO Jia-xin, AN Jing, YANG An-na, et al. Effects of five Arbuscular mycorrhiza fungi on the tolerance of white clover(Trifolium repens) to copper contamination[J]. Chinese Journal of Grassland, 2011, 33(6): 57–63. |
| [25] | 张薇, 吕金印, 柳玲. 不同基因型番茄幼苗对镉胁迫的生理响应及镉吸收差异[J]. 农业环境科学学报, 2010, 29(6): 1065–1071. ZHANG Wei, LÜ Jin-yin, LIU Ling. Difference in cadmium absorption and physiological responses of different varieties of tomatoes to cadmium stress[J]. Journal of Agro-Environment Science, 2010, 29(6): 1065–1071. |
| [26] | 肖昕. 重金属复合污染对小麦的毒理效应及其微观机制[D]. 北京: 中国矿业大学, 2009. XIAO Xin. Toxicological effects and micromechanism of heavy metals pollution on wheat[D]. Beijing:China University of Mining and Technology, 2009. |
| [27] | Cai Y, Cao F B, Wei K, et al. Genotypic dependent effect of exogenous glutathione on Cd-induced changes in proteins, ultrastructure and antioxidant defense enzymes in rice seedlings[J]. Journal of Hazardous Materials, 2011, 192(3): 1056–1066. DOI:10.1016/j.jhazmat.2011.06.011 |
| [28] | 关伟, 张金珠, 王占全, 等. 镉胁迫对桃树根尖细胞超微结构的影响[J]. 北京农学院学报, 2010, 25(3): 18–20. GUAN Wei, ZHANG Jin-zhu, WANG Zhan-quan, et al. Effect of cadmium stress on the ultrastructure of cell in peach root apex[J]. Journal of Beijing University of Agriculture, 2010, 25(3): 18–20. |
 2017, Vol. 36
2017, Vol. 36