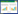文章信息
- 李志丰, 鲍恋君, 王珍, 张莹, 曾永平
- LI Zhi-feng, BAO Lian-jun, WANG Zhen, ZHANG Ying, ZENG Eddy Y.
- BDE-209在罗非鱼体内的代谢及其在烹饪过程中的变化
- Metabolism of decabromodiphenyl ether in tilapia and its fate during cooking processes
- 农业环境科学学报, 2017, 36(6): 1062-1069
- Journal of Agro-Environment Science, 2017, 36(6): 1062-1069
- http://dx.doi.org/10.11654/jaes.2017-0141
文章历史
- 收稿日期: 2017-02-08
多溴联苯醚(PBDEs)是溴代阻燃剂中非常重要的一类[1]。根据溴化程度的不同,工业上多溴联苯醚可以分为五溴联苯醚、八溴联苯醚和十溴联苯醚三类混合物[2],其中工业五溴联苯醚和八溴联苯醚混合物的主要组分四溴、五溴、六溴及七溴同系物已经被列入持久性有机污染物清单,十溴联苯醚混合物在欧盟、美国、加拿大已逐渐停止生产使用[3],然而目前国内尚未全面停止。由于PBDEs是添加型阻燃剂[4],较易从产品中释放出来,从而进入到环境各个介质[5]。
鱼肉是人体重要的动物蛋白来源,能为人类提供必需的营养物质、矿物质、维生素和ω-3脂肪酸[6]。鱼体可通过食物(饲料或浮游动植物)和鱼鳃摄入环境中的PBDEs[7-9]。经实验证明,食物摄入是PBDEs进入鱼体的主要途径。BDE-209是目前使用最广泛的工业品十溴联苯醚的主要组分,由于其分子量大,一度被认为不易被生物吸收富集[10],但近年来研究结果表明,BDE-209可被生物吸收,并且可以进一步降解为毒性更高的低溴代化合物[11]。例如,Feng等[12]将BDE-209直接注射到虹鳟鱼腹膜,发现其主要脱溴产物是BDE-47、-49、-99、-197、-207,主要甲氧基代谢产物包括MeO-BDE-47、MeO-BDE-68、MeO-BDE-100,羟基类代谢产物是OH-BDE-28和OH-BDE-42。
罗非鱼是世界上最受欢迎的养殖鱼种之一,具有生长快、食性广、易存活、环境适应能力强等特点。近年来罗非鱼产量增长迅速,可解决发展中国家蛋白短缺和发达国家日益增长的蛋白需求问题[13],因此关注BDE-209在罗非鱼体内的富集和代谢是十分有意义的。本研究通过给罗非鱼喂食含BDE-209的饲料,探究BDE-209在鱼体中的浓度与富集时间之间的关系,初步对BDE-209的代谢产物进行定性定量分析。此外,由于摄食是人体暴露PBDEs最主要的途径,目前大多数的研究都集中在食物原材料中PBDEs的种类和含量,然而食物一般要经过烹饪才能被人们食用,在烹饪过程中PBDEs可能挥发或降解,因此本文同时研究了罗非鱼体内PBDEs在不同的烹饪过程中的变化情况。
1 材料与方法 1.1 仪器与材料多溴联苯醚的混标物含BDE-28、-47、-66、-85、-99、-100、-153、-154、-183,单标BDE-209、回收率物质BDE-51、BDE-115、氟代BDE-208(F-BDE-208)及内标BDE-69均购自美国Accustandard公司。内标13C-BDE-139购自美国Cambridge Isotope Laboratories公司。恒温加热板,玻璃烧杯(50 mL),不锈钢烧杯(250 mL),电磁炉(美的C21-RT2125电磁炉)。
饲料加标依据世界经济合作与发展组织Test No.305推荐的溶剂加标方法与注意原则[14],将BDE-209溶解于二氯甲烷,在棕色瓶中与颗粒大小一致的罗非鱼饲料混合均匀,待溶剂完全挥发后,避光保存[15]。加标饲料中BDE-209浓度为(152±11)μg·g-1。
1.2 罗非鱼的加标饲养罗非鱼湿重(448±99)g,体长(30.9±2.2)cm。饲养用鱼缸尺寸为50 cm×50 cm×40 cm。罗非鱼的饲养参照OECD(世界经济合作与发展组织)推荐的方法[14]。由于成年罗非鱼好斗,每个鱼缸里只饲养一条罗非鱼。饲养时,罗非鱼经消毒后放入鱼缸(水深约35 cm),每天测定记录气温、空气湿度、水温、水体pH值以及电导率,实行人工驯化饲养1个月后对罗非鱼喂食加标饲料。在实验初期设计每组3条罗非鱼(共15条),实验过程中出现因病死亡现象,仅剩10条,分别标记为1~10号鱼,并分成5组(每组2条)。前4组(1~8号鱼)是实验组,对罗非鱼喂食加标BDE-209饲料,每天投入约2 g饲料,20 min后用纱网及时打捞吃剩的饲料,晾干至恒重,计算并记录每条鱼摄食饲料的量。根据加标饲料里BDE-209的浓度及每天每条鱼摄食饲料的量,计算每条鱼每天摄入BDE-209的量。每隔10 d取一组。第5组为对照组,喂食普通饲料,并与实验组第4组同时(40 d)取样。鱼体经解剖,取鱼体背部的肌肉为样品。饲养过程中,水温为(29.1±1.4)℃,水体pH值为7.1±0.2。
1.3 烹饪本研究选取水煮、蒸、油炸三种最为常见的烹饪方式。为了更好地探究PBDEs在烹饪过程中的降解变化规律,避免在烹饪过程中BDE-209代谢产物对BDE其他同系物的变化造成干扰,本研究对鱼肉进行分别加标BDE-209和BDE同系物混合物(BDE-28、-47、-66、-85、-99、-100、-153、-154、-183)。取大约6.5 g绞碎鱼肉置于烧杯或不锈钢杯中,加入含目标物的丙酮溶液,混合均匀后置于通风橱内静置48 h直至丙酮完全挥发。为避免光解,在加标的过程中,将玻璃烧杯壁用铝箔纸遮盖,不锈钢杯只用铝箔纸遮盖杯口。鱼肉中BDE-209的加标浓度为12 ng·g-1湿重,单个BDEs同系物的加标浓度均为1.2 ng·g-1湿重。
在烹饪加热时,水煮与油炸过程均采用加热板,而蒸的过程则采用电磁炉。将加标鱼肉样品进行烹饪的具体方式为:
(1)蒸:铁锅(锅底直径14.0 cm,锅口直径31.5 cm,锅深7.9 cm)中加1300 mL超纯水(饮用水经过Milli-Q®超纯净化水系统净化)。铁锅中设不锈钢架,并使不锈钢架顶面不与铁锅中水面接触。将锅置于电磁炉上,电磁炉功率设置为1600 W。加热锅中的水直至水沸腾,然后将玻璃烧杯转移至不锈钢架上,盖上锅盖,防止蒸汽冒出。
(2)水煮:取超纯水(饮用水经过Milli-Q®超纯净化水系统净化)60 mL加到不锈钢烧杯(250 mL)中,提前预热恒温加热板(ANSAI® 946C)直至温度升至并保持在200 ℃。不锈钢烧杯放置在恒温加热板最中间,加热水煮过程中不锈钢烧杯敞口。
(3)油炸:将1.0 g花生油添加至已加标鱼肉中,将恒温加热板(ANSAI 946C)预热到250 ℃,将玻璃烧杯放置在恒温加热板的正中央,在油炸过程中,玻璃杯敞口。
每个烹饪条件均进行3个平行样测试,同时选择不同的烹饪时间,如10、20、30、35 min。在烹饪过程中,每隔3 min记录下鱼肉温度,烹饪结束后直至鱼肉温度降到环境温度(图 1)。在烹饪过程中,由于水分蒸发等原因,鱼肉的实际温度远低于预设值。
|
| 图 1烹饪过程鱼肉温度变化(烹饪时间:35 min) Figure 1Temperature in fish during the culinary process |
鱼体肌肉经过冷冻干燥,用研钵研磨碎。取1 g左右(干重)的鱼肉置于聚四氟乙烯管中,加入混合比例溶剂(正己烷:二氯甲烷:丙酮=2:2:1,体积比)约40 mL,再加入回收率指示物(BDE-51、13C-BDE-139与F-BDE-208),在超声仪中超声萃取30 min,放置过夜并离心,将上清液转移至浓缩管中。然后加入40 mL相同混合比例溶剂至聚四氟乙烯管中,重复上述步骤。合并3次萃取液后,在柔和的氮气下将其浓缩至3 mL,加入15 mL正己烷进行溶剂置换,浓缩至2 mL,并转移至聚四氟乙烯管中进行酸烧,每次加浓硫酸3~4 mL,10 000 r·min-1下离心1 min,用滴管移除下部烧黑的油脂,重复上述操作4次,直至浓硫酸不变色,即酸烧完成。在聚四氟乙烯管中加入少量的无水Na2SO4(0.1 g),以去除残留的浓硫酸。取上层清液转移至浓缩管,经浓缩后将其溶剂置换成正己烷,并再次将其浓缩至1 mL。最后,将浓缩液转移至细胞瓶中进行氮吹至500 μL,加入内标BDE-69和13C-BDE-139后进行测样。将同一鱼体解剖得到的肌肉混合,取3个鱼肉样品确定鱼体中目标物的浓度。烹饪部分鱼肉则未经冷冻干燥,其他前处理步骤和检测方法与上述的相同。
1.5 仪器分析使用安捷伦公司7890A-5975C气相色谱-质谱联用仪分析样品,离子源为负化学电离源(NCI源)。采用DB-5HT毛细管色谱柱(15 m×0.25 mm×0.25 μm,Agilent J & W)分离目标化合物,柱温箱的起始温度为155 ℃(保留2 min),以60 ℃·min-1的速率升温至270 ℃并保留2 min,以50 ℃·min-1升温至320 ℃保留4.5 min。以超纯氦气作为载气,其流速为1 mL·min-1,离子源与四极杆的温度分别为200、150 ℃。全扫描和选择性离子扫描同时进行,全扫描m/z范围75~490,用以定性和发现新的化合物;选择性离子扫描模式则对目标化合物进行定量。目标化合物分成两组,第一组包括BDE-28、-47、-66、-85、-99、-100、-153、-154、-183,选择的离子为79、81、160.8;第二组是BDE-209,选择的离子为79、81、486.4。
1.6 质量保证与质量控制(QA/QC)实验过程中2个溶剂空白和1个基质加标,与样品平行做分析。溶剂空白没有检测到目标化合物,基质加标样品中目标物的回收率范围为93%~119%,亦说明酸烧过程对目标物没有影响。样品中BDE-51、BDE-115、F-BDE-208的回收率(平均值±标准偏差)分别为(110±12)%、(120±12)%、(117±12)%。样品中目标物的浓度未经过回收率校正。每检测10个样品,分析1个标准样品,保证仪器的响应偏差在±20%之内和BDE-209的降解率在10%以内才可继续测样分析。
2 结果与分析 2.1 BDE-209的总摄入量与其在鱼肉中的浓度变化在加标饲养期间(10~40 d),由于BDE-209具有一定的毒性,同时实验环境对鱼的生长也造成了一定压力,致使鱼的体重几乎没有变化。故BDE-209的浓度在罗非鱼体内富集时没有经生长而稀释。
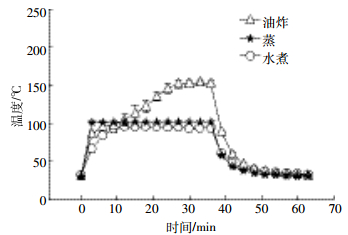
不同时刻取出的1~8号鱼肌肉中BDE-209浓度分别是(1.8±1.4)和(2.6±1.4)ng·g-1(饲养10 d)、(7.2±0.7)和(10±1.4)ng·g-1(饲养20 d)、(9.6±0.6)和(7.6±1.9)ng·g-1(饲养30 d)、(16±1.7)和(16±3.6)ng·g-1(饲养40 d)湿重,如图 2所示。对照组(第5组)与加标前的罗非鱼中PBDEs均低于检测限。由图 2可知,随着富集时间的延长,BDE-209在鱼体肌肉中的累积浓度也升高。通过对比同一组相同富集时间鱼肌肉中BDE-209浓度时发现,不同个体罗非鱼对BDE-209的生物可利用率略有差异。
|
| 图 2鱼体BDE-209的总摄入量与其在肌肉中浓度 Figure 2Total dietary intake amounts and concentration of BDE-209 in tilapia muscle |
前期研究证明BDE-209在鱼体内可进行生物代谢[16-18]。为确认其在罗非鱼体内的代谢情况,本研究选择BDE-209含量最高的8号鱼体样品进行色谱分析。如图 3的质谱图显示,经与现有标准品对比,确认峰1、2、3、4、9是BDE-209、-206、-207、-208及BDE-154。另外,在高温进样过程中,BDE-209可代谢为BDE-206、-207、-208。为排除仪器内降解,本研究将鱼样品中BDE-206、-207、-208和BDE-209峰面积比值与其在相同浓度的BDE-209基质加标样品的值相比较,发现其在8号鱼样中比值远高于基质加标样。再者,我们亦未在加标饲料中检测到BDE-206、-207、-208。故可以确认BDE-206、-207、-208为BDE-209在鱼体中脱溴降解产物。此外,根据文献报道的PBDEs在DB-5HT柱子上出峰顺序[19],可以推知BDE-209的代谢产物还包括八溴联苯醚(峰5)、七溴联苯醚(峰6与峰7)和六溴联苯醚(峰8与峰10)。

|
| 图 38号鱼体样品中BDE-209及其代谢产物的色谱图 Figure 3Gas chromatograms of the 8th fish sample showing the peaks of BDE-209 and its major metabolites |
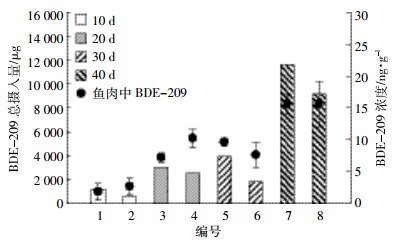
蒸和水煮过程使鱼肉中BDE-209的量虽略有减少,但并无显著性差异(图 4)。在油炸过程中,当烹饪时间为10、20、30、35 min时,鱼肉中BDE-209的量分别降低了6%、36%、70%及77%,其中在油炸35 min内,BDE-209的浓度从(11.4±0.4)ng·g-1显著降低至(2.6±1.0)ng·g-1。该结果说明BDE-209随着油炸时间的延长,降解量增加。同时,在样品色谱图上观测到其他化合物的峰,由于用于加标的鱼肉和花生油中均没有检测到其他BDE同系物,且加标的化合物仅有BDE-209,可以推测其他这些化合物极有可能为BDE-209在高温油炸过程中的降解产物。经鉴定,BDE-209在油炸过程的脱溴产物为BDE-153、-183、-196、-197、-203、-206、-207、-208,但其他BDE-209的降解产物由于未有标准品,还有待进一步验证(图 5)。
|
| 图 4不同烹饪方式下鱼肉BDE-209烹饪前后浓度(烹饪时间:35 min) Figure 4Concentrations of BDE-209 in fish before and after the different cooking processes (cooking time: 35 min) |

|
| 1: BDE-69(IS), 2: BDE-51(SS), 3: BDE-115(SS), 4: 13C-BDE-139(IS), 5: F-BDE-208(SS), 6: BDE-209, 7: BDE-153, 8: BDE-183, 9: BDE-197, 10: BDE-203, 11: BDE-196, 12: BDE-208, 13: BDE-207, 14: BDE-206 图 5油炸烹饪过程中BDE-209及其降解产物的色谱图(烹饪时间:35 min) Figure 5Gas chromatograms of fish samples before and after the frying process showing the peaks of BDE-209 and its major metabolites (cooking time: 35 min) |
在4个不同烹饪时间内(10、20、30、35 min),鱼肉中低溴代BDEs同系物(BDE-28、-47、-66、-85、-99、-100、-153、-154、-183)的浓度在蒸、煮及油炸前后没有显著性差异(P>0.05,配对t检验),其中,在烹饪时间为35 min鱼肉中低溴代BDEs同系物经烹饪过程导致的浓度变化列于图 6。此外,在水煮、蒸和油炸过程鱼肉样品的谱图中并未发现除加标BDE外其他同系物的色谱峰。该结果说明在这三种烹饪过程中,加标BDE同系物无明显的化学变化。

|
| 图 66不同烹饪方式下BDEs同系物烹饪前后浓度(烹饪时间:35 min) Figure 6Concentrations of individual BDE congeners in fish undergoing different cooking processes (cooking time: 35 min) |
关于BDE-209在鱼体内的代谢已有一些研究[16-18]。结合本研究结果可以看出,不同种类的鱼对BDE-209的降解能力不一样,降解的产物也有差异[20]。在罗非鱼肌肉中BDE-209相对于其代谢产物的含量低,表明BDE-209在罗非鱼体内被大量地转化为低溴化合物。对本研究中BDE-209代谢物的小峰进一步定性,发现有代谢产物5-HO-BDE-47,它的毒性比母体大[21-22],其他小峰有待进一步定性。Wan等[16]在鲟鱼微粒体加入BDE-209的试管模拟实验中,发现其脱溴产物有BDE-204、-202、-201、-154、-188、-184、-183、-197、-126。Stapleton等[17]给鲤鱼喂食加标BDE-209的研究表明,BDE-209亦在鲤鱼中发生生物降解,主要的降解产物有7个,其中两个主要产物是BDE-155和BDE-154,其他代谢产物是六溴联苯醚、七溴联苯醚和八溴联苯醚。这一结果与本研究罗非鱼体内的代谢产物类似,但也略有差异。此外,低溴代BDE同系物的毒性较BDE-209高[23-24],环境中的BDE-209经鱼生物转化成溴代同系物后,将会对环境或人体造成更高的毒性。低溴代BDE同系物迁移性更强,BDE-209在鱼体内的脱溴反应将对其在环境中的归宿产生影响[25]。
另外,假定BDE-209的主要代谢产物峰5、6、7、8、10与BDE-154在相同浓度下的仪器响应相同,定量代谢产物峰5、6、7、8、10的总浓度,再将其结合BDE-206、-207、-208的浓度值,可得到1~8号鱼鱼肉中BDE-209的代谢产物总浓度分别为(99±11)、(62±13)、(214±17)、(403±88)、(336±64)、(183±1.6)、(523±15)、(409±20)ng·g-1湿重。总的来说,代谢产物在罗非鱼肌肉中目标物总浓度占(97±0.8)%(图 7),表明BDE-209在罗非鱼体内被大量地转化为低溴化合物。
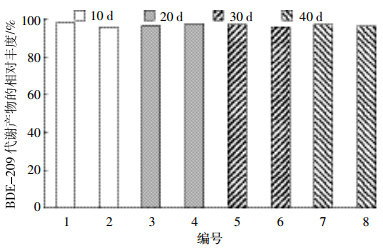
|
| 图 7代谢产物占罗非鱼肌肉中PBDEs的量 Figure 7Relative abundance of metabolites of BDE-209 in tilapia |
样品1~8号鱼体肌肉中BDE-209及其脱溴代谢产物的总浓度(湿重)分别是101、64、221、413、345、191、538、425 ng·g-1;每条鱼的湿重分别是560、290、442、294、459、423、485、551 g;每条鱼摄食BDE-209的量分别为1181、597、3030、2568、3929、1821、11 634、9164 μg。依据Stapleton等[17]提出BDE-209在生物体内可利用率计算方法,即BDE-209及其代谢产物在生物体内与摄入量的比值,可得BDE-209在罗非鱼体内经肌肉归一化的生物可利用率为(3.7±0.9)%(图 8)。这一结果略高于其在鲤鱼(0.44%)与虹鳟鱼(0.02%~0.13%)中的值[17, 26]。前期研究中鲤鱼与虹鳟鱼的体长分别是10、14 cm,属于成长期;本研究中罗非鱼长大约为30 cm,属于成熟期。理论上,同一类型的鱼在成长期对于污染物的吸收能力较成熟期的大[27]。这一现象表明,罗非鱼体较鲤鱼与虹鳟鱼对BDE-209的吸收能力强。假设亦只考虑BDE-209在鱼体的量,BDE-209在罗非鱼的生物平均可利用率为0.14%,也高于虹鳟鱼(约0.005%)[26]。
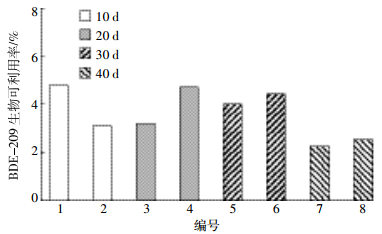
|
| 图 8罗非鱼体内BDE-209的生物可利用率 Figure 8Bioavailability of BDE-209 in tilapia |
在水煮和蒸的烹饪过程中,10种目标PBDEs同系物的组成保持不变,其鱼肉含量在烹饪前后无显著性差异(P>0.05,配对t检验)。这一结果说明水煮和蒸的烹饪方式对PBDEs的摄食暴露风险的影响不显著,由于水煮和蒸过程中,鱼肉的温度约为100 ℃,均低于目标物的沸点浓度(370~425 ℃)[28]。另外,在油炸烹饪前后,BDE-28、-47、-66、-85、-99、-100、-153、-154、-183在鱼肉中含量无显著性差异(P>0.05,配对t检验),然而BDE-209的含量却在油炸35 min后减少了77%,同时生成了低溴代同系物,包括BDE-153、-183、-197、-203、-196、-208、-207、-206。虽然在油炸过程中鱼肉的温度记录大约是150 ℃,远低于BDE-209沸点浓度(>425 ℃),但极可能由于受热不均一导致部分温度高,从而导致BDE-209的脱溴反应。由于脱溴化合物的毒性比BDE-209高,高温油炸烹饪过程会增加摄食暴露风险。
另外,在烹饪过程含抗氧化性的调料可以减少对象污染物的生成,例如:在烤制牛肉饼的过程中,加入含洋葱、大蒜、柠檬汁的卤汁可以分别减少31.2%、28.6%和14.6%的杂环胺生成量[29]。然而,在烹饪过程中加入的调味品却可促进有害化合物的生成。如当烹饪时加入三氯蔗糖,可以生成多氯萘[30]。类似,烹饪时加入含有氯的有机调味剂时,在高温下可生成二噁英和多氯代二苯并呋喃[31]。上述结果表明,基于食材中有机污染物浓度评估人体摄食暴露风险的结果[32-34]存在较大的不确定性。因此,人体膳食暴露风险评估需考虑烹饪过程中目标污染物的变化。此外,为达到健康摄食,综合文献调研与本研究的结果建议采取如下措施:在烹饪前对食材进行预处理,例如通过对蔬菜与水果进行清洗或削皮可以减少农药残留[35-37];在食品烹饪过程中采取防护措施,前期研究结果显示用铝箔纸和香蕉树叶包裹肉,可以显著降低在木炭烤肉过程中PAHs的量[38];采用蒸、水煮等温和的食物烹饪方式。
4 结论(1)BDE-209在罗非鱼体内的代谢产物有BDE-208、-207、-206、-154及六溴、七溴与八溴联苯醚。大约97%的BDE-209在罗非鱼体内被转化为低溴化合物。同时,BDE-209在罗非鱼体内的生物可利用性较低。
(2)水煮和蒸的烹饪方式对罗非鱼体内PBDEs的摄食暴露风险的影响不显著,但高温油炸烹饪过程会增加BDE-209的摄食暴露风险。
(3)有机污染物的人体膳食暴露风险评估需考虑其在烹饪过程中的变化。
| [1] | Birnbaum L S, Staskal D F. Brominated flame retardants:Cause for concern?[J]. Environmental Health Perspectives, 2003, 112(1): 9–17. DOI:10.1289/ehp.6559 |
| [2] | La Guardia M J, Hale R C, Harvey E. Detailed polybrominated diphenyl ether(PBDE) congener composition of the widely used penta-, octa-, and deca-PBDE technical flame-retardant mixtures[J]. Environmental Science and Technology, 2006, 40(20): 6247–6254. DOI:10.1021/es060630m |
| [3] | Birnbaum L S, Bergman A. Brominated and chlorinated flame retardants:The San Antonio statement[J]. Environmental Health Perspectives, 2010, 118(12): A514–A515. DOI:10.1289/ehp.1003088 |
| [4] | Alaee M, Arias P, Sjodin A, et al. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release[J]. Environment International, 2003, 29(6): 683–689. DOI:10.1016/S0160-4120(03)00121-1 |
| [5] | de Wit C A. An overview of brominated flame retardants in the environment[J]. Chemosphere, 2002, 46(5): 583–624. DOI:10.1016/S0045-6535(01)00225-9 |
| [6] | Ross P S, Couillard C M, Ikonomou M G, et al. Large and growing environmental reservoirs of Deca-BDE present an emerging health risk for fish and marine mammals[J]. Marine Pollution Bulletin, 2009, 58(1): 7–10. DOI:10.1016/j.marpolbul.2008.09.002 |
| [7] | Schecter A, Papke O, Tung K C, et al. Polybrominated diphenyl ethers contamination of united states food[J]. Environmental Science and Technology, 2004, 38(20): 5306–5311. DOI:10.1021/es0490830 |
| [8] | Domingo J L. Polybrominated diphenyl ethers in food and human dietary exposure:A review of the recent scientific literature[J]. Food and Chemical Toxicology, 2012, 50(2): 238–249. DOI:10.1016/j.fct.2011.11.004 |
| [9] | Ni K, Lu Y, Wang T, et al. A review of human exposure to polybrominated diphenyl ethers(PBDEs) in China[J]. International Journal of Hygiene and Environmental Health, 2013, 216(6): 607–623. DOI:10.1016/j.ijheh.2013.02.002 |
| [10] | Costa L G, Giordano G. Is decabromodiphenyl ether(BDE-209) a developmental neurotoxicant?[J]. Neuro Toxicology, 2011, 32(1): 9–24. |
| [11] | Chen Q, Yu L, Yang L, et al. Bioconcentration and metabolism of decabromodiphenyl ether(BDE-209) result in thyroid endocrine disruption in zebra fish larvae[J]. Aquatic Toxicology, 2012, 110/111: 141–148. DOI:10.1016/j.aquatox.2012.01.008 |
| [12] | Feng C, Xu Y, Zha J, et al. Metabolic pathways of decabromodiphenyl ether(BDE209) in rainbow trout(Oncorhynchus mykiss) via intraperitoneal injection[J]. Environmental Toxicology and Pharmacology, 2015, 39(2): 536–544. DOI:10.1016/j.etap.2015.01.006 |
| [13] | Josupeit H. World market of tilapia[EB/OL].[2017-1-20]. http://www.infopesca.org/sites/default/files/complemento/proyectos/194/World%20Market%20of%20Tilapia2.pdf. |
| [14] | Organization for Economic Co-operation and Development. OECD Test No. 305OECD guidelines for testing of chemicals 'Bioaccumulation in fish:Aqueous and dietary exposure'[S]. Paris:OECD, 2012. |
| [15] | Soderstrom G, Sellstrom U, de Wit C A, et al. Photolytic debromination of decabromodiphenyl ether(BDE 209)[J]. Environmental Science and Technology, 2004, 38(1): 127–132. DOI:10.1021/es034682c |
| [16] | Wan Y, Zhang K, Dong Z M, et al. Distribution is a major factor affecting bioaccumulation of decabrominated diphenyl ether:Chinese sturgeon(Acipenser sinensis) as an example[J]. Environmental Science and Technology, 2013, 47(5): 2279–2286. DOI:10.1021/es304926r |
| [17] | Stapleton H M, Alaee M, Letcher R J, et al. Debromination of the flame retardant decabromodiphenyl ether by juvenile carp(Cyprinus carpio) following dietary exposure[J]. Environmental Science and Technology, 2004, 38(1): 112–119. DOI:10.1021/es034746j |
| [18] | Vigano L, Roscioli C, Guzzella L. Decabromodiphenyl ether(BDE-209) enters the food web of the River Po and is metabolically debrominated in resident cyprinid fishes[J]. Science of the Total Environment, 2011, 409(23): 4966–4972. DOI:10.1016/j.scitotenv.2011.07.062 |
| [19] | Korytar P, Covaci A, de Boer J, et al. Retention-time database of 126 polybrominated diphenyl ether congeners and two Bromkal technical mixtures on seven capillary gas chromatographic columns[J]. Journal of Chromatography A, 2005, 1065(2): 239–249. DOI:10.1016/j.chroma.2004.12.059 |
| [20] | Stapleton H M, Brazil B, Holbrook R D, et al. In vivo and in vitro debromination of decabromodiphenyl ether(BDE-209) by juvenile rainbow trout and common carp[J]. Environmental Science and Technology, 2006, 40(15): 4653–4658. DOI:10.1021/es060573x |
| [21] | Zheng X, Zhu Y, Liu C, et al. Accumulation and biotransformation of BDE-47 by zebrafish larvae and teratogenicity and expression of genes along the hypothalamus-pituitary-thyroid axis[J]. Environmental Science and Technology, 2012, 46(23): 12943–12951. DOI:10.1021/es303289n |
| [22] | Van Boxtel A L, Kamstra J H, Cenijn P H, et al. Microarray analysis reveals a mechanism of phenolic polybrominated diphenylether toxicity in zebra fish[J]. Environmental Science and Technology, 2008, 42(5): 1773–1779. DOI:10.1021/es0720863 |
| [23] | Meerts I A, Letcher R J, Hoving S, et al. In vitro estrogenicity of polybrominated diphenyl ethers, hydroxylated PBDEs, and Polybrominated Bisphenol A compounds[J]. Environmental Health Perspectives, 2001, 109(4): 399–407. DOI:10.1289/ehp.01109399 |
| [24] | Darnerud P O, Eriksen G S, Johannesson T, et al. Polybrominated diphenyl ethers:Occurrence, dietary exposure, and toxicology[J]. Environmental Health Perspectives, 2001, 109(Suppl): 49–68. |
| [25] | Tittlemier S A, Halldorson T, Stern G A, et al. Vapor pressures, aqueous solubilities, and Henry's Law Constants of some brominated brominated flame retardants[J]. Environmental Toxicology and Chemistry, 2002, 21(9): 1804–1810. DOI:10.1002/etc.v21:9 |
| [26] | Kierkegaard A, Balk L, Tjarnlund U, et al. Dietary uptake and biological effects of decabromodiphenyl ether in rainbow trout(Oncorhynchus mykiss)[J]. Environmental Science and Technology, 1999, 33(10): 1612–1617. DOI:10.1021/es9807082 |
| [27] | Hendriks A J, Van der Linde A, Cornelissen G, et al. The power of size:1. Rate constants and equilibrium ratios for accumulation of organic substances related to octanol-water partition ratio and species weight[J]. Environmental Toxicology and Chemistry, 2001, 20(7): 1399–1420. |
| [28] | Rahman F, Langford K H, Scrimshaw M D, et al. Polybrominated diphenyl ether(PBDE) flame retardants[J]. Science of the Total Environment, 2001, 275(1): 1–17. |
| [29] | Gibis M. Effect of oil marinades with garlic, onion, and lemon juice on the formation of heterocyclic aromatic amines in fried beef patties[J]. Journal of Agricultural and Food Chemistry, 2007, 55(25): 10240–10247. DOI:10.1021/jf071720t |
| [30] | Dong S, Liu G, Zhang B, et al. Formation of polychlorinated naphthalenes during the heating of cooking oil in the presence of high amounts of sucralose[J]. Food Control, 2013, 32(1): 1–5. DOI:10.1016/j.foodcont.2012.11.001 |
| [31] | Wu J, Dong S, Liu G, et al. Cooking process:A new source of unintentionally produced dioxins?[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5444–5449. DOI:10.1021/jf200216r |
| [32] | 王俊霞, 王春艳, 刘莉莉, 等. 多溴联苯醚在市场鲫鱼体内分布和食鱼暴露量[J]. 环境科学, 2014, 35(8): 3175–3182. WANG Jun-xia, WANG Chun-yan, LIU Li-li, et al. Distribution of polybrominated diphenyl ethers in wild crucian carp and exposure estimation of dietary intake[J]. Environmental Science, 2014, 35(8): 3175–3182. |
| [33] | Su G Y, Liu X H, Gao Z S, et al. Dietary intake of polybrominated diphenyl ethers(PBDEs) and polychlorinated biphenyls(PCBs) from fish and meat by residents of Nanjing, China[J]. Environment International, 2012, 42: 138–143. DOI:10.1016/j.envint.2011.05.015 |
| [34] | Chan J K, Man Y B, Wu S C, et al. Dietary intake of PBDEs of residents at two major electronic waste recycling sites in China[J]. Science of the Total Environment, 2013, 463/464: 1138–1146. DOI:10.1016/j.scitotenv.2012.06.093 |
| [35] | Zohair A, Salim A B, Soyibo A A, et al. Residues of polycyclic aromatic hydrocarbons(PAHs), polychlorinated biphenyls(PCBs) and organo-chlorine pesticides in organically-farmed vegetables[J]. Chemosphere, 2006, 63(4): 541–553. DOI:10.1016/j.chemosphere.2005.09.012 |
| [36] | Claeys W L, Schmit J F, Bragard C, et al. Exposure of several Belgian consumer groups to pesticide residues through fresh fruit and vegetable consumption[J]. Food Control, 2011, 22(3): 508–516. |
| [37] | Yu Y X, Huang N B, Zhang X Y, et al. Polybrominated diphenyl ethers in food and associated human daily intake assessment considering bioaccessibility measured by simulated gastrointestinal digestion[J]. Chemosphere, 2011, 83(2): 152–160. DOI:10.1016/j.chemosphere.2010.12.049 |
| [38] | Farhadian A, Jinap S, Hanifah H N, et al. Effects of meat preheating and wrapping on the levels of polycyclic aromatic hydrocarbons in charcoal-grilled meat[J]. Food Chemistry, 2011, 124(1): 141–146. DOI:10.1016/j.foodchem.2010.05.116 |
 2017, Vol. 36
2017, Vol. 36